人乳头瘤病毒(human papillomavirus,HPV)是无包膜DNA病毒,已发现超过200种亚型,且约1/3可感染生殖道鳞状上皮。高危型HPV是宫颈癌的主要病原体,特别是HPV16、HPV18、HPV31和HPV35,与宫颈癌关系更为密切,占90%以上。建立持续性感染是HPV引发宫颈癌的前提,而逃避天然免疫和适应性免疫的监督则是必要条件。Janus激酶/信号转导与转录激活因子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)通路是调节先天免疫反应的主要途径。JAK/STAT通路的激活由外界细胞因子、生长因子和干扰素(interferon,IFN)介导,导致下游数百个基因表达增加,从而促进或抑制HPV扩增[1]。HPV与STAT之间有多重关联,本文仅就JAK/STAT信号通路与HPV感染导致宫颈癌的关系进行综述。
1 HPV蛋白和病毒复制周期HPV基因组长约8 kb,含有早期基因、晚期基因和调节基因及至少8个开放读码框,分别编码E1、E2、E4、E5、E6、E7早期蛋白,以及L1、L2衣壳蛋白。HPV感染上皮基底细胞,其生命周期与上皮细胞分化密切相关。在HPV生命周期中,病毒E1 ~E4蛋白水平随基因组扩增而上升,E4蛋白在上皮细胞中积累以支持病毒合成。E1~E4蛋白通过其N端富含亮氨酸的基序与细胞角蛋白相关联,最终有助于病毒颗粒释放[2]。最近研究表明,病毒与宿主的相互作用可能影响病毒基因组扩增,破坏HPV16 E1~E4角蛋白结合基序,导致病毒生命周期中的扩增缺陷[3]。在未分化和分化细胞中,E6、E7蛋白均对HPV生命周期有调节作用,并在维持病毒游离基因中发挥重要作用。
HPV生命周期依赖上皮细胞分化。由于HPV仅编码少量蛋白,它们必须利用宿主细胞的复制酶进行复制[4]。HPV感染鳞状上皮基底细胞后,其基因组在细胞中维持低水平(每个细胞中约100拷贝)。在已感染的基底细胞中,HPV的游离基因和细胞染色体一起复制,并均匀分配至新的基底细胞中,子代基底细胞将继续分化。随着这种被感染的子代基底细胞的分化,病毒基因组将复制至上千个拷贝数。然而,关于最初病毒进入细胞后病毒早期基因表达的机制、病毒蛋白如何靶向作用于天然免疫应答等有关信息,还知之甚少。
2 HPV感染引起IFN水平变化病原体进入人体后,由可识别非自身分子的模式识别受体(pattern recognition receptor,PRR)识别,即识别病原体相关分子模式(pathogen-associated molecular pattern,PAMP)。PAMP包括细菌表面的脂多糖、内毒素及病毒基因组的核酸基序。病毒感染后被PRR识别,常导致下游信号转导通路级联式激活,包括干扰素调节因子(interferon regulatory factor,IRF)通路、STAT通路,以及细胞因子如IFN、白细胞介素(interleukin,IL)的产生。IFN家族主要有3型。人类细胞中,Ⅰ型包括IFN-α、IFN-β、IFN-ε、IFN-κ、IFN-ω等;Ⅱ型为IFN-γ;Ⅲ型包括IFN-λ1、IFN-λ2、IFN-λ3等。IRF家族有9个成员,无活性的IRF最初位于细胞质中,识别病毒感染后处于激活状态,并发挥不同的作用。其中IRF1、IRF3、IRF5、IRF7是Ⅱ型IFN的主要活化剂,而IRF2是IRF1活性的负调节物。
同时,HPV感染后可抑制宿主细胞IFN信号转导,此过程是通过调节IRF来降低IFN合成。HPV16 E7通过组蛋白去乙酰化酶(histone deacetylase,HDAC)依赖机制阻断IRF1的表达。相似的是,过表达HPV38 E6和E7可下调IRF1和主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ重链表达[5]。HPV16 E6蛋白也以IRF为靶点,并与IRF3结合来抑制转录活性。上述因子相互作用,使HPV蛋白下调IRF,并降低IFN-α、IFN-β、IFN-κ的表达[6]。IFN-κ是皮肤组织中特异表达的独特IFN,可能是影响HPV感染的主要亚型。有研究显示,HPV E6通过调节IFN-κ启动子的甲基化来抑制其表达[6],也能引起PRR表达模式变化[7]。IRF被认为是直接调节HPV转录反馈回路的一部分,因为在角质细胞中IRF-2可激活E6和E7启动子[8],而IRF-3抑制HPV8表达[9]。
3 STAT蛋白的激活及作用STAT蛋白家族有7个成员:STAT1、STAT2、STAT3、STAT4、STAT5α、STAT5β和STAT6。它们可被细胞中的一系列信号蛋白激活,如细胞因子、生长因子、与细胞表面特定受体结合的激素等。STAT蛋白激活磷酸化后形成同源或异源二聚体,迁至胞核并参与细胞生理或病理过程,包括增殖、分化、凋亡、血管生成[10],以及细胞转变、癌形成等[11]。
STAT1、STAT2与Ⅰ和Ⅱ型IFN的调节有关,而STAT5受细胞因子的调节并可激活一系列下游基因。感染病毒的细胞在识别感染后进行IFN合成与分泌,然后胞外IFN与邻近细胞的受体结合并激活JAK/STAT通路,从而刺激数百种基因表达,阻断病毒传播。在典型的Ⅰ型IFN通路中,IFN-α和IFN-β与异源二聚体跨膜IFN-α受体(interferon α receptor,IFNAR)结合。IFNAR的参与可激活受体相关的JAK1和酪氨酸激酶2(tyrosine kinase 2,TYK2),磷酸化胞质中无活性的STAT蛋白。与此相似,IFN-γ结合IFN-γ受体(interferon γ receptor,IFNGR),激活JAK1和JAK2,磷酸化STAT蛋白。
在未感染细胞中,未磷酸化的STAT蛋白定位于胞质中。受体与IFN结合后,STAT蛋白受体相关激酶磷酸化,如JAK1、JAK2和TYK2。磷酸化后,STAT1和STAT2形成异源二聚体,并与IRF9形成复合物,即干扰素刺激基因因子3(interferon-stimulated gene factor 3,ISGF3)。ISGF3复合物迁至细胞核,与位于超过100个抗病毒基因(即ISG)的启动子区域中的干扰素刺激应答元件(interferon-stimulated response element,ISRE)结合,并诱导抗病毒基因表达。其中两个重要的抗病毒因子是RNA依赖蛋白激酶(RNA-dependent protein kinase,PKR)和核糖核酸酶L(RNase L),PKR可阻止病毒蛋白翻译,RNase L介导病毒RNA降解。IFN-γ与其受体结合后激活JAK激酶,使STAT1蛋白磷酸化,形成同源二聚体,并迁至细胞核,与活化的IFN-γ激活序列(interferon γ activated sequence,GAS)结合,该序列元件位于诱导ISG表达的启动子中。ISGF3和STAT1同源二聚体可激活一组重叠的基因[12]。同样,STAT5在胞质中以未磷酸化的形式存在,细胞因子与细胞因子受体结合使STAT5磷酸化,并使STAT5的STAT5α和STAT5β这两个亚型形成同源或异源二聚体,这些二聚体可激活一系列下游基因,但与STAT1和STAT2激活的基因不同[12]。最近研究还表明,未磷酸化的STAT1和STAT2可与IRF9形成三聚体复合物以诱导少数基因的表达,而这些基因有抗病毒或免疫调节的功能[13]。
4 STAT蛋白与HPV感染的关系 4.1 HPV感染抑制STAT1表达,STAT1表达抑制HPV复制如上所述,HPV感染后通过调节IRF来降低IFN合成,而IFN是STAT通路激活的主要细胞因子,其表达下降导致STAT激活减少。除抑制IFN表达,HPV蛋白还干扰JAK/STAT通路诱导,其中高危型HPV E6的重要靶标是转录因子P53,E6与细胞E3泛素连接酶即E6相关蛋白(E6-associated protein,E6AP)结合以降解P53,也可通过阻止其乙酰化来抑制P53功能,进而抑制STAT1表达。E7可与ISGF3复合物中的P48结合,阻止该复合物向核迁移,从而抑制ISG基因表达。HPV31和HPV16阳性宫颈角质上皮的微阵列分析表明,E6和E7可抑制STAT1转录,但不抑制STAT2转录,导致HPV31阳性角质上皮中STAT1表达抑制及下游基因转录相应降低。高危型HPV蛋白可抑制一系列ISG表达,包括黏液病毒抗性蛋白1(myxovirus resistance 1,MX1)、IFN诱导的四肽重复蛋白(IFN-induced protein with tetratricopeptide repeats,IFIT)和2′-5′寡聚腺苷酸合成酶(2’-5’-oligoadenylate synthetase,OAS)。然而,一旦增加外源IFN,这些基因表达可恢复至正常水平。有研究表明,IFIT1与E1复制蛋白结合,使E1在胞质中聚集,导致HPV复制减少[14]。与IFIT1不同,IFIT系列的其他成员,如干扰素诱导跨膜蛋白(IFN-induced transmembrane protein,IFITM)对HPV感染无任何抑制作用[15]。病毒蛋白一般以活化的双链DNA蛋白激酶为靶点,且可抑制PKR表达,导致真核生物翻译起始因子2α(eukaryotic translation initiation factor 2α,eIF2α)下降。此外,HPV E6可使PKR定位于胞质P体中,进一步抑制PKR活性。
分化细胞中,HPV蛋白对STAT1表达的抑制对病毒游离基因的维持和扩增至关重要[16]。用表达STAT1的载体转染HPV感染细胞使其恢复蛋白表达水平时,可发现细胞中HPV基因组数量迅速下降,感染细胞的分化、扩增受到抑制,而整合HPV基因组的细胞成为主要类型。这种对HPV的抑制是通过STAT1本身还是下游分子发挥作用,还不清楚。此外,HPV与STAT1共同作用可激活核蛋白P300/CBP和MCM5。HPV E6结合P300/CBP能减少P53乙酰化,而P53可阻断IFN诱导的细胞生长停滞。在所有HPV阳性鳞状或腺状细胞发育不良等级中,MCM5水平升高,但其在HPV生命周期中的作用尚不清楚。以上结果表明,抑制STAT1在HPV感染中有重要作用。
4.2 HPV感染促进STAT3表达及激活STAT家族的其他成员如STAT3和STAT5在HPV阳性细胞中的调节与STAT1不同,它们与细胞增殖、分化和天然免疫应答调节有关。在很多人类肿瘤细胞系中发现STAT3,如卵巢癌、前列腺癌、乳腺癌等[17]。有报道称STAT3的表达随宫颈病变分级升高而增加,并表明STAT3的表达与HPV感染有关,HPV16/18阳性组织中STAT3的表达比HPV阴性组织高[18]。另有研究表明,HPV阳性细胞中STAT3表达增多,这是由于E6和E7降低miRNA-125水平,后者可调节STAT3合成[19]。用小干扰RNA(small interfering RNA,siRNA)或药理学抑制剂抑制STAT3活性,可导致P53和pRb积累,从而降低HPV基因表达[20]。用HPV E6特异siRNA沉默E6,可导致STAT3信号转导消除;而高表达HPV E7,则增加STAT3磷酸化。
4.3 STAT5与HPV感染STAT5由两个亚型组成,包括STAT5a和STAT5b。有研究表明,敲除小鼠STAT5a、STAT5b基因可表现出围生期致死表型,且严重损伤淋巴细胞的发育及分化[21]。另有研究在HPV31阳性细胞中,利用匹莫齐特直接抑制STAT5表达,结果阻断了HPV31基因组的扩增及HPV晚期基因的表达[1]。此外,高危型HPV蛋白表达可诱导STAT5激活,而STAT5的活化可诱导毛细血管扩张性共济失调突变基因(ataxia telangiectasia mutated,ATM)DNA损伤修复途径。用短发夹RNA(short hairpin RNA,shRNA)下调STAT5水平,则抑制ATM DNA损伤通路的激活[1],激活的ATM通路对HPV基因组扩增是必需的[22],但对游离基因的稳定维持作用甚微。HPV蛋白通过糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)和TiP60来诱导ATM活化。此外,高危型HPV蛋白也会激活共济失调性毛细血管扩张和Rad3相关通路(ataxia telangiectasia and Rad3-related, ATR),ATR通路介导单链DNA的断裂修复,可进一步调节HPV复制。STAT5调节ATR活性,部分是通过抑制ATR的结合物拓扑异构酶Ⅱ结合蛋白1(topoisomerase Ⅱ-binding protein 1,TopBP1)的转录来实现的[23]。
HPV感染过程中,HPV抑制STAT1表达,却激活STAT5。Ⅰ或Ⅱ型IFN与受体结合,激活相关激酶,诱导STAT1磷酸化。TYK2激酶可被HPV E6调节。磷酸化的STAT1与STAT2形成同源二聚体或异源二聚体,迁至细胞核以激活超过百种基因的表达。HPV E6或E7抑制STAT1转录。相比之下,HPV能促进STAT5磷酸化,并入核发挥作用[24]。此外,HPV蛋白可调节宿主免疫因子,HPV E6与P300/CBP结合可抑制P53乙酰化。E6也可调节CBP和IFR3;而E7通过P48抑制ISGF3的核迁移,进而抑制STAT1依赖的下游基因的诱导及表达(图 1)。
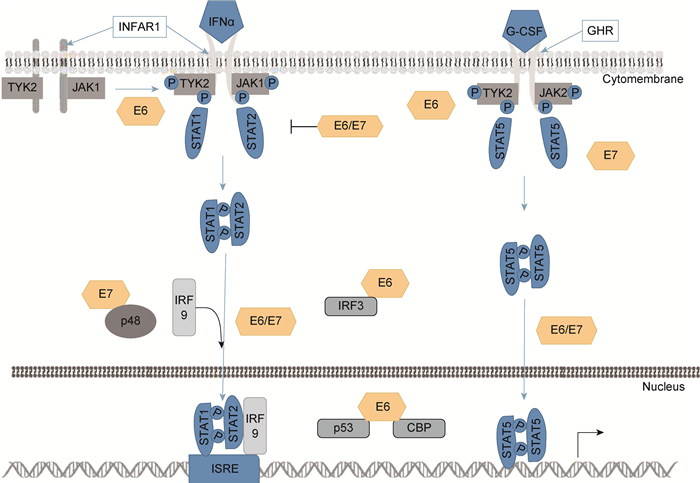
|
| 图 1 HPV调控STAT信号通路 Fig. 1 Regulation of STAT pathway by HPV |
STAT是天然免疫应答的重要调节因子,HPV靶向该途径的成员建立持续感染。其中STAT1的表达在HPV感染细胞中被抑制,且胞外IFN与邻近细胞的受体结合激活JAK/STAT通路,磷酸化后STAT1和STAT2形成异源二聚体并与IRF9形成复合物,该复合物迁至细胞核,诱导抗病毒基因表达,从而抑制HPV基因的表达和扩增。STAT5在HPV感染细胞中被激活,并通过抑制STAT5激活以阻断HPV基因组扩增。STAT5通过激活ATM DNA损伤途径来调节基因组扩增。综上所述,HPV感染与STAT信号转导通路之间的关系是复杂的,但有章可循,通过探究它们之间的关系,可为临床抗HPV感染的治疗提供新的思路和方向。
| [1] |
Hong S, Laimins LA. The JAK-STAT transcriptional regulator, STAT-5, activates the ATM DNA damage pathway to induce HPV 31 genome amplification upon epithelial differentiation[J]. PLoS Pathog, 2013, 9(4): e1003295.
[DOI]
|
| [2] |
Egawa N, Wang Q, Griffin HM, Murakami I, Jackson D, Mahmood R, Doorbar J. HPV16 and 18 genome amplification show different E4-dependence, with 16E4 enhancing E1 nuclear accumulation and replicative efficiency via its cell cycle arrest and kinase activation functions[J]. PLoS Pathog, 2017, 13(3): e1006282.
[DOI]
|
| [3] |
Nakahara T, Peh WL, Doorbar J, Lee D, Lambert PF. Human papillomavirus type 16 E1-E4 contributes to multiple facets of the papillomavirus life cycle[J]. J Virol, 2005, 79(20): 13150-13165.
[DOI]
|
| [4] |
Hebner CM, Laimins LA. Human papillomaviruses: basic mechanisms of pathogenesis and oncogenicity[J]. Rev Med Virol, 2006, 16(2): 83-97.
[DOI]
|
| [5] |
Lo Cigno I, De Andrea M, Borgogna C, Albertini S, Landini MM, Peretti A, Johnson KE, Chandran B, Landolfo S, Gariglio M. The nuclear DNA sensor IFI16 acts as a restriction factor for human papillomavirus replication through epigenetic modifications of the viral promoters[J]. J Virol, 2015, 89(15): 7506-7520.
[DOI]
|
| [6] |
Rincon-Orozco B, Halec G, Rosenberger S, Muschik D, Nindl I, Bachmann A, Ritter TM, Dondog B, Ly R, Bosch FX, Zawatzky R, Rösl F. Epigenetic silencing of interferon-kappa in human papillomavirus type 16-positive cells[J]. Cancer Res, 2009, 69(22): 8718-8725.
[DOI]
|
| [7] |
Reiser J, Hurst J, Voges M, Krauss P, Münch P, Iftner T, Stubenrauch F. High-risk human papillomaviruses repress constitutive kappa interferon transcription via E6 to prevent pathogen recognition receptor and antiviral-gene expression[J]. J Virol, 2011, 85(21): 11372-11380.
[DOI]
|
| [8] |
Lace MJ, Anson JR, Haugen TH, Turek LP. Interferon regulatory factor (IRF)-2 activates the HPV-16 E6-E7 promoter in keratinocytes[J]. Virology, 2010, 399(2): 270-279.
[DOI]
|
| [9] |
Oldak M, Tolzmann L, Wnorowski A, Podgórska MJ, Silling S, Lin R, Hiscott J, Müller CS, Vogt T, Smola H, Smola S. Differential regulation of human papillomavirus type 8 by interferon regulatory factors 3 and 7[J]. J Virol, 2011, 85(1): 178-188.
[DOI]
|
| [10] |
Horvath CM. STAT proteins and transcriptional responses to extracellular signals[J]. Trends Biochem Sci, 2000, 25(10): 496-502.
[DOI]
|
| [11] |
Bowman T, Garcia R, Turkson J, Jove R. STATs in oncogenesis[J]. Oncogene, 2000, 19(21): 2474-2488.
[DOI]
|
| [12] |
Heltemes-Harris LM, Farrar MA. The role of STAT5 in lymphocyte development and transformation[J]. Curr Opin Immunol, 2012, 24(2): 146-152.
[DOI]
|
| [13] |
Loo YM, Gale M Jr. Immune signaling by RIG-I-like receptors[J]. Immunity, 2011, 34(5): 680-692.
[DOI]
|
| [14] |
Terenzi F, Saikia P, Sen GC. Interferon-inducible protein, P56, inhibits HPV DNA replication by binding to the viral protein E1[J]. EMBO J, 2008, 27(24): 3311-3321.
[DOI]
|
| [15] |
Warren CJ, Griffin LM, Little AS, Huang IC, Farzan M, Pyeon D. The antiviral restriction factors IFITM1, 2 and 3 do not inhibit infection of human papillomavirus, cytomegalovirus and adenovirus[J]. PLoS One, 2014, 9(5): e96579.
[DOI]
|
| [16] |
Hong S, Mehta KP, Laimins LA. Suppression of STAT-1 expression by human papillomaviruses is necessary for differentiation-dependent genome amplification and plasmid maintenance[J]. J Virol, 2011, 85(18): 9486-9494.
[DOI]
|
| [17] |
Berclaz G, Altermatt HJ, Rohrbach V, Siragusa A, Dreher E, Smith PD. EGFR dependent expression of STAT3 (but not STAT1) in breast cancer[J]. Int J Oncol, 2001, 19(6): 1155-1160.
[URI]
|
| [18] |
Sobti RC, Singh N, Hussain S, Suri V, Bharti AC, Das BC. Overexpression of STAT3 in HPV-mediated cervical cancer in a North Indian population[J]. Mol Cell Biochem, 2009, 330(1/2): 193-199.
[URI]
|
| [19] |
Fan Z, Cui H, Xu X, Lin Z, Zhang X, Kang L, Han B, Meng J, Yan Z, Jiao S. MiR-125a suppresses tumor growth, invasion and metastasis in cervical cancer by targeting STAT3[J]. Oncotarget, 2015, 6(28): 25266-25280.
[URI]
|
| [20] |
Shukla S, Mahata S, Shishodia G, Pandey A, Tyagi A, Vishnoi K, Basir SF, Das BC, Bharti AC. Functional regulatory role of STAT3 in HPV16-mediated cervical carcinogenesis[J]. PLoS One, 2013, 8(7): e67849.
[DOI]
|
| [21] |
Cui Y, Riedlinger G, Miyoshi K, Tang W, Li C, Deng CX, Robinson GW, Hennighausen L. Inactivation of Stat5 in mouse mammary epithelium during pregnancy reveals distinct functions in cell proliferation, survival, and differentiation[J]. Mol Cell Biol, 2004, 24(18): 8037-8047.
[DOI]
|
| [22] |
Moody CA, Laimins LA. Human papillomaviruses activate the ATM DNA damage pathway for viral genome amplification upon differentiation[J]. PLoS Pathog, 2009, 5(10): e1000605.
[DOI]
|
| [23] |
Hong S, Dutta A, Laimins LA. The acetyltransferase Tip60 is a critical regulator of the differentiation-dependent amplification of human papillomaviruses[J]. J Virol, 2015, 89(8): 4668-4675.
[DOI]
|
| [24] |
Hong S, Laimins LA. Manipulation of the innate immune response by human papillomaviruses[J]. Virus Res, 2017, 231: 34-40.
[DOI]
|
 2018, Vol. 13
2018, Vol. 13


