Epstein-Barr病毒(Epstein-Barr virus,EBV)为人类疱疹病毒科γ亚科DNA病毒,是可引起人类感染的淋巴滤泡病毒,具有嗜B细胞特性。全世界人群中EBV感染非常普遍,大多数在儿童时期即感染并终生携带[1]。超过90%的成年人血清中EBV抗体阳性,且EBV能在产生抗体的宿主体内持续存在。大量流行病学研究表明,EBV感染与包括淋巴瘤在内的多种人类疾病的发生有关。近年来,EBV与不同类型淋巴瘤的关系颇受国内外学者的关注。本研究对伴EBV感染的淋巴瘤患者的临床特征及生存情况进行分析,为EBV相关淋巴瘤的临床研究提供帮助。
1 材料与方法 1.1 对象回顾性分析2013年1月—2016年12月于复旦大学附属华东医院(以下称本院)就诊的49例伴EBV感染的淋巴瘤患者临床资料,所有病例均经组织活检病理学证实,采用2016年世界卫生组织(World Health Organization,WHO)造血与淋巴组织肿瘤分类标准,收集患者性别、年龄、病理类型、是否合并B症状、Ann Arbor分期、白蛋白、肝酶、β2微球蛋白、乳酸脱氢酶(lactate dehydrogenase,LDH)、白细胞、中性粒细胞、血红蛋白、国际预后指数(international prognostic index,IPI)等信息。患者临床分期采用Ann Arbor分期标准。采用IPI和美国东部肿瘤协作组织(Eastern Collaborative Oncology Group,ECOG)体力状态评分评估患者状态。
1.2 随访患者确诊淋巴瘤后,部分在门诊或住院接受随访;患者死亡,随访结束;随访截止日期为2017年6月30日。
1.3 统计学处理应用SPSS 24.0统计学软件,正态分布数据采用t检验,非正态分布数据采用秩和检验。用Kaplan-Merier法估计总生存率,Log-Rank检验比较不同组间生存曲线,P<0.05为差异有统计学意义。
2 结果 2.1 一般临床资料49例患者中,男37例,女13例,男女比约为2.85:1;中位年龄51.5岁(15~85岁)。B细胞类型18例,T/NK细胞类型31例。按Ann Arbor分期标准进行临床分期:Ⅰ~Ⅱ期13例(26.5%),Ⅲ~Ⅳ期36例(73.5%)。IPI评分:0~2分21例(42.9%),3~5分28例(57.1%)。
2.2 临床表现发热:49例患者最常见的临床表现为发热,体温高峰多在38.5~41 ℃,抗生素治疗无明显效果。淋巴结肿大:32例患者淋巴结肿大,多为浅表淋巴结无痛性、进行性肿大,颈部、腋下、腹股沟淋巴结肿大者多见,其中深部淋巴结肿大者1例(纵隔)。呼吸系统受累:17例患者临床症状主要为鼻塞、涕血、咳嗽、咳痰等。肝脾大:18例患者脾大,9例肝大。皮肤受累症状:皮疹、皮肤瘙痒2例。消化系统受累:腹痛、腹泻、乏力、纳差、巩膜黄染等3例。其他部位:睾丸肿大2例,口腔溃疡1例。EBV相关T/NK细胞淋巴瘤和EBV相关B细胞淋巴瘤患者临床表现见表 1。
| 临床表现 | T/NK细胞 淋巴瘤 |
B细胞 淋巴瘤 |
P值 |
| 发热 | 87.1% | 38.9% | 0.000 |
| 淋巴结肿大 | 67.7% | 83.3% | 0.233 |
| 呼吸系统受累 | 41.9% | 16.7% | 0.069 |
| 脾大 | 48.4% | 22.2% | 0.070 |
| 肝大 | 25.8% | 5.6% | 0.078 |
| 消化系统受累 | 16.1% | 16.7% | 0.961 |
| 皮肤受累 | 3.2% | 5.6% | 0.691 |
| 睾丸肿大 | 3.2% | 5.6% | 0.691 |
| 伴噬血综合征 | 41.9% | 5.6% | 0.007 |
目前,在淋巴瘤患者中检测EBV的方法主要有3种[2-3]:通过病例组织活检原位杂交检测EBV编码RNA(EBV-encoded RNA,EBER)、检测外周血EBV DNA,以及血清免疫学检测EBV抗体。前两种检测方法准确率较高。目前,原位杂交检测EBER被多数学者认为是EBV检测的金标准;而外周血EBV DNA检测方便,可用于临床动态检测[4]。本研究统计骨髓病理活检报告,行原位杂交检测EBER者共49例,其中EBER阳性27例(包括6例未行EBV DNA检测者),阳性率为55.1%。参考国外相关研究[5]及本院实验室聚合酶链反应(polymerase chain reaction,PCR)检测下线,以外周血EBV DNA>5×103拷贝/mL为阳性判断标准。135例经外周血检测EBV DNA患者中,>5×103拷贝/mL者22例(均未行EBER检测),阳性率为16.3%。EBV相关B细胞淋巴瘤与T/NK细胞淋巴瘤的实验室指标测值见表 2。T/NK细胞淋巴瘤和B细胞淋巴瘤患者的血红蛋白为95.67 g/L、101.64 g/L,β2微球蛋白为4.18 mg/L、3.42 mg/L,三酰甘油为1.9 mmol/L、1.45 mmol/ L,纤维蛋白原降解产物为2.3 mg/L、2.4 mg/L,活化部分凝血活酶时间为37.7 s、34.9 s,两组之间这几项指标无统计学差异。T/NK细胞淋巴瘤患者的白细胞中位数为3.7×109/L,白蛋白为31.70 g/L,血小板为67×109/L,丙氨酸氨基转移酶为62 U/L,天冬氨酸氨基转移酶为76.2 U/L,乳酸脱氢酶为410.6 U/L,铁蛋白为1 500.0 μg/L,C反应蛋白和红细胞沉降率分别为8 mg/L和16 mm/h,纤维蛋白原为2.39 g/L;而B细胞淋巴瘤的白细胞中位数为6.65×109/L,白蛋白为36.42 g/L,血小板为147.5×109/L,丙氨酸氨基转移酶为28.5 U/L,天冬氨酸氨基转移酶为34 U/L,乳酸脱氢酶为236.5 U/L,铁蛋白为306.65 μg/L,C反应蛋白和红细胞沉降率分别为18.9 mg/L和31.5 mm/h,纤维蛋白原为3.77 g/L。两组之间这几项指标差异有统计学意义(P<0.05)。
| 实验室指标 | T/NK细胞淋巴瘤 | B细胞淋巴瘤 | P值 |
| 白蛋白(g/L) | 31.70±7.68 | 36.42±7.15 | 0.039 |
| 血红蛋白(g/L) | 95.67±24.44 | 101.64±28.47 | 0.442 |
| 白细胞(×109/L) | 3.7 (0.5~25.9) | 6.65 (1.4~14.1) | 0.025 |
| 血小板(×109/L) | 67 (1.2~319) | 147.5 (7~356) | 0.036 |
| 丙氨酸氨基转移酶(U/L) | 62 (8~405) | 28.5 (7~190) | 0.013 |
| 天冬氨酸氨基转移酶(U/L) | 76.2 (5~414) | 34 (10~125) | 0.033 |
| 碱性磷酸酶(U/L) | 114 (33~1 008) | 103 (59~342) | 0.820 |
| 乳酸脱氢酶(U/L) | 410.6 (144.4~1 969) | 236.5 (133.9~609.7) | 0.014 |
| β2微球蛋白(mg/L) | 4.18 (1.45~11.17) | 3.42 (1.88~17.66) | 0.500 |
| C反应蛋白(mg/L) | 8 (1.1~70) | 18.9 (4.5~124.1) | 0.017 |
| 红细胞沉降率(mm/h) | 16 (4~133) | 31.5 (12~130) | 0.024 |
| 铁蛋白(μg/L) | 1 500.0 (143.3~2 000) | 306.65 (20.7~2 000) | 0.018 |
| 三酰甘油(mmol/L) | 1.9 (0.8~6.5) | 1.45 (0.4~4.3) | 0.110 |
| 纤维蛋白原(g/L) | 2.39±1.76 | 3.77±1.35 | 0.002 |
| 纤维蛋白原降解产物(mg/L) | 2.3 (0.2~95) | 2.4 (0.1~31.7) | 0.366 |
| 活化部分凝血活酶时间(s) | 37.7 (1.69~117.4) | 34.9 (1.13~50.4) | 0.158 |
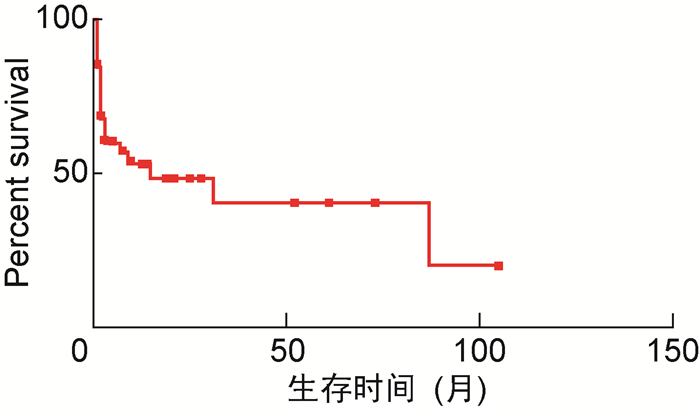
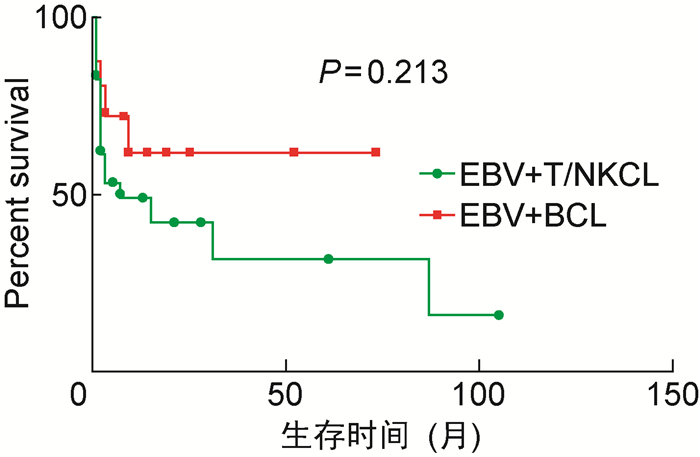
49例患者中,失访3例,死亡23例,存活23例。失访的3例患者中,1例为富淋巴细胞型霍奇金淋巴瘤;2例为结外NK/T细胞淋巴瘤,其中1例伴噬血细胞综合征。46例患者的生存曲线见图 1,中位随访时间为5个月,中位生存时间为15个月。Kplan-Meier生存分析计算1个月生存率为84.4%,6个月生存率为59.8%,1年生存率为53.2%,3年生存率为40.3%。随访截止时,EBV相关B细胞淋巴瘤患者的1个月、6个月、1年、3年生存率分别为87.5%、72.2%、61.9%、61.9%,EBV相关T/NK细胞淋巴瘤患者的1个月、6个月、1年、3年生存率分别为82.8%、53.5%、49.1%、31.5%。两者生存曲线见图 2,生存率差异无统计学意义(P=0.213)。
|
| 图 1 46例患者的生存曲线 Fig. 1 The survival curve of 46 patients |
|
| 图 2 EBV相关淋巴瘤患者的生存曲线 Fig. 2 The survival curves of EBV-associated T/NK cell lymphoma and B cell lymphoma |
EBV是一种广泛存在于人类中的DNA病毒,已在多种疾病中检出。其为嗜B细胞的人类疱疹病毒,人群普遍易感。EBV可长期潜伏于被感染的B细胞内,形成持续潜伏感染。极少数可发展为EBV相关上皮细胞恶性肿瘤和淋巴瘤,但机制尚不完全清楚,可能涉及多种因素。机体免疫功能低下是淋巴瘤发生的诱因,与EBV感染结合是淋巴瘤发生的关键。可能致病机制如下:EBV感染使淋巴细胞染色体发生突变或易位,导致c-myc癌基因激活和过度表达,最终导致淋巴瘤发生;EBV感染使淋巴细胞系中Fas介导的细胞凋亡受抑制,凋亡抑制基因bcl-2表达异常,导致淋巴细胞凋亡受抑制而发生淋巴瘤[6]。近年来研究表明,多种淋巴瘤患者中存在不同程度的EBV感染。以往认为EBV感染的靶细胞是人类B细胞,但已有证据表明人类T细胞淋巴瘤患者中也存在EBV感染。
EBV感染是B细胞淋巴增生性疾病的一个常见特征,包括弥漫性大B细胞淋巴瘤,其中约10%的患者EBV阳性,免疫功能低下者及老年人的发病率最高[7]。有学者研究中国北部EBV相关弥漫性大B细胞淋巴瘤的发病率为3.8%,较中国南部低[8]。本研究EBV相关B细胞淋巴瘤中,弥漫性大B细胞淋巴瘤占50.0%(9/18);而T细胞淋巴瘤中,结外NK/T细胞淋巴瘤占51.6%(16/31),外周T细胞淋巴瘤占19.4%(6/31)。
EBV感染的临床表现复杂多样,常累及全身各器官。Adam等[9]认为,EBV相关B细胞淋巴瘤可能出现淋巴结或结外累及,B症状临床上较常见。Jung等[10]报道,EBV相关T细胞淋巴瘤的主要表现为淋巴结肿大,乳酸脱氢酶升高。Jeon等[11]分析15例EBV相关T/NK细胞淋巴瘤患者,73%和60%患者存在脾大及肝大,1例皮肤受累。本研究B细胞淋巴瘤和T/NK细胞淋巴瘤患者中,发热者分别占38.9%、87.1%,伴噬血细胞综合征者分别占5.6%、41.9%,差异有统计学意义(P<0.05)。由此可见,EBV阳性淋巴瘤中,T/NK细胞淋巴瘤更易出现发热,更易伴噬血细胞综合征,这可能与T/NK细胞淋巴瘤自身具有侵袭性相关。伴噬血细胞综合征者(14例)预后很差,71.4%(10/14)死亡。国外也有研究[12]报道,EBV相关淋巴瘤伴噬血细胞综合征患者中,30%~50%死亡。
在EBV相关淋巴瘤实验室检查指标方面,EBV相关T/NK细胞淋巴瘤的丙氨酸氨基转移酶、天冬氨酸氨基转移酶、乳酸脱氢酶的升高水平,以及纤维蛋白原和白蛋白的降低水平,均较EBV相关B细胞淋巴瘤显著,表明前者肝功能损伤严重。这可能与T/NK细胞淋巴瘤患者更易合并噬血细胞综合征、触发细胞因子风暴有关。EBV本身对肝细胞并无直接杀伤作用[13],但EBV感染可间接导致肝损伤。EBV感染细胞后,脂质过氧化反应产生过多自由基,从而发生肝毒性反应。此外,病毒感染引起的集体免疫功能紊乱可能是导致严重肝损伤的原因;B细胞大量激活也能引起淋巴结肿大和肝脾大。白细胞和血小板在EBV相关T/NK细胞淋巴瘤中的降低水平较EBV相关B细胞淋巴瘤明显,可能与T/NK细胞淋巴瘤患者多存在脾功能亢进有关,细胞被吞噬导致白细胞及血小板减少明显。而C反应蛋白与红细胞沉降率在EBV相关B细胞淋巴瘤中的升高水平比EBV相关T/NK细胞淋巴瘤明显,表明这两者仅反映淋巴瘤的炎症状态,并不是可靠的实验室指标。
在生存情况方面,EBV相关T/NK细胞淋巴瘤患者较B细胞淋巴瘤患者生存时间更短,与以往研究中T/NK细胞淋巴瘤患者预后比B细胞淋巴瘤患者差的结论相似,因此不能证明EBV感染导致T/NK细胞淋巴瘤患者预后不良。
EBV的转化生长特性及其在一系列B细胞淋巴瘤和上皮恶性肿瘤发病机制中的作用已明确,多种T/NK细胞淋巴瘤亚型与EBV的相关性也在逐渐明确中。国外研究表明,EBV阳性淋巴瘤患者较EBV阴性淋巴瘤患者预后差,但对EBV的清除仍缺乏有效方法,因此预防EBV感染至关重要。近年来EBV免疫学研究也有较多进展,但仍不成熟,希望有所突破。
本研究存在一定不足:其一,为单中心研究,缺乏多中心研究数据,不能有效反映其他医院或地区的情况;其二,样本小,需进一步扩大样本量,比较B细胞淋巴瘤与T/NK细胞淋巴瘤患者的生存时间,以帮助临床医师了解预后情况。
| [1] |
Heslop HE. Biology and treatment of Epstein-Barr virus-associated non-Hodgkin lymphomas[J]. Hematology, 2005, 1(1): 260-266.
[DOI]
|
| [2] |
卢璐, 孙文文, 袁风菊, 杨开颜. EB病毒在不同类型淋巴瘤中的表达及检测方法的比较[J]. 医学研究杂志, 2014, 43(2): 80-83. [URI]
|
| [3] |
邓玲, 邵建永, 张旭, 汤涛, 邵琼, 李银珍. EBV-DNA拷贝数和EBERs原位表达在鼻NK/T细胞淋巴瘤诊断中的一致性研究[J]. 新医学, 2014, 45(5): 316-319. [DOI]
|
| [4] |
Jo SA, Hwang SH, Kim SY, Shin HJ, Chung JS, Sol MY, Chang CL, Lee EY. Quantitation of whole blood Epstein-Barr virus DNA is useful for assessing treatment response in patients with non-Hodgkin's lymphoma[J]. Int J Lab Hematol, 2010, 32(1 Pt 1): e106-e113.
[PubMed]
|
| [5] |
Thompson MP, Kurzrock R. Epstein-Barr virus and cancer[J]. Clin Cancer Res, 2004, 10(3): 803-821.
[DOI]
|
| [6] |
张福明, 李凡. EB病毒与淋巴瘤关系的研究[J]. 医学综述, 2004, 10(5): 298-299. [DOI]
|
| [7] |
Healy JA, Dave SS. The role of EBV in the pathogenesis of diffuse large B cell lymphoma[J]. Curr Top Microbiol Immunol, 2015, 390(Pt 1): 315-337.
[PubMed]
|
| [8] |
Pan Y, Meng B, Zhang H, Cao W, Wang H, Bi C, Liu F, Sun B, Hao X, Ai WZ, Fu K. Low incidence of Epstein-Barr virus-positive diffuse large B-cell lymphoma of the elderly in Tianjin, northern China[J]. Leuk Lymphoma, 2013, 54(2): 298-303.
[DOI]
|
| [9] |
Adam P, Bonzheim I, Fend F, Quintanilla-Martinez L. Epstein-Barr virus-positive diffuse large B-cell lymphomas of the elderly[J]. Adv Anat Pathol, 2011, 18(5): 349-355.
[DOI]
|
| [10] |
Jung KS, Cho SH, Kim SJ, Ko YH, Kim WS. Clinical features and treatment outcome of Epstein-Barr virus-positive nodal T-cell lymphoma[J]. Int J Hematol, 2016, 104(5): 591-595.
[DOI]
|
| [11] |
Jeon YK, Kim JH, Sung JY, Han JH, Ko YH; Hematopathology Study Group of the Korean Society of Pathologists. Epstein-Barr virus-positive nodal T/NK-cell lymphoma:an analysis of 15 cases with distinct clinicopathological features[J]. Hum Pathol, 2015, 46(7): 981-990.
[DOI]
|
| [12] |
Smith MC, Cohen DN, Greig B, Yenamandra A, Vnencak-Jones C, Thompson MA, Kim AS. The ambiguous boundary between EBV-related hemophagocytic lymphohistiocytosis and systemic EBV-driven T cell lymphoproliferative disorder[J]. Int J Clin Exp Pathol, 2014, 7(9): 5738-5749.
[PubMed]
|
| [13] |
Canović P, Gajović O, Todorović Z, Mijailović Z. Epstein-Barr virus hepatitis associated with icterus—a case report[J]. Med Pregl, 2006, 59(3/4): 179-182.
[PubMed]
|
 2018, Vol. 13
2018, Vol. 13


