2. 上海交通大学医学院附属新华医院,上海 200092;
3. 上海市公共卫生临床中心,上海 201508
2. Xinhua Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200092, China;
3. Shanghai Public Health Clinical Center, Shanghai 201508, China
手足口病(hand,foot and mouth disease,HFMD)是当今世界尤其是亚太地区的常见传染病,儿童和成年人均可发病,5岁以下儿童多见。手足口病可由肠道病毒71型(enterovirus type 71,EV71)、柯萨奇病毒A组16型(coxsackievirus A16,CA16)、CA6和CA10等多种肠道病毒引起。自2012年,中国多省[1-4]陆续报道了CA6导致的手足口病疫情,表明CA6已成为我国手足口病的主要致病原。
基因突变和重组是肠道病毒进化过程中的常见现象,基因突变或重组后的肠道病毒可能出现毒力变化,导致重症甚至死亡病例[5-7]。本课题组前期对感染重组型CA6(recombinant CA6,R CA6)与非重组型CA6(non-recombinant CA6,NR CA6)手足口病患者的临床特征进行比较,发现R CA6会引起更广泛的皮肤损伤[4],但机制尚不清楚。此外,R CA6与NR CA6在重症手足口病中的分布是否有差异,仍未知。
本研究基于国家科技重大专项发热伴出疹症候群监测平台,收集2011—2016年上海地区手足口病病例的临床标本,分析病原谱的构成和主要病原体流行规律,并对近年来我国手足口病的主要病原体CA6进行基因型重组检测,通过细胞学实验和统计学分析探寻R CA6与NR CA6感染细胞的差异及其在重症手足口病患者中的分布差异,为上海地区手足口病防控预警和疫苗研发提供数据。
1 材料与方法 1.1 研究对象2011年1月—2016年12月,共采集两家哨点医院(上海市公共卫生临床中心、上海交通大学医学院附属新华医院)临床诊断为手足口病的3 973例患者的标本,包括咽拭子、肛拭子、粪便和疱液。其中重症病例的诊断标准为:临床诊断除手足口病外,还有抽搐/高热惊厥、肺炎、心肌损伤和脑损伤等其他并发症。将标本放入病毒采样管(友康基业生物科技有限公司,货号01130803),暂存于4 ℃,48 h内冷链运送至上海市公共卫生临床中心病原体检测和生物安全部。
1.2 研究方法 1.2.1 核酸抽提利用高通量核酸自动抽提仪(QIAcube HT Plasticware)和核酸抽提试剂盒(cador Pathogen 96 QIAcube HT Kit)对标本进行病毒核酸抽提,立即置-80 ℃冰箱中保存备用。
1.2.2 肠道病毒通用型核酸和分型检测所有标本经抽提核酸后进行肠道病毒通用型核酸检测,将肠道病毒通用型核酸阳性标本继续用EV71、CA16、CA6和CA10特异性引物和探针[1]进行分型。
1.2.3 R CA6和NR CA6分型将经CA6特异性引物和探针检测为阳性的标本,用2C区特异性引物[2]区分为两种基因型:重组型和非重组型。
1.2.4 R CA6与NR CA6株的分离和病毒半数组织培养感染剂量(50% tissue culture infective dose,TCID50)测定将R CA6和NR CA6阳性标本接种于RD细胞,观察细胞病变效应(cytopathic effect,CPE)。CPE达80%~90%后,将培养物反复冻融,10 000 r/min离心5 min,收获上清病毒液,分装到1.5 mL EP管,-80 ℃冻存备用。采用Reed-Muench法计算每株病毒的TCID50。
1.2.5 CA6 RNA定量检测标准曲线的建立进行CA6标准片段的聚合酶链反应(polymerase chain reaction,PCR)扩增,将回收纯化的标准片段连接至pMD-18 T载体,连接产物转化后进行挑克隆鉴定,提取质粒(上海莱枫质粒DNA小量提取试剂盒,货号DK302)并测序鉴定(苏州金唯智生物科技有限公司),根据质粒浓度计算DNA拷贝数。将标准品稀释,以不同稀释度标准品拷贝数的对数值为横坐标,相应循环阈值(cycle threshold, Ct)为纵坐标,绘制标准曲线。
1.2.6 R CA6和NR CA6株在不同细胞中的生长曲线将RD、KB、MRC-5和HEp-2细胞以每孔8×105个铺种于6孔板,24 h后将R CA6和NR CA6株以每孔1×108病毒拷贝数接入,37 ℃、5% CO2培养。于各时间点(6、12、24、48、72、96 h)吸取细胞上清液,通过定量标准曲线法检测病毒拷贝数。以时间为横坐标,基因拷贝数对数值为纵坐标,绘制病毒生长曲线。
1.2.7 CCK8检测R CA6和NR CA6株导致RD细胞活性下降的曲线将RD细胞以每孔1.5×104个铺种于96孔板,24 h后将R CA6和NR CA6株以每孔1×102 TCID50接入,37 ℃、5% CO2培养。用CCK8试剂盒(同仁化学)检测各时间点(1.5、24、48、72、96 h)的细胞活性,重复3次。采用GraphPad Prism 5.0软件作图,以时间为横坐标,细胞活性百分比为纵坐标,绘制细胞活性曲线。采用t检验,P<0.05为差异有统计学意义。
1.2.8 R CA6和NR CA6在重症手足口病患者中的分布回顾性统计CA6阳性重症病例,分为R CA6和NR CA6两组,采用t检验,P<0.05为差异有统计学意义。
2 结果 2.1 2011—2016年上海地区手足口病病原谱2011年1月—2016年12月,对3 973例手足病患儿标本进行肠道病毒通用型核酸和分型检测。结果显示,肠道病毒通用型核酸阳性率为72.09%(2 864/3 973)。EV71、CA16、CA6和CA10的阳性检出率分别为26.88%(1 068/3 973)、12.64%(502/3 973)、24.26%(964/3 973)和1.91%(76/3 973);其他型别肠道病毒占6.32%(251/3 973);还检出3例共感染病例:EV71和CA16共感染2例,CA6和CA16共感染1例。各年度手足口病主要病原体的阳性检出率详见表 1。
| 检出类型 | 2011年 | 2012年 | 2013年 | 2014年 | 2015年 | 2016年 |
| EV71 | 46.33%(682) | 25.10%(123) | 16.67%(61) | 28.21%(123) | 3.93%(17) | 7.99%(62) |
| CA16 | 19.57%(288) | 15.51%(76) | 2.46%(9) | 19.27%(84) | 4.39%(19) | 3.35%(26) |
| CA6 | 7.61%(112) | 17.55%(86) | 53.28%(195) | 21.10%(92) | 35.80%(155) | 41.75%(324) |
| CA10 | 3.13%(46) | 1.63%(8) | 2.46%(9) | 0%(0) | 2.08%(9) | 0.52%(4) |
| 其他型别 | 3.33%(49) | 6.94%(34) | 7.65%(28) | 3.90%(17) | 12.93%(56) | 8.63%(67) |
| 共感染 | 0.07%(1) | 0%(0) | 0%(0) | 0.46%(2) | 0%(0) | 0%(0) |
| 阴性 | 19.97%(294) | 33.27%(163) | 17.49%(64) | 27.06%(118) | 40.88%(177) | 37.76%(293) |
对上海地区手足口病主要病原体EV71、CA16、CA6和CA10进行月份分析(图 1)。结果显示,2011—2012年秋季,EV71和CA16为主要病原体,CA6和CA10阳性检出率较低。自2012年秋季起,CA6检出率迅速上升,其高位流行状况一直持续至2013年末。2014年,EV71在4—7月、CA6在8—12月有较高检出率,两者呈现交替流行的趋势。2015—2016年,CA6为检出的首位病原体,其次为EV71。
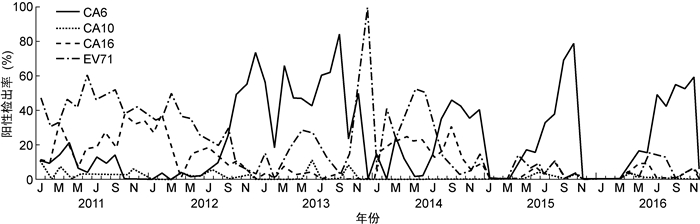
|
| 图 1 2011—2016年上海地区手足口病主要病原体的月份分布 Fig. 1 Month distribution of the main pathogens of HFMD in Shanghai from 2011 to 2016 |
对2012—2016年所有核酸检测为CA6阳性的样本进行2C区重组分型(图 2)。结果显示,2012年共发现3个R CA6样本,占3.66%(3/82);2013—2014年CA6高位流行期间,R CA6构成比较2012年上升,分别占28.64%(59/206)和38.10%(32/84);2015—2016年R CA6构成比较2013和2014年下降,分别占5.81%(9/155)和1.55%(5/322)。
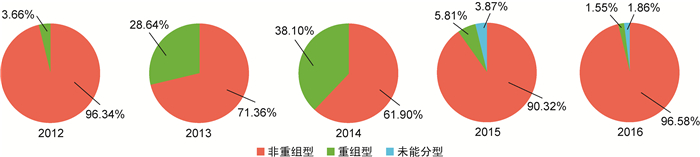
|
| 图 2 2012—2016年上海地区R CA6和NR CA6样本构成比 Fig. 2 Composition of recombinant and non-recombinant CA6 samples in Shanghai from 2012 to 2016 |
将5039(R CA6代表株)和5063(NR CA6代表株)分别接种于RD、MRC-5、KB和HEp-2细胞。病毒生长曲线显示,两者在RD细胞中增殖良好,在MRC-5、KB和HEp-2细胞中无明显增殖(图 3)。

|
| 图 3 R CA6和NR CA6代表株在不同细胞中的生长曲线 Fig. 3 Growth curves of recombinant and non-recombinant CA6 strains in different cells at different time points |
将5038、5039和5110(R CA6代表株)与5055、5245和5063(NR CA6代表株)接种于RD细胞。细胞活性曲线显示,0~48 h,接种R CA6代表株的细胞活性下降较慢;48~96 h,接种R CA6代表株的细胞活性下降加快,超过NR CA6。经统计学分析,各时间点两者导致细胞活性下降的水平无显著差异(图 4)。
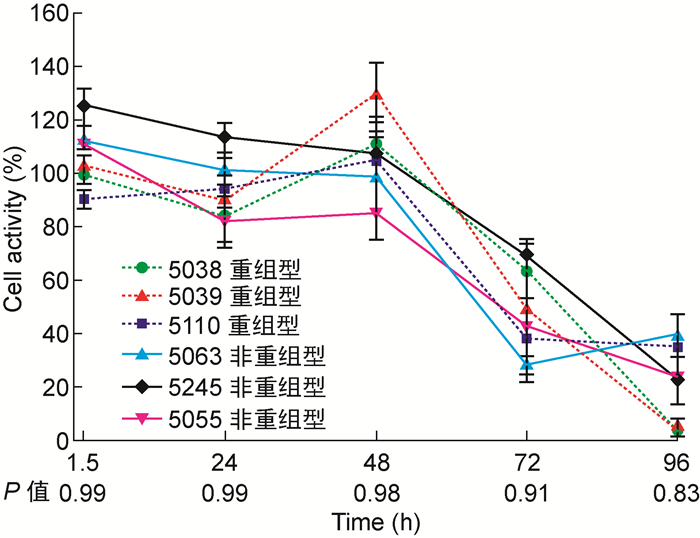
|
| 图 4 接种R CA6和NR CA6代表株的细胞活性曲线 Fig. 4 Cell activity curves with inoculated recombinant and non-recombinant CA6 strains |
重症病例中R CA6和NR CA6的分布见表 2,经统计学分析,两者无显著差异(P=0.06)。
| 组别 | 抽搐/ 高热惊厥 |
肺炎 | 心肌 损伤 |
脑损伤 | 合计 |
| R CA6 | 2 | 0 | 1 | 4 | 7 |
| NR CA6 | 0 | 3 | 5 | 3 | 11 |
| 合计 | 2 | 3 | 6 | 7 | 18 |
众所周知,EV71和CA16是导致世界范围尤其是亚太地区手足口病流行的主要病原体。然而,自2008年芬兰[8]暴发CA6相关手足口病后,西班牙、法国、日本、美国[9-12]等多个国家随即报道了CA6的流行;我国自2012年后,CA6成为手足口病主要病原体。本课题组对上海地区手足口病的多年监测数据显示,2012年秋季至2013年,CA6保持高位流行;2014年,EV71和CA6呈现春夏和秋冬交替流行;2015—2016年,CA6为检出的首位病原体。虽然目前已有有效的EV71疫苗[13],但针对CA6的疫苗尚未研制,因此长期持续监测手足口病病原体的变化,对疫情防控和疫苗研发意义重大。
早期Schmidt等[14]从乳鼠肌肉中分离获得高滴度的CA6,再接种至RD细胞,发现病毒可复制,但将CA6阳性样本直接接种至RD细胞,未获得阳性结果。直至2007—2009年,中国台湾地区[15]和新加坡[16]的研究者通过接种RD细胞获得了较多CA6阳性病毒株,推测与CA6特性改变有关。本研究通过2株病毒代表株尝试观察CA6在不同细胞中的增殖能力,具有局限性,后期希望通过扩大病毒株数量和细胞种类继续深入探索。
肠道病毒具有多种基因型,在进化过程中很易发生基因突变和重组。2008年安徽阜阳[17]、2011年湖北襄阳[18]暴发了大规模的手足口病疫情。后期研究发现,EV71与CA16在3D区发生重组,但疫情是否由重组病毒导致,尚不清楚。Zhang等[5]报道重组的CB2可引起重症手足口病,Hu等[6]和Yip等[7]则报道重组的CB4、CA2感染可导致儿童死亡,因此肠道病毒重组与病毒毒力强弱及患者病情严重程度具有相关性。本研究回顾性统计重症手足口病患者中R CA6和NR CA6的分布,发现CA6导致的重症手足口病数量较少,且统计学分析未见显著差异。
本课题组前期研究发现,与NR CA6相比,感染R CA6的患者出现上肢、下肢和前腹部更广泛的皮疹,差异具有统计学意义[4],但未能解释该现象。本研究将R CA6和NR CA6代表株同时等量接种于RD细胞,试图从细胞学角度探寻两者生物学特性,但未见显著差异。因此,R CA6在临床上导致更广泛皮疹的机制,还需进一步研究。
| [1] |
Han JF, Xu S, Zhang Y, Zhu SY, Wu DL, Yang XD, Liu H, Sun BX, Wu XY, Qin CF. Hand, foot, and mouth disease outbreak caused by coxsackievirus A6, China, 2013[J]. J Infect, 2014, 69(3): 303-305.
[DOI]
|
| [2] |
Lu J, Zeng H, Zheng H, Yi L, Guo X, Liu L, Sun L, Tan X, Li H, Ke C, Lin J. Hand, foot and mouth disease in Guangdong, China, in 2013: new trends in the continuing epidemic[J]. Clin Microbiol Infect, 2014, 20(7): O442-O445.
[DOI]
|
| [3] |
Li JL, Yuan J, Yang F, Wu ZQ, Hu YF, Xue Y, Zhou BP, Jin Q. Epidemic characteristics of hand, foot, and mouth disease in southern China, 2013: coxsackievirus A6 has emerged as the predominant causative agent[J]. J Infect, 2014, 69(3): 299-303.
[DOI]
|
| [4] |
Feng X, Guan W, Guo Y, Yu H, Zhang X, Cheng R, Wang Z, Zhang Z, Zhang J, Li H, Zhuang Y, Zhang H, Lu Z, Li M, Yu H, Bao Y, Hu Y, Yao Z. A novel recombinant lineage's contribution to the outbreak of coxsackievirus A6-associated hand, foot and mouth disease in Shanghai, China, 2012—2013[J]. Sci Rep, 2015, 5: 11700.
[DOI]
|
| [5] |
Zhang J, Zhang H, Zhao Y, Guo C, Yang Z, Ma S. Molecular characterization of a new human coxsackievirus B2 associated with severe hand-foot-mouth disease in Yunnan Province of China in 2012[J]. Arch Virol, 2017, 162(1): 307-311.
[DOI]
|
| [6] |
Hu YF, Du J, Zhao R, Xue Y, Yang F, Jin Q. Complete genome sequence of a recombinant coxsackievirus B4 from a patient with a fatal case of hand, foot, and mouth disease in Guangxi, China[J]. J Virol, 2012, 86(19): 10901-10902.
[DOI]
|
| [7] |
Yip CC, Lau SK, Woo PC, Wong SS, Tsang TH, Lo JY, Lam WK, Tsang CC, Chan KH, Yuen KY. Recombinant coxsackievirus A2 and deaths of children, Hong Kong, 2012[J]. Emerg Infect Dis, 2013, 19(8): 1285-1288.
[DOI]
|
| [8] |
Österback R, Vuorinen T, Linna M, Susi P, Hyypiä T, Waris M. Coxsackievirus A6 and hand, foot, and mouth disease, Finland[J]. Emerg Infect Dis, 2009, 15(9): 1485-1488.
[DOI]
|
| [9] |
Montes M, Artieda J, Piñeiro LD, Gastesi M, Diez-Nieves I, Cilla G. Hand, foot, and mouth disease outbreak and coxsackievirus A6, northern Spain, 2011[J]. Emerg Infect Dis, 2013, 19(4): 676-678.
[URI]
|
| [10] |
Mirand A, Henquell C, Archimbaud C, Ughetto S, Antona D, Bailly JL, Peigue-Lafeuille H. Outbreak of hand, foot and mouth disease/herpangina associated with coxsackievirus A6 and A10 infections in 2010, France: a large citywide, prospective observational study[J]. Clin Microbiol Infect, 2012, 18(5): E110-E118.
[DOI]
|
| [11] |
Fujimoto T, Iizuka S, Enomoto M, Abe K, Yamashita K, Hanaoka N, Okabe N, Yoshida H, Yasui Y, Kobayashi M, Fujii Y, Tanaka H, Yamamoto M, Shimizu H. Hand, foot, and mouth disease caused by coxsackievirus A6, Japan, 2011[J]. Emerg Infect Dis, 2012, 18(2): 337-339.
[DOI]
|
| [12] |
Centers for Disease Control and Prevention (CDC). Notes from the field: severe hand, foot, and mouth disease associated with coxsackievirus A6—Alabama, Connecticut, California, and Nevada, November 2011—February 2012[J]. MMWR Morb Mortal Wkly Rep, 2012, 61(12): 213-214.
[PMC]
|
| [13] |
Zhu F, Xu W, Xia J, Liang Z, Liu Y, Zhang X, Tan X, Wang L, Mao Q, Wu J, Hu Y, Ji T, Song L, Liang Q, Zhang B, Gao Q, Li J, Wang S, Hu Y, Gu S, Zhang J, Yao G, Gu J, Wang X, Zhou Y, Chen C, Zhang M, Cao M, Wang J, Wang H, Wang N. Efficacy, safety, and immunogenicity of an enterovirus 71 vaccine in China[J]. N Engl J Med, 2014, 370(9): 818-828.
[DOI]
|
| [14] |
Schmidt NJ, Ho HH, Lennette EH. Propagation and isolation of group A coxsackieviruses in RD cells[J]. J Chin Microbiol, 1975, 2(3): 183-185.
[URI]
|
| [15] |
Lo SH, Huang YC, Huang CG, Tsao KC, Li WC, Hsieh YC, Chiu CH, Lin TY. Clinical and epidemiologic features of coxsackievirus A6 infection in children in northern Taiwan between 2004 and 2009[J]. J Microbiol Immunol Infect, 2011, 44(4): 252-257.
[DOI]
|
| [16] |
Wu Y, Yeo A, Phoon MC, Tan EL, Poh CL, Quak SH, Chow VT. The largest outbreak of hand, foot and mouth disease in Singapore in 2008: the role of enterovirus 71 and coxsackievirus A strains[J]. Int J Infect Dis, 2010, 14(12): e1076-e1081.
[DOI]
|
| [17] |
Zhang Y, Zhu Z, Yang W, Ren J, Tan X, Wang Y, Mao N, Xu S, Zhu S, Cui A, Zhang Y, Yan D, Li Q, Dong X, Zhang J, Zhao Y, Wan J, Feng Z, Sun J, Wang S, Li D, Xu W. An emerging recombinant human enterovirus 71 responsible for the 2008 outbreak of hand, foot and mouth disease in Fuyang city of China[J]. Virol J, 2010.
[DOI]
|
| [18] |
Li J, Huo X, Dai Y, Yang Z, Lei Y, Jiang Y, Li G, Zhan J, Zhan F. Evidences for intertypic and intratypic recombinant events in EV71 of hand, foot and mouth disease during an epidemic in Hubei Province, China, 2011[J]. Virus Res, 2012, 169(1): 195-202.
[DOI]
|
 2018, Vol. 13
2018, Vol. 13


