2. 淮北朝阳医院, 淮北 235000
2. Huaibei Chaoyang Hospital, Huaibei 235000, China
潘多拉菌(Pandoraea)是2000年Coenye等发现并命名的一个新菌属,目前有10个菌种(其中Pandoraea genomospecies包含3个未正式命名的基因种),很难通过传统生物化学方法鉴别[1]。此菌的表型类似于洋葱伯克霍尔德菌、皮克特罗尔斯顿菌或少见嗜铜菌,常导致鉴定错误。分子生物学技术是鉴定此类细菌的最有效方法[2]。国内对此菌鲜有报道。本实验室从新生儿血培养中检出1株潘多拉菌,通过分子生物学基因测序后,再采用常规方法重新评估,详情报道如下。
1 临床材料 1.1 病例患者,男性,年龄23 d,因“全身皮肤黏膜黄染18 d”入院。入院时主要症状及体征如下:呼吸平稳,体温正常,全身皮肤黏膜黄染,以头面部、四肢、躯干为著,两肺呼吸音清,未闻及干湿啰音,精神反应欠佳。入院诊断为“新生儿黄疸:高胆红素血症?新生儿败血症?”主要实验室检查结果如下:经皮胆红素测定(2016年5月18日门诊)示215 μmol/L;梅毒螺旋体明胶凝集试验(Treponema pallidum particle agglutination assay,TPPA)阳性;梅毒甲苯胺红不加热血清反应素试验(toluidine red untreated serum test,TRUST)示1:2;血常规示白细胞6.59×109/L↓,中性粒细胞绝对值1.21×109/L↓,淋巴细胞3.85×109/L↑,中性粒细胞18.40%↓,淋巴细胞58.40%↑,嗜酸性粒细胞8.60%↑;血清学指标超敏C反应蛋白、C反应蛋白均正常;肝功能示总胆红素212.5 μmol/L↑,直接胆红素18.2 μmol/L↑,总胆汁酸14.00 μmol/L↑,总蛋白51.8 g/L↓,白蛋白36.9 g/L↓,白球比2.5↓,前白蛋白128 mg/L↓,谷氨酰转移酶155 U/L↑;大小便常规示正常。细菌学检查结果如下:2016年5月19日行血培养(梅里埃儿童瓶,单次) 15.12 h报阳,涂片显示为革兰阴性杆菌,培养及多次VITEK 2 Compact全自动微生物分析仪鉴定为尿道寡源杆菌,测序为潘多拉菌属。给予患者青霉素钠20万U、头孢哌酮/舒巴坦0.2 g治疗;10 d后根据细菌学结果,停用青霉素,使用氨苄西林钠0.2 g,并继续使用头孢哌酮/舒巴坦。1周后出院时,患儿全身皮肤黏膜无黄染,生命体征平稳,病情治愈,门诊随访。
1.2 仪器和方法 1.2.1 仪器BacT/ALERT 3D全自动血培养仪、VITEK 2 Compac全自动微生物鉴定及药敏分析仪和配套GN鉴定卡为法国梅里埃生物公司产品,KB法药敏纸片购自英国Oxoid公司,S1000TMThermal Cycler PCR仪为美国Bio-Rad公司产品,哥伦比亚血平板及巧克力平板购自郑州安图生物工程股份有限公司,快速革兰染色液购自珠海贝索生物技术有限公司。
1.2.2 方法培养及染色:采集患儿2~5 mL外周血注入梅里埃儿童血培养瓶中,置于BacT/ALERT 3D全自动血培养仪进行培养,报阳后转种于哥伦比亚血平板及巧克力平板,35 ℃、5% CO2培养24 h,对生长菌落进行快速革兰染色。生化鉴定及药敏试验:采用VITEK 2 Compac全自动微生物鉴定及药敏分析系统对菌株进行鉴定,选用GN鉴定卡,KB药敏法,具体操作按说明书进行。16S rRNA基因测序鉴定:rRNA基因序列的扩增及测序采用PrepManTM Ultra样品制备液,按操作说明书提取细菌总DNA。16S rRNA基因扩增采用广谱引物27f(5′-AGAGTTTGATCCTGGCTCAG-3′)与1492r(5′-GGTTACCTTGTTACGACTT-3′),使用Lysis Buffer for Microorganism to Direct PCR(TaKaRa)及2×Taq PCR MasterMix进行核酸提取并扩增。为保证PCR的准确性,分别以无菌去离子水、大肠埃希菌ATCC 25922作为阴性对照。扩增产物送广州艾基生物技术有限公司测序。
2 结果 2.1 形态和染色特性潘多拉菌为需氧菌,在哥伦比亚血平板及巧克力琼脂平板上35 ℃能生长,CO2培养箱中培养18~24 h,形成圆形、凸起、边缘整齐、表面光滑、直径0.5~1 mm大小的菌落(图 1)。革兰染色为阴性杆菌,无芽胞,呈宽0.55~0.7 μm、长4.0~15 μm的直杆菌,常单个出现。在心浸液琼脂上35 ℃培养18~24 h,可形成短至中等长度的直杆菌。其革兰染色形态见图 2。

|
| 图 1 哥伦比亚血平板、巧克力琼脂平板培养72 h Fig. 1 Culture on Columbia blood plate and chocolate agar plate for 72 h |

|
| 图 2 显微镜下形态(革兰染色) Fig. 2 Microscopic morphology (Gram staining) |
氧化酶、触酶阳性,生化反应不活跃,不发酵也不氧化糖类。硝酸盐还原、亚硝酸盐还原、尿素、鸟氨酸、赖氨酸、精氨酸、尿素酶阴性,γ-谷氨酰转移酶、L-脯氨酸芳胺酶、酪氨酸芳胺酶、柠檬酸盐(钠)、乳酸盐产碱、琥珀酸盐产碱、氨基乙酸芳胺酶、组氨酸同化、L-苹果酸盐同化、ELLAN、L-乳酸盐同化阳性。
由于美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)暂无此菌药敏解释标准,参照CLSI-M100中铜绿假单胞菌药敏解释标准进行KB法药敏试验(回顾性分析后,发现应参考非肠杆菌科细菌的药敏解释标准进行MIC法药敏试验)。对亚胺培南、四环素、复方磺胺甲唑、氨苄西林/舒巴坦敏感,对头孢他啶、庆大霉素、妥布霉素、哌拉西林、阿米卡星、氨曲南、头孢吡肟、环丙沙星、左氧氟沙星、美罗培南、替卡西林耐药,对哌拉西林/他唑巴坦中介(表 1)。
| 抗生素 | 敏感性 |
| 头孢他啶 | 耐药 |
| 阿米卡星 | 耐药 |
| 氨曲南 | 耐药 |
| 庆大霉素 | 耐药 |
| 妥布霉素 | 耐药 |
| 哌拉西林 | 耐药 |
| 头孢吡肟 | 耐药 |
| 环丙沙星 | 耐药 |
| 左氧氟沙星 | 耐药 |
| 美罗培南 | 耐药 |
| 替卡西林 | 耐药 |
| 亚胺培南 | 敏感 |
| 四环素 | 敏感 |
| 复方磺胺甲唑 | 敏感 |
| 氨苄西林/舒巴坦 | 敏感 |
| 哌拉西林/他唑巴坦 | 中介 |
进行靶向DNA测序,16S rRNA基因扩增可见单一清晰目的条带,与食草酸潘多拉菌(Pandoraea oxalativorans)序列相似度最高,为100%,但未高于第二相似度菌株痰潘多拉菌(Pandoraea sputorum) 0.8%,因此只能鉴定到潘多拉菌属(图 3)。
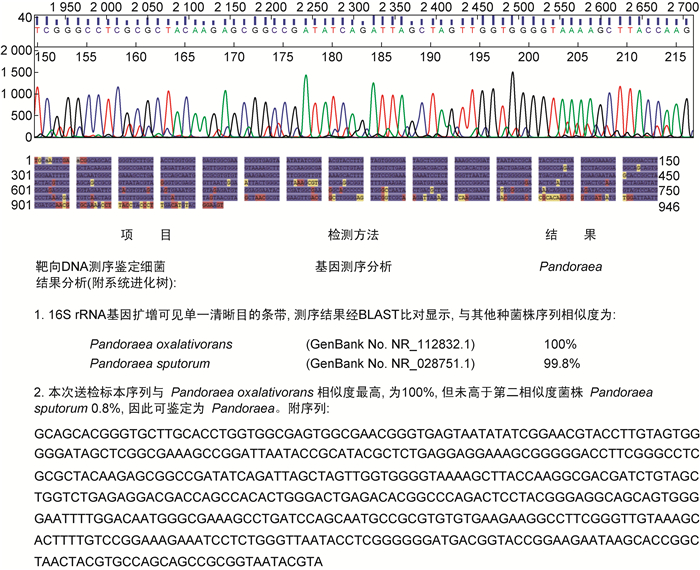
|
| 图 3 基因测序 Fig. 3 Gene sequencing |
潘多拉菌可分离自败血症和呼吸道感染(主要是囊性纤维化)患者,也可分离自非囊性纤维化患者的血培养和环境样本[3],其致病性尚未完全阐明。本研究中的菌株分离自疑似新生儿败血症患儿,与文献[4]中表述相似。
新生儿败血症是新生儿时期较常见的重症疾病,缺乏典型临床特征,尤其是体征、症状不明显,有多种表现形式。黄疸可能为唯一或突出表现,表现为黄疸突然加重或消退后反复出现,或一直不退。本例患儿出生5 d后开始黄疸,23 d黄疸加重,临床表现为黄疸,精神、食欲一般,睡眠一般。此患儿总蛋白51.8 g/L,白蛋白36.9 g/L,白球比2.5,前白蛋白128 mg/L,均偏低,且合并梅毒螺旋体感染(TPPA阳性,TRUST 1:2),母孕期有上呼吸道感染及梅毒病史、行青霉素治疗史。患儿免疫力低下,机体抵抗能力下降,白细胞及中性粒细胞未升高反而下降,淋巴细胞升高,C反应蛋白正常,单次血培养阳性。虽然临床表现符合报道中黄疸可能为败血症唯一表现,但不能确定为新生儿败血症。
根据新生儿败血症诊断标准[5],具有临床表现并符合下列任一项:①血培养培养出致病菌;②培养出条件致病菌,则需与另次(份)血培养出同种细菌,才能确定诊断为新生儿败血症。或具有临床表现且具备以下任一项:①非特异性检查如白细胞计数、白细胞分类、C反应蛋白、前降钙素、白细胞介素6(interleukin 6,IL-6)、血小板计数、微量法红细胞沉降率中,非特异性检查异常≥2项;②血标本病原菌抗原或DNA检测阳性才能临床诊断新生儿败血症。考虑到本实验室第1次分离到该菌,且后续也未分离到该菌,如果是污染,则该菌临床污染可能性大,污染源可能是医护人员、患者体表等。由于该菌致病性至今尚未完全阐明,临床无法判断是否为致病菌排除污染可能,所以临床怀疑新生儿败血症时,实验室应建议临床血培养至少同时采集2套血标本[2个不同采集部位和(或)不同采集时间],同时进行其他非特异性检查,结合临床表现,才能提高新生儿败血症的诊断率。
到目前为止,潘多拉菌的致病因子、致病机制及不同患者间的传播概率均不清楚,需更多的临床病例数据。临床常规微生物学方法对潘多拉菌属鉴定或种间鉴别较困难。本实验室采用VITEK2 Compact全自动微生物鉴定及药敏分析系统鉴定该菌为尿道寡源菌,鉴定率为94%。查阅尿道寡源菌相关文献,尿道寡源菌苯丙氨酸脱氨酶阳性[6],而本菌苯丙氨酸脱氨酶阴性,与其不一致,遂进行靶向DNA测序,测序结果为潘多拉菌属。此菌国内报道较少,主要是其易被鉴定为洋葱伯克霍尔德菌、皮克特罗尔斯顿菌或少见嗜铜菌[7-8],对可疑潘多拉菌应进一步利用分子生物学检测方法进行鉴定[9]。首先应用属特异性引物panF-panR鉴定为潘多拉菌属,然后利用种特异性引物[spuF-spuR(痰潘多拉菌、norF-norR(纽伦堡潘多拉菌)、pnoF-pnoR(呼吸潘多拉菌)、appuF-panR(背叛潘多拉菌、肺潘多拉菌)]进行潘多拉菌属间的鉴定[9]。结果表明,所有检测的灵敏度>97%,特异度>98%(呼吸潘多拉菌为82%),但不能对背叛潘多拉菌与肺潘多拉菌进行鉴别。该菌16S rRNA序列与食草酸潘多拉菌相似度为100%,但未高于第二相似度痰潘多拉菌0.8%,仅能报告潘多拉菌属。
本研究表明,潘多拉菌对青霉素类、头孢菌素类、美罗培南、氨基糖苷类、氯霉素、氟喹诺酮类耐药,对四环素、复方磺胺甲唑和亚胺培南敏感,β-内酰胺类抗生素/β-内酰胺酶抑制剂复合物对其也有较强抑菌活性,与文献[3, 10-12]基本一致。回顾分析发现,参考CLSI-M100铜绿假单胞菌的药敏解释标准进行判读实有不妥,且只进行KB法药敏试验未能提供具体MIC值,无法更好地指导临床用药(当时实验室仅开展KB法药敏试验),应参考其他非肠杆菌科细菌的MIC解释标准进行判读,从而有效指导临床治疗。
综上所述,目前常规临床微生物学方法很难将潘多拉菌正确鉴定到属或种的水平,分子生物学技术是最有效的手段[13]。临床分离到尿道寡源菌、洋葱伯克霍尔德菌、皮克特罗尔斯顿菌或少见嗜铜菌,如果怀疑潘多拉菌,建议进行分子生物学检测。该菌对多类抗生素耐药,临床需谨慎用药[14]。
| [1] |
Jeong SE, Lee HJ, Jia B, Jeon CO. Pandoraea terrae sp. nov., isolated from forest soil, and emended description of the genus Pandoraea Coenye et al. 2000[J]. Int J Syst Evol Microbiol, 2016, 66(9): 3524-3530.
[DOI]
|
| [2] |
Coenye T, Falsen E, Hoste B, Ohlén M, Goris J, Govan JR, Gillis M, Vandamme P. Description of Pandoraea gen. nov. with Pandoraea apista sp. nov., Pandoraea pulmonicola sp. nov., Pandoraea pnomenusa sp. nov., Pandoraea sputorum sp. nov. and Pandoraea norimbergensis comb. nov[J]. Int J Syst Evol Microbiol, 2000, 50(Pt 2): 887-899.
[PubMed]
|
| [3] |
Lipuma JJ. The changing microbial epidemiology in cystic fibrosis[J]. Clin Microbiol Rev, 2010, 23(2): 299-323.
[DOI]
|
| [4] |
李金钟, 刘利平. 潘多拉菌的分离鉴定及临床意义[J]. 国际检验医学杂志, 2009, 30(9): 876-878. [DOI]
|
| [5] |
中华医学会儿科学分会新生儿组, 中华医学会中华儿科杂志编辑委员会. 新生儿败血症诊疗方案[J]. 中华儿科杂志, 2003, 41(12): 897-899. [DOI]
|
| [6] |
陈东科, 孙长贵. 实用临床微生物学检验与图谱[M]. 北京: 人民卫生出版社, 2011: 463-464.
|
| [7] |
Bosshard PP, Zbinden R, Abels S, Böddinghaus B, Altwegg M, Böttger EC. 16S rRNA gene sequencing versus the API 20 NE system and the VITEK 2 ID-GNB card for identification of nonfermenting Gram-negative bacteria in the clinical laboratory[J]. J Clin Microbiol, 2006, 44(4): 1359-1366.
[DOI]
|
| [8] |
Pimentel JD, MacLeod C. Misidentification of Pandoraea sputorum isolated from sputum of a patient with cystic fibrosis and review of Pandoraea species infections in transplant patients[J]. J Clin Microbiol, 2008, 46(9): 3165-3168.
[DOI]
|
| [9] |
Henry DA, Mahenthiralingam E, Vandamme P, Coenye T, Speert DP. Phenotypic methods for determining genomovar status of the Burkholderia cepacia complex[J]. J Clin Microbiol, 2001, 39(3): 1073-1078.
[DOI]
|
| [10] |
Lim YL, Ee R, Yong D, Yu CY, Ang GY, Tee KK, Yin WF, Chan KG. Complete genome sequence analysis of Pandoraea pnomenusa type strain DSM 16536T isolated from a cystic fibrosis patient[J]. Front Microbiol, 2016, 7: 109.
[DOI]
|
| [11] |
Ambrose M, Malley RC, Warren SJ, Beggs SA, Swallow OF, McEwan B, Stock D, Roddam LF. Pandoraea pnomenusa isolated from an Australian patient with cystic fibrosis[J]. Front Microbiol, 2016, 7: 692.
[DOI]
|
| [12] |
Daneshvar MI, Hollis DG, Steigerwalt AG, Whitney AM, Spangler L, Douglas MP, Jordan JG, MacGregor JP, Hill BC, Tenover FC, Brenner DJ, Weyant RS. Assignment of CDC weak oxidizer group 2 (WO-2) to the genus Pandoraea and characterization of three new Pandoraea genomospecies[J]. J Clin Microbiol, 2001, 39(5): 1819-1826.
[DOI]
|
| [13] |
Greninger AL, Streithorst J, Golden JA, Chiu CY, Miller S. Complete genome sequence of sequential Pandoraea apista isolates from the same cystic fibrosis patient supports a model of chronic colonization with in vivo strain evolution over time[J]. Diagn Microbiol Infect Dis, 2017, 87(1): 1-6.
[DOI]
|
| [14] |
Martina PF, Martínez M, Frada G, Alvarez F, Leguizamón L, Prieto C, Barrias C, Bettiol M, Lagares A, Bosch A, Ferreras J, von Specht M. First time identification of Pandoraea sputorum from a patient with cystic fibrosis in Argentina: a case report[J]. BMC Pulm Med, 2017, 17(1): 33.
[DOI]
|
 2018, Vol. 13
2018, Vol. 13


