水痘-带状疱疹病毒(varicella-zoster virus,VZV)属疱疹病毒科α疱疹病毒亚科,人是其唯一宿主,初次感染后发生水痘。VZV具有嗜神经性,初次感染期间,可沿感觉神经上行,潜伏在背根和三叉神经节;当免疫力下降或在其他诱因下,可再次激活引起带状疱疹。日本学者Takahashi采用人胚肺成纤维细胞分离VZV Oka株,在人胚肺成纤维细胞、豚鼠胚成纤维细胞、人二倍体细胞WI-38和MRC-5中连续传代,建立了VZV Oka疫苗株(vOka)。全球各地广泛使用vOka株生产水痘疫苗,并用该毒株研制和生产带状疱疹疫苗,显示了良好的安全性和有效性[1-4]。用于生产疫苗的vOka株未经克隆纯化,含有许多不同的单基因型病毒。早期的Sanger法测序显示,vOka株与亲本株(pOka)之间至少存在42个位点的差异,除少数几个位点突变为疫苗型外,大部分位点为亲本型与疫苗型并存[5]。这些位点通常称为单核苷酸多态性(single nucleotide polymorphism,SNP)位点。随着研究的深入和测序技术的进步,更多关于各疫苗公司的Oka株病毒序列和SNP位点信息被报道。由于各疫苗公司毒种来源、建库方式、细胞基质及生产工艺等各不相同,疫苗病毒序列虽然非常相似,但仍存在一定的差异,不同批次之间也有差异[6-9]。本研究采用二代测序(next-generation sequencing,NGS)技术,对上海生物制品研究所有限责任公司(以下简称SIBP)不同年度生产的水痘疫苗进行病毒全基因组测序,分析疫苗质量的一致性,并与日本大阪大学微生物病研究会(BIKEN)vOka毒种及不同厂家疫苗病毒序列进行相关性比较。
1 材料与方法 1.1 材料选取SIBP于2015—2017年生产的3批水痘疫苗(以2015、2016和2017表示),以及国内A公司(以CompA表示)于2015年生产的水痘疫苗。病毒RNA/DNA提取试剂盒购自宝生物工程(大连)有限公司。
1.2 方法 1.2.1 病毒核酸的提取将每支疫苗用0.5 mL注射用水溶解,采用病毒RNA/DNA提取试剂盒提取水痘病毒基因组DNA,Qubit2.0定量核酸浓度。
1.2.2 测序将提取的病毒核酸样品送上海人类基因组研究中心进行样品纯度分析,采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit构建文库,于Illumina Hiseq2500测序仪进行测序。数据经clean后的序列,采用Bowtie2默认参数,与参考序列(vOka株,GenBank登录号:AB097932)进行mapping,生成consensus sequence序列,并统计每个碱基的组成和各自检出频率。
1.2.3 序列分析将疫苗的consensus sequence序列与vOka和pOka(GenBank登录号:AB097933)序列进行比较,与pOka相同的碱基为亲本型,突变碱基为疫苗型。根据疫苗型位点检出频率(proportion of vaccine-type allele,Pv),分析SNP位点及其碱基组成,并对SIBP 3个不同年度生产的疫苗的批间一致性、SIBP生产的疫苗与其他公司疫苗的相关性和差异位点进行分析。序列位点采用Dumas株(GenBank登录号:NC_001348)的位点编号;分析区间为基因组上游至开放读码框(open reading frame,ORF)69上游,不包括含有ORF69/ORF70/ORF71在内的反向末端重复短序列。
1.3 统计学分析采用GraphPad Prism 5软件对数据进行统计学分析,相关性分析采用Spearman法,平均值比较采用Mann-Whitney U检验,P<0.05为差异有统计学意义。
2 结果 2.1 SNP位点统计对SIBP于2015—2017连续3年生产的疫苗和CompA疫苗,采用NGS技术进行病毒全基因组测序,BIKEN工作种子批毒种、GSK公司水痘疫苗(n=2)和Merck公司水痘-带状疱疹疫苗(n=4)(由于毒种及序列的相似性,以下统称为水痘疫苗)的测序数据取自文献(采用Agilent公司的SureSelect XT v1.5标准程序制备DNA文库,于Illumina Miseq测序仪进行测序)[6]。不同疫苗序列Pv≥阈值的位点数见图 1。SIBP疫苗平均有77个位点Pv≥10%;46个位点Pv≥20%,在20%~80%区间分布较均匀;12个位点Pv≥90%。3批疫苗之间具有良好的一致性。从超过Pv阈值的疫苗型位点数量来看,SIBP和GSK公司的疫苗与BIKEN毒种非常接近,介于CompA与Merck公司之间,Merck公司Pv≥30%的疫苗型位点数量相对较低。
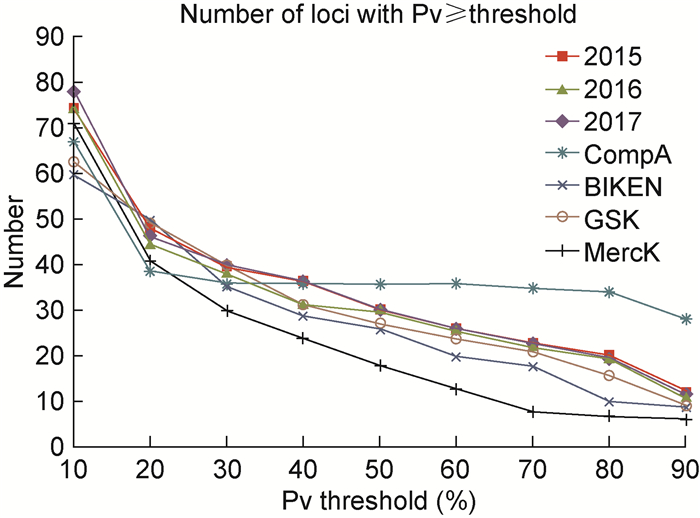
|
| 图 1 5种水痘疫苗/毒种Oka株病毒基因序列中Pv超过阈值的位点数量 Fig. 1 The number of loci with Pv exceeding threshold in the Oka viral genomes of 5 varicella vaccines/seed lot |
SIBP生产的3个年度疫苗中,至少出现2次Pv≥10%的位点数共76个,两两之间Pv最大差值<10%,与均值的最大差值<5%,差异率≥12%的位点均为低频疫苗型位点(Pv<22.4%)。共有40个位点Pv均值≥30%,其中19个位点导致氨基酸残基变异;15个位于ORF62区域。3批疫苗中这40个位点的Pv值见图 2,可看出3批疫苗具有良好的一致性。Sanger测序法检测到的混合碱基位点[9]被NGS法全部检出;NGS检出而Sanger法未检出的混合碱基位点中,仅1个位点Pv≥30%。
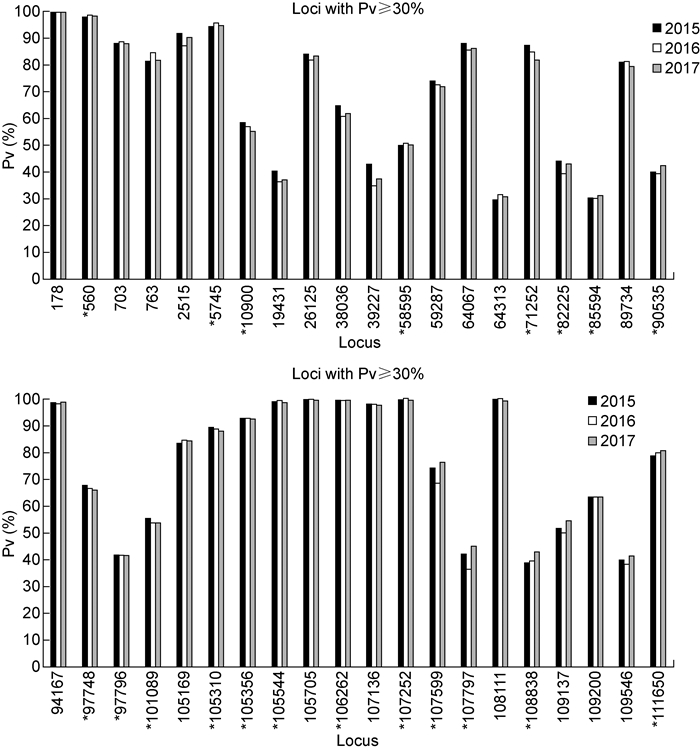
|
| *: Locus with amino acid variation. 图 2 SIBP水痘疫苗Oka株病毒基因序列中有40个位点的Pv均值≥30% Fig. 2 The 40 loci with Pv≥30% in the Oka viral genome of SIBP varicella vaccine |
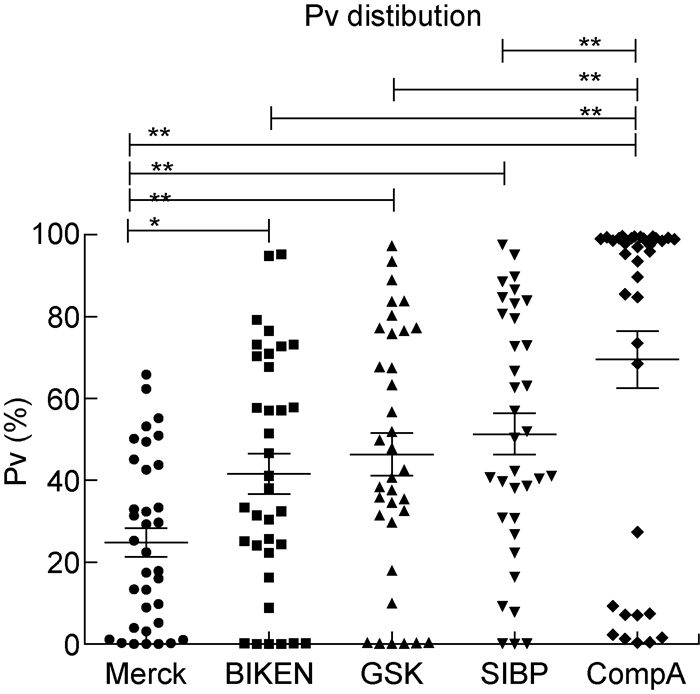
SIBP、CompA、GSK和Merck公司的水痘疫苗毒种源于Oka株,疫苗病毒基因序列、SNP位点及其碱基组成极其相似。但由于来源毒种的代次和制造工艺不同,各公司疫苗基因序列仍存在一些差异。为了解不同公司的疫苗/毒种在基因水平的特征和差异,对Pv≥30%的SNP位点进行比较研究。在SIBP、CompA、GSK和Merck公司疫苗病毒与BIKEN毒种的任意一个基因序列中,Pv≥30%的SNP位点共有48个,其中35个位点两两之间Pv最大差值≥30%。5种Oka株病毒中这35个位点的Pv见图 3。对35个位点的Pv进行Spearman相关性分析(表 1),结果表明4种疫苗均与BIKEN毒种显著相关,但相关程度存在差异。其中,GSK公司和SIBP均与BIKEN具有非常好的相关性,相关系数>0.9;Merck和CompA与BIKEN、GSK、SIBP的相关系数分别在0.4和0.6左右,但Merck与CompA相关性不显著。尽管Pv差异较大,但5种病毒SNP位点的碱基组成基本相同,仅个别序列在某些位点具有独特的突变。如Merck公司在8744(ORF7,N46)、106001(ORF62,K1045E),CompA在58868(ORF31,D621Y)有独特的碱基突变,未见于其他序列。总体看来,SIBP和GSK公司疫苗与BIKEN毒种有适中的Pv值,大部分介于其他两种疫苗之间;Merck公司的Pv整体偏小;CompA呈现两极分布,一部分SNP比其他疫苗更趋向于疫苗型,而另一部分则以野生型为主,基因组多态性不如其他病毒。采用Mann-Whitney U检验对5种疫苗/毒种在这35个位点的Pv均值进行比较(图 4),结果显示BIKEN、GSK和SIBP之间无显著差异;Merck与BIKEN之间差异显著(P<0.05);CompA与其他公司之间差异非常显著(P<0.01)。
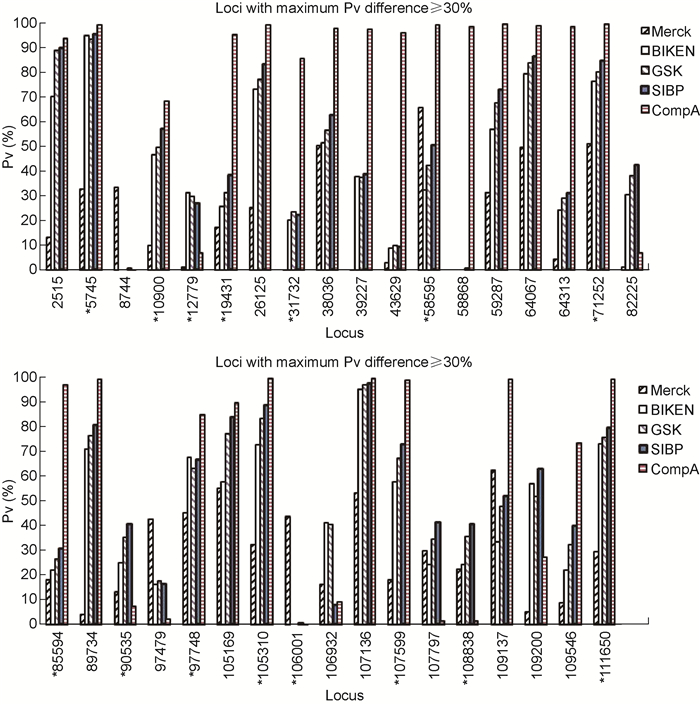
|
| *: Locus with amino acid variation. 图 3 5种水痘疫苗/毒种Oka株病毒基因序列中有35个位点的Pv值最大差异≥30% Fig. 3 The 35 loci in the Oka viral genomes of 5 varicella vaccines/seed lot with maximum difference of Pv≥30% |
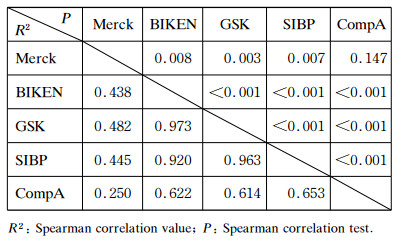
|
|
| *P < 0.05, **P < 0.01, Mann-Whitney U test. 图 4 5种水痘疫苗/毒种Oka株病毒基因序列在35个位点的Pv分布 Fig. 4 The distributions of Pv in 35 loci in the Oka viral genomes of 5 varicella vaccines/seed lot |
SIBP从BIKEN引进Oka株毒种及水痘疫苗生产技术,率先实现了水痘疫苗的国产化。GSK和Merck公司的水痘疫苗毒种也来自BIKEN。虽然毒种来源相同,各公司疫苗病毒序列之间仍存在一些差异,但同一产品的批间差异很小[8, 10-11]。我国有4种国产水痘疫苗上市,采用Sanger法对疫苗或毒种进行测序研究[9, 12-13]。本研究首次报道采用NGS对SIBP疫苗的测序结果,并与其他公司疫苗进行比较,从分子水平分析SIBP疫苗质量的一致性及与不同公司疫苗/毒种的相关性。SIBP在3个年度生产的水痘疫苗中,Pv≥10%和Pv≥30%的SNP位点分别为77个和40个,其中分别有28个和15个位于ORF62区域。ORF62及其上下游非编码区的变异被认为与疫苗减毒密切相关,Oka株病毒超过1/3的SNP位点位于该区域,与文献报道[6]相符。3批疫苗在SNP位点数量、碱基组成及Pv方面具有良好的一致性,批间Pv差值<10%,与平均值的差值<5%。研究结果表明,SIBP生产的水痘疫苗具有良好的病毒基因水平上的一致性。
以相同Oka株毒种制备的水痘疫苗和带状疱疹疫苗具有良好的批间一致性,但不同公司的水痘疫苗病毒序列仍具有明显的差异[6]。本研究对SIBP生产的水痘疫苗与其他3个公司的水痘疫苗及BIKEN毒种的NGS结果进行比较,结果表明,5种Oka株病毒序列总体上具有相似的SNP位点与碱基组成。进一步对35个存在较大差异的位点进行分析,发现SIBP、GSK公司疫苗与BIKEN毒种具有非常好的相似性,而它们与Merck及CompA公司疫苗差异较大。从毒种来源代次、采用的细胞基质及在其中传代的次数来看,SIBP与GSK公司疫苗较为相似,与Merck公司疫苗有些差异,这可能是造成最终疫苗中Oka株病毒基因组差异的主要原因。Depledge等发现,BIKEN毒种与GSK、Merck公司疫苗之间有共同的137个SNP核心位点[6],本研究中的35个位点均在此范围内。不同疫苗/毒种在基因序列上虽然存在微小差异,但在临床研究中均显示了良好的安全性和免疫原性。国外有一些疫苗所致水痘样皮疹或带状疱疹的研究报道,对分离病毒株进行序列分析,发现某些位点具有异常高的亲本型比例[14-16],由此引发是否有必要纯化毒种的思考。国内未见从疫苗所致病例中分离病毒的序列分析报道。
综上,本研究采用NGS对SIBP生产的水痘疫苗进行了病毒基因序列深度分析,获得了有关SNP位点、碱基组成和频率的详细信息,对疫苗的质量管理提供了基础数据。如能对各公司生产的同类疫苗积累多批数据,获得疫苗的SNP位点及碱基组成频率均值及范围,将有可能作为表征疫苗特性的指纹图谱,对疫苗的质量控制、偏差分析、安全性评价、疫苗相关疾病分析等提供线索与依据。
| [1] |
Quinlivan M, Breuer J. Clinical and molecular aspects of the live attenuated Oka varicella vaccine[J]. Rev Med Virol, 2014, 24(4): 254-273.
[DOI]
|
| [2] |
Yoshikawa T, Ando Y, Nakagawa T, Gomi Y. Safety profile of the varicella vaccine (Oka vaccine strain) based on reported cases from 2005 to 2015 in Japan[J]. Vaccine, 2016, 34(41): 4943-4947.
[DOI]
|
| [3] |
Goulleret N, Mauvisseau E, Essevaz-Roulet M, Quinlivan M, Breuer J. Safety profile of live varicella virus vaccine (Oka/Merck): five-year results of the European Varicella Zoster Virus Identification Program (EU VZVIP)[J]. Vaccine, 2010, 28(36): 5878-5882.
[DOI]
|
| [4] |
Willis ED, Woodward M, Brown E, Popmihajlov Z, Saddier P, Annunziato PW, Halsey NA, Gershon AA. Herpes zoster vaccine live: A 10-year review of post-marketing safety experience[J]. Vaccine, 2017, 35(52): 7231-7239.
[DOI]
|
| [5] |
Gomi Y, Sunamachi H, Mori Y, Nagaike K, Takahashi M, Yamanishi K. Comparison of the complete DNA sequences of the Oka varicella vaccine and its parental virus[J]. J Virol, 2002, 76(22): 11447-11459.
[DOI]
|
| [6] |
Depledge DP, Yamanishi K, Gomi Y, Gershon AA, Breuer J. Deep sequencing of distinct preparations of the live attenuated varicella-zoster virus vaccine reveals a conserved core of attenuating single-nucleotide polymorphisms[J]. J Virol, 2016, 90(19): 8698-8704.
[DOI]
|
| [7] |
Jeon JS, Won YH, Kim IK, Ahn JH, Shin OS, Kim JH, Lee CH. Analysis of single nucleotide polymorphism among varicella-zoster virus and identification of vaccine-specific sites[J]. Virology, 2016, 496: 277-286.
[DOI]
|
| [8] |
Kanda RK, Quinlivan ML, Gershon AA, Nichols RA, Breuer J. Population diversity in batches of the varicella Oka vaccine[J]. Vaccine, 2011, 29(17): 3293-3298.
[DOI]
|
| [9] |
袁萍, 谢蕾, 王月红, 黄帼英, 孙范玉, 刘朝阳, 周翎乔, 马雷钧, 石玮, 王亮, 朱为. 水痘疫苗生产工艺变更前后Oka株病毒基因序列及疫苗质量分析[J]. 国际生物制品学杂志, 2017, 40(5): 209-213. [DOI]
|
| [10] |
Depledge DP, Kundu S, Jensen NJ, Gray ER, Jones M, Steinberg S, Gershon A, Kinchington PR, Schmid DS, Balloux F, Nichols RA, Breuer J. Deep sequencing of viral genomes provides insight into the evolution and pathogenesis of varicella zoster virus and its vaccine in humans[J]. Mol Biol Evol, 2014, 31(2): 397-409.
[PubMed]
|
| [11] |
Tillieux SL, Halsey WS, Thomas ES, Voycik JJ, Sathe GM, Vassilev V. Complete DNA sequences of two Oka strain varicella-zoster virus genomes[J]. J Virol, 2008, 82(22): 11023-11044.
[DOI]
|
| [12] |
权娅茹, 陈震, 邱平, 崔晓雨, 李长贵, 袁力勇. 国产水痘减毒活疫苗关键基因的序列分析和比较[J]. 中国医学科学院学报, 2017, 39(5): 637-642. [DOI]
|
| [13] |
陈哲文, 金于兰, 瞿爱东, 马相虎, 王亮, 杨忠东. 水痘减毒活疫苗Oka株的传代稳定性[J]. 中国生物制品学杂志, 2010, 23(12): 1333-1337. [URI]
|
| [14] |
Loparev VN, Rubtcova E, Seward JF, Levin MJ, Schmid DS. DNA sequence variability in isolates recovered from patients with postvaccination rash or herpes zoster caused by Oka varicella vaccine[J]. J Infect Dis, 2007, 195(4): 502-510.
[DOI]
|
| [15] |
Quinlivan ML, Gershon AA, Al Bassam MM, Steinberg SP, LaRussa P, Nichols RA, Breuer J. Natural selection for rash-forming genotypes of the varicella-zoster vaccine virus detected within immunized human hosts[J]. Proc Natl Acad Sci USA, 2007, 104(1): 208-212.
[DOI]
|
| [16] |
Tseng HF, Schmid DS, Harpaz R, LaRussa P, Jensen NJ, Rivailler P, Radford K, Folster J, Jacobsen SJ. Herpes zoster caused by vaccine-strain varicella zoster virus in an immunocompetent recipient of zoster vaccine[J]. Clin Infect Dis, 2014, 58(8): 1125-1128.
[DOI]
|
 2018, Vol. 13
2018, Vol. 13


