随着人口老龄化、侵入性医疗操作的增加及广谱抗生素的应用,血流感染和侵袭性真菌感染逐年增加。侵袭性真菌病是重症监护室(intensive care unit,ICU)常见真菌病,病死率极高。白假丝酵母(Candida albicans,C. albicans;又称白念珠菌)是常见的条件性致病真菌,于正常人体呼吸道、消化道、泌尿生殖道均有定植。白念珠菌移位所致感染疾病居侵袭性真菌病首位[1-3]。临床上念珠菌血症的诊断主要依靠血培养,但目前阳性率不高,因此寻找早期白念珠菌感染的生物标记是迄需解决的难题。
代谢组学(metabonomics)是后基因组学时代兴起的跨领域学科,研究生命体被外界刺激后的病理生理变化及自身基因变化等导致的体内代谢水平的多元动态反应[4-5]。非靶向代谢组学是尽可能多地定性和相对定量生物体中的代谢物,最大限度地反映代谢物的特点。目前,超高效液相色谱-四级杆飞行时间串联质谱(ultra-high performance liquid chromatography/quadrupole-time-of-flight tandem mass spectrometry,UHPLC-Q-TOF-MS)已广泛用于代谢组学研究。亲水互相作用色谱(hydrophilic interaction liquid chromatography,HILIC)是专门针对极性极强的代谢物而开发的色谱柱,因为其有与反相液相色谱(reversed phase liquid chromato-graphy,RPLC)互补的选择性而得到广泛应用[6]。研究表明,亲水互相作用色谱-电喷雾电离四级杆飞行时间串联质谱(hydrophilic interaction liquid chromatography-electrospray ionization/quadrupole-time-of-flight mass spectrometry,HILIC-ESI-Q-TOF-MS)能提供中心碳循环代谢的最大信息量,受到很大关注[7]。本研究采用HILIC UHPLC-Q-TOF-MS技术结合数据依赖性采集方式对白念珠菌感染组和对照组进行全谱分析,同时获得一级质谱和二级质谱,然后采用XCMS软件对数据进行峰提取和代谢物鉴定,寻找两组的差异代谢物,为早期白念珠菌的诊断和治疗提供理论基础。
1 材料和方法 1.1 菌株来源及实验动物白念珠菌标准菌株ATCC 10231购自上海鲁微科技有限公司。40只无特定病原体(specific pathogen free,SPF)级雄性Wistar大鼠购于上海斯莱克实验动物有限公司,体重约250 g,其中20只用于构造白念珠菌感染模型,20只用于白念珠菌血流感染代谢组学分析。大鼠饲养于复旦大学附属上海市第五人民医院动物房,于实验前适应喂养2周。
1.2 仪器和试剂使用的仪器主要有:Triple TOF 5600+质谱仪(AB Sciex公司)、Agilent 1290 Infinity LC超高效液相色谱仪(Agilent公司)、Eppendorf低温高速离心机5430R (Eppendorf公司)、色谱柱(Waters公司;型号:ACQUITY UPLC BEH Amide column 1.7 μm,2.1 mm×100 mm)。试剂主要有:乙腈(Merck公司)、乙酸铵(Sigma公司)、沙氏培养基(Sabouraud dextrose agar,SDA)(上海鲁微科技有限公司)、水合氯醛(广州彬鹏公司)、氢化可的松(天津生物化学制药有限公司)。冻存管及EP管购自生工生物工程(上海)股份有限公司,实验用水均为Mili-Q纯水仪制备的去离子水。
1.3 方法 1.3.1 菌液配制及模型构造37 ℃条件下,将白念珠菌于沙氏培养基(2%琼脂、2%蛋白胨和4%葡萄糖)行平板分离培养,随后于沙氏液体培养基(2%蛋白胨和4%葡萄糖)中增殖培养,120 r/min摇菌48 h,测光密度(optical density,OD)并进行活菌计数,倍比稀释至1×1010 CFU/mL、1×109 CFU/mL、1×108 CFU/mL、1×107 CFU/mL、1×106 CFU/mL备用。于念珠菌感染大鼠前3 d,每只大鼠每天皮下注射氢化可的松25 mg,第4天用不同密度的菌液尾静脉注射感染大鼠,共5组,每组4只,注射量为1 mL/100 g。感染24 h后,通过心脏取血留1 mL全血,处死大鼠,取肾脏、脾脏和肝脏组织,每只大鼠每个器官取0.5 g组织,加入2 mL无菌生理盐水研磨成组织匀浆。将100 μL全血和组织匀浆于37 ℃沙氏培养基行平板分离并培养48 h,然后进行菌落计数。通过观察大鼠精神状态、感染24 h后器官中白念珠菌负荷及该时段内大鼠存活情况来筛选合适的模型。
1.3.2 动物模型建立将大鼠随机分为白念珠菌组10只、正常对照组10只。白念珠菌组注射白念珠菌菌液(2.5×108 CFU),建模方法同模型构造,正常对照组注射无菌生理盐水,注射量均为1 mL/100 g。白念珠菌组于感染后24 h通过心脏取血收集血液标本,放入乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝管中,4 ℃ 3 000 r/min离心10 min,取上清液,分装血浆并于-80 ℃储存。
1.3.3 样品预处理于4 ℃缓慢解冻后分装,每100 μL加入400 μL预冷的甲醇/乙腈(体积比1: 1)溶液,振荡混匀,-20 ℃静置10 min。4 ℃ 14 000 r/min离心15 min,取上清液,冻干,用100 μL乙腈/水(体积比1: 1)溶液复溶待用。
1.3.4 样品分析条件① 色谱条件:采用Agilent 1290 Infinity LC超高效液相色谱系统HILIC进行分离,柱温25 ℃,流速0.3 mL/min,进样量2 μL。流动相组成A:水+25 mmol/L乙酸铵+25 mmol/L氨水;组成B:乙腈。洗脱程序如表 1所示。②质谱条件:采用ESI模式。超高效液相色谱分离后,用Triple TOF 5600+质谱仪进行分析:雾化气气压60 psi(413 685 Pa),辅助气气压60 psi(413 685 Pa),气帘气压30 psi(206 842 Pa),温度600 ℃,毛细血管电压5 500 V,去簇电压±60 V,碰撞能量(35±15)eV。TOF-MS扫描范围:60~1 000 Da;子离子扫描范围:25~1 000 Da。TOF-MS扫描累积时间0.20 s/谱图,产物离子扫描累积时间0.05 s/谱图。二级质谱采用信息依赖性采集(information-dependent acquisition,IDA),高灵敏度模式。
| Time | Mobile phase A | Mobile phase B |
| 0-1 min | 5% A | 95% B |
| 1-14 min | 5% to 35 % A | 95% to 65 % |
| 14-16 min | 35%to 60%A | 65% to 40% |
| 16-18 min | 60% A | 40% B |
| 18-18.1 min | 60% to 5% A | 40% to 95% B |
| 18.1-23 min | 5% A | 95% B |
原始数据通过XCMS软件进行锋对齐、保留时间矫正和提取峰面积。对XCMS软件提取的数据,删除组别总和>2/3的离子峰,应用SIMCA-P14.1版本(瑞典Umetrics公司)进行模式识别,Pareto-scaling预处理后进行多维统计分析,包括无监督的主成分分析(principal component analysis,PCA)、有监督的偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)和正交偏最小二乘法判别分析(orthogonal PLS-DA,OPLS-DA)。选择变量投影重要度(variable importance in the projection,VIP)>1作为差异代谢物的选择标准,将这些差异代谢物的质核比(m/z)与网络数据库如HMDB(http://hmdb.ca)、METLIN(http://metlin.scripps.edu)等对比,初步确定差异物的相对分子质量及结构式,然后根据分子式及质谱图、标准品保留时间、质核比等确定差异代谢物。采用R(3.4.4版本)软件对代谢物的样品表达进行聚类分析。采用GraphPad 6软件进行统计分析,差异代谢物的单变量比较采用t检验,P<0.05为差异有统计学意义。根据白念珠菌组与对照组的差异代谢物建立受试者工作特征曲线(receiver operating characteristic curve,ROC),计算曲线下面积(area under curve,AUC)及95% CI。最后,在KEGG网站(http://www.kegg.jp)对代谢物进行Pathway富集分析。
2 结果 2.1 大鼠模型对沙氏培养基上的菌落进行计数,大鼠内脏分布的白念珠菌负荷如表 2所示。挑选感染后24 h时肝脏、脾脏、肾脏及血液中均有白念珠菌菌落且存活的大鼠的白念珠菌密度作为建模所需的白念珠菌密度。
| Tissue | 1a | 1b | 1c | 1d | 2a | 2b | 2c | 2d | 3a | 3b | 3c | 3d | 4a | 4b | 4c | 4d | 5a | 5b | 5c | 5d |
| Kidney | The rats died within 24 h. No living blood and tissue specimens were obtained | The rats died within 24 h. No living blood and tissue specimens were obtained | 1 000 | 1 000 | <10 | 100 | <10 | 100 | 10 | 10 | 0 | <10 | 0 | 0 | <10 | |||||
| Spleen | 100 | 10 | <10 | <10 | 0 | 0 | <10 | 0 | 0 | 0 | 0 | 0 | 0 | |||||||
| Liver | 10 | <10 | 0 | 0 | <10 | <10 | 0 | 10 | 0 | 0 | <10 | 0 | 0 | |||||||
| Blood | <10 | <10 | 0 | <10 | 0 | <10 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |||||||
| Approximate CFU of Candida per 100 mL of tissue homogenates or blood cultured on SDA plates. | ||||||||||||||||||||
建模结果如表 2所示,第1组大鼠(注射2.5×1010 CFU白念珠菌)于16 h内全部死亡,未取血液及器官样本;第2组大鼠(注射2.5×109 CFU白念珠菌)于24 h内死亡3只,存活大鼠的血培养及肝、脾、肾组织匀浆中白念珠菌培养均阳性;第3组大鼠(注射2.5×108 CFU白念珠菌)于24 h内全部存活,2只血培养阳性,大部分器官组织匀浆中白念珠菌培养阳性,符合本研究系统性白念珠菌感染的建模要求;第4、5组(注射2.5×107 CFU、2.5×106 CFU白念珠菌)大鼠于24 h内全部存活,仅1只血培养阳性,组织匀浆中均培养出白念珠菌,但阳性率较低,发现白念珠菌血流感染早期易发生于泌尿系统。第1~4组大鼠感染白念珠菌后24 h出现精神萎靡、饮食不积极、嗜睡、活动不积极、尾巴毛湿润等症状。
2.2 血浆代谢谱图采用OPLS-DA、PLS-DA、PCA模型分别进行模式识别,结果见图 1。PCA、OPLS-DA及PLS-DA均能区分两组。PCA模型的参数主要参考R2X的值,R2X越接近1,表明模型越稳定可靠,一般R2X>0.5的模型可靠性较好。对两组进行PCA分析,R2X为0.601时PCA模型能较好地区分两组。R2Y和Q2分别为SIMCA软件中PLS-DA和OPLS-DA模型的参数,R2Y表示模型对Y轴的解释能力,Q2表示模型的预测能力。R2Y和Q2越接近1,表明模型越稳定可靠,一般Q2>0.5的模型稳定可靠。PLS-DA模型中,R2Y为0.976,Q2为0.834,表示PLS-DA模型能解释两组97.6%的差异,准确预测样品组别83.4%。OPLS-DA模型中,R2Y为0.976,Q2为0.886,表示OPLS-DA模型能解释两组97.6%的差异,准确预测样品组别88.6%。结果提示,OPLS-DA、PLS-DA、PCA均能很好地鉴别白念珠菌组与对照组,两组代谢物的生物差异明显。
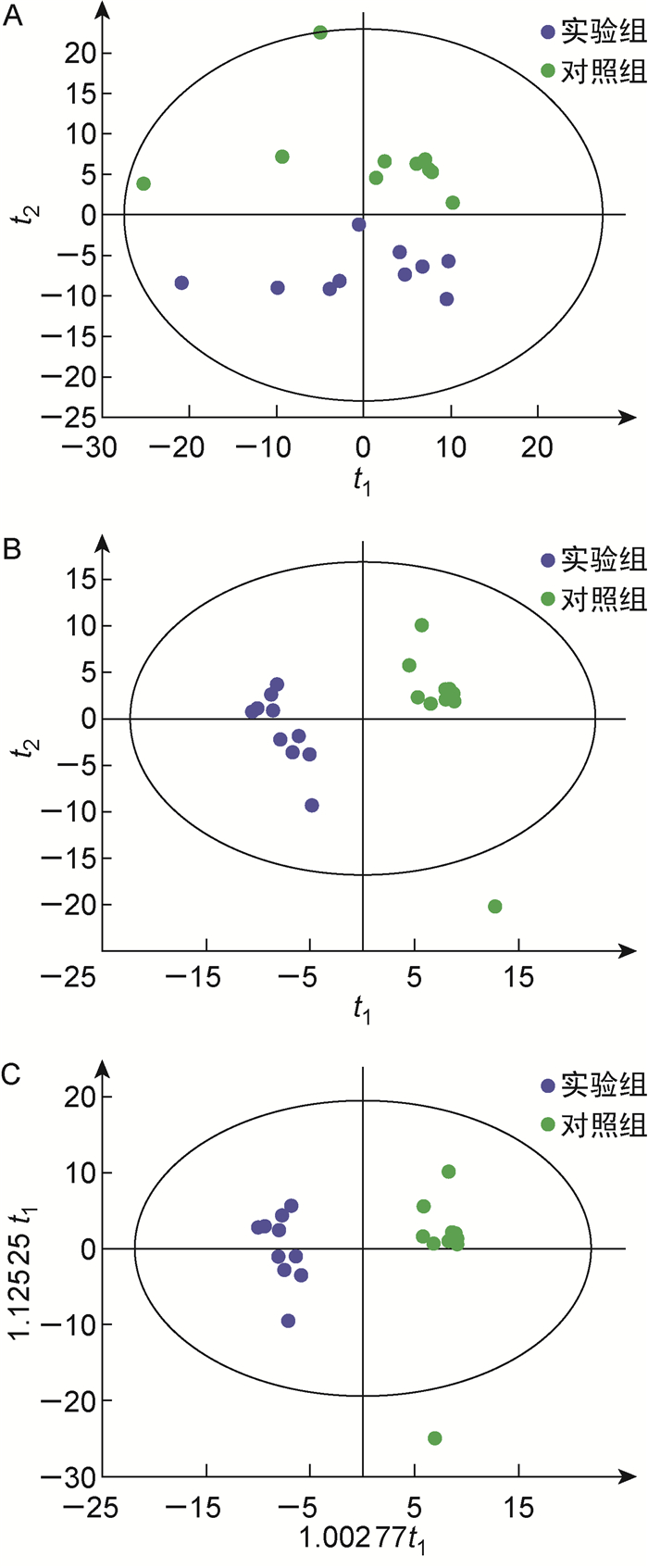
|
| A: PCA. B: PLS-DA. C: OPLS-DA 图 1 PCA、PLS-DA和OPLS-DA二维得分图 Fig. 1 2D PCA, PLS-DA and OPLS-DA score maps |
通过计算PLS-DA模型中的VIP值来衡量各代谢物的表达模式对各组样本分类判别的影响强度和解释能力。一般以VIP>1作为候选蛋白标记的标准。本研究选择同时具有多维统计分析筛选标准(VIP>1)和单变量统计分析筛选标准(P<0.05)的代谢物作为具有显著性差异的代谢物,VIP>1且0.05<P<0.1的代谢物则作为差异代谢物,最终确定18个代谢产物为差异标记(表 3)。
| Name | Adduct | Description | VIP | P value | m/z | t value |
| M182T560 | (M+H)+ | L-Tyrosine | 1.050 83 | 1.58×10-7 | 182.080 4 | 8.248 |
| M188T476 | (M+H-H2O)+ | Indolelactic acid | 2.583 61 | 1.58×10-6 | 188.069 9 | 6.991 |
| M468T332 | (M+H)+ | LysoPC(14: 0) | 2.012 81 | 1.8×10-6 | 468.306 5 | 6.924 |
| M426T393 | (M+NH4)+ | Cholic acid | 1.467 94 | 3.82×10-6 | 426.319 7 | 6.537 |
| M522T350 | (M+H)+ | LysoPC(18: 1(9Z)) | 4.349 76 | 5.84×10-5 | 522.352 3 | 5.215 |
| M524T348_2 | (M+H)+ | LysoPC(18: 0) | 7.416 54 | 0.000 202 | 524.369 2 | 4.643 |
| M205T476 | (M+H)+ | L-Tryptophan | 1.708 34 | 0.000 479 | 205.096 4 | 4.252 |
| M196T159 | (M+NH4)+ | L-Gulonic acid γ-lactone | 1.421 94 | 0.000 645 | 196.080 5 | 4.119 |
| M132T513 | (M+H)+ | L-Leucine | 1.014 37 | 0.002 575 | 132.101 | 3.497 |
| M410T236 | (M+NH4)+ | Chenodeoxycholate | 3.200 86 | 0.007 323 | 410.325 | 3.022 |
| M153T143 | (M+H)+ | N1-methyl-2-pyridone-5-carboxamide | 1.032 65 | 0.013 687 | 153.064 9 | 2.732 |
| M190T138 | (M+H)+ | 3-Indolepropionic acid | 2.542 5 | 0.013 88 | 190.085 4 | 2.725 |
| M146T707 | (M+H)+ | Acetylcholine | 1.914 51 | 0.014 087 | 146.116 7 | 2.718 |
| M61T174 | (M+H)+ | Urea | 1.106 78 | 0.015 415 | 61.039 08 | 2.676 |
| M757T260 | (M+Na)+ | PC(16: 0/16: 0) | 1.924 44 | 0.015 539 | 756.551 3 | 2.672 |
| M568T280 | (M-H+2Na)+ | 1-Stearoyl-sn-glycerol 3-phosphocholine | 1.797 81 | 0.019 56 | 568.336 6 | 2.563 |
| M118T509 | (M+H)+ | Betaine | 3.422 91 | 0.032 508 | 118.085 4 | 2.317 |
| M243T175 | (M+H)+ | Thymidine | 1.058 98 | 0.040 061 | 243.096 5 | 2.213 |
对质谱采集及筛选的候选生物标记在白念珠菌组与对照组之间的差异进行t检验和ROC分析,进一步筛选和评价。结果显示,这18个代谢产物在白念珠菌组血浆与对照组血浆中有明显差异(P<0.05)(表 3)。其中LysoPC(14: 0)、LysoPC(18: 1(9Z))、LysoPC(18: 0)、L-Tryptophan、L-Gulonic acid γ-lactone这5个代谢物AUC值均>0.90(图 2,表 4)。
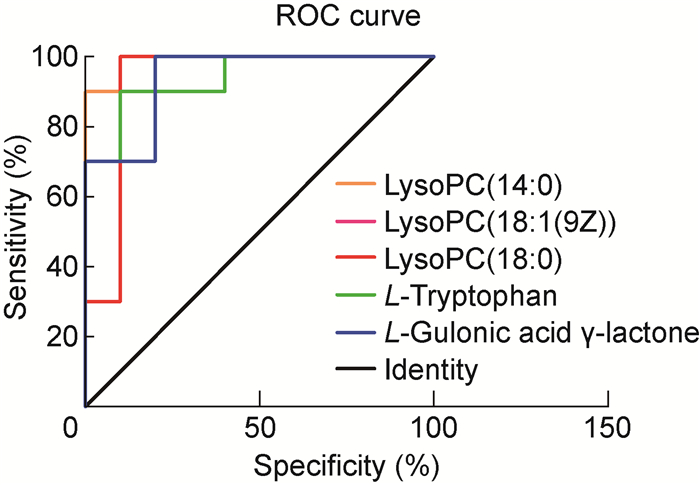
|
| 图 2 候选标记的ROC分析 Fig. 2 ROC analysis of candidate biomarkers |
| Description | AUC | 95%CI |
| LysoPC(14: 0) | 0.990 0 | 0.958 3-1.000 0 |
| LysoPC(18: 1(9Z)) | 0.930 0 | 0.794 0-1.000 0 |
| LysoPC(18: 0) | 0.930 0 | 0.794 0-1.000 0 |
| L-Tryptophan | 0.940 0 | 0.839 7-1.000 0 |
| L-Gulonic acid γ-lactone | 0.940 0 | 0.794 0-1.000 0 |
为更加直观地显示代谢物的差异性及代谢物在各组中的表达差异,对差异代谢物的表达进行层次聚类(hierarchical clustering),结果见图 3。将得到的差异代谢物提交至KEGG网站,获得33条代谢相关通路。分析相关通路,mTOR信号通路及cAMP信号通路引起了关注(图 4)。
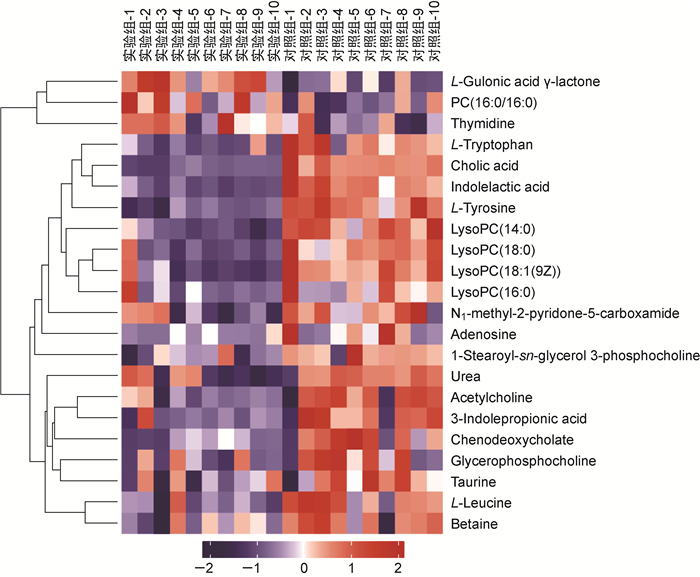
|
| 图 3 聚类分析图 Fig. 3 Cluster analysis |
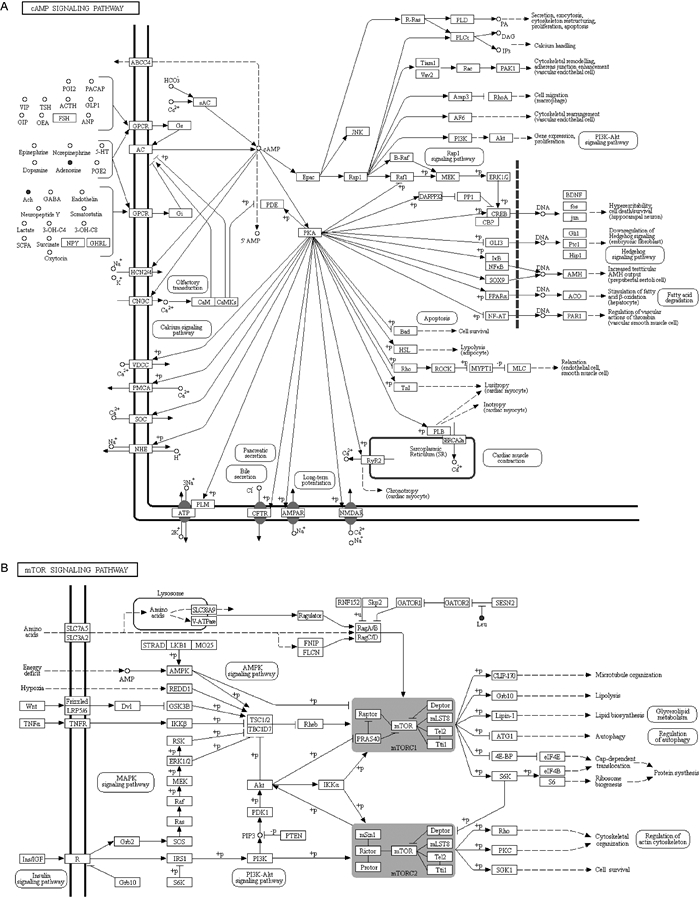
|
| A: cAMP pathway. B: mTOR pathway. 图 4 KEGG上富集到的cAMP通路和mTOR通路 Fig. 4 The cAMP pathway and mTOR pathway enriched on KEGG |
近年来,随着肿瘤发病率上升、人口老龄化及广谱抗生素应用,深部真菌感染已成为重要的医院内感染。尽管不断有新的抗真菌药物出现,但侵袭性真菌病的病死率仍居高不下,带来了沉重的医疗负担。白念珠菌感染是ICU常见真菌病,病死率极高[8],但其确证主要依靠阳性率并不高的血培养,因此如何早期诊断和有效控制成为刻不容缓的公共卫生话题。目前,国内外对白念珠菌的研究主要集中在基因组学和蛋白组学,代谢组学研究较少。但代谢物是细胞调控过程的终产物,其种类和数量变化被视为宿主对基因或环境变化刺激的最终响应,与生物体的功能活动变化有更加直接的联系。
本研究采用HILIC UHPLC-Q-TOF-MS技术结合数据依赖性采集方式,对白念珠菌感染组和对照组进行全谱分析,获得一级质谱和二级质谱,寻找两组的差异代谢物。对数据进行矫正和归一化处理后,采用SIMCA软件对数据进行判别。PCA是一种非监督的数据分析方法,将原本鉴定到的所有代谢物重新进行线性组合,形成一组新的综合变量,根据所分析的问题从中选取几个综合变量,使它们尽可能多地反映原有变量的信息,从而达到降维的目的[9]。与PCA不同,PLS-DA和OPLS-DA为有监督的判别分析统计方法[10],采用它们建立代谢物表达量与样品类别之间的关系模型,可实现对样品类别的预测[11]。OPLS-DA是在PLS-DA的基础上进行修正,滤除与分类信息无关的噪声,提高了模型的解析能力和有效性[12]。本研究中这3种模型均能将白念珠菌组与对照组区分,表明两组代谢物存在生物差异。OPLS-DA和PLS-DA通过R2Y和Q2对模型进行评价,比PCA通过单一的R2X对模型进行评价有更好的稳定性。PCA非监督的模型判别可能受实验误差、生物个体差异等因素的干扰。OPLS-DA通过正交方法滤除无关噪声,可提高模型判别效率。
本研究结果表明,白念珠菌组与对照组大鼠血浆代谢组学存在明显差异,最终确定18个代谢产物可能为白念珠菌代谢差异产物,大部分属短肽类,主要参与代谢、碳循环、保持细胞膜的稳定性及维持生理稳态。其中,L-色氨酸、吲哚乳酸及L-亮氨酸已有其他文献证实在维护肠道稳态、防止肠源性念珠菌移位、维持哺乳动物肠道免疫平衡中发挥重要作用[13-14]。白念珠菌可通过改变宿主的色氨酸代谢来抑制白细胞介素17(interleukin 17,IL-17)的产生及调节IL-22的产生,从而改变宿主抗真菌的防御能力[13, 15-16]。本研究中L-色氨酸的高表达可能与宿主体液免疫激活有关。L-亮氨酸是宿主免疫和肾脏疾病中的重要代谢产物,亮氨酸及亮氨酸氨基肽酶在急性肝损伤、肾损伤和慢性肾脏疾病中升高。本研究中亮氨酸升高可能与白念珠菌血症导致肾脏损伤有关。既往研究证实,LysoPC有抗感染和抗炎作用[17-18],本研究质谱结果也显示LysoPC增高,可能与宿主抗感染代谢途径有关。LysoPC(14: 0)、LysoPC(18: 1(9Z))、LysoPC(18: 0)、L-Tryptophan、L-Gulonic acid γ-lactone这5个代谢物AUC值均>0.90,高于G实验用于深部真菌诊断的AUC值0.83及真菌血培养的AUC值0.73[19-20]。本研究是对白念珠菌感染生物标记进行的初步探索,所得结论需更多临床样本来验证和支持。在富集到的33条通路中,mTOR信号通路及cAMP信号通路引起注意。mTOR信号通路通过整合细胞外的营养、能量及生长因子等多种信号来调节宿主免疫应答,是细胞自噬的关键调节点。本研究在通路分析中所富集到的mTOR信号通路可能与宿主通过抑制mTOR来调节自身免疫应答以应对真菌感染有关。此外,cAMP信号通路是一条细胞内经典信号通路,细胞受外界刺激后可通过cAMP信号通路调节细胞内基因转录,这条通路的激活可能与白念珠菌引起的促炎反应有关。
本研究表明,采用UHPLC-Q-TOF-MS研究白念珠菌感染Wistar大鼠中血浆代谢物方法可行,PCA、OPLS-DA及PLS-DA均可区分代谢物的差异表达。OPLS-DA及PLS-DA通过有监督的方法减少误差,为寻找白念珠菌早期感染的血浆代谢标记奠定了基础。初步筛选出的18个差异代谢物,可能是大鼠血浆代谢差异物。本研究也有不足之处:首先,建立模型时,由于设备条件有限,未能在更早时间(12 h内)建立白念珠菌感染模型而更早诊断和治疗白念珠菌感染以降低病死率。其次,用于质谱检测的样本量较小,进行标记评价时可能导致检验效能降低。最后,本研究为白念珠菌血症生物标记的初步探索,缺乏后续的标记验证。未来将在白念珠菌感染患者血浆中做进一步的靶向验证,为早期诊断和治疗提供可靠的临床依据。
| [1] |
李光辉, 朱德妹, 汪复, 倪语星, 孙景勇, 徐英春, 张小江, 胡云建, 艾效曼, 俞云松, 杨青, 孙自镛, 陈中举, 贾蓓, 黄文祥, 卓超, 苏丹虹, 魏莲花, 吴玲, 张朝霞, 季萍, 王传清, 王爱敏, 张泓, 孔菁, 徐元宏, 沈继录, 单斌, 杜艳. 2010年中国CHINET血流感染的病原菌分布及耐药性[J]. 中国感染与化疗杂志, 2012, 12(4): 251-258. [DOI]
|
| [2] |
吴昌德, 郭凤梅, 邱海波. 中国ICU患者侵袭性念珠菌感染现状[J]. 中国医刊, 2018, 53(6): 585-587. [DOI]
|
| [3] |
刘蓉, 乔莉, 张劲松. 念珠菌血流感染病原学及影响预后的危险因素分析[J]. 临床急诊杂志, 2015, 16(1): 5-8. [URI]
|
| [4] |
许国旺, 路鑫, 杨胜利. 代谢组学研究进展[J]. 中国医学科学院学报, 2007, 29(6): 701-711. [DOI]
|
| [5] |
Nicholson JK, Lindon JC, Holmes E. 'Metabonomics': understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29(11): 1181-1189.
[DOI]
|
| [6] |
Plumb RS, Granger JH, Stumpf CL, Johnson KA, Smith BW, Gaulitz S, Wilson ID, Castro-Perez J. A rapid screening approach to metabonomics using UPLC and oa-TOF mass spectrometry: application to age, gender and diurnal variation in normal/Zucker obese rats and black, white and nude mice[J]. Analyst, 2005, 130(6): 844-849.
[DOI]
|
| [7] |
Ivanisevic J, Zhu ZJ, Plate L, Tautenhahn R, Chen S, O'Brien PJ, Johnson CH, Marletta MA, Patti GJ, Siuzdak G. Toward 'omic' scale metabolite profiling: a dual separation—mass spectrometry approach for coverage of lipids and central carbon metabolism[J]. Anal Chem, 2013, 85(14): 6876-6884.
[DOI]
|
| [8] |
汪甜, 叶燕青, 潘庭静. 真菌血流感染临床特点及危险因素分析[J]. 临床内科杂志, 2016, 33(7): 475-478. [DOI]
|
| [9] |
阿基业. 代谢组学数据处理方法——主成分分析[J]. 中国临床药理学与治疗学, 2010, 15(5): 481-489. [URI]
|
| [10] |
Surmacki J, Brozek-Pluska B, Kordek R, Abramczyk H. The lipid-reactive oxygen species phenotype of breast cancer. Raman spectroscopy and mapping, PCA and PLSDA for invasive ductal carcinoma and invasive lobular carcinoma. Molecular tumorigenic mechanisms beyond Warburg effect[J]. Analyst, 2015, 140(7): 2121-2133.
[DOI]
|
| [11] |
柯朝甫, 武晓岩, 侯艳, 李康. 偏最小二乘判别分析交叉验证在代谢组学数据分析中的应用[J]. 中国卫生统计, 2014, 31(1): 85-87. [URI]
|
| [12] |
Westerhuis JA, van Velzen EJ, Hoefsloot HC, Smilde AK. Multivariate paired data analysis: multilevel PLSDA versus OPLSDA[J]. Metabolomics, 2010, 6(1): 119-128.
[URI]
|
| [13] |
Zelante T, Iannitti RG, Cunha C, De Luca A, Giovannini G, Pieraccini G, Zecchi R, D'Angelo C, Massi-Benedetti C, Fallarino F, Carvalho A, Puccetti P, Romani L. Tryptophan catabolites from microbiota engage aryl hydrocarbon receptor and balance mucosal reactivity via interleukin-22[J]. Immunity, 2013, 39(2): 372-385.
[DOI]
|
| [14] |
Cervantes-Barragan L, Chai JN, Tianero MD, Di Luccia B, Ahern PP, Merriman J, Cortez VS, Caparon MG, Donia MS, Gilfillan S, Cella M, Gordon JI, Hsieh CS, Colonna M. Lactobacillus reuteri induces gut intraepithelial CD4+CD8αα+ T cells[J]. Science, 2017, 357(6353): 806-810.
[DOI]
|
| [15] |
Cheng SC, Joosten LA, Kullberg BJ, Netea MG. Interplay between Candida albicans and the mammalian innate host defense[J]. Infect Immun, 2012, 80(4): 1304-1313.
[DOI]
|
| [16] |
Brown AJ, Brown GD, Netea MG, Gow NA. Metabolism impacts upon Candida immunogenicity and pathogenicity at multiple levels[J]. Trends Microbiol, 2014, 22(11): 614-622.
[DOI]
|
| [17] |
Hung ND, Kim MR, Sok DE. Mechanisms for anti-inflammatory effects of 1--[15(S)-hydroxyeicosapentaenoyl] lysophosphatidylcholine, administered intraperitoneally, in zymosan A-induced peritonitis[J]. Br J Pharmacol, 2011, 162(5): 1119-1135.
[URI]
|
| [18] |
Shi Y, Zhang P, Zhang L, Osman H, Mohler ER 3rd, Macphee C, Zalewski A, Postle A, Wilensky RL. Role of lipoprotein-associated phospholipase A2 in leukocyte activation and inflammatory responses[J]. Atherosclerosis, 2007, 191(1): 54-62.
[DOI]
|
| [19] |
冉宝才, 胡仁静, 胡锡池. 血浆1, 3-β-D葡聚糖的检测在深部真菌感染诊断中的应用价值[J]. 国际检验医学杂志, 2017, 38(13): 1770-1772, 1775. [DOI]
|
| [20] |
黄云昆, 史玉芹, 朱雯梅, 王佳, 姚瑶. 血浆(1, 3)-β-D葡聚糖检测对深部真菌感染诊断的临床评价[J]. 检验医学与临床, 2013, 10(5): 520-521, 523. [DOI]
|
 2019, Vol. 14
2019, Vol. 14

