结核病是由结核分枝杆菌(Mycobacterium tuberculosis,M. tuberculosis)引起的慢性传染病。尽管过去几十年结核病防治工作取得了重大进展,但结核病仍是全球头号传染病杀手。2018年世界卫生组织全球结核病报告显示,2017年全球有1 000万人患结核病,160万人死于结核病,且耐多药结核病对公共卫生安全的威胁越发严峻。因此,探索抗结核药物作用新靶点,研发新型抗结核药物显得尤为重要。
核糖体拯救途径对细菌拯救熄火核糖体(也叫非终止核糖体复合物)至关重要,主要包括由tmRNA-SmpB介导的反式翻译途径及ArfA和ArfB分别介导的两种替代途径[1-3]。反式翻译是绝大多数细菌体内存在的主要核糖体拯救途径[4],其作用机制是当mRNA在核糖体上翻译突然终止时,由ssrA基因编码的tmRNA中的开放读码框(open reading frame,ORF)被嵌入到核糖体解码中心的密码子缺失位置,此时以tmRNA作为mRNA而恢复翻译过程,直到ORF末端的终止密码子处终止,最终释放的蛋白因含有ssrA基因的标签肽序列而被ClpXP、Lon等蛋白酶识别并水解[5-8]。当反式翻译过程失活或表达受到抑制时,有些细菌如大肠埃希菌会启动由ArfA(YhdL)或ArfB(YaeJ)介导的核糖体拯救途径[9-13]。然而,迄今为止在结核分枝杆菌中没有发现能替代反式翻译这一拯救途径的因子。已有研究表明,tmRNA及其结合蛋白SmpB在结核分枝杆菌中均为必需基因[14-15],反式翻译过程对结核分枝杆菌的生长及其生理功能的调控发挥着重要作用。例如,抗结核重要药物丙嗪酰胺(pyrazinamide,PZA)可抑制结核分枝杆菌的反式翻译途径而达到杀菌目的[16-17]。因此,深入探究反式翻译在结核分枝杆菌中的功能及将其作为靶点研发新型抗结核药物具有重要意义。
为快速探究反式翻译在分枝杆菌中的表达及功能特点,本研究以快生长的耻垢分枝杆菌(Mycobacterium smegmatis,M. smegmatis,Msm)为实验菌株,选取mCherry和egfp作为报告基因,成功构建了能在耻垢分枝杆菌中反映反式翻译动态表达水平的报告体系。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒大肠埃希菌(DH5α)、耻垢分枝杆菌为本实验室保存菌株,pMV261穿梭质粒为本实验室保存质粒。
1.1.2 试剂PrimeSTAR HS DNA Polymerase、工具酶BamH Ⅰ和Hind Ⅲ均购自TaKaRa公司,T4 DNA连接酶购自New England Biolabs公司,琼脂糖凝胶电泳回收试剂盒、质粒抽提试剂盒购自Axygen公司,Middlebrook 7H9和7H10购自BD公司,BCA蛋白定量试剂盒购自北京艾德莱生物科技有限公司,ECL Prime Western Blotting Detection Reagent购自GE Healthcare公司。其他试剂均为实验室常用分析纯试剂。
1.1.3 引物设计为使菌株能表达非成熟错误蛋白,设计引物时,在报告基因3'端缺失终止密码子的情况下添加大肠埃希菌终止子序列(表 1中的下划线序列),来诱导mRNA非成熟的转录终止。以下所有标写mCherry-T和EGFP-T名称的基因,均为在报告基因末端添加了终止子序列而设计的启动基因。所有引物均由上海睿迪生物科技有限公司合成,设计序列详见表 1。
| Primer | Sequence (5'-3') |
| mCherry F | 5'-AAAGGATCCATGGTGAGCAAGGGCGA-3' |
| mCherry R | 5'-TTTAAGCTTTCACTTGTACAGCTCGTCCATG-3' |
| mCherry-T R | 5'-TTTAAGCTTAAAAAAGCCCGCTCATTAGGCGGGCTGCCTTGTACAGCTCGT-3' |
| EGFP F | 5'-AAAGGATCCGTGAGCAAGGGCGAGGAGC-3' |
| EGFP R | 5'-TTTAAGCTTTTACTTGTACAGCTCGTC-3' |
| EGFP-T R | 5'-TTTAAGCTTAAAAAAGCCCGCTCATTAGGCGGGCTGCCTTGTACAGCTCGT-3' |
mCherry、mCherry-T、EGFP、EGFP-T目的基因分别用引物对mCherry F/mCherry R、mCherry F/mCherry-T R、EGFP F/EGFP R、EGFP F/EGFP-T R进行扩增。获得4种目的基因的聚合酶链反应(polymerase chain reaction,PCR)产物,纯化,进行BamHⅠ和HindⅢ酶切,于含有T4 DNA连接酶的体系中分别与BamH Ⅰ和HindⅢ双酶切后的pMV261质粒载体片段进行连接。将连接产物转化至大肠埃希菌(DH5α)感受态细胞,在含50 μg/mL卡那霉素的LB固体平板上筛选阳性克隆,通过BamHⅠ和HindⅢ双酶切鉴定和DNA测序验证阳性克隆中插入基因的正确性。将正确的重组质粒分别命名为pMV261-mCherry、pMV261-mCherry-T、pMV261-EGFP和pMV261-EGFP-T。
1.2.2 耻垢分枝杆菌感受态细胞的制备及转化挑取耻垢分枝杆菌单菌落于7H9-OADC液体培养基中培养至对数期,收集菌体用于制备感受态细胞。将纯化后的pMV261-mCherry、pMV261-mCherry-T、pMV261-EGFP、pMV261-EGFP-T质粒电转至制备好的耻垢分枝杆菌感受态细胞中,电转复苏后涂布于含有20 μg/mL卡那霉素抗性的7H10-OADC固体平板中,37 ℃孵育3 d,挑取耻垢分枝杆菌重组菌株。
1.2.3 重组耻垢分枝杆菌菌体颜色观察分别挑取重组耻垢分枝杆菌Msm∷mCherry和Msm∷mCherry-T单菌落,于7H9-OADC液体培养基(含20 μg/mL卡那霉素)中培养至对数期,分别取50 mL菌液离心,收集菌体,去除上清液后观察菌体颜色并拍照记录。
1.2.4 重组耻垢分枝杆菌中EGFP的表达分析分别挑取重组耻垢分枝杆菌Msm∷EGFP和Msm∷EGFP-T单菌落,于7H9-OADC液体培养基(含20 μg/mL卡那霉素)中培养至对数期,离心收集菌体。超声碎菌后,于4 ℃,13 000 r/min离心30 min,取上清液,用BCA蛋白定量法计算蛋白浓度。分别取30 μg的Msm∷EGFP和Msm∷EGFP-T蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),电泳后取一块胶用考马斯亮蓝染色液染色,另一块进行蛋白免疫印迹检测。以EGFP标记的鼠单克隆抗体作为一抗,辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠IgG作为二抗,增强化学发光法(enhanced chemiluminescence, ECL)鉴定EGFP的表达。
1.2.5 报告体系在耻垢分枝杆菌中的动态表达将4种菌株接种于7H9-OADC培养基,培养至对数期,按1%的比例分别重新转接至50 mL 7H9-OADC新鲜培养基中。以mCherry作为报告基因的实验菌株于培养15、21、40、45 h时分别收集菌体并观察颜色变化;以egfp作为报告基因的实验菌株于培养15、21、30、40 h时分别收集菌体,按1.2.4所述方法定量检测Msm∷EGFP和Msm∷EGFP-T两种菌株中的EGFP表达量。
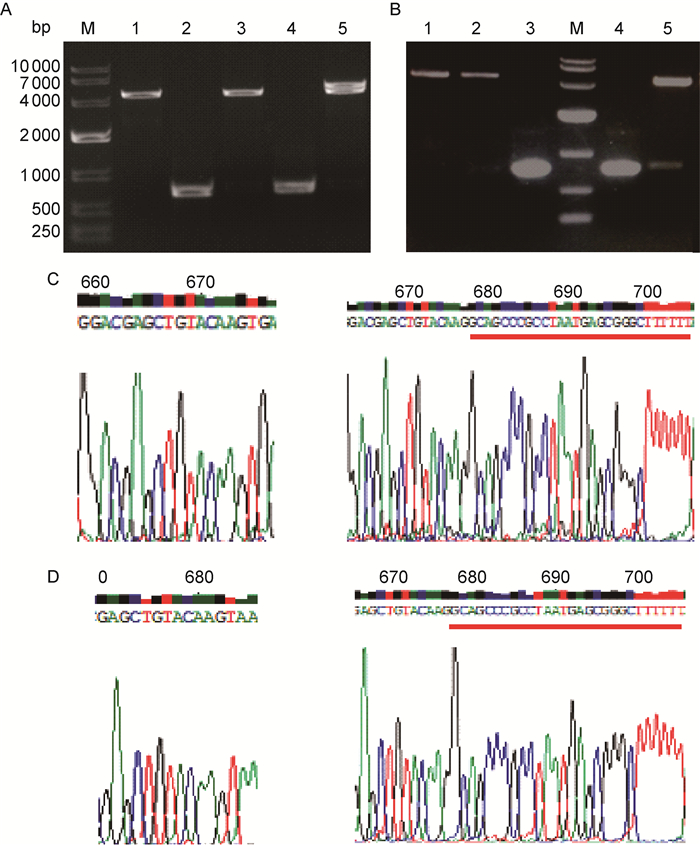
2 结果 2.1 耻垢分枝杆菌反式翻译报告体系的构建及表达 2.1.1 mCherry和EGFP表达载体的构建将重组质粒pMV261-mCherry和pMV261-mCherry-T分别进行BamH Ⅰ和Hind Ⅲ双酶切,理论上应该出现大小为4 680 bp的大片段及711 bp和736 bp的小片段。电泳结果显示,实际获得的大、小片段与理论一致(图 1A)。同样,阳性重组质粒pMV261-EGFP和pMV261-EGFP-T经BamH Ⅰ和Hind Ⅲ双酶切后,电泳获得4 680 bp的大片段及717 bp和742 bp的小片段(目的基因)(图 1B)。对测序结果进行分析,可看到pMV261-mCherry-T和pMV261-EGFP-T两种重组质粒测序图谱C端比对照质粒多了GCAGCCCGCCTAATGAGCAGC-GGGCTTTTTT这一段大肠埃希菌终止子序列。结果与预期一致,表明4种质粒均构建成功(图 1C、图 1D)。
|
| A: Restriction map of the vectors of pMV261-mCherry and pMV261-mCherry-T. M: DNA marker DL 10000; Lane 1: pMV261 digested by BamH Ⅰ and Hind Ⅲ; Lane 2: mCherry; Lane 3: pMV261-mCherry digested by BamH Ⅰ and Hind Ⅲ; Lane 4: mCherry-T; Lane 5: pMV261-mCherry-T digested by BamH Ⅰ and Hind Ⅲ. B: Restriction map of the vectors of pMV261-EGFP and pMV261-EGFP-T. M: DNA marker DL 10000; Lane 1: pMV261 digested by BamH Ⅰ and Hind Ⅲ; Lane 2: pMV261-EGFP digested by BamH Ⅰ and Hind Ⅲ; Lane 3: EGFP; Lane 4: EGFP-T; Lane 5: pMV261-EGFP-T digested by BamH Ⅰ and Hind Ⅲ. C: Results of DNA sequencing of pMV261-mCherry (left) and pMV261-mCherry-T (right) vectors. D: Results of DNA sequencing of pMV261-EGFP (left) and pMV261-EGFP-T (right) vectors. 图 1 4种重组质粒的酶切鉴定及DNA测序图谱 Fig. 1 Enzymatic digestion and DNA sequencing of four recombinant plasmids |
将测序成功后的4种重组质粒分别电转至耻垢分枝杆菌感受态细胞,挑取卡那霉素抗性的单克隆菌落,于7H9-OADC培养基中培养至OD600=0.8。采用菌体颜色变化和蛋白免疫印迹法分别检测mCherry和egfp两种报告基因在耻垢分枝杆菌中的表达情况。结果显示,pMV261-mCherry和pMV261-mCherry-T两个重组菌株因mCherry红色荧光蛋白的表达,最终使菌体呈现红色,但pMV261-mCherry-T菌株颜色比pMV261-mCherry的颜色浅(图 2A)。蛋白免疫印迹法定量检测EGFP表达水平时,发现EGFP-T的蛋白条带比EGFP正常表达的蛋白相对分子质量略大,且前者蛋白水平明显低于后者(图 2B、图 2C)。这一方面是基于细菌体内反式翻译作用原理,即在不成熟的mRNA出现时,细菌会启动反式翻译途径,并将翻译出的目标蛋白标签上ssrA的氨基酸序列,从而使蛋白相对分子质量略变大[18]。另一方面,带有终止子序列的mCherry和egfp基因在表达过程中,因启动反式翻译过程促进了错误蛋白的水解,使得蛋白水平比正常表达时要低。上述结果提示,启动分枝杆菌反式翻译体系的重组菌株Msm∷mCherry-T和Msm∷EGFP-T构建成功。

|
| A: Cell color of Msm∷pMV261-mCherry and Msm∷pMV261-mCherry-T. B: SDS-PAGE of whole cell lysate from Msm∷pMV261-EGFP and Msm∷pMV261-EGFP-T at the same protein quantification level. C: Comparison of EGFP expression levels between Msm∷pMV261-EGFP and Msm∷pMV261-EGFP-T by Western blotting. 图 2 报告体系在耻垢分枝杆菌中的表达 Fig. 2 Expression of the reporting system in Mycobacterium smegmatis |
比较Msm∷pMV261-mCherry与Msm∷pMV261-mCherry-T在不同生长时间内的颜色变化(图 3A)及Msm∷pMV261-EGFP与Msm∷pMV261-EGFP-T菌体中EGFP表达水平(图 3B),分别观察mCherry-T和EGFP-T两种报告体系在耻垢分枝杆菌生长不同阶段的动态表达特点。

|
| A: Cell color of Msm∷pMV261-mCherry and Msm∷pMV261-mCherry-T at different growth stages. Tubes 1, 3, 5 and 7 represent Msm∷pMV261-mCherry. Tubes 2, 4, 6 and 8 represent Msm∷pMV261-mCherry-T. B: The expression levels of EGFP in Msm∷pMV261-EGFP and Msm∷pMV261-EGFP-T at different growth stages. 图 3 耻垢分枝杆菌中反式翻译的动态表达 Fig. 3 Dynamic expression of trans-translation system in Mycobacterium smegmatis |
结果表明,当mCherry在耻垢分枝杆菌中正常表达时,随着培养时间延长,mCherry红色荧光蛋白在细菌体内逐渐积累,使得细菌颜色(红色)逐渐加深;而当mCherry-T在耻垢分枝杆菌中错误表达时,与mCherry正常表达相比,在细菌培养的任一阶段,菌体颜色均较正常要浅,表明错误表达的红色荧光蛋白在菌体内部被部分水解。从mCherry-T在耻垢分枝杆菌中的自身表达来看,细菌生长从15 h到21 h菌体颜色有加深的趋势,而从21 h到45 h菌体颜色逐渐变浅。蛋白免疫印迹法定量结果显示,重组菌株中非成熟的EGFP表达水平在生长任一阶段均比正常表达的EGFP水平低,且错误表达的EGFP与错误表达的mCherry一样,在生长至对数期时错误蛋白含量最高,对数期后反式翻译过程的参与导致大量错误蛋白被水解而逐渐降低,并于40 h后完全水解。上述结果进一步证实了耻垢分枝杆菌中反式翻译报告体系的成功构建,且细菌体内反式翻译进程是一个动态变化的过程,当蛋白出现翻译异常时,细菌可立即启动反式翻译途径。同时,当细菌生长到达对数生长期,随着错误蛋白的积累,反式翻译过程也更加强烈并可快速将错误蛋白水解,以确保细菌的正常生长及生理功能。
3 讨论细菌反式翻译的作用是将停滞在mRNA上熄火的核糖体释放,以保证蛋白质的正常翻译和稳定表达,进而保障细菌的正常生长及生理功能。此外,反式翻译还能参与调控细菌对压力环境的胁迫反应。研究发现,大肠埃希菌tmRNA缺陷体在热激、氧化还原、饥饿等压力条件下均表现出生存能力下降的状态[19],表明大肠埃希菌反式翻译在细菌应对压力环境中具有重要调控作用。同时,人们发现很多核糖体抑制剂可提高tmRNA的表达水平,如利用红霉素处理耻垢分枝杆菌时,会导致tmRNA前体(pre-tmRNA)和成熟tmRNA增加[20],由此推测tmRNA表达增强是细菌受抗生素胁迫时的重要应激反应。
反式翻译作为结核分枝杆菌中的核糖体拯救途径,其调控对结核分枝杆菌的生长及生理功能至关重要。近年来一线药物PZA通过抑制反式翻译途径发挥抗结核作用机制的发现,使得该途径成为研究抗菌药物作用靶点的新方向[16-17]。因此,反式翻译途径的深入研究对探讨结核分枝杆菌潜伏感染、新药研发等有十分重要的意义。
基于结核分枝杆菌中ssrA和smpB均为必需基因这一特点[14-15],利用传统基因敲除的方法来研究反式翻译的功能变得更为艰难。因此,构建一种能引起细菌体内反式翻译表达及研究其特点的报告体系,有望从侧面探究反式翻译在分枝杆菌中的作用。本研究利用缺失终止密码子的mRNA会使核糖体熄火这一特点,分别以mCherry和egfp作为报告基因,成功构建了能诱导启动分枝杆菌反式翻译途径的体系。两种报告体系可分别从菌体颜色变化和蛋白定量水平来展示反式翻译启动过程。反式翻译报告体系的成功构建,不仅可用于后续深入探究分枝杆菌中反式翻译的功能,还可作为以反式翻译途径为靶点的抗结核药物的筛选平台。
| [1] |
James NR, Brown A, Gordiyenko Y, Ramakrishnan V. Translational termination without a stop codon[J]. Science, 2016, 354(6318): 1437-1440.
[DOI]
|
| [2] |
Huter P, Muller C, Arenz S, Beckret B, Wilson DN. Structural basis for ribosome rescue in bacteria[J]. Trends Biochem Sci, 2017, 42(8): 669-680.
[DOI]
|
| [3] |
Ma CY, Kurita D, Li N, Chen Y, Himeno H, Gao N. Mechanistic insights into the alternative translation termination by ArfA and RF2[J]. Nature, 2017, 541(7638): 550-553.
[DOI]
|
| [4] |
Keiler KC. Mechanisms of ribosome rescue in bacteria[J]. Nat Rev Microbiol, 2015, 13(5): 285-297.
[DOI]
|
| [5] |
Gottesman S, Roche E, Zhou Y, Sauer RT. The ClpXP and ClpAP proteases degrade proteins with carboxy-terminal peptide tails added by the SsrA-tagging system[J]. Genes Dev, 1998, 12(9): 1338-1347.
[DOI]
|
| [6] |
Flynn JM, Levchenko I, Seidel M, Wickner SH, Sauer RT, Baker TA. Overlapping recognition determinants within the ssrA degradation tag allow modulation of proteolysis[J]. Proc Natl Acad Sci USA, 2001, 98(19): 10584-10589.
[DOI]
|
| [7] |
Herman C, Thévenet D, Bouloc P, Walker GC, D'Ari R. Degradation of carboxy-terminal-tagged cytoplasmic proteins by the Escherichia coli protease HflB (FtsH)[J]. Genes Dev, 1998, 12(9): 1348-1355.
[DOI]
|
| [8] |
Choy JS, Aung LL, Karzai AW. Lon protease degrades transfer-messenger RNA-tagged proteins[J]. J Bacteriol, 2007, 189(18): 6564-6571.
[DOI]
|
| [9] |
Shimizu Y. ArfA recruits RF2 into stalled ribosomes[J]. J Mol Biol, 2012, 423(4): 624-631.
[URI]
|
| [10] |
Chadani Y, Ono K, Kutsukake K, Abo T. Escherichia coli YaeJ protein mediates a novel ribosome-rescue pathway distinct from SsrA- and ArfA-mediated pathways[J]. Mol Microbiol, 2011, 80(3): 772-785.
[URI]
|
| [11] |
Kurita D, Chadani Y, Muto A, Abo T, Himeno H. ArfA recognizes the lack of mRNA in the mRNA channel after RF2 binding for ribosome rescue[J]. Nucleic Acids Res, 2014, 42(21): 13339-13352.
[DOI]
|
| [12] |
Ivanova N, Pavlov MY, Felden B, Ehrenberg M. Ribosome rescue by tmRNA requires truncated mRNAs[J]. J Mol Biol, 2004, 338(1): 33-41.
[URI]
|
| [13] |
Moore SD, Sauer RT. The tmRNA system for translational surveillance and ribosome rescue[J]. Annu Rev Biochem, 2007, 76: 101-124.
[DOI]
|
| [14] |
Personne Y, Parish T. Mycobacterium tuberculosis possesses an unusual tmRNA rescue system[J]. Tuberculosis (Edinb), 2014, 94(1): 34-42.
[DOI]
|
| [15] |
Alumasa JN, Manzanillo PS, Peterson ND, Lundrigan T, Baughn AD, Cox JS, Keiler KC. Ribosome rescue inhibitors kill actively growing and nonreplicating persister Mycobacterium tuberculosis cells[J]. ACS Infect Dis, 2017, 3(9): 634-644.
[DOI]
|
| [16] |
Shi W, Zhang X, Jiang X, Yuan H, Lee JS, Barry CE 3rd, Wang H, Zhang W, Zhang Y. Pyrazinamide inhibits trans-translation in Mycobacterium tuberculosis[J]. Science, 2011, 333(6049): 1630-1632.
[DOI]
|
| [17] |
Yang J, Liu Y, Bi J, Cai Q, Liao X, Li W, Guo C, Zhang Q, Lin T, Zhao Y, Wang H, Liu J, Zhang X, Lin D. Structural basis for targeting the ribosomal protein S1 of Mycobacterium tuberculosis by pyrazinamide[J]. Mol Microbiol, 2015, 95(5): 791-803.
[DOI]
|
| [18] |
Ramadoss NS, Alumasa JN, Cheng L, Wang Y, Li S, Chambers BS, Chang H, Chatterjee AK, Brinker A, Engels IH, Keiler KC. Small molecule inhibitors of trans-translation have broad-spectrum antibiotic activity[J]. Proc Natl Acad Sci USA, 2013, 110(25): 10282-10287.
[DOI]
|
| [19] |
Palecková P, Bobek J, Felsberg J, Mikulík K. Activity of translation system and abundance of tmRNA during development of Streptomyces aureofaciens producing tetracycline[J]. Folia Microbiol (Praha), 2006, 51(6): 517-524.
[DOI]
|
| [20] |
Andini N, Nash KA. Expression of tmRNA in mycobacteria is increased by antimicrobial agents that target the ribosome[J]. FEMS Microbiol Lett, 2011, 322(2): 172-179.
[DOI]
|
 2019, Vol. 14
2019, Vol. 14

