2. 上海健康医学院神经精神药理学实验室,上海 201318;
3. 国家老年疾病临床医学研究中心(复旦大学附属华山医院,上海 200041
2. Laboratory of Neuropsychopharmacology, Shanghai University of Medicine & Health Sciences, Shanghai201318, China;
3. National Clinical Research Center on aging and medicine, Huashan Hospital, Shanghai 200041, China
随着人口逐渐老龄化,探究老年痴呆的认知、行为表现与其大脑潜在病理之间的关系已成为一项巨大的挑战。阿尔茨海默病(Alzheimer’s disease,AD)是世界范围内普遍存在的神经退行性疾病,也是引发老年痴呆的主要原因之一,占所有老年痴呆病例的50%~70%。虽然AD发病缓慢,但病情会进行性加重,由最初的短期记忆丧失发展为语言障碍和定向障碍等行为问题,逐渐丧失机体功能,最终导致死亡[1]。
AD与神经元损伤及进行性的突触功能障碍有关。是否存在脑细胞外淀粉样肽β(amyloid β,Aβ)的沉积和细胞内Tau蛋白(tau protein,Tau)过度磷酸化而神经原纤维缠结(neurofibrillarytangle,NFT)是该疾病的病理诊断标准[2]。淀粉样前体蛋白(amyloid precursor protein,APP)是一种高表达的神经元正常跨膜蛋白,在细胞的代谢过程中由β和γ分泌酶裂解成Aβ,Aβ聚集到细胞外形成低聚物和纤维,最终形成斑块[3]。Tau蛋白是一种细胞内微管结合蛋白,过度磷酸化时,会引起微管的解体,从而导致轴突转运障碍[4]。AD的确切病因尚未明了,至今缺乏有效治愈AD的方法。
人类胃肠道中的微生物数量庞大,总数约为1014个,其中约99%是厌氧菌,其余的是太古菌、原生动物和真菌等[5]。肠道微生物对人体健康发挥着重要的作用,包括能量的摄取、维生素的生物合成和病原入侵的防止等[6]。在分娩时和哺乳期,新生儿接触到来自于母体与环境中的大量微生物,这些微生物会逐渐定植在胃肠道中。婴儿时期的微生物组成是高度动态的,约在7岁时逐步稳定,与成人的构成相似。此后,体内微生物组的构成长期保持稳定,但个体间差异较大。伴随着年龄的增加,肠道菌群的多样性减少,个体间差异变大,该变化与多种老年慢性疾病的发生和发展密切相关[7]。近年来报道AD的发生与肠道菌群改变有关,微生物和中枢神经系统相互作用的假说也成为AD发生的可能机制之一。因此,全面了解肠道微生物组遗传及功能的多样性,分析其与AD发生的关联性,对有关AD的临床危险因素和发病机制的研究具有较大推动作用,可为找出有效干预手段提供线索。
1 肠道菌群与中枢神经系统相互作用的基础——肠脑轴大脑和肠道微生物群之间通过脑-内脏-交感神经轴(脑肠轴)进行交流。脑肠轴由中枢神经系统、神经内分泌系统、免疫系统、自主神经系统的交感神经、副交感神经分支、肠神经系统和肠道微生物群构成[8]。肠道与大脑之间的沟通主要有3种方式:传入神经纤维,通过神经免疫调控和利用神经内分泌途径[9]。肠道微生物群参与调控大脑的许多功能,例如:细菌通过迷走神经和肾上腺素能神经等多种通讯方式,调控外周神经系统和中枢神经系统的活动。调节下丘脑-垂体-肾上腺(hypothalamic pituitary adrenal,HPA)轴的激活状态,HPA轴受刺激而释放皮质醇,进而控制脑小胶质细胞的活化状态;影响细胞因子的释放及单核细胞从外周向大脑的迁移;产生神经递质、神经肽和激素等多种物质,影响宿主的精神健康[10]。
另外,脑损伤及不同的心理状态均可影响肠道微生物群的组成,并可能诱发疾病。如卒中引起的脑损伤被证明会改变小鼠盲肠菌群的组成,表现为普雷沃菌科显著降低,肠球菌科比例升高,并与脑损伤的严重程度呈正相关[11]。急性抑郁症患者的拟杆菌、变形杆菌和放线菌比例较高,而厚壁菌门的比例显著降低[12]。
2 肠道微生态与AD的相关性肠道微生态的构成已被证明与衰老和AD存在密切的关联。此外,动物模型、粪便微生物群移植和益生菌干预等多种试验也被用于研究肠道微生物群与AD的相关性。
2.1 肠道微生物群与衰老和AD的关联衰老与肠道微生物群组成的变化明显有关。一般来说,在老化的肠道中,肠道微生物的多样性降低,某些被认为有益的细菌,如拟杆菌、乳酸菌和双歧杆菌的数量会减少,尽管厚壁菌门和拟杆菌门仍然占主导地位,但相对比例发生了变化。Mariat等[13]对婴儿、成年人和老年人3个年龄组人群的粪便菌群进行比较,研究表明,在这3个年龄组中,厚壁菌门/拟杆菌门的比值分别为0.4、10.9和0.6;Biagi等[14]强调了核心肠道微生物群(疣微菌科、拟杆菌科和毛螺菌科)的存在,老化的特征是亚优势种的丰度增加,而核心微生物群的丰度降低。Shen等[15]比较了中国西南地区老年人组和中年人组的粪便菌群组成,粪球菌和萨特菌属的含量明显较高,毛螺旋菌属和草酸杆菌属则相反,结果显示,另枝菌属的存在与年龄呈负相关。Scott等[16]评估了老年小鼠的行为、生理与盲肠微生物群的关系,老龄(20~21月龄)小鼠与低龄(2~3月龄)的小鼠相比,表现出更明显的空间记忆缺陷、焦虑样行为以及更高的肠道通透性,其卟啉单胞菌科和臭杆菌属的丰度亦明显增加。
Zhuang等[17]发现AD患者的细菌种群与对照组相比,拟杆菌、放线菌、反刍球菌、变形杆菌、硒单胞菌等显著增加。Vogt等[18]观察到AD患者肠道菌群的物种多样性显著降低,且其脑脊液中的生物标志物YKL-40与拟杆菌、梭菌科的数量呈正相关。Lukiw等[19]对AD患者的研究表明,其血清中丰富的脆弱拟杆菌脂多糖是促炎转录因子核因子κB(nuclear factor-kappa B,NF-κB) (p50/p65)复合体的诱发物,且NF-κB (p50 / p65)复合体是一个炎性神经退行性疾病致病通路的诱发器。以上研究结果也提示了肠道菌群与AD的关联性。
2.2 AD动物模型与微生物群移植越来越多的动物模型被用于评估肠道菌群对AD的影响。Zhang等[20]比较了野生型和AD模型小鼠不同年龄段的粪便微生物组成。结果表明,微生物群组成在8~12月龄时发生了变化,表现为AD模型小鼠的疣微菌门和变形菌门丰度显著增加,而瘤胃球菌属和丁酸球菌的丰度显著下降,具有益生菌潜能的丁酸酯产生菌普鲁卡菌的丰度也显著降低。Kong等[21]发现AD果蝇中乙酸杆菌和乳酸菌比例显著下降,气相色谱-质谱联用仪测定肠道菌群代谢产物短链脂肪酸(short chain fatty acids,SCFAs)的结果也显示,乙酸酯的产量明显下调。该研究证明肠道菌群失调可能通过调节SCFAs的含量参与AD的发病。
与普通动物模型相比,无菌(germ free,GF)动物模型的主要优势在于可以在不同的发育时间点引入特定的细菌群,以便研究其机制。Harach等[22]发现8月龄的APPPS1(APP/PS1 transgenic mice)小鼠与8月龄的对照组小鼠相比,厚壁菌门、疣微菌门、变形菌门和放线菌显著减少,拟杆菌门和软壁菌门同时增多。GF-APPPS1小鼠模型的Aβ淀粉样病变显著少于常规饲养的APPPS1小鼠,但被移植APPPS1小鼠的粪便后可显著增加脑内Aβ的沉积。由于GF-APPPS1小鼠免疫系统发育受限,提示肠道微生物群可能通过非免疫途径参与AD的病理发展。
2.3 益生菌干预益生菌是活的微生物,通常可以改善或恢复肠道菌群的功能。Sanborn等[23]证明了使用益生菌鼠李糖乳杆菌(Lactobacillus rhamnosus GG, LGG)干预对中老年人情绪和认知功能具有积极的影响。Akbari等[24]在60名AD患者中评估益生菌补充剂(嗜酸乳杆菌、干酪乳杆菌、双歧杆菌、发酵乳杆菌)对认知功能和代谢状态的影响。结果显示,益生菌干预组的简易精神状态检查表(mini-mental state examination,MMSE)评分较对照组有了显著提高。Distrutti等[25]通过使用益生菌混合物(VSL3)改变肠道菌群组成来改善神经元间的长时程增强作用(long-term potentiation,LTP)与年龄关系。VSL 3是一种由8株革兰阳性菌株,包括嗜热链球菌、长双歧杆菌、嗜酸乳杆菌和植物乳杆菌等组成的益生菌混合物。研究表明,经VSL 3处理的老龄大鼠,年龄相关性的LTP缺陷(即老龄动物维持LTP的能力减弱)有所减轻,同时小胶质细胞活化标志物轻度减少,脑源性神经营养因子(brain derived neurotrophic factor,BDNF)和突触蛋白表达增加。
但是,Deschasaux等[6]发现感染LGG改变了小鼠的微生物群,反而引起应激性记忆障碍。因此,不是所有使用益生菌的干预都有积极的效果。这些数据支持了肠道微生物群可以影响神经元功能,从而影响AD发生、发展的观点。
3 肠道菌群影响AD的可能机制肠道菌群可通过包括代谢产物、神经递质及慢性神经炎症等多途径,影响AD的发生(图 1)。
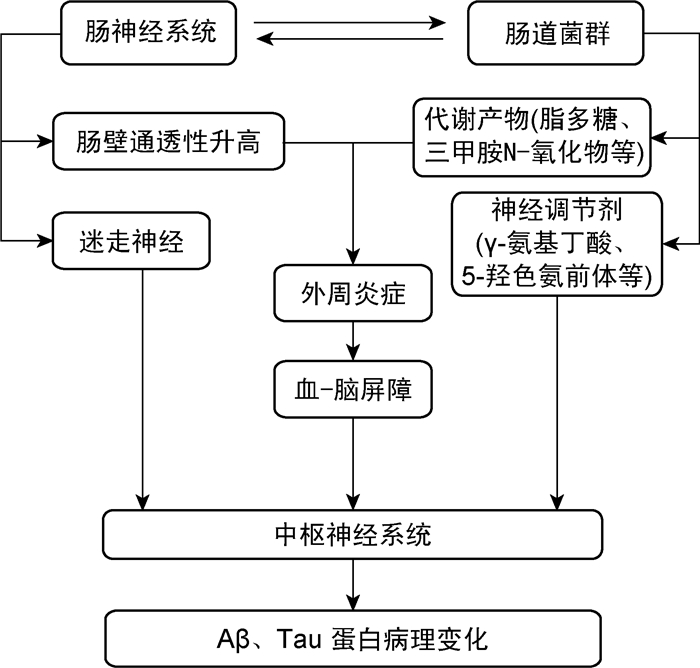
|
| 图 1 肠道菌群影响AD的可能途径 Fig. 1 Possible pathways of gut microbiota affecting AD |
肠黏膜屏障在保持吸收营养能力的同时,还能阻隔有害物质进入体内环境,保护黏膜组织和循环系统免受微生物、毒素和抗原等促炎物质的侵害。当细胞间的紧密连接出现问题时,会引起肠漏,诱发各类疾病。在衰老过程中,肠黏膜屏障和血-脑屏障的通透性也会增高。Leblhuber等[26]通过高效液相色谱分析发现AD患者血液中的钙网蛋白浓度显著升高,表明钙网蛋白可穿过紊乱的肠道屏障功能,从肠道进入循环系统导致神经炎症。提示肠道菌群产生的有害代谢产物,可穿过血-脑屏障损害神经元的功能。
肠道菌群可以产生脂多糖(lipopolysaccharide, LPS)、多胺、SCFAs等代谢产物影响中枢神经系统(central nervous system,CNS)。Zhao等[27]首次报道了AD患者大脑海马和颞上叶新皮质中存在LPS。与对照组相比,老年AD患者大脑新皮质的平均LPS水平增加了26倍。Zhan等[28]用免疫印迹和免疫组化方法检测AD患者和对照组的脑灰质和脑白质标本,结果显示AD患者的大肠埃希菌K99蛋白和LPS水平均高于对照组,LPS与Aβ共定位于AD的脑淀粉样斑块及血管周围。另外,大量研究证明大肠埃希菌、枯草芽胞杆菌、伤寒沙门菌、肠炎沙门菌、结核分枝杆菌、金黄色葡萄球菌等能诱生大量的细菌性淀粉样肽。三甲胺N-氧化物(trimethylamine N-oxide,TMAO)是一种肠道微生物代谢产生的小分子。Vogt等[29]检测了AD、轻度认知障碍(mild cognitive impairment,MCI)和对照组脑脊液中的TMAO和AD生物标志物(NFT和Aβ42)水平,在AD和MCI患者中两者的表达水平均较对照组明显升高,并伴随有神经元变性。然而,多项研究发现用微生物产生的SCFAs可以改善GF动物受损的小胶质细胞功能,小胶质细胞与清除脑内碎片、斑块等聚集物有关[30]。因此,并非所有的微生物代谢产物都对神经系统产生消极影响。
3.2 肠道菌群通过神经递质影响AD压力和情绪会导致大脑通过释放激素或神经递质影响肠道微生物组成,肠道菌群也可通过产生神经递质前体或调节神经递质,影响大脑功能。如:抑郁和焦虑常常伴随着结肠运动的改变,而结肠运动又改变了肠道微生物的组成和稳定[31]。肠道菌群可以合成γ-氨基丁酸(γ-aminobutyric acid,GABA),刺激肠壁嗜铬细胞分泌5-羟色胺(5-hydroxytryptamine,5-HT),影响脑内脑源性神经营养因子、多巴胺(dopamine,DA)的表达等[32]。
GABA通过与突触前和突触后神经元传递过程中质膜上的特定跨膜受体结合,作用于大脑中的抑制性突触,该系统的功能障碍可导致认知障碍。Solas等[33]对AD患者的尸检研究发现,其额叶、颞叶和顶叶皮质的GABA水平均降低,证明了GABA缺乏与AD发生的相关性。消化道中存在乳酸菌、乳球菌、双歧杆菌、链球菌等大量革兰阳性兼性厌氧菌或微嗜氧菌,可将谷氨酸脱羧合成为GABA。Bravo等[34]发现给小鼠喂食鼠李糖乳杆菌JB-1,可降低GABA Aα2 mRNA在前额叶皮质和杏仁核的表达,并减少应激诱导的皮质酮及焦虑样行为的产生。
5-HT是一种单胺类神经递质,在调节认知、学习、记忆和许多生理过程中起重要的作用。超过95%的5-HT在肠道中合成,假丝酵母、链球菌、大肠埃希菌、肠球菌等在5-HT的合成中发挥重要的作用。Linstow等[35]采用高压液相色谱法对18月龄的AD转基因小鼠新皮质、海马、纹状体、脑干和小脑中5-HT含量进行分析。结果显示,与野生型小鼠相比,AD小鼠所有单胺的区域特异性水平发生了变化,其中新皮质中5-HT含量降低了30%,脑干中5-HT含量升高了18%。Yano等[36]发现GF小鼠血液中5-HT含量大约比无特定病原体(specific pathogen free, SPF)小鼠低60%,且在重建GF小鼠肠道菌群时5-HT浓度明显升高。
3.3 肠道菌群与慢性神经炎症炎症反应对大脑既有利又有害。一方面,慢性、轻度TLR4刺激可通过激活神经元自噬来减少Tau蛋白的过磷酸化[37];另一方面,炎症在AD的发展过程中起促进作用。促炎细胞因子(proinflammatory cytokines)可增强APP的表达,促进Aβ在海马体中的形成。细菌淀粉样蛋白被认为是一种病原相关分子模式(pathogen-associated molecular pattern,PAMP)的识别分子,可引起TLR2的活化。研究发现TLR2诱导Notch1的上调和小胶质细胞的活化,并可促进AD的发展[38]。肠道微生物群可通过激活宿主的先天免疫系统,从而增强对脑内Aβ的炎症反应,导致神经炎症[39]。
外周炎症可在慢性神经炎症的发生、发展中发挥作用。Villarán等[40]用硫酸葡聚糖钠(dextran sulfate sodium,DSS)诱导建立溃疡性结肠炎(ulcerative colitis,UC)大鼠模型,向其黑质内注射LPS诱导中脑炎症反应,以验证外周炎症是否会改变中脑炎症。结果显示,UC增强了LPS的炎症反应,血清炎症标志物(TNFα、IL-1β、IL-6和急性期蛋白C反应蛋白)水平升高,黑质内诱导型一氧化氮合酶、细胞间黏附分子-1、小胶质细胞和星形胶质细胞群增加。肠漏导致LPS渗漏可引起外周炎症,从而影响AD的发生。
因此,肠道微生物群对宿主免疫系统的诱导、培育起重要作用,免疫系统的在很大程度上维持着宿主与这些高度多样化和不断进化的微生物之间的共生。肠道菌群与神经系统的正常运作密切相关,但当微生物群的稳态变化导致肠道通透性增加时,可促进细菌和内毒素在肠道上皮屏障上的易位,引发与促炎细胞因子产生相关的免疫应答,从而导致各种神经系统疾病。
4 结语AD是一种复杂的慢性疾病。AD病因的复杂性导致了人们对其认识的局限性,限制了该领域研究的发展。增龄、遗传、外周病变和环境因素都可能是诱发因素。越来越多的临床和生物医学证据表明,肠道微生物群及其代谢产物可能影响中枢神经系统功能,导致个体行为偏差,菌群失调已被证明与认知障碍有关。
环境因素(如饮食失衡、抗生素的滥用和生活方式的改变)都可能改变肠道微生物群的组成甚至致其崩溃,进而肠道通透性(肠漏)和血-脑屏障通透性(脑漏)增加,引起外周和中枢神经系统炎症,最终导致神经系统疾病的发生。据此推断,长期的个性化饮食调整或益生菌干预而调节肠道微生物群是一种可实现的策略,用于包括AD在内的神经系统退行性疾病的创新治疗。微生态的干预研究也将为重新认识AD并找出预防和治疗AD的新方法带来希望。
| [1] |
Xu R, Wang QQ. Towards understanding brain-gut-microbiome connections in Alzheimer's disease[J]. BMC Syst Biol, 2016, 10(Suppl 3): 63.
[DOI]
|
| [2] |
Tremlett H, Bauer KC, Appel-Cresswell S, Finlay BB, Waubant E. The gut microbiome in human neurological disease: A review[J]. Ann Neurol, 2017, 81(3): 369-382.
[DOI]
|
| [3] |
Hu X, Wang T, Jin F. Alzheimer's disease and gut microbiota[J]. Sci China Life Sci, 2016, 59(10): 1006-1023.
[DOI]
|
| [4] |
Bhattacharjee S, Lukiw WJ. Alzheimer's disease and the microbiome[J]. Front Cell Neurosci, 2013, 7: 153.
[DOI]
|
| [5] |
Gilbert JA, Blaser MJ, Caporaso JG, Jansson JK, Lynch SV, Knight R. Current understanding of the human microbiome[J]. Nat Med, 2018, 24(4): 392-400.
[DOI]
|
| [6] |
Deschasaux M, Bouter KE, Prodan A, Levin E, Groen AK, Herrema H, Tremaroli V, Bakker GJ, Attaye I, Pinto-Sietsma SJ, van Raalte DH, Snijder MB, Nicolaou M, Peters R, Zwinderman AH, Bäckhed F, Nieuwdorp M. Depicting the composition of gut microbiota in a population with varied ethnic origins but shared geography[J]. Nat Med, 2018, 24(10): 1526-1531.
[DOI]
|
| [7] |
Kim S, Jazwinski SM. The Gut microbiota and healthy aging: A mini-review[J]. Gerontology, 2018, 64(6): 513-520.
[DOI]
|
| [8] |
La Rosa F, Clerici M, Ratto D, Occhinegro A, Licito A, Romeo M, Iorio CD, Rossi P. The gut-brain axis in Alzheimer's disease and omega-3. A critical overview of clinical trials[J]. Nutrients, 2018, 10(9).
[DOI]
|
| [9] |
Westfall S, Lomis N, Kahouli I, Dia SY, Singh SP, Prakash S. Microbiome, probiotics and neurodegenerative diseases: deciphering the gut brain axis[J]. Cell Mol Life Sci, 2017, 74(20): 3769-3787.
[DOI]
|
| [10] |
Mayer EA, Tillisch K, Gupta A. Gut/brain axis and the microbiota[J]. J Clin Invest, 2015, 125(3): 926-938.
[DOI]
|
| [11] |
Ghaisas S, Maher J, Kanthasam A. Gut microbiome in health and disease: linking the microbiome-gut-brain axis and environmental factors in the pathogenesis of systemic and neurodegenerative diseases[J]. Pharmacol Ther, 2016, 158: 52-62.
[DOI]
|
| [12] |
Dinant TG, Cryan JF. Mood by microbe: towards clinical translation[J]. Genome Med, 2016, 8(1): 36.
[DOI]
|
| [13] |
Mariat D, Firmesse O, Levenez F, Guimarǎes V, Sokol H, Doré J, Corthier G, Furet JP. The Firmicutes/Bacteroidetes ratio of the human microbiota changes with age[J]. BMC Microbiol, 2009, 9: 123.
[DOI]
|
| [14] |
Biagi E, Franceschi C, Rampelli S, Severgnini M, Ostan R, Turroni S, Consolandi C, Quercia S, Scurti M, Monti D, Capri M, Brigidi P, Candela M. Gut microbiota and extreme longevity[J]. Curr Biol, 2016, 26(11): 1480-1485.
[DOI]
|
| [15] |
Shen X, Miao J, Wan Q, Wang S, Li M, Pu F, Wang G, Qian W, Yu Q, Marotta F, He F. Possible correlation between gut microbiota and immunity among healthy middle-aged and elderly people in southwest China[J]. Gut Pathog, 2018, 10: 4.
[DOI]
|
| [16] |
Scott KA, Ida M, Peterson VL, Prenderville JA, Moloney GM, Izumo T, Murphy K, Murphy A, Ross RP, Stanton C, Dinan TG, Cryan JF. Revisiting Metchnikoff:Age-related alterations in microbiota-gut-brain axis in the mouse[J]. Brain Behav Immun, 2017, 65: 20-32.
[DOI]
|
| [17] |
Zhuang ZQ, Shen LL, Li WW, Fu X, Zeng F, Gui L, Lü Y, Cai M, Zhu C, Tan YL, Zheng P, Li HY, Zhu J, Zhou HD, Bu XL, Wang YJ. Gut microbiota is altered in patients with Alzheimer's disease[J]. J Alzheimer Dis, 2018, 63(4): 1337-1346.
[DOI]
|
| [18] |
Vogt NM, Kerby RL, Dill-McFarland KA, Harding SJ, Merluzzi AP, Johnson SC, Carlsson CM, Asthana S, Zetterberg H, Blennow K, Bendlin BB, Rey FE. Gut microbiome alterations in Alzheimer's disease[J]. Sci Rep, 2017, 7(1): 13537.
[DOI]
|
| [19] |
Lukiw WJ. Bacteroides fragilis lipopolysaccharide and inflammatory signaling in Alzheimer's disease[J]. Front Microbiol, 2016, 7: 1544.
[DOI]
|
| [20] |
Zhang L, Wang Y, Xiayu X, Shi C, Chen W, Song N, Fu X, Zhou R, Xu YF, Huang L, Zhu H, Han Y, Qin C. Altered gut microbiota in a mouse model of Alzheimer's disease[J]. J Alzheimers Dis, 2017, 60(4): 1241-1257.
[DOI]
|
| [21] |
Kong Y, Jiang B, Luo X. Gut microbiota influences Alzheimer's disease pathogenesis by regulating acetate in Drosophila model[J]. Future Microbiol, 2018, 13: 1117-1128.
[DOI]
|
| [22] |
Harach T, Marungruang N, Duthilleul N, Cheatham V, McCoy KD, Frisoni G, Neher JJ, Fåk F, Jucker M, Lasser T, Bolmont T. Erratum: Reduction of Abeta amyloid pathology in APPPS1 transgenic mice in the absence of gut microbiota[J]. Sci Rep, 2017, 7: 46856.
[DOI]
|
| [23] |
Sanborn V, Azcarate-Peril MA, Updegraff J, Manderino LM, Gunstad J. A randomized clinical trial examining the impact of LGG probiotic supplementation on psychological status in middle-aged and older adults[J]. Contemp Clin Trials Commun, 2018, 12: 192-197.
[DOI]
|
| [24] |
Akbari E, Asemi Z, Daneshvar Kakhaki R, Bahmani F, Kouchaki E, Tamtaji OR, Hamidi GA, Salami M. Effect of probiotic supplementation on cognitive function and metabolic status in Alzheimer's disease: A randomized, double-blind and controlled trial[J]. Front Aging Neurosci, 2016, 8: 256.
[DOI]
|
| [25] |
Distrutti E, O'Reilly JA, McDonald C, Cipriani S, Renga B, Lynch MA, Fiorucci S. Modulation of intestinal microbiota by the probiotic VSL3 resets brain gene expression and ameliorates the age-related deficit in LTP[J]. PLoS One, 2014, 9(9): e106503.
[DOI]
|
| [26] |
Leblhuber F, Geisler S, Steiner K, Fuchs D, Schütz B. Elevated fecal calprotectin in patients with Alzheimer's dementia indicates leaky gut[J]. J Neural Transm, 2015, 122(9): 1319-1322.
[DOI]
|
| [27] |
Zhao YH, Jaber V, Lukiw WJ. Secretory products of the human GI tract microbiome and their potential impact on Alzheimer's disease (AD): detection of lipopolysaccharide (LPS) in AD hippocampus[J]. Front Cell Infect Microbiol, 2017, 7: 318.
[DOI]
|
| [28] |
Zhan XH, Stamova B, Jin LW, DeCarli C, Phinney B, Sharp FR. Gram-negative bacterial molecules associate with Alzheimer disease pathology[J]. Neurology, 2016, 87(22): 2324-2332.
[DOI]
|
| [29] |
Vogt NM, Romano KA, Darst BF, Engelman CD, Johnson SC, Carlsson CM, Asthana S, Blennow K, Zetterberg H, Bendlin BB, Rey FE. The gut microbiota-derived metabolite trimethylamine N-oxide is elevated in Alzheimer's disease[J]. Alzheimers Res Ther, 2018, 10(1): 124.
[DOI]
|
| [30] |
Erny D, Hrabě de Angelis AL, Jaitin D, Wieghofer P, Staszewski O, David E, Keren-Shaul H, Mahlakoiv T, Jakobshagen K, Buch T, Schwierzeck V, Utermöhlen O, Chun E, Garrett WS, McCoy KD, Diefenbach A, Staeheli P, Stecher B, Amit I, Prinz M. Host microbiota constantly control maturation and function of microglia in the CNS[J]. Nat Neurosci, 2015, 18(7): 965-977.
[DOI]
|
| [31] |
Lach G, Schellekens H, Dinan TG, Cryan JF. Anxiety, depression, and the microbiome: a role for gut peptides[J]. Neurotherapeutics, 2018, 15(1): 36-59.
[DOI]
|
| [32] |
赵浩伊, 王迪, 张玉凤, 吴琼. 肠道菌群异常与阿尔茨海默病发生相关性的研究进展[J]. 神经解剖学杂志, 2017, 33(4): 476-480. [DOI]
|
| [33] |
Solas M, Puerta E, Ramirez MJ. Treatment options in Alzheimer's disease: The GABA story[J]. Curr Pharm Des, 2015, 21(34): 4960-4971.
[DOI]
|
| [34] |
Bravo JA, Forsythe P, Chew MV, Escaravage E, Savignac HM, Dinan TG, Bienenstock J, Cryan JF. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve[J]. Proc Natl Acad Sci USA, 2011, 108(38): 16050-16055.
[DOI]
|
| [35] |
von Linstow CU, Severino M, Metaxas A, Waider J, Babcock AA, Lesch KP, Gramsbergen JB, Finsen B. Effect of aging and Alzheimer's disease-like pathology on brain monoamines in mice[J]. Neurochem Int, 2017, 108: 238-245.
[DOI]
|
| [36] |
Yano JM, Yu K, Donaldson GP, Shastri GG, Ann P, Ma L, Nagler CR, Ismagilov RF, Mazmanian SK, Hsiao EY. Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis[J]. Cell, 2015, 161(2): 264-276.
[DOI]
|
| [37] |
Qin YR, Liu Y, Hao WL, Decker Y, Tomic I, Menger MD, Liu CF, Fassbender K. Stimulation of TLR4 attenuates Alzheimer's disease-related symptoms and pathology in tau-transgenic mice[J]. J Immunol, 2016, 197(8): 3281-3292.
[DOI]
|
| [38] |
Ghosh S, Wu MD, Shaftel SS, Kyrkanides S, LaFerla FM, Olschowka JA, O'Banion MK. Sustained interleukin-1beta overexpression exacerbates tau pathology despite reduced amyloid burden in an Alzheimer's mouse model[J]. J Neurosci, 2013, 33(11): 5053-5064.
[DOI]
|
| [39] |
Pistollato F, Sumalla Cano S, Elio I, Masias Vergara M, Giampieri F, Battino M. Role of gut microbiota and nutrients in amyloid formation and pathogenesis of Alzheimer disease[J]. Nutr Rev, 2016, 74(10): 624-634.
[DOI]
|
| [40] |
Villarán RF, Espinosa-Oliva AM, Sarmiento M, de Pablos RM, Argüelles S, Delgado-Cortés MJ, Sobrino V, Van Rooijen N, Venero JL, Herrera AJ, Cano J, Machado A. Ulcerative colitis exacerbates lipopolysaccharide-induced damage to the nigral dopaminergic system: potential risk factor in Parkinson's disease[J]. J Neurochem, 2010, 114(6): 1687-1700.
[DOI]
|
 2019, Vol. 14
2019, Vol. 14



