结核病仍然是威胁人类健康的重大疾病,世界卫生组织(World Health Organization,WHO) 2018年数据显示,2017年度全球共有1 010万新发病例及160万死亡病例[1]。结核分枝杆菌(Mycobacterium tuberculosis, M. tuberculosis)是结核病的病原菌,其感染致病机制复杂,是该领域研究的难点[2]。近年来有研究表明, 结核分枝杆菌结构域蛋白的乙酰化修饰可能与其毒力和潜伏感染相关[3-4]。Nε-Lys乙酰化是蛋白翻译后修饰的一种方式,对细菌的生长和代谢具有重要作用[5]。从结核分枝杆菌基因组信息分析得知结核分枝杆菌中有20余种具Gcn5 N-acetyltransferase(GNAT)结构域的蛋白,硫醇乙酰基转移酶(mycothiol acetyltransferase, MshD)是其中一个较重要的酶。该酶参与催化硫醇合成的最后一步反应,将乙酰CoA的乙酰基转移至硫醇前体,进而形成完整的硫醇。硫醇是结核分枝杆菌中主要的低相对分子质量醇,对维持细菌内的氧化还原稳态起重要作用[6-7]。
本实验以无毒的H37Ra菌株作为研究对象,根据同源重组原理,利用噬菌体侵染技术[8-9]构建mshD基因敲除株,并对其生物学特性进行分析,以期为后续深入开展该基因的功能研究奠定基础。
1 材料与方法 1.1 实验材料 1.1.1 引物设计与合成根据美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)中结核分枝杆菌减毒株H37Ra的基因位置及序列分别设计mshD基因及其同源臂的引物,详见表 1。引物由上海生工生物工程有限公司合成。
| Prime | Sequence(5′→3′) | Amplicon size/bp | Note |
| mshDLS | TTTTTTTTCCATAAATTGGAACTGGGAGACGCCTTTCCC | 850 | Van91Ⅰ |
| mshDLA | TTTTTTTTCCATTTCTTGGCTGCGCTGCTCGTCGGCGGT | Van91Ⅰ | |
| mshDRS | TTTTTTTTCCATAGATTGGACCACCTACAGCGTCGATAC | 850 | Van91Ⅰ |
| mshDRA | TTTTTTTTCCATCTTTTGGATGTAGTCCTCGGTGGCCTT | Van91Ⅰ | |
| mshDF | ATAGAATTCGTGACGGCGCTTGACTGGCG | 948 | EcoRⅠ |
| mshDR | TATAAGCTTTCAGTTATCCGTGCCAGCCAGCG | HindⅢ |
大肠埃希菌DH5α、结核分枝杆菌减毒株H37Ra、耻垢分枝杆菌mc2155、pMV361质粒均为本实验保存;大肠埃希菌TOP10、HB101菌株,p0004S、phAE159质粒均由美国W. R. Jacobs实验室提供;prime STAR DNA polymerase、Van91Ⅰ限制性内切酶、T4连接酶、PacⅠ限制性内切酶、CIP碱性去磷酸化酶均购自美国New England Biolabs公司;plasmid DNA extract kit、DNA gel extraction kit购自美国Axygen公司;噬菌体包装试剂盒MaxPlax lambda packaging extract购自美国Epicentre生物技术公司;hygromycin、ampicillin、kanamycin购自德国Sigma公司;RT-qPCR所用试剂购自日本Takara公司;MP缓冲液﹝包含25 mL 1 mol/L Tris-HCl (pH 7.4)、5 mL 1 mol/L MgSO4、1 mL 1 mol/L CaCl2、15 mL 5 mol/L NaCl﹞购自上海生工生物工程有限公司;OADC(100 mL)包括5 g bovine albumin fraction V(上海艾研生物科技有限公司)、0.03 g catalase(德国Sigma公司)、2 g glucose、0.85 g NaCl、12 μL oleic acid(上海生工生物工程有限公司)。
1.1.3 仪器宏观变倍体式显微镜(型号:Stereo Discovery. V20)购自德国卡尔蔡司公司。
1.2 敲除株与回补株的构建 1.2.1 mshD基因敲除株的构建[10]用mshDLS mshDLA、mshDRS mshDRA两对引物分别扩增mshD基因上下游各800 bp的同源臂序列,限制性内切酶Van91Ⅰ酶切同源臂及p0004S质粒,连接酶切产物并将重组质粒通过热激法转入大肠埃希菌TOP10感受态,挑取单菌落过夜培养并抽取质粒,将质粒送至上海生工生物工程有限公司测序验证。将成功构建的mshD-p0004S质粒连接至分枝杆菌类穿梭质粒phAE159,使用限制性内切酶PacⅠ及噬菌体包装试剂盒完成穿梭质粒mshD-phAE159的构建。将穿梭质粒mshD-phAE159通过电转化方法转入耻垢分枝杆菌感受态,待长出噬菌斑后,收集噬菌斑,置于MP缓冲液中,4 ℃放置过夜。吸取100 μL噬菌体、300 μL新鲜培养的耻垢分枝杆菌与温热的4 mL Top Agar,混匀,平铺在LB固体培养基上,于30 ℃培养箱中静置培养3 d后,将上层培养基收集到适量MP缓冲液中,4 ℃放置过夜。重复上述扩增步骤,直至噬菌体滴度达到1010 PFU/mL及敲除菌株与噬菌体浓度比例达到1:10以上。高滴度噬菌体与H37Ra感受态于37 ℃孵育3~4 h后,再加入10 mL 7H9 OADC培养基复苏16~24 h,离心收集菌体并涂布于7H10 OADC固体培养基(75 μg/mL hyg),37 ℃培养4~6周。挑取单菌落,置于5 mL 7H9 OADC液体培养基中,37 ℃培养20 d,抽取菌体基因组并以基因组为模板PCR扩增目的基因。引物:mshDLS、mshDRA(表 1);程序:98 ℃ 3 min;98 ℃ 10 s,64 ℃ 15 s,72 ℃ 1 min,29个循环。PCR产物送上海生工生物工程有限公司测序。
1.2.2 mshD基因回补株的构建使用引物mshDF、mshDR(表 1)对H37Ra基因组进行PCR扩增获得mshD基因,用限制性内切酶EcoRⅠ和Hind Ⅲ同时酶切mshD基因片段及pMV361质粒。连接酶切产物,并将重组质粒通过热激法转入大肠埃希菌DH5α感受态,涂布于LB固体培养基(50 μg/mL Kana),37 ℃倒置培养过夜。挑取单菌落,置于5 mL LB液体培养基中,37 ℃、200 r/min过夜培养并抽取质粒,质粒送至上海生工生物工程有限公司测序验证。将构建成功的mshD-pMV361质粒电转入H37Ra mshD基因敲除株感受态,待长出单菌落后,挑取并置5 mL 7H9 OADC液体培养基中,37 ℃培养20 d。最后收集菌体,抽取其基因组,并以基因组为模板PCR扩增目的基因。引物:mshDF、mshDR(表 1);程序:98 ℃ 3 min;98 ℃ 10 s,64 ℃ 15 s,72 ℃ 1 min,29个循环。PCR产物送上海生工生物工程有限公司测序,同时以野生株基因组为模板做对照。
1.2.3 转录水平验证分别收集对数期野生株、敲除株、回补株菌液各10 mL,并对其进行RNA抽提及RT-qPCR验证。RT-qPCR反应条件:10 μL 2×T5 Fast qPCR Mix,0.8 μL 10 μmol/L Primer-F,0.8 μL 10 μmol/L Primer-R,1 μL cDNA,0.2 μL 50×ROX Reference DyeⅠ,ddH2O补齐至20 μL。程序:95 ℃ 1 min;95 ℃ 10 s,60 ℃ 5 s,72 ℃ 15 s,40个循环。
1.3 敲除株生物学特性鉴定 1.3.1 菌落形态观察分别收集WT、KO、COM对数期菌液各5 mL,低频水浴超声,参数:超声15 s,停止15 s,8个循环;静置20 min,转移上清液至新的无菌离心管,制备菌悬液。用7H9 OADC培养基调整菌悬液浓度至OD600为0.3,并将菌液进行10倍梯度稀释至菌浓度为10-4。取100 μL稀释后的菌液涂布于7H10 OADC培养基,封口膜封口,37 ℃倒置培养4~6周。使用宏观变倍体式显微镜观察菌落形态。
1.3.2 生物膜形成观察制备菌悬液,4 000 r/min离心收集菌体,用Sauton培养基调整菌浓度至OD600为0.3,稀释30倍,于24孔板中分别加入1.3 mL稀释后的菌液,实验设置3个复孔。最后用封口膜封口,锡箔纸包裹,37 ℃培养箱中静置培养4~6周。宏观变倍体式显微镜下观察生物膜的形成。
1.3.3 生长曲线测定制备菌悬液,4 000 r/min离心收集菌体,用PBS分别调整WT、KO、COM菌浓度至OD600为0.6,按1:50比例转接入7H9 OADC培养基,37 ℃培养箱中静置培养。每隔1 d定点取样,测定OD600的值,实验设置3个复孔。
1.3.4 敲除株与野生株抗胁迫能力检测制备菌悬液,4 000 r/min离心收集菌体,用PBS调整菌浓度至OD600为0.2,用5 mmol/L H2O2、0.05% SDS在50 ℃热激处理菌液1.5 h以及低氧处理5、10、15 d。低氧处理方式:用15 mL离心管,2/3装液量,石蜡封口,于37 ℃静置培养。将菌液进行10倍梯度稀释至菌浓度为10-3和10-2,取100 μL菌液涂布于7H10 OADC培养基,37 ℃培养箱中倒置培养4~6周。最后进行菌落计数,计算存活率。
1.4 统计学方法上述实验均设置生物学及技术重复各3次。其中,菌体存活率为胁迫处理后的菌体CFU与未经处理的菌体CFU的比值。
2 结果 2.1 构建出mshD基因敲除株以敲除株基因组为模板,用mshD基因左臂上游引物和mshD基因右臂下游引物进行PCR扩增,得到mshD基因长度为948 bp,左臂右臂序列长度均为800 bp,表明mshD基因已被敲除,此时mshD基因被sacB和hyg基因替换(图 1A)。以H37Ra基因组为模板,用左臂上游引物和右臂下游引物进行PCR扩增得到2 548 bp的序列片段,为同源臂序列长度与mshD基因序列长度的总和。以敲除株基因组为模板进行PCR扩增得到5 200 bp的序列片段(图 1B),为同源臂序列长度与sacB和hyg基因序列长度的总和。将PCR产物纯化后送至上海生工生物工程有限公司测序,结果显示目的基因大小与预测结果一致。
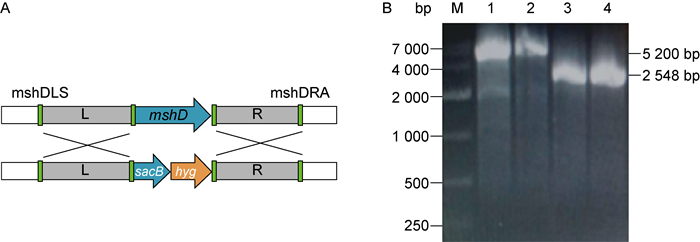
|
| A: Homologous recombination schematic. mshD gene replaced by sacB and hyg genes. B: PCR electrophoresis identification. M: 12 000 bp marker; 1: genome of knockout strain, the annealing temperature is 62 ℃; 2: genome of knockout strain, the annealing temperature is 64 ℃; 3: genome of H37Ra, the annealing temperature is 62 ℃; 4: genome of H37Ra, the annealing temperature is 64 ℃. 图 1 mshD基因敲除株基因组PCR验证电泳图 Fig. 1 PCR identification of the mshD gene knockout strain |
以回补株基因组为模板,用mshD基因上下游引物进行PCR扩增,同时以野生株基因组为模板做对照。结果得到948 bp的基因片段,与对照结果一致(图 2)。说明目的基因定点整合到H37Ra基因组上,mshD基因回补株构建成功。
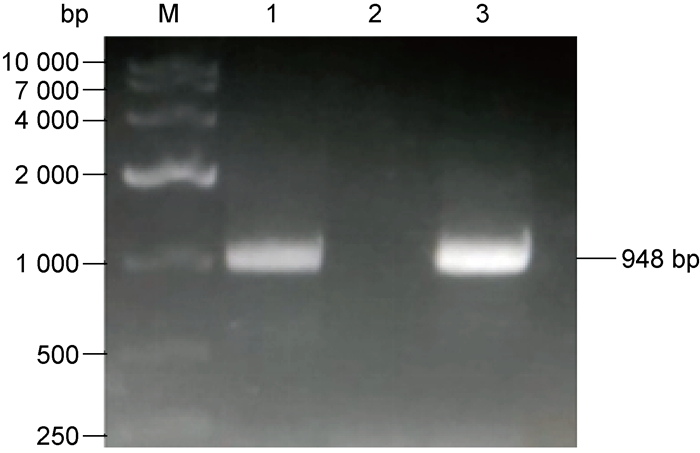
|
| M: 10000 bp DNA marker; 1: genome of H37Ra; 2: genome of the knockout strain; 3: genome of the complemented strain. 图 2 H37Ra野生株、mshD基因敲除株及回补株PCR验证电泳图 Fig. 2 PCR identification of H37Ra, mshD gene knockout strain and complemented strain |
RT-QPCR验证结果显示(图 3),敲除株中mshD基因的转录水平为零,至此说明mshD基因敲除成功;由于本实验的pMV361质粒上携带Hsp60强启动子,结果致使回补株中mshD基因的转录水平近似为野生株的4倍。
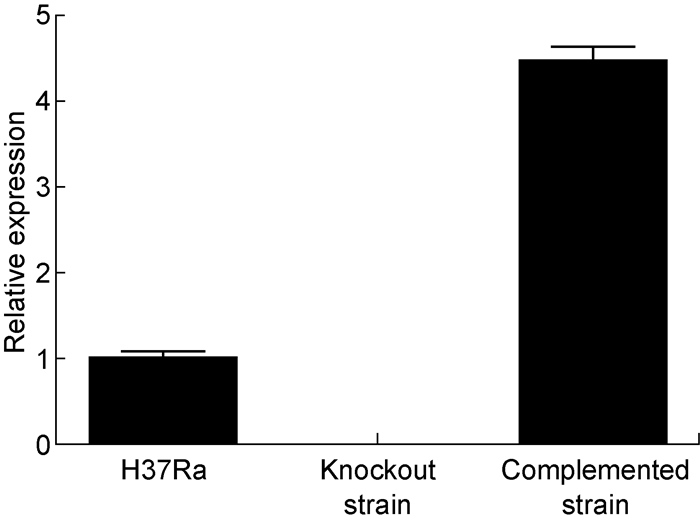
|
| 图 3 H37Ra野生株、mshD基因敲除株及回补株转录水平验证 Fig. 3 Verification of H37Ra, mshD gene knockout strain and complemented strain at the transcription level |
与野生株相比,敲除株菌落褶皱减少,且菌落偏小;回补株菌落扁平,呈白色,无明显褶皱。野生株和回补株在培养4周时已形成菌落,而敲除株直至6周时才形成大小适宜的菌落(图 4)。
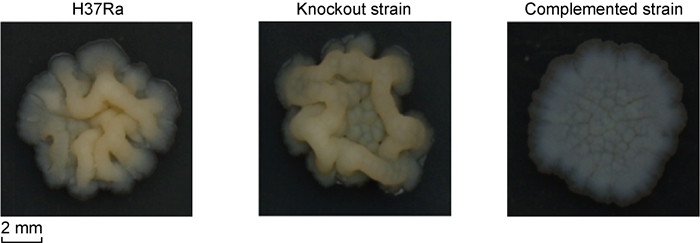
|
| 图 4 H37Ra野生株、mshD基因敲除株及回补株菌落形态 Fig. 4 Colony morphology of H37Ra, mshD gene knockout strain and complemented strain |
将生物膜置于宏观变倍体式显微镜下观察(图 5),结果显示4周时,敲除株生物膜并没有完全形成,而野生株和回补株生物膜已形成,且褶皱明显;6周时,敲除株生物膜已形成,但膜的厚度<野生株和回补株,且褶皱较少。

|
| 图 5 H37Ra野生株、mshD基因敲除株及回补株生物膜 Fig. 5 Biofilm formation of H37Ra, mshD gene knockout strain and complemented strain |
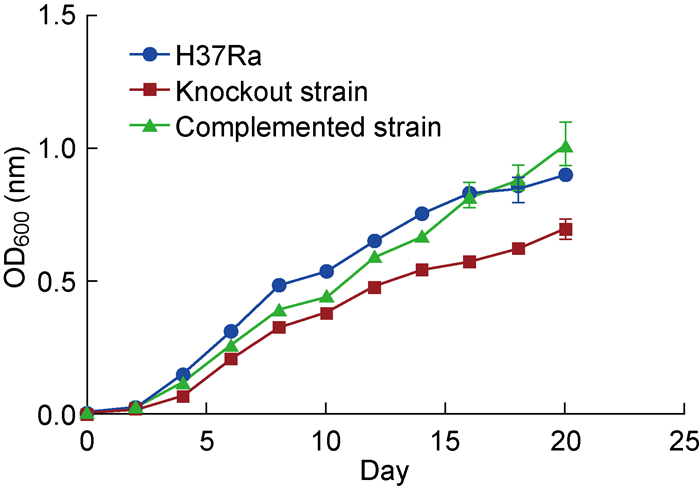
从生长曲线的结果可以看出,mshD基因敲除株的生长曲线始终低于野生株和回补株,而回补株的生长曲线和野生株基本保持一致(图 6)。综合上述结果,认为此回补株具有一定的参考意义。同时也进一步说明了mshD基因对菌体生长具有重要作用,该基因的缺失明显抑制了菌体生长。
|
| 图 6 H37Ra野生株、mshD基因敲除株及回补株生长曲线 Fig. 6 Growth curves of H37Ra, mshD gene knockout strain and complemented strain |
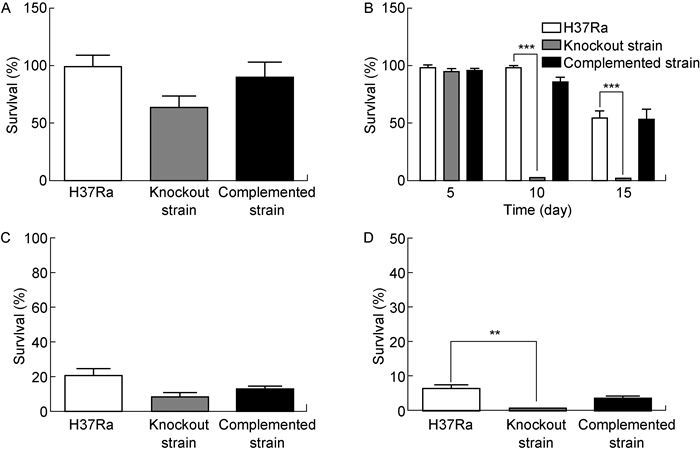
抗胁迫实验的结果显示(图 7),在5 mmol/L H2O2和0.05%SDS作用下敲除株存活率略低于野生株和回补株,这种差异在低氧处理及50 ℃热激作用下更加显著。在低氧处理5 d时,野生株、敲除株、回补株生长均不受影响;低氧处理10 d时,野生株和回补株生长仍不受影响,但敲除株的存活率骤然下降至约3%;低氧处理15 d时,野生株和回补株的存活率下降至约50%,而敲除株的存活率下降至约2%。
|
| A: Analysis of antioxidant capacity of different strains. B: Analysis of anti-hypoxia ability of different strains. C: Analysis of anti-detergent ability of different strains. D: Analysis of heat resistance of different strains. **:P < 0.01; ***:P < 0.001. 图 7 H37Ra野生株、mshD基因敲除株及回补株耐H2O2、低氧、SDS和热激的能力 Fig. 7 The ability of H37Ra, mshD gene knockout strain and complemented strain resistant to H2O2, hypoxia, SDS and heat shock |
硫醇是存在于分枝杆菌和其他多数放线菌中的小分子醇类,具有维持细胞氧化还原稳态和抗毒素作用[11]。在结核分枝杆菌中,硫醇的合成依次需要硫醇糖基转移酶MshA、硫醇去乙酰化酶MshB、硫醇连接酶MshC、MshD的参与[12]。MshD参与催化硫醇合成的最后一步反应,能将acetyl-coenzyme A (CoA)的乙酰基团转移至硫醇前体Cys-GlcN-Ins,进而形成完整的硫醇。Vetting等[13]解析了MshD蛋白的晶体结构,发现该蛋白由2个结构域组成,呈β1α1α2β2β3β4α3β5α4β6拓扑结构。Rawat等[14-15]探索了耻垢分枝杆菌中硫醇的合成途径及MshD缺失对菌体的影响。Buchmeier等[12]对结核分枝杆菌Erdman株的研究发现,当MshD缺失后,硫醇含量只有野生株含量的1%,硫醇前体的含量处于较高水平。此外有研究表明,MshD可能与结核病的快速诊断相关。目前大多数临床诊断测试的灵敏度不高,特异性不强,且检测周期较长[16]。近年来分子生物学诊断方法的出现为结核病的治疗拓宽了思路,最新研究发现可通过对菌体抗原的检测实现结核病的精准诊断[17]。Zeitoun等[18]研究发现在大量结核病患者的血清中均检测出MshD蛋白,因此认为MshD可作为一种潜在的新型生物标志物用于活动性结核病的诊断。
结核分枝杆菌侵染宿主后,需应对机体内一系列的逆环境,其中包括巨噬细胞内的低氧环境。结核分枝杆菌在胞外环境生存时也同样会遇到压力刺激,因此菌体的抗胁迫能力与其胞内外的生存能力密切相关。本研究结果显示,mshD基因敲除株菌落形态及大小都发生了变化,生物膜形成能力也相对减弱,生长明显变慢,抗胁迫能力下降。这说明在结核分枝杆菌中mshD基因对菌体生长代谢具有重要的作用,可能原因是MshD的缺失导致硫醇合成受影响,进而导致菌体生长及代谢的变化。由于本实验前期尝试多次并未构建成功携带自身启动子的pMV361质粒,故而选择使用带有Hsp60启动子的pMV361质粒。虽然回补株mshD基因的转录水平比野生株高近4倍,但仍然可为后期实验提供一定的参考价值。本研究结果为MshD作为新型生物标志物用于诊断活动性结核病提供了实验依据。
结核分枝杆菌的乙酰化修饰对菌体的生长和代谢具有重要作用,近年来研究表明乙酰化可能与结核分枝杆菌的毒力和潜伏感染相关。基因组分析表明,结核分枝杆菌硫醇乙酰化酶MshD属于GNAT家族,而与GNAT家族其他蛋白不同,MshD包括两个乙酰转移酶的结构域,且这两个结构域的C端序列高度同源。MshD作为乙酰化酶参与了结核分枝杆菌硫醇的合成,但其是否会影响菌体蛋白的乙酰化修饰及其他代谢通路活性还有待深入研究。在结核分枝杆菌中,硫醇的缺失导致菌体生长明显被抑制,且硫醇对维持细菌内的氧化还原稳态起重要作用,作为可在细胞内生存的结核分枝杆菌,硫醇对其应对巨噬细胞内不利微环境是否起重要调控作用,尚需进一步探索。
| [1] |
WHO. Tuberculosis (TB)[DB/OL]. Global Health Observatory (GHO) data. http://www.who.int/gho/tb/en.
|
| [2] |
Murphy DJ, Brown JR. Novel drug target strategies against Mycobacterium tuberculosis[J]. Curr Opin Microbiol, 2008, 11(5): 422-427.
[DOI]
|
| [3] |
Bi J, Gou Z, Zhou F, Chen Y, Gan J, Liu J, Wang H, Zhang X. Acetylation of lysine 182 inhibits the ability of Mycobacterium tuberculosis DosR to bind DNA and regulate gene expression during hypoxia[J]. Emerg Microbes Infect, 2018, 7(1): 108.
[DOI]
|
| [4] |
Bi J, Wang Y, Yu H, Qian X, Wang H, Liu J, Zhang X. Modulation of central carbon metabolism by acetylation of isocitrate lyase in Mycobacterium tuberculosis[J]. Sci Rep, 2017, 7: 44826.
[DOI]
|
| [5] |
Verdin E, Ott M. 50 years of protein acetylation: from gene regulation to epigenetics, metabolism and beyond[J]. Nat Rev Mol Cell Biol, 2015, 16(4): 258-264.
[DOI]
|
| [6] |
Koledin T, Newton GL, Fahey RC. Identification of the mycothiol synthase gene (mshD) encoding the acetyltransferase producing mycothiol in actinomycetes[J]. Arch Microbiol, 2002, 178(5): 331-337.
[DOI]
|
| [7] |
Newton GL, Ta P, Fahey RC. A mycothiol synthase mutant of Mycobacterium smegmatis produces novel thiols and has an altered thiol redox status[J]. J Bacteriol, 2005, 187(21): 7309-7316.
[DOI]
|
| [8] |
Lewis KN, Liao R, Guinn KM, Hickey MJ, Smith S, Behr MA, Sherman DR. Deletion of RD1 from Mycobacterium tuberculosis mimics bacille Calmette-Guérin attenuation[J]. J Infect Dis, 2003, 187(1): 117-123.
[DOI]
|
| [9] |
Villela AD, Rodrigues VD Junior, Pinto AF, Wink PL, Sánchez-Quitian ZA, Petersen GO, Campos MM, Basso LA, Santos DS. Characterisation of iunH gene knockout strain from Mycobacterium tuberculosis[J]. Mem Inst Oswaldo Cruz, 2017, 112(3): 203-208.
[DOI]
|
| [10] |
Jain P, Hsu T, Arai M, Biermann K, Thaler DS, Nguyen A, González PA, Tufariello JM, Kriakov J, Chen B, Larsen MH, Jacobs WR Jr. Specialized transduction designed for precise high-throughput unmarked deletions in Mycobacterium tuberculosis[J]. MBio, 2014, 5(3): e01245-14.
[DOI]
|
| [11] |
Singh AR, Strankman A, Orkusyan R, Purwantini E, Rawat M. Lack of mycothiol and ergothioneine induces different protective mechanisms in Mycobacterium smegmatis[J]. Biochem Biophys Rep, 2016, 8: 100-106.
[DOI]
|
| [12] |
Buchmeier NA, Newton GL, Fahey RC. A mycothiol synthase mutant of Mycobacterium tuberculosis has an altered thiol-disulfide content and limited tolerance to stress[J]. J Bacteriol, 2006, 188(17): 6245-6252.
[DOI]
|
| [13] |
Vetting MW, Roderick SL, Yu M, Blanchard JS. Crystal structure of mycothiol synthase (Rv0819) from Mycobacterium tuberculosis shows structural homology to the GNAT family of N-acetyltransferases[J]. Protein Sci, 2003, 12(9): 1954-1959.
[DOI]
|
| [14] |
Rawat M, Johnson C, Cadiz V, Av-Gay Y. Comparative analysis of mutants in the mycothiol biosynthesis pathway in Mycobacterium smegmatis[J]. Biochem Biophys Res Commun, 2007, 363(1): 71-76.
[DOI]
|
| [15] |
Rawat M, Newton GL, Ko M, Martinez GJ, Fahey RC, Av-Gay Y. Mycothiol-deficient Mycobacterium smegmatis mutants are hypersensitive to alkylating agents, free radicals, and antibiotics[J]. Antimicrob Agents Chemother, 2002, 46(11): 3348-3355.
[DOI]
|
| [16] |
Flores LL, Steingart KR, Dendukuri N, Schiller I, Minion J, Pai M, Ramsay A, Henry M, Laal S. Systematic review and meta-analysis of antigen detection tests for the diagnosis of tuberculosis[J]. Clin Vaccine Immunol, 2011, 18(10): 1616-1627.
[DOI]
|
| [17] |
Bekmurzayeva A, Sypabekova M, Kanayeva D. Tuberculosis diagnosis using immunodominant, secreted antigens of Mycobacterium tuberculosis[J]. Tuberculosis (Edinb), 2013, 93(4): 381-388.
[DOI]
|
| [18] |
Zeitoun H, Bahey-El-Din M, Kassem MA, Aboushleib HM. Mycothiol acetyltransferase (Rv0819) of Mycobacterium tuberculosis is a potential biomarker for direct diagnosis of tuberculosis using patient serum specimens[J]. Lett Appl Microbiol, 2017, 65(6): 504-511.
[DOI]
|
 2019, Vol. 14
2019, Vol. 14


