2. 同济大学附属上海市肺科医院结核病临床研究中心, 上海 200433;
3. 复旦大学上海医学院基础医学院病原生物学系, 教育部、卫健委、医科院医学分子病毒学重点实验室, 上海 200032
2. Clinic and Research Center of Tuberculosis, Shanghai Pulmonary Hospital, Tongji University School of Medicine, Shanghai 200433, China;
3. Key Laboratory of Medical Molecular Virology(MOE/NHC/CAMS), and Department of Microbiology and Parasitology, School of Basic Medical Sciences, Shanghai Medical College, Fudan University, Shanghai 200032, China
结核病(Tuberculosis, TB)的病原菌结核分枝杆菌(Mycobacterium tuberculosis, Mtb)能在宿主细胞内寄生、繁殖。Mtb侵入机体后可被巨噬细胞表面的受体识别,通过胞吞作用进入巨噬细胞[1]。毒性较强的Mtb不但能抑制吞噬体和溶酶体的融合,阻止吞噬细胞对其的杀伤,而且能够调节巨噬细胞的分化和成熟,从而进行免疫逃逸[2]。γ干扰素活化的巨噬细胞可促进吞噬体与溶酶体融合来清除细胞,因此,细胞免疫在调控Mtb感染过程中发挥重要作用。探究Mtb与宿主细胞的关系,对于深入阐明Mtb的致病机制以及宿主的抗结核免疫具有重要意义。
microRNA(简称miRNA)是一种约19~22 nt长的内源性非编码RNA,通过与靶基因的调控区域结合,在转录后水平降解mRNA或抑制靶基因的翻译,从而调控基因的表达[3]。Mtb感染能引起宿主细胞中miRNA表达量发生显著变化。以往的研究表明,命名为miR-125b-5p的miRNA在结核病人体内含量显著升高[4-5],但其具体作用机制未知。本研究通过观察miR-125b-5p对分枝杆菌在宿主细胞及小鼠体内生长情况的影响,探讨其与结核感染的关系,以期证明miR-125b-5p在抗结核免疫过程中所发挥的作用。
1 材料和方法 1.1 材料 1.1.1 菌株和细胞耻垢分枝杆菌(Mycobacterium smegmatis, MS)和牛分枝杆菌(Mycobacterium bovis)卡介苗(Bacillus Calmette-Guérin vaccine, BCG)由本实验室保存。人肺上皮细胞A549、人巨噬细胞THP-1及鼠巨噬细胞RAW264.7源自中国科学院生化细胞研究所细胞库。
1.1.2 试验动物C57BL/6小鼠,SPF级,7~8周龄,雌性,共12只,购自上海斯莱克实验动物有限公司。
1.1.3 培养基7H9液体培养基和10%OADC增菌液购自BD公司,7H10固体培养基购自BD公司,1640培养基加10%胎牛血清(fatal bovine serum,FBS)购自GIBCO公司。
1.1.4 试剂miR-125b-5p模拟物(miR-125b-5p-mi)、miR-125b-5p抑制剂(miR-125b-5p-in)及其miRNA对照(mi-con、in-con)均购自天根生化科技有限公司,Trizol购自Qiagen公司,miRcute miRNA First-Strand cDNA Synthesis试剂盒和miRcute miRNA q-PCR Detection(SYBR Green)试剂盒购自天根生化科技有限公司。表达miR-125b-5p抑制剂的慢病毒购自上海吉凯基因科技有限公司。
1.1.5 引物miR-125b-5p荧光定量聚合酶链反应引物(5 ′ -UCA CCG GGUGUAAAUCAGCUU-3 ′)和U6引物(5 ′ -CTCGCTTCGGCAGCACA-3 ′)购自天根生化科技有限公司。
1.2 方法 1.2.1 分枝杆菌的培养和计数分枝杆菌培养采用7H9液体培养基和10%OADC增菌液,在37 ℃恒温培养箱中进行。用7H10固体培养基和10%OADC培养3~4周,然后计算菌落数目。
1.2.2 细胞培养所有细胞都采用1640培养基加10% FBS,于5% CO2和37 ℃条件下培养。
1.2.3 miRNA转染按照转染试剂Lipo2000的说明书,将终浓度为50 nmol/L的miR-125b-5p-mi、miR-125b-5p-in及其对照mi-con、in-con与细胞孵育。在孵育后的不同时间点收集细胞,进行实验。
1.2.4 细菌感染细胞在被细菌感染前,用佛波酯(Phorbol 12-myristate 13-acetate, PMA)以50 ng/ml的浓度诱导THP-1细胞。分别用分枝杆菌以MOI=10:1(细菌:细胞)的比例感染诱导后的THP-1细胞、A549或RAW264.7细胞。感染4 h后,洗掉未被细胞吞噬的细菌。根据实验目的在不同的时间点取样,用于提取RNA或microRNA,或者用于菌落计数。
1.2.5 荧光定量聚合酶链反应检测用Trizol裂解细胞,抽提总RNA,用miRcute miRNA First-Strand cDNA Synthesis试剂盒进行miRNA cDNA第1链合成。用miRcute miRNA q-PCR Detection试剂盒对miR-125b-5p的表达量进行荧光定量聚合酶链反应(polymerase chain reaction, PCR)检测,miR-125b-5p的荧光定量PCR引物为5 ′ -UCA CCG GGUGUAAAUCAGCUU-3 ′。荧光定量PCR的反应条件为95 ℃变性120 s;95 ℃变性15 s,60 ℃退火30 s,共40个循环。核内小RNA U6作为内参,U6的引物为5 ′ -CTCGCTTCGGCA-GCACA-3 ′。
1.2.6 分枝杆菌感染小鼠C57BL/6小鼠12只,饲养于上海市肺科医院P2动物房。实验组6只小鼠攻毒剂量1.3×107 CFU/只,攻毒方式为尾静脉注射;对照组6只小鼠注射等体积的磷酸盐缓冲液(phosphate buffer saline,PBS)。在分枝杆菌感染后第3天,开始在小鼠后肢足垫注射表达miR-125b-5p抑制剂的慢病毒进行治疗,剂量为5×106TU/只。小鼠饲养3周后颈椎脱臼处死,在无菌的超净台内将小鼠解剖,取出肺脏并称重,在研钵中将脏器全部研磨制成匀质的悬液,取300 μ L细胞悬液抽提RNA,用荧光定量PCR检测miR-125b-5p的表达量。肺部病理切片用苏木素-伊红染色(hematoxylin-eosin staining)。
1.3 统计学方法实验数据采用GraphPad Prism 5软件进行分析。两组样本均数检验采用t检验,多组样本均数检验采用单因素方差分析。P < 0.05为差异具有统计学意义。
2 结果 2.1 分枝杆菌感染诱导细胞内miR-125b-5p的上调表达为验证分枝杆菌的感染是否会改变宿主细胞中miR-125b-5p的表达量,首先采用生长速率较快的耻垢分枝杆菌感染人肺上皮细胞A549。在感染24 h后,荧光定量PCR检测发现miR-125b-5p在感染细胞中的表达量比未感染的细胞提高了约15倍(图 1A)。随后,用生长速率比较缓慢的牛分枝杆菌BCG感染A549细胞,检测发现感染后的miR-125b-5p表达量比感染前提高了20多倍。
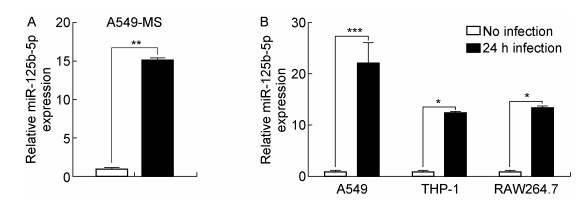
|
| A: The relative expressions of miR-125b-5p were tested by q-PCR method in A549 cells with MS infection for 24 hours and those without infection, respectively. B: The relative expressions of miR-125b-5p in A549, THP-1 and RAW264.7 cells were tested by q-PCR method in cell with BCG infection for 24 hours and those without infection, respectively. These experiments were repeated at least 3 times. *:P < 0.05,* *:P < 0.01,* * *:P < 0.001. (n=3) 图 1 分枝杆菌感染不同类型的细胞诱导了细胞内miR-125b-5p的上调表达 Fig. 1 Mycobacteria infection induced miR-125b-5p up-regulation in target cells |
为了验证分枝杆菌感染是否能够提高miR-125b-5p在巨噬细胞中的表达量,分别采用BCG感染人源巨噬细胞系THP-1和小鼠巨噬细胞系RAW264.7。发现miR-125b-5p在两种巨噬细胞中的表达量都提高了10倍以上(图 1B)。上述结果证明分枝杆菌感染能诱导宿主细胞中miR-125b-5p显著上调表达。
为了验证分枝杆菌感染是否影响miR-125b-5p在宿主体内的表达量,采用BCG感染C57BL/6小鼠。在感染1个月后,提取小鼠脏器内的RNA,反转成cDNA,进行荧光定量PCR检测。结果发现,miR-125b-5p在BCG感染小鼠的肺中表达量约为PBS对照组的15倍(图 2)。结果说明,分枝杆菌感染能够提高miR-125b-5p在小鼠肺中的表达量, 即miR-125b-5p表达量与分枝杆菌感染密切相关。
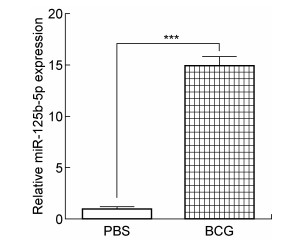
|
| * * *:P < 0.001. (n=6) 图 2 miR-125b-5p在BCG感染的C57BL/6小鼠肺部的表达水平显著高于对照组 Fig. 2 The expression of miRNA-125b-5p in BCG infected mice lung is significantly higher than that in uninfected mice lung |
为验证miR-125b-5p的表达量改变是否影响分枝杆菌在细胞内的生长,用BCG感染吞噬细胞,然后向细胞内转染miR-125b-5p的模拟物或对照。培养3 d后,裂解细胞。裂解液涂板,培养3周后进行菌落计数,发现在模拟物转染的A549细胞中,BCG菌落数目大约是对照组的3倍(图 3A,左图)。与此类似,在模拟物转染的巨噬细胞THP-1和RAW264.7中,BCG的菌落数目都比对照组提高了约2倍(图 3A,中、右图)。结果说明,转染miR-125b-5p模拟物后,分枝杆菌在细胞内生长、繁殖的速率增加,菌落数目增多。
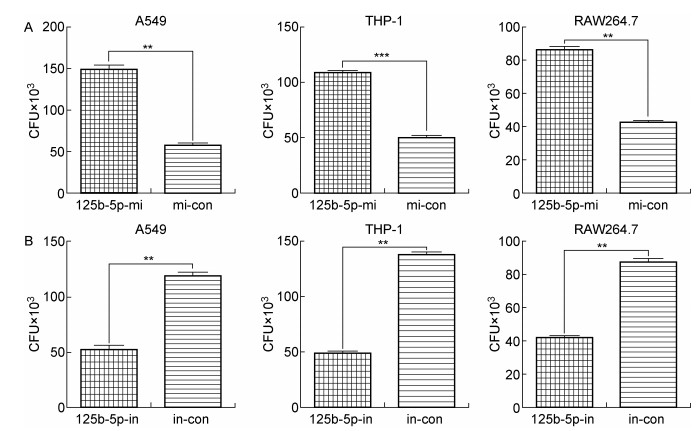
|
| A: The BCG CFUs were counted in lysate of A549, THP-1 and RAW264.7 cells transfected by the mimic of miR-125b-5p (125b-5p-mi) or control microRNAs (mi-con), respectively. B: The BCG CFUs were counted in lysate of A549, THP-1 and RAW264.7 cells transfected by the inhibitor of miR-125b-5p (125b-5p-in) or control microRNAs (in-con), respectively. These experiments were repeated at least 3 times. * *:P < 0.01,* * *:P < 0.001. (n=3) 图 3 miR-125b-5p及其抑制剂对细胞内感染的BCG生长的影响 Fig. 3 miR-125b-5p regulated the growth of mycobacteria in phagocytes |
用BCG感染吞噬细胞后,再转染miR-125b-5p抑制剂来减低细胞内miR-125b-5p的表达量。菌落计数的结果表明,在被抑制剂转染的A549细胞中,BCG菌落数目约是对照组的50%(图 3B,左图)。同样,在被抑制剂转染的巨噬细胞THP-1和RAW264.7中,BCG的菌落数目都比对照组显著降低(图 3B,中、右图)。结果说明,在转染miR-125b-5p抑制剂后,分枝杆菌在细胞内的生长数目减少。表明miR-125b-5p的表达能够促进分枝杆菌在细胞内的生长。
2.3 miR-125b-5p抑制剂减低分枝杆菌感染小鼠体内的细菌载量为了验证miR-125b-5p是否能够调节分枝杆菌在宿主体内的生长,在BCG感染小鼠后的第4天,注射表达miR-125b-5p抑制剂的慢病毒到小鼠体内。感染1个月后,解剖小鼠,取脾脏,进行菌落计数。结果表明,在注射抑制剂的小鼠脾脏中BCG菌落数目显著低于对照组(P < 0.05,图 4A)。同时,取小鼠的肺部切片进行病理分析,发现对照组小鼠肺部出现了显著的结核病理损伤,而治疗组小鼠肺部的结核病理损伤较少。这说明注射表达miR-125b-5p抑制剂的慢病毒在降低小鼠体内miR-125b-5p表达量后能显著抑制分枝杆菌在小鼠体内的生长,减轻肺部病理损伤。
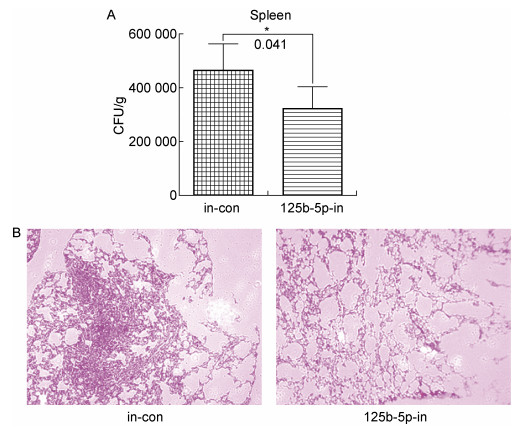
|
| A: The BCG CFUs were counted in spleen lysate of mice infected by BCG and administrated by miR-125b-5p inhibitor or control microRNAs, respectively. B: Histologic evaluation of lung tissue sections of BCG infected mice with administration of miR-125b-5p inhibitor or control microRNAs, respectively. *:P < 0.05. (n=6) 图 4 miR-125b-5p的抑制剂治疗BCG感染的C57BL/6小鼠能够显著降低分枝杆菌在脾脏的细菌载量,减轻肺部病理损伤 Fig. 4 Administration of miR-125b-5p inhibitor in BCG infected mice significantly reduced the mycobacteria burden in mice spleen and pathological damage in mice lung comparing to the control mice |
microRNA与Mtb感染的发生和发展密切相关。microRNA不仅可以作为结核病的生物标志物,而且还与细胞凋亡、自噬以及抗结核免疫调控等密切相关[6]。本研究深入探讨了miR-125b-5p在抗结核免疫过程中的作用。
Mtb是一种胞内寄生菌,主要寄生于宿主的巨噬细胞和肺上皮细胞[7-9]。因此,选择人肺上皮细胞A549和人巨噬细胞THP-1[10],及小鼠的巨噬细胞RAW264.7进行研究。无论用快速生长的耻垢分枝杆菌还是缓慢生长的BCG进行感染,细胞内miR-125b-5p的表达量均显著上调。感染BCG后,小鼠肺部miR-125b-5p的表达量也显著上调。结果证明无论在体内还是体外,分枝杆菌的感染都能诱导miR-125b-5p上调表达,提示miR-125b-5p的表达与分枝杆菌在宿主内生长存在密切关系。
为了进一步证实miR-125b-5p对分枝杆菌在宿主细胞内生长的作用,分别转染miR-125b-5p模拟物和miR-125b-5p抑制剂,结果发现BCG在细胞中的生长发生显著改变。且miR-125b-5p抑制剂能够显著降低BCG感染小鼠体内的细菌载量。这表明miR-125b-5p抑制剂具有治疗BCG感染的潜在应用价值,也证明了miRNA具有用于结核病治疗的潜力。
miR-125b-5p与其他miRNA一样,具有多个靶点,受多种调控,可能通过多个机制调控分枝杆菌的生长[11-12],例如,miR-125b-5p是否能够调控巨噬细胞中吞噬体与溶酶体的融合[13],是否能够调控一氧化氮或维生素D通路相关的杀菌通路[14],是否能影响细胞的自噬或凋亡过程等[15]。所以,miR-125b-5p影响分枝杆菌在宿主细胞和小鼠体内生长的作用机制还有待进一步探究,可利用miR-125b-5p敲除的转基因小鼠在系统水平上探究miR-125b-5p对分枝杆菌在宿主体内生长的影响[16]。
| [1] |
Cohen SB, Gern BH, Delahaye JL, Adams KN, Plumlee CR, Winkler JK, Sherman DR, Gerner MY, Urdahl KB. Alveolar macrophages provide an early Mycobacterium tuberculosis niche and initiate dissemination[J]. Cell Host Microbe, 2018, 24(3): 439-446.
[URI]
|
| [2] |
Pieters J. Mycobacterium tuberculosis and the macrophage:maintaining a balance[J]. Cell Host Microbe, 2008, 3(6): 399-407.
[URI]
|
| [3] |
Denli AM, Tops BB, Plasterk RH, Ketting RF, Hannon GJ. Processing of primary microRNAs by the Microprocessor complex[J]. Nature, 2004, 432(7014): 231-235.
[URI]
|
| [4] |
Chakrabarty S, Kumar A, Raviprasad K, Mallya S, Satyamoorthy K, Chawla K. Host and MTB genome encoded miRNA markers for diagnosis of tuberculosis[J]. Tuberculosis (Edinb), 2019, 116: 37-43.
[URI]
|
| [5] |
Shen H, Gu J, Xiao H, Liang S, Yang E, Yang R, Huang D, Chen C, Wang F, Shen L, Chen ZW. Selective destruction of interleukin 23-induced expansion of a major antigen-specificγδ T-cell subset in patients with tuberculosis[J]. J Infect Dis, 2017, 215(3): 420-430.
[URI]
|
| [6] |
王杰, 刘春法, 崔永勇, 赵德明, 周向梅. 结核分枝杆菌感染相关microRNA的研究进展[J]. 畜牧与兽医, 2016, 48(10): 130-133. [URI]
|
| [7] |
Amaral EP, Lasunskaia EB, D'Império-Lima MR. Innate immunity in tuberculosis:how the sensing of mycobacteria and tissue damage modulates macrophage death[J]. Microbes Infect, 2015, 18(1): 11-20.
[URI]
|
| [8] |
熊坤龙, 程训佳, 张文宏, 王菲菲. 中性粒细胞在抗结核免疫中的作用[J]. 微生物与感染, 2018, 13(3): 186-192. [URI]
|
| [9] |
王静娴, 杨春. 结核分枝杆菌与巨噬细胞相互作用的研究进展[J]. 微生物与感染, 2010, 05(3): 181-185. [URI]
|
| [10] |
Bermudez LE, Goodman J. Mycobacterium tuberculosis invades and replicates within type II alveolar cells[J]. Infect Immun, 1996, 64(4): 1400-1406.
[URI]
|
| [11] |
Ward J, Kanchagar C, Veksler-Lublinsky I, Lee RC, McGill MR, Jaeschke H, Curry SC, Ambros VR. Circulating microRNA profiles in human patients with acetaminophen hepatotoxicity or ischemic hepatitis[J]. Proc Natl Acad Sci USA, 2014, 111(33): 12169-12174.
[URI]
|
| [12] |
Banerjee S, Cui H, Xie N, Tan Z, Yang S, Icyuz M, Thannickal VJ, Abraham E, Liu G. miR-125a-5p regulates differential activation of macrophages and inflammation[J]. J Biol Chem, 2013, 288(49): 35428-35436.
[URI]
|
| [13] |
Yang T, Ge B. miRNAs in immune responses to Mycobacterium tuberculosis infection[J]. Cancer Lett, 2018, 431: 22-30.
[URI]
|
| [14] |
Liu PT, Wheelwright M, Teles R, Komisopoulou E, Edfeldt K, Ferguson B, Mehta MD, Vazirnia A, Rea TH, Sarno EN, Graeber TG, Modlin RL. MicroRNA-21 targets the vitamin D-dependent antimicrobial pathway in leprosy[J]. Nat Med, 2012, 18(2): 267-273.
[URI]
|
| [15] |
Etna MP, Sinigaglia A, Grassi A, Giacomini E, Romagnoli A, Pardini M, Severa M, Cruciani M, Rizzo F, Anastasiadou E, Di Camillo B, Barzon L, Fimia GM, Manganelli R, Coccia EM. Mycobacterium tuberculosis-induced miR-155 subverts autophagy by targeting ATG3 in human dendritic cells[J]. PLoS Pathog, 2018, 14(1): e1006790.
[DOI]
|
| [16] |
Yuan Y, Lin D, Feng L, Huang M, Yan H, Li Y, Chen Y, Lin B, Ma Y, Ye Z, Mei Y, Yu X, Zhou K, Zhang Q, Chen T, Zeng J. Upregulation of miR-196b-5p attenuates BCG uptake via targeting SOCS3 and activating STAT3 in macrophages from patients with long-term cigarette smoking-related active pulmonary tuberculosis[J]. J Transl Med, 2018, 16(1): 284.
[URI]
|
 2020, Vol. 15
2020, Vol. 15


