2. 上海市(复旦大学附属)公共卫生临床中心, 上海 201508
2. Shanghai Public Health Clinical Center, Fudan University, Shanghai 201508, China
获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS)目前仍然是全球最重要的医疗健康问题之一,其病原体为人类免疫缺陷病毒(human immunodeficiency virus,HIV)。目前,该病毒仍在全世界范围内蔓延[1]。自1983年发现HIV以来,人类从未停止对HIV-1的科学研究。1996年美籍华裔科学家何大一等人提出的高效抗反转录病毒药物联合疗法(highly active antiretroviral therapy, HARRT)在预防和治疗HIV-1感染方面卓有成效,大大提高了AIDS患者的存活率。但是,由于该疗法不能清除病毒,患者需终身服药,药物副作用大,患者依从性差,导致病毒产生逃逸变异和(或)耐药[2]。病毒长期感染机体后诱导产生的中和抗体在抗病毒感染免疫中发挥重要的保护作用,过去十多年来研究者从HIV-1长期感染者体内分离到多个能中和大多数HIV-1流行毒株的广谱中和抗体(broadly neutralizing antibody, bNAb)。这些抗HIV-1的bNAb在动物实验和人体临床研究中被证明具有预防和治疗AIDS病毒感染的效果[3-5]。此外,靶向宿主细胞的受体或辅助受体的抗体也能高效中和HIV-1不同流行株[6-7]。
最近研究表明,bNAb的单一疗法虽然能够抑制病毒感染,但最终都会出现相关的病毒逃逸突变[8-9]。bNAb的联合使用在体内显示出更好的保护效果[8-11],但是这种治疗方式需要2种或2种以上的抗体,大大增加了治疗费用。基于基因工程方法构建的双特异性或多特异性抗体能够同时靶向2个或多个不同的抗原表位,可以克服这种疗法的不足,且在体内、外都显示出较强的中和活性[12-14]。以cross-MAb和knobs-into-holes技术构建的双特异性抗体10E8V2.0-iMab在HIV-1感染的人源化小鼠模型中显示出非常强的抗HIV-1中和活性,但是这类双特异性抗体通常需要多个不同表达质粒的共同优化转染,表达之后的纯化步骤也比较复杂,在后期的临床开发将面临很大的挑战[14]。本研究通过基因工程方法构建了一种新的单基因编码、由2个抗体的单链可变区(single chain fragment variable, scFv)与抗体的可结晶片段(fragment crystallizable, Fc)串联组成的双特异性抗体iMab-PGT151,这2个抗体的scFv分别靶向CD4蛋白和HIV-1包膜糖蛋白的gp120-gp41交界面。所构建的双特异性抗体iMab-PGT151不仅能特异性结合相应的2个靶点,还表现出较强的中和活性和广谱性,并且没有自体反应性。该抗体也许能成为预防和治疗HIV-1感染的候选药物之一,期望为AIDS的预防、治疗提供新的途径。
1 材料和方法 1.1 材料 1.1.1 质粒表达HIV-1 Env的质粒、pNL4-3质粒、抗体表达质粒和双特异性抗体表达载体质粒均由本实验室保存,双特异性抗体的质粒iMab-PGT151由南京金斯瑞生物科技有限公司合成。
1.1.2 细胞和毒株293F悬浮细胞购自北京义翘神州生物技术有限公司,293T细胞购自北京康为世纪生物科技有限公司,U87细胞和HEp-2细胞、20株HIV-1假病毒均由本实验室保存。
1.1.3 试剂Primestar DNA聚合酶购自Takara公司,限制性核酸内切酶和一步法快速克隆试剂盒购自NEB公司,转染试剂EZ-Trans购自上海李记生物科技有限公司,OPM无血清培养基购自上海奥浦迈生物科技公司,Protein G-琼脂糖购自常州天地人和生物科技有限公司,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)预制胶购自南京金斯瑞生物科技有限公司,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐﹝2, 2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS﹞显色液、蛋白相对分子质量(Mr)标准品(marker)和羊抗人IgG(H+L)抗体购自Thermo公司,脱脂奶粉购自生工生物工程(上海)股份有限公司,牛血清白蛋白(bovine serum albumin, BSA)购自大连美仑生物技术有限公司,辣根过氧化物酶(horseradish peroxidase,HRP)偶联的羊抗人IgG二抗购自美国Jackson公司,Luciferace荧光素酶试剂盒购自Promega公司,心磷脂(cardiolipin)和4′, 6-二脒基-2-苯基吲哚(4′, 6-diamidino-2-phenylindole, DAPI)染料购自Sigma公司,人可溶性CD4蛋白(sCD4)和BG505 SOSIP.664 HIV三聚体膜蛋白、抗体iMab、PGT151、4E10、VRC01、35O22、10E8和N6均由本实验室制备。双特异性抗体无缝克隆到CMVR载体引物由上海擎科生物科技有限公司合成,具体引物序列见表 1。
| Primers | Sequence (5′-3′) |
| CMVR-iMab-F | CATCCTTTTTCTAGTAGCAACTGCAACCGGTGTACATTCTGACATCGTGATGACC |
| CMVR-PGT151-R | GAGTTTTGTCACAAGATTTGGGCTCGGATCCGCTCGAGACGGTGAC |
主要仪器包括PCR仪(Thermo公司)、SDS-PAGE电泳仪(Biorad公司)、多功能酶标仪(美国Perkin Elmer公司)和Leica SP8 X激光共聚焦显微镜(德国Leica公司)。
1.2 方法 1.2.1 双特异性抗体的设计与质粒构建编码双特异性抗体iMab-PGT151的scFv基因根据已公开的抗体序列(https://www.ncbi.nlm.nih.gov/protein/)经密码子优化后由南京金斯瑞生物科技有限公司合成, 其中每个scFv轻、重链之间由3个G4S(GGGGS)重复序列的柔性linker连接,2个抗体的scFv之间由4个G4S重复序列的柔性linker连接。通过PCR技术(94 ℃ 3 min;98 ℃ 10 s,60 ℃ 1 min,72 ℃ 2 min,35个循环;72 ℃ 5 min)和无缝克隆技术将双特异性抗体iMab-PGT151的scFv基因装入含人源抗体Fc片段的抗体表达载体中,进一步通过双酶切和测序对重组质粒进行验证,图 1A和1B为结构域排列顺序和结构示意图。
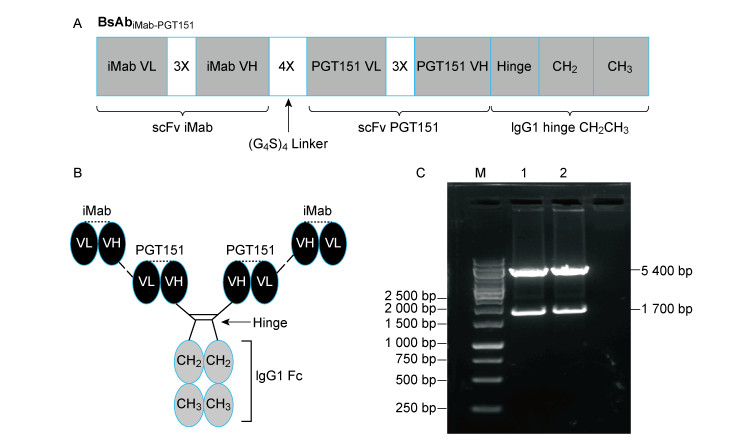
|
| A: Schematic diagram of bispecific antibody iMab-PGT151 domain sequence. 3X, (G4S)3 linker (GGGGSGGGGSGGGGS); 4X, (G4S)4 linker (GGGGSGGGGSGGGGSGGGGS). B: Schematic diagram of bispecific antibody iMab-PGT151 structure. scFv: single-chain variable fragment; VH: variable heavy chain; VL: variable light chain; CH: constant heavy chain. C: Double digestion identification. M: 10000 bp marker; 1 and 2: iMab-PGT151 expression plasmid after double digestion. 图 1 双特异性抗体iMab-PGT151的结构示意图和双酶切验证电泳图 Fig. 1 The Schematic diagram of bispecific antibody iMab-PGT151 and double digestion identification |
将上述构建成功的双特异性抗体表达质粒或各单克隆抗体配对重、轻链表达的质粒,分别用EZ-Trans试剂转染293F悬浮细胞,转染5 d后收集培养上清液,2 500 g离心10 min,用0.22 μm的滤膜过滤培养上清液,然后经Protein G-琼脂糖进行抗体亲和纯化。通过SDS-PAGE检测抗体的纯度和Mr,将纯化的抗体经超滤浓缩和分装后进行液氮速冻,-80 ℃保存备用。
1.2.3 酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)检测双特异性抗体的结合特异性首先在96孔板中每孔加入100 μL的sCD4蛋白(2 μg/mL)或BG505蛋白(2 μg/mL),4 ℃包被过夜。用含有0.05% Tween的磷酸盐缓冲溶液(phosphate buffer saline, PBS)(即PBS-T)洗涤3次,加入含5%脱脂奶粉的PBS置室温封闭1 h。封闭结束后,用0.05% PBS-T洗涤5次,加入梯度稀释的抗体,37 ℃孵育1 h。用0.05% PBS-T洗涤5次,加入1:2 500稀释的HRP偶联的羊抗人IgG二抗置室温孵育1 h;再用0.05% PBS-T洗涤3次,每孔加入100 μL ABTS显色15 min;多功能酶标仪检测405 nm的OD值,并采用GraphPad Prism 8软件进行统计和分析。
1.2.4 HIV-1假病毒的中和实验HIV-1假病毒由pNL4-3骨架质粒和表达HIV-1 Env的质粒共转染293T细胞而制备,转染72 h后,2 500 g离心10 min,收集含有假病毒的上清液,分装后冻于-80 ℃冰箱中。使用U87细胞检测双特异性抗体对HIV-1假病毒的中和作用。首先将梯度稀释的抗体与假病毒在培养箱中孵育30 min,使抗体与假病毒充分接触,孵育结束后每孔加入10 000个U87细胞。于37 ℃ 5% CO2细胞培养箱中培养2 d,加入裂解液裂解细胞,通过测量细胞裂解液中的荧光素酶活性对抗体的中和效果进行定量分析。最后用GraphPad Prism 8软件计算IC50。IC50指病毒感染减少50%时的抗体浓度。
1.2.5 间接免疫荧光染色法检测双特异性抗体iMab-PGT151的自体反应性使用间接免疫荧光染色法检测抗体对HEp-2的反应性。具体步骤为:实验前1 d在每个激光共聚焦小皿中加入5×105个HEp-2细胞,第2天,用4%的多聚甲醛溶液固定细胞后进一步通过0.1% TritonX-100溶液破膜,PBS洗涤后加入含5%脱脂奶粉的PBS置室温封闭1 h。0.05% PBS-T洗涤3次后,加入经PBS稀释后浓度为50 μg/mL的双特异性抗体,37 ℃反应1 h;4E10抗体作为阳性对照,VRC01抗体作为阴性对照。用0.05% PBS-T洗涤3次后加入1:400稀释的Alexa Fluor 647偶联的羊抗人IgG(H+L)抗体,37 ℃孵育1 h,0.05% PBS-T洗涤3次,加入DAPI孵育15 min。PBS洗涤后将细胞置于激光共聚焦显微镜下观察结果。
1.2.6 ELISA检测心磷脂结合能力首先在96孔板中每孔加入100 μL的心磷脂(20 μg/mL),4 ℃包被过夜。0.05% PBS-T洗涤3次,加入含3% BSA的PBS置室温封闭2 h。0.05% PBS-T洗涤5次,然后加入3倍梯度稀释的抗体,37 ℃孵育2 h。0.05% PBS-T洗涤5次,加入1:2 500稀释的HRP偶联的羊抗人IgG二抗,室温孵育1 h。0.05% PBS-T洗涤后每孔加入100 μL ABTS显色15 min,多功能酶标仪检测405 nm的OD值,并采用GraphPad Prism 8软件进行统计和分析。
2 结果 2.1 双特异性抗体iMab-PGT151质粒构建成功双特异性抗体iMab-PGT151的编码基因由2个亲本抗体iMab和PGT151的scFv基因与编码人IgG1抗体的Fc片段基因串联而成,每个scFv轻、重链之间由3个G4S重复序列的柔性linker连接,2个抗体的scFv之间由4个G4S重复序列的柔性linker连接,具体的结构域排列顺序与结构如图 1A和1B所示。经双酶切对重组质粒进行验证,发现双酶切后片段大小为1 700 bp,符合预期Mr大小(图 1C),测序正确。
2.2 双特异性抗体iMab-PGT151能够表达纯化双特异性抗体iMab-PGT151表达质粒构建成功后,转染293F细胞进行瞬时表达。为了确定双特异性抗体是否成功表达,对纯化后的双特异性抗体进行SDS-PAGE变性凝胶电泳分析,用考马斯亮蓝对凝胶染色。结果显示,iMab-PGT151抗体Mr在90 000左右,符合预期Mr大小且条带单一;对照抗体VRC01、iMab、PGT151和N6的重链在50 000左右,轻链在25 000左右(图 2)。以上结果表明,构建的双特异抗体iMab-PGT151能够成功表达,并且纯度较高。

|
| From the left to the right, the sample are marker, monoclonal antibodies iMab, PGT151, VRC01, N6 and bispecific antibody iMab-PGT151. 图 2 bNAb和双特异性抗体的表达与纯化 Fig. 2 Expression and purification of broad neutralizing antibodies iMab, PGT151, VRC01, N6 and bispecific antibody iMab-PGT151 |
在双特异性抗体iMab-PGT151中,亲本抗体iMab的结合表位为人的CD4蛋白,抗体PGT151的结合表位位于HIV-1三聚体包膜蛋白gp120与gp41的交界面。为了确定双特异性抗体iMab-PGT151与相应配体的结合特性,使用ELISA分别检测其结合人sCD4蛋白和HIV-1包膜三聚体糖蛋白BG505 SOSIP.664的能力。结果如图 3A所示,双特异性抗体iMab-PGT151与sCD4蛋白有较强的结合能力,接近同亲本抗体iMab结合sCD4的活性。此外,双特异性抗体iMab-PGT151也能够结合HIV-1包膜三聚体糖蛋白BG505,但结合能力一般,结果如图 3B所示。以上结果表明,双特异性抗体iMab-PGT151能够分别结合亲本抗体的各个配体,具有双特异性。
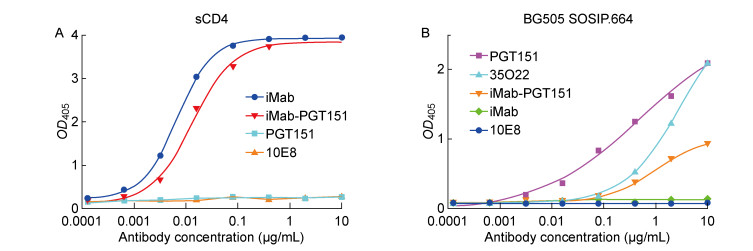
|
| A: ELISA binding of iMab-PGT151, iMab, PGT151 or 10E8 to human sCD4 protein. B: ELISA binding of iMab-PGT151, 35O22, PGT151, iMab or 10E8 to BG505 SOSIP.664 protein. 图 3 双特异性抗体iMab-PGT151的结合特异性 Fig. 3 Binding specificities of bispecific antibody iMab-PGT151 to its ligands |
为了确定双特异性抗体iMab-PGT151中和HIV-1假病毒的能力,检测了双特异性抗体iMab-PGT151对20株HIV-1假病毒的中和能力, 其中包括15个对VRC01抗体具有抗性的病毒株和7个对亲本抗体iMab或PGT151具有抗性的病毒株CNE56、242-14、7165.18、6322.V4.C1、6471.V1.C16、57128.vrc15和x2088.c9。结果显示,双特异性抗体iMab-PGT151能够100%中和20株假病毒,IC50值为0.084 μg/mL,而亲本抗体PGT151和iMab的IC50值分别为0.017 μg/mL和0.169 μg/mL,中和假病毒的比例分别为70%和90%。亲本抗体iMab和PGT151都不能中和的假病毒6471.V1.C16,双特异性抗体iMab-PGT151对其却能够很好地中和,如图 4A和4B所示。以上结果表明,构建的双特异性抗体iMab-PGT151能够高效中和被检的20株假病毒,显示出较强的中和活性和广谱度。
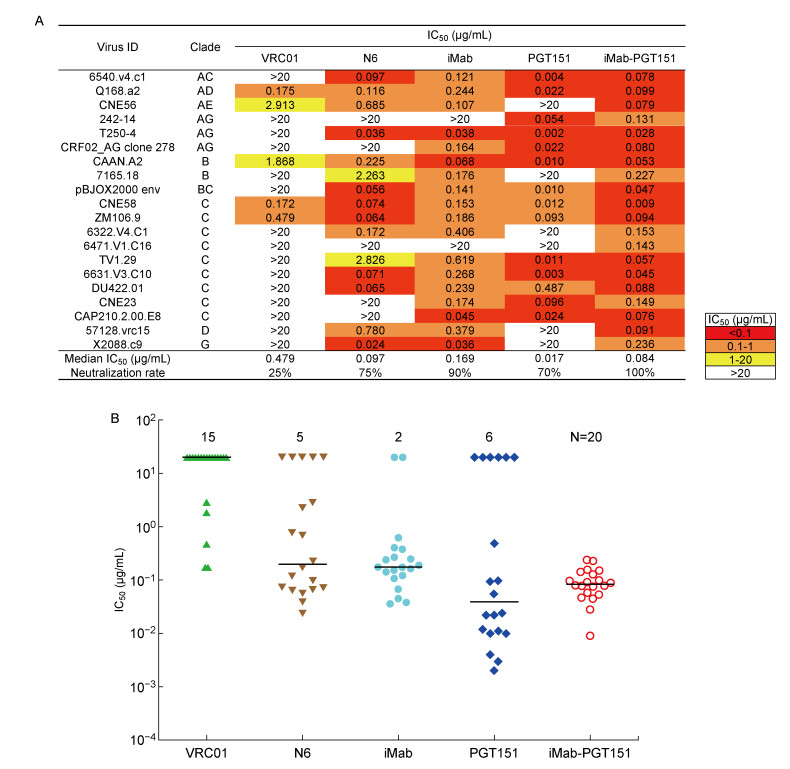
|
| A: Neutralization profile of iMab-PGT151, in comparison to the other monoclonal antibody, against 20 pseudoviruses. Values <0.1 μg/mL are highlighted in red, values between 0.1 and 1 μg/mL are highlighted in orange, values between 1 and 20 μg/mL are highlighted in yellow, and values >20 μg/mL are highlighted in white. B: Neutralization scatterplot of iMab-PGT151, in comparison to monoclonal antibodies iMab, PGT151, N6 and VRC01, against 20 pseudoviruses. 图 4 双特异性抗体iMab-PGT151的中和效力和广度 Fig. 4 Extraordinary neutralization potency and breadth of bispecific antibody iMab-PGT151 |
为了检测双特异性抗体iMab-PGT151的自体反应性,用间接免疫荧光染色法检测双特异性抗体iMab-PGT151对HEp-2的反应性。结果如图 5A所示,与阳性对照抗体4E10和阴性对照抗体VRC01相比,构建的双特异性抗体iMab-PGT151不与HEp-2细胞反应;同样的,亲本抗体iMab和PGT151也不与HEp-2细胞反应。

|
| A: Reactivity of iMab-PGT151, iMab and PGT151 with HEp-2 epithelial cells. VRC01 was used as a negative control and 4E10 was used as a positive control. All pictures were shown at 40x magnification. B: ELISA analysis of iMab-PGT151, iMab, PGT151 binding to cardiolipin. 图 5 双特异性抗体iMab-PGT151无自体反应性 Fig. 5 Bispecific antibody iMab-PGT151 is not autoreactive |
为了进一步检测双特异性抗体iMab-PGT151的自体反应性,使用ELISA检测了双特异性抗体iMab-PGT151对心磷脂的结合能力。结果如图 5B所示,与阳性对照抗体4E10和阴性对照抗体VRC01相比,构建的双特异性抗体iMab-PGT151及亲本抗体iMab和PGT151均不与心磷脂结合。以上结果表明,双特异性抗体iMab-PGT151既不与HEp-2细胞结合,也不与心磷脂结合,不具有自体反应性。
3 讨论以往的研究表明,在长期感染HIV-1的患者中,有20%~30%的患者体内可检测出能中和不同HIV-1毒株的bNAb[15]。过去10多年来,研究者从HIV-1长期感染者体内分离到多个能中和大多数HIV-1流行毒株的bNAb,这些bNAb主要识别HIV-1包膜蛋白的6个表位区:位于gp120上的CD4结合位点(CD4 binding site, CD4bs)、糖基化的V1V2区(V1V2-glycan)、糖基化的V3区(V3-glycan)、沉默区(silent face)、gp120与gp41交界面(gp120-gp41 interface)和gp41的近膜端外部区域(membrane proximal external region, MPER)[16-18]。此外,靶向宿主细胞的受体或辅助受体的抗体也能高效中和HIV-1的不同流行株。比如,针对CD4胞外结构域2的ibalizumab(iMab)抗体或针对趋化因子受体5(chemokine receptor 5,CCR5)的PRO140抗体都能很好地阻止HIV-1感染[6-7]。有研究者通过cross-MAb和knobs-into-holes技术构建的双特异性抗体10E8V2.0-iMab在HIV-1感染的人源化小鼠模型中显示出非常强的抗HIV-1中和活性。但是这类双特异性抗体通常需要多个不同表达质粒的共同优化转染才能产生双特异性抗体,表达之后的纯化步骤也比较复杂,需要去除非正确配对的副产物。后期的大规模扩大表达纯化流程中也需要构建稳定表达的细胞系和优化纯化步骤,这使得今后在临床应用开发上将面临极大的挑战[14]。
本研究选择了一种新型单基因编码的串联双特异性抗体iMab-PGT151,该双特异性抗体包括靶向CD4的iMab抗体和靶向HIV-1包膜gp120与gp41交界面的PGT151抗体[19-21]。由于双特异性抗体iMab-PGT151由单一基因编码,保证了产物的均一性,更加有利于将来的临床生产和质控。ELISA表明,双特异性抗体iMab-PGT151具有双特异性,其各个scFv片段均能够发挥功能,结合各自相应的靶点。
本研究检测的HIV-1假病毒数量虽然只有20株,但可看出双特异性抗体iMab-PGT151的中和广谱度较亲本抗体有明显提高,其能100%中和20株被检的HIV-1假病毒,且可很好地中和亲本抗体iMab和PGT151的抗性毒株6471.V1.C16。这可能是由于2种抗体的串联改变了各亲本抗体的结构,促进了其与配体的结合。此外,与目前中和活性最强的N6相比, 双特异性抗体iMab-PGT151也能够100%中和15株VRC01抗性假病毒,IC50值达0.084 μg/mL,而抗体N6只能中和75%的VRC01抗性假病毒。因此,双特异性抗体iMab-PGT151具有广阔的临床应用开发前景。
本研究通过间接免疫荧光染色法和ELISA[22]证明构建的双特异性抗体iMab-PGT151既不与HEp-2反应,也不与心磷脂结合,抗体没有自体反应性,对后期临床研究以及通过疫苗引发相似抗体的研究均有重要帮助。
综上所述,本研究成功构建的双特异性抗体iMab-PGT151,有着更强的中和活性和广谱度,并且无自体反应性,有望成为预防和治疗HIV-1的候选药物之一。
| [1] |
Teeraananchai S, Kerr SJ, Amin J, Ruxrungtham K, Law MG. Life expectancy of HIV-positive people after starting combination antiretroviral therapy: a meta-analysis[J]. HIV Med, 2017, 18(4): 256-266.
[DOI]
|
| [2] |
Hammer SM, Squires KE, Hughes MD, Grimes JM, Demeter LM, Currier JS, Eron JJ Jr, Feinberg JE, Balfour HH Jr, Deyton LR, Chodakewitz JA, Fischl MA. A controlled trial of two nucleoside analogues plus indinavir in persons with human immunodeficiency virus infection and CD4 cell counts of 200 per cubic millimeter or less[J]. N Engl J Med, 1997, 337(11): 725-733.
[DOI]
|
| [3] |
Horwitz JA, Halper-Stromberg A, Mouquet H, Gitlin AD, Tretiakova A, Eisenreich TR, Malbec M, Gravemann S, Billerbeck E, Dorner M, Büning H, Schwartz O, Knops E, Kaiser R, Seaman MS, Wilson JM, Rice CM, Ploss A, Bjorkman PJ, Klein F, Nussenzweig MC. HIV-1 suppression and durable control by combining single broadly neutralizing antibodies and antiretroviral drugs in humanized mice[J]. Proc Natl Acad Sci USA, 2013, 110(41): 16538-16543.
[DOI]
|
| [4] |
Ananworanich J, McSteen B, Robb ML. Broadly neutralizing antibody and the HIV reservoir in acute HIV infection: a strategy toward HIV remission?[J]. Curr Opin HIV AIDS, 2015, 10(3): 198-206.
[DOI]
|
| [5] |
Barouch DH, Deeks SG. Immunologic strategies for HIV-1 remission and eradication[J]. Science, 2014, 345(6193): 169-174.
[DOI]
|
| [6] |
Freeman MM, Seaman MS, Rits-Volloch S, Hong X, Kao CY, Ho DD, Chen B. Crystal structure of HIV-1 primary receptor CD4 in complex with a potent antiviral antibody[J]. Structure, 2010, 18(12): 1632-1641.
[DOI]
|
| [7] |
Trkola A, Ketas TJ, Nagashima KA, Zhao L, Cilliers T, Morris L, Moore JP, Maddon PJ, Olson WC. Potent, broad-spectrum inhibition of human immunodeficiency virus type 1 by the CCR5 monoclonal antibody PRO 140[J]. J Virol, 2001, 75(2): 579-588.
[DOI]
|
| [8] |
Shingai M, Nishimura Y, Klein F, Mouquet H, Donau OK, Plishka R, Buckler-White A, Seaman M, Piatak M Jr, Lifson JD, Dimitrov DS, Nussenzweig MC, Martin MA. Antibody-mediated immunotherapy of macaques chronically infected with SHIV suppresses viraemia[J]. Nature, 2013, 503(7475): 277-280.
[DOI]
|
| [9] |
Bar KJ, Sneller MC, Harrison LJ, Justement JS, Overton ET, Petrone ME, Salantes DB, Seamon CA, Scheinfeld B, Kwan RW, Learn GH, Proschan MA, Kreider EF, Blazkova J, Bardsley M, Refsland EW, Messer M, Clarridge KE, Tustin NB, Madden PJ, Oden K, O'Dell SJ, Jarocki B, Shiakolas AR, Tressler RL, Doria-Rose NA, Bailer RT, Ledgerwood JE, Capparelli EV, Lynch RM, Graham BS, Moir S, Koup RA, Mascola JR, Hoxie JA, Fauci AS, Tebas P, Chun TW. Effect of HIV antibody VRC01 on viral rebound after treatment interruption[J]. N Engl J Med, 2016, 375(21): 2037-2050.
[DOI]
|
| [10] |
Scheid JF, Horwitz JA, Bar-On Y, Kreider EF, Lu CL, Lorenzi JC, Feldmann A, Braunschweig M, Nogueira L, Oliveira T, Shimeliovich I, Patel R, Burke L, Cohen YZ, Hadrigan S, Settler A, Witmer-Pack M, West AP Jr, Juelg B, Keler T, Hawthorne T, Zingman B, Gulick RM, Pfeifer N, Learn GH, Seaman MS, Bjorkman PJ, Klein F, Schlesinger SJ, Walker BD, Hahn BH, Nussenzweig MC, Caskey M. HIV-1 antibody 3BNC117 suppresses viral rebound in humans during treatment interruption[J]. Nature, 2016, 535(7613): 556-560.
[DOI]
|
| [11] |
Kong R, Louder MK, Wagh K, Bailer RT, deCamp A, Greene K, Gao H, Taft JD, Gazumyan A, Liu C, Nussenzweig MC, Korber B, Montefiori DC, Mascola JR. Improving neutralization potency and breadth by combining broadly reactive HIV-1 antibodies targeting major neutralization epitopes[J]. J Virol, 2015, 89(5): 2659-2671.
[DOI]
|
| [12] |
Fabozzi G, Pegu A, Koup RA, Petrovas C. Bispecific antibodies: Potential immunotherapies for HIV treatment[J]. Methods, 2019, 154: 118-124.
[DOI]
|
| [13] |
Wu X, Guo J, Niu M, An M, Liu L, Wang H, Jin X, Zhang Q, Lam KS, Wu T, Wang H, Wang Q, Du Y, Li J, Cheng L, Tang HY, Shang H, Zhang L, Zhou P, Chen Z. Tandem bispecific neutralizing antibody eliminates HIV-1 infection in humanized mice[J]. J Clin Invest, 2018, 128(6): 2239-2251.
[DOI]
|
| [14] |
Huang YX, Yu J, Lanzi A, Yao X, Andrews CD, Tsai L, Gajjar MR, Sun M, Seaman MS, Padte NN, Ho DD. Engineered bispecific antibodies with exquisite HIV-1-neutralizing activity[J]. Cell, 2016, 165(7): 1621-1631.
[DOI]
|
| [15] |
Doria-Rose NA, Klein RM, Daniels MG, O'Dell S, Nason M, Lapedes A, Bhattacharya T, Migueles SA, Wyatt RT, Korber BT, Mascola JR, Connors M. Breadth of human immunodeficiency virus-specific neutralizing activity in sera: clustering analysis and association with clinical variables[J]. J Virol, 2010, 84(3): 1631-1636.
[DOI]
|
| [16] |
Kwong PD, Mascola JR. HIV-1 vaccines based on antibody identification, B cell ontogeny, and epitope structure[J]. Immunity, 2018, 48(5): 855-871.
[DOI]
|
| [17] |
Landais E, Moore PL. Development of broadly neutralizing antibodies in HIV-1 infected elite neutralizers[J]. Retrovirology, 2018, 15(1): 61.
[DOI]
|
| [18] |
Sok D, Burton DR. Recent progress in broadly neutralizing antibodies to HIV[J]. Nat Immunol, 2018, 19(11): 1179-1188.
[DOI]
|
| [19] |
Burkly LC, Olson D, Shapiro R, Winkler G, Rosa JJ, Thomas DW, Williams C, Chisholm P. Inhibition of HIV infection by a novel CD4 domain 2-specific monoclonal antibody. Dissecting the basis for its inhibitory effect on HIV-induced cell fusion[J]. J Immunol, 1992, 149(5): 1779-1787.
[PubMed]
|
| [20] |
Blattner C, Lee JH, Sliepen K, Derking R, Falkowska E, de la Pea AT, Cupo A, Julien JP, van Gils M, Lee PS, Peng W, Paulson JC, Poignard P, Burton DR, Moore JP, Sanders RW, Wilson IA, Ward AB. Structural delineation of a quaternary, cleavage-dependent epitope at the gp41-gp120 interface on intact HIV-1 Env trimers[J]. Immunity, 2014, 40(5): 669-680.
[DOI]
|
| [21] |
Song R, Franco D, Kao CY, Yu F, Huang Y, Ho DD. Epitope mapping of ibalizumab, a humanized anti-CD4 monoclonal antibody with anti-HIV-1 activity in infected patients[J]. J Virol, 2010, 84(14): 6935-6942.
[DOI]
|
| [22] |
Haynes BF, Fleming J, St Clair EW, Katinger H, Stiegler G, Kunert R, Robinson J, Scearce RM, Plonk K, Staats HF, Ortel TL, Liao HX, Alam SM. Cardiolipin polyspecific autoreactivity in two broadly neutralizing HIV-1 antibodies[J]. Science, 2005, 308(5730): 1906-1908.
[DOI]
|
 2020, Vol. 15
2020, Vol. 15


