支气管哮喘是一种慢性气道炎性疾病,特征表现为嗜酸性粒细胞大量浸润,T辅助细胞2型(T helper 2, Th2)细胞因子高表达,气道高反应性(airway hyper reactivity,AHR)和可逆性气道阻塞。病毒感染是支气管哮喘急性加重的重要诱发因素,其中呼吸道合胞病毒(respiratory syncytial virus,RSV)是常见的气道感染病毒,RSV感染与哮喘发生关系密切。已有许多研究证实RSV感染是引起婴幼儿毛细支气管炎及肺炎的主要原因,婴幼儿时期因RSV毛细支气管炎而住院的儿童,其随后发生反复喘息和哮喘的概率显著增加[1]。
白细胞介素-33(interleukin,IL-33)在2005年被分离认定,属于IL-1家族新成员[2]。IL-33通过表达于T细胞、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞和固有淋巴细胞的肿瘤发生抑制蛋白2(suppression of tumorigenicity 2, ST2)受体增强Th2细胞反应[3-5]。近年来许多有关IL-33在过敏性哮喘病人和小鼠模型中作用的研究发现,给予过敏性鼻炎小鼠模型抗IL-33抗体可起到治疗作用[6];中和IL-33抗体治疗哮喘小鼠动物模型,可减轻小鼠气道嗜酸性粒细胞浸润及黏液分泌[7];哮喘病人感染鼻病毒后,IL-33通过鼻病毒激活ST2+固有淋巴细胞(innate lymphoid cells, ILC)释放IL-13,而健康人感染鼻病毒后,IL-33的分泌可激活自然杀伤细胞(natural killer cell, NK细胞),增加干扰素(interferon,IFN)γ的分泌以发挥抗病毒作用,且不影响健康人IL-5和IL-13的释放[8]。
虽有许多关于IL-33与过敏性哮喘相关性的研究,但IL-33在RSV急性感染导致哮喘急性加重过程中的作用却研究甚少。本课题组在前期研究中成功建立了RSV感染诱发哮喘急性加重的小鼠模型,且发现支气管哮喘及RSV急性感染所致的支气管哮喘急性发作过程中存在明显的IL-33高表达,同时伴随血浆IgE升高,肺组织炎性细胞浸润,肺泡灌洗液中嗜酸性粒细胞表达升高及肺组织中Th2类细胞因子IL-13和IL-5升高[9]。为进一步探究阻断IL-33能否在支气管哮喘急性发作过程中起到治疗作用,本研究选择RSV感染致小鼠哮喘急性发作动物模型,利用抗IL-33抗体观察IL-33对RSV感染所致哮喘急性加重小鼠肺部炎症及细胞因子表达的影响,期望为临床治疗提供参考。
1 材料和方法 1.1 材料 1.1.1 试剂与仪器杜氏磷酸盐缓冲液(Dulbecco’s phosphate buffered saline,DPBS)购自美国Hyclone公司;核酸抽提试剂盒(Qiagen RNeasy Mini Kit)购自德国QIAGEN公司,RT-PCR试剂盒One step PrimeScript RT-PCR Kit购自大连宝生物工程有限公司;小鼠IL-33、IL-4、IL-13、IL-17和IFN-γ细胞因子酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒购自美国Ebioscience公司,卵清蛋白(ovalbumin,OVA)购自美国Sigma公司;铝佐剂50 mL购自美国Thermo scientific公司;Applied Biosystem 7500荧光定量PCR仪购自美国Thermo公司;雾化器购自日本OMRON公司。
1.1.2 病毒和细胞RSV A2株由上海中医药大学喻晓馈赠,来源美国模式培养物集存库(American Type Culture Collection,ATCC);人喉癌上皮细胞(Hep-2)由复旦大学附属上海市公共卫生临床中心保存。使用含10% 胎牛血清(fetal bovine serum, FBS)的Dulbecco改良Eagle培养基(Dulbecco’s modified Eagle medium,DMEM)培养Hep-2细胞,将细胞置于37 ℃、5% CO2的细胞培养箱中,待细胞长满单层后,将RSV接种于Hep-2细胞,换用含4% FBS的DMEM,细胞置于37 ℃、5% CO2细胞培养箱维持扩增,待细胞病变达80%时收获病毒上清液冻存于-80 ℃备用。测得病毒空斑形成单位(plaque forming unit,PFU)为107/mL。
1.1.3 试验动物3周龄无特定病原体动物(specific pathogen free,SPF)级雌性BALB/c小鼠28只,由国家啮齿类实验动物种子中心上海分中心(斯莱克公司)提供。
1.2 方法 1.2.1 实验分组将实验小鼠随机分为5组,每组5~6只。A组:正常对照组(control组);B组:单纯RSV感染组(RSV组);C组:支气管哮喘组(asthma组);D组:RSV感染致支气管哮喘加重并对照抗体组[asthma+RSV+Cab(control anti-body)组];E组:RSV感染致支气管哮喘加重经抗IL-33抗体治疗组(asthma+RSV+anti-IL-33组)。
1.2.2 小鼠模型制备第0天给予A、B组小鼠腹腔注射125 μL PBS,C、D、E组小鼠腹腔注射致敏剂125 μL(含1%OVA及铝佐剂50 μL的PBS),第7~14天每天予以小鼠1%OVA或PBS雾化吸入30 min。第13天给予B、D和E组小鼠100 μL含1×106/mL PFU的RSV悬液滴鼻,给予A和C组小鼠等体积的PBS滴鼻。在第8、10和12天,D和E组小鼠分别腹腔内注射抗IL-33对照抗体IgG和抗IL-33抗体(200 μg/只)[10-11],在第15天处死小鼠并取肺组织使用苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,对小鼠模型进行鉴定。实验步骤如图 1所示。
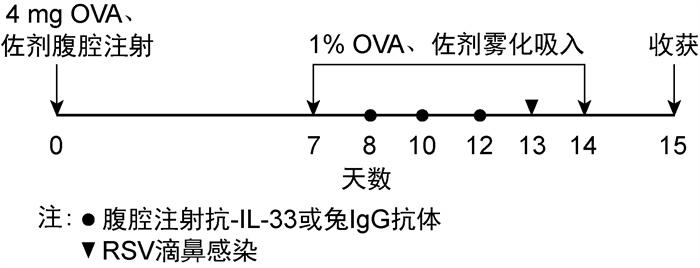
|
| Mice were sensitized and challenged by ovalbumin and alum. Anti-IL-33 antibody and control antibody were given separately on day 8, 10 and 12 by I.P. Infection mouse were treated with 100 μL RSV(1×106/mL PFU) on day 13 by I.N. Mice were sacrificed at day 15. 图 1 实验流程 Fig. 1 Experiment protocol |
取小鼠右下肺组织,10%中性甲醛固定后石蜡包块及切片,进行HE染色,光镜下观察肺组织病理变化。
1.2.4 实时反转录聚合酶链反应检测肺组织细胞因子取小鼠肺组织,根据说明书步骤抽提肺组织总RNA,采用实时反转录聚合酶链反应(real-time reverse transcriptional polymerase chain reaction,real-time RT PCR)检测肺组织中il-13, il-4, 视黄酸受体相关孤儿受体(retinoic acid receptor-related orphan receptor,ror)-γt, 叉头状转录因子3(forkhead box P3,foxp3), ifnγ以及il-33 mRNA表达量,β-actin为管家基因。反应体系共25 μL,包括2×Buffer 12.5 μL、ExTaqHS 0.5 μL、Enzyme Mix0.5 μL,上下游引物(见表 1)各1 μL,H2O 7 μL。在Applied Biosystem扩增仪上进行扩增,反应条件为反转录42 ℃ 30 min,预变性95 ℃ 1 min,变性95 ℃ 15 s,退火延伸52 ℃ 1 min,40个循环,于退火延伸温度时收集荧光信号,扩增结束后运行熔解曲线生成程序。反应结束后得出每个反应管内的荧光信号到达设定的域值时所经历的循环数(cycle threshold, Ct)值,以β-actin为内参,校正单个样本目的基因的Ct值,即ΔCt值(Ct目的基因-Ct管家基因),对照组与实验组目的基因的相对表达值以2-ΔΔCt表示,式中ΔΔCt=实验组(Ct目的基因-Ct管家基因)-对照组(Ct目的基因-Ct管家基因)。
| Name | Sequence (5′-3′) | |
| IL-33 | Forward | TGCCTCCCTGAGTACATACA |
| Reverse | CTGGTCTTGCTCTTGGTCTTT | |
| IL-4 | Forward | TTGAGAGAGATCATCGGCATTT |
| Reverse | CTCACTCTCTGTGGTGTTCTTC | |
| IL-13 | Forward | GCAGCATGGTATGGAGTGT |
| Reverse | TATCCTCTGGGTCCTGTAGATG | |
| Foxp3 | Forward | GAGAAAGCGGATACCAAA |
| Reverse | TGTGAGGACTACCGAGCC | |
| RORγt | Forward | TGCAAGACTCATCGACAAGG |
| Reverse | AGGGGATTCAACATCAGTGC | |
| IFN-γ | Forward | CCATCGGCTGACCTAGAGAA |
| Reverse | GATGCAGTGTGTAGCGTTCA | |
| β-action | Forward | GAGGTATCCTGACCCTGAAGTA |
| Reverse | CACACGCAGCTCATTGTAGA |
每只小鼠收集约1 mL支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),3 000 rpm离心10 min,取上清液100 μL行ELISA检测,检测肺泡灌洗液中IL-33、IL-4、IL-13、IL-17和IFN-γ的表达水平。试验过程参照实际说明书进行,根据系列稀释的标准品浓度,应用酶标仪450 nm波长下测量各反应孔的吸光度(OD值),从而计算各细胞因子的浓度值。
1.2.6 统计学方法采用GraphPad Prism5统计软件处理数据,数据以mean±SEM表示,多组间比较用单因素方差分析(oneway analysis of variance, ANOVA)。P<0.05代表差异有统计学意义。
2 结果 2.1 IL-33抗体治疗RSV感染诱导的哮喘急性加重小鼠肺组织的病理变化肺组织HE染色结果显示,正常小鼠肺部气道周围无炎性细胞浸润;RSV感染组小鼠肺组织气道周围及肺间质炎性细胞浸润,肺泡腔狭窄。支气管哮喘小鼠肺组织内可见明显的气道狭窄、气道上皮损伤及周围炎性细胞浸润;RSV感染诱发的哮喘小鼠肺组织周围细胞浸润更加明显,符合支气管哮喘急性发作特征,提示RSV感染导致哮喘急性加重模型成功建立。阻断IL-33后炎症细胞浸润较急性加重组稍有减轻,如图 2所示。
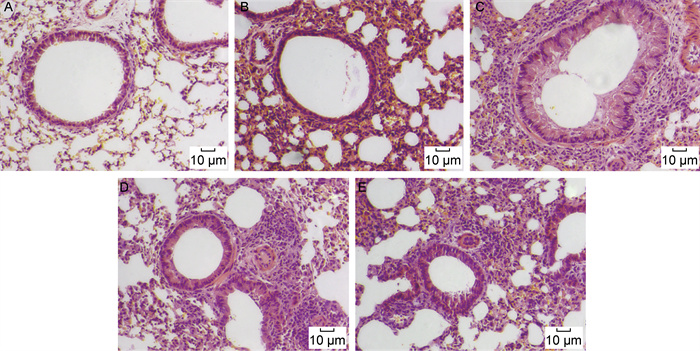
|
| A: Normal control group; B: RSV-infected group; C: Asthma model group(sensitized and challenged by ovalbumin and alum); D: RSV induced aggravation of asthma group(treated with control antibody each other day by i.p.); E: RSV induced aggravation of asthma group (treated with anti-IL-33 antibody each other days by i.p.). 图 2 各组小鼠肺组织HE病理染色结果 Fig. 2 The pathologic changes of lung tissues of different groups of mice |
ELISA结果显示,支气管哮喘组小鼠肺泡中炎症因子IL-4、IL-13、IL-17和IL-33的表达较对照组均有显著升高(对应的P值分别为P < 0.01,P < 0.001,P < 0.05,P < 0.001)。与哮喘组比较,IL-33和IL-4在RSV感染导致哮喘加重小鼠中的表达明显升高(P < 0.01,P < 0.01),IL-13和IL-17的表达虽有升高趋势,但无明显统计学意义。IL-4的升高提示RSV感染后Th2型细胞免疫反应进一步加强,符合哮喘急性发作特征。阻断IL-33后,IL-13、IL-4和IL-17的表达量均明显下降(P < 0.01,P < 0.01,P < 0.05),说明阻断IL-33作用后能下调导致哮喘的主要效应因子表达。与空白对照组相比,Th1细胞的主要效应细胞因子IFN-γ在单纯RSV感染组和支气管哮喘组无明显变化。与单纯RSV感染组相比,RSV导致的哮喘急性加重过程中,IFN-γ的表达有所升高(P < 0.05),但阻断IL-33后IFN-γ蛋白的表达无明显变化,具体如图 3所示。
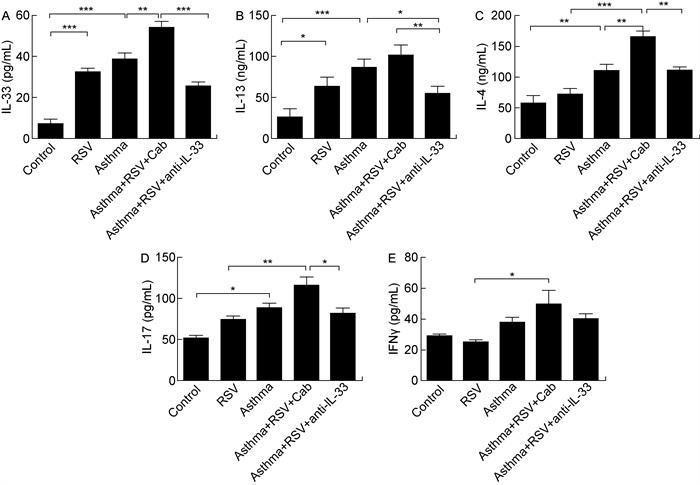
|
| *P < 0.05; * *P < 0.01; * * *P < 0.001. 图 3 ELISA检测BALF中细胞因子IL-33、IL-13、IL-4、IL-17和IFN-γ的表达 Fig. 3 The production of cytokines (IL-33, IL-13, IL-4, IL-17 and IFN-γ) in BALF from different groups of mice detected by ELISA |
与对照组比较,il-33 mRNA的表达在哮喘组小鼠中有明显升高(P < 0.05)。与哮喘组比较,RSV感染所致的哮喘急性加重组il-33的相对表达量进一步升高(P < 0.05),il-4基因转录水平也表现出相同的变化趋势(P < 0.05)。与对照组比较,哮喘组小鼠il-13基因表达明显升高(P < 0.01),RSV感染诱发哮喘急性加重组il-13的表达虽有进一步升高趋势,但无统计学差异。阻断IL-33后,il-13和il-4的表达均明显受到抑制(P < 0.001)。不同于Th2细胞因子的变化,与对照组相比,ifnγ在单独RSV感染组和单纯哮喘组中均无明显升高,但支气管哮喘组小鼠感染RSV后ifnγ的表达较单纯哮喘组小鼠的明显升高(P < 0.05),阻断IL-33后ifnγ的表达无明显变化。单纯RSV感染组小鼠调节性T细胞(regulatory T cells, Treg细胞)的转录调节因子Foxp3的表达较对照组无升高,而哮喘组小鼠foxp3的表达与对照组比较呈明显的下降趋势(P < 0.01),RSV感染后的哮喘小鼠组较RSV感染组小鼠foxp3的表达明显升高(P < 0.05)。阻断IL-33后,foxp3的表达也被抑制(P < 0.05)。与对照组比较,Th17细胞分化调控因子rorγt在RSV感染小鼠组的表达未见升高,而在支气管哮喘小鼠组的表达水平明显升高(P < 0.01),阻断IL-33能明显抑制rorγt的表达(P < 0.01),具体如图 4所示。
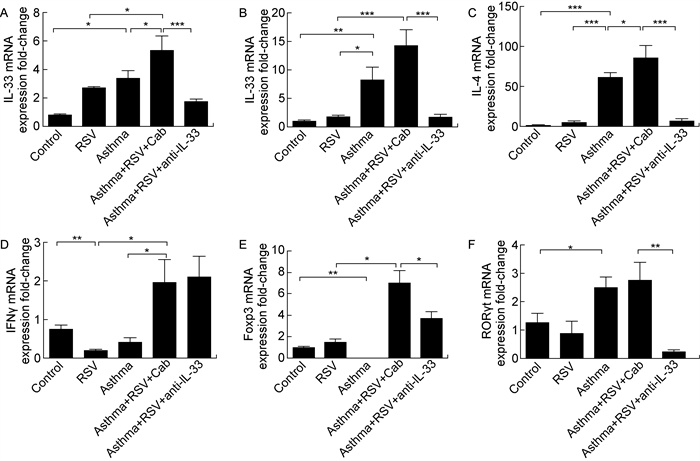
|
| *P < 0.05; * *P < 0.01; * * *P < 0.001. 图 4 Real-time RT PCR方法检测肺组织中il-33, il-13, il-4, ifn-γ, foxp3以及rorγt mRNA的表达 Fig. 4 The relative gene expression of the cytokines il-33, il-13, il-4, ifn-γ, foxp3 and rorγt mRNA in the lung of the mice from different groups detected by real-time RT PCR |
本研究结果表明,支气管哮喘组小鼠中IL-33存在过度分泌,在RSV感染导致支气管哮喘急性加重过程中IL-33的表达进一步升高,同时伴随Th2细胞炎性细胞因子的表达升高。这些细胞因子在支气管哮喘的发病过程中具有重要的作用,如IL-4促进Th2细胞的聚集,上调IgE水平,IL-13能参与气道黏液的分泌,而IL-33的阻断能减轻该类细胞因子的分泌,提示IL-33可通过增强Th2类细胞炎症反应加重肺组织损伤。肺部组织病理结果也提示,RSV诱导支气管哮喘急性加重的小鼠肺组织支气管周围炎性细胞浸润较明显,在给予IL-33抗体治疗后炎性细胞浸润症状减轻,提示阻断IL-33可能通过降低IL-4和IL-13等细胞因子的释放,从而减轻肺组织损伤。
国内外已有多项研究证明IL-33在支气管哮喘的发病过程中发挥着重要作用。Cayrol等[12]发现,IL-33可作为过敏性气道疾病中的“警报素”:在不同致敏原引起的过敏性哮喘中,病原刺激产生的IL-33通过快速水解其核心“传感器”领域激活2型固有淋巴细胞(type 2 innate lymphoid cell, ILC2),从而激活Ⅱ型免疫反应,阻断这种水解作用能减轻过敏性气道炎症。Werder等[10]发现,鼻病毒感染诱导的哮喘急性加重能增强Ⅱ型细胞免疫反应,而给予IL-33抗体治疗后能减轻Ⅱ型细胞免疫反应,并且能减少鼻病毒的复制,增加IFN- λ的分泌,从而发挥抗病毒效应。
亦有许多研究证实,IL-33可通过调节细胞免疫参与过敏性气道炎症反应过程,它与辅助性T细胞之间有着密切联系。Zeng等[13]发现,RSV感染BALB/c小鼠3 d后能引起IL-33及其受体生长刺激表达基因2蛋白(growth stimulation expressed gene 2,ST2)升高,给予抗ST2治疗后能减少肺组织内嗜酸性粒细胞的聚集,降低Th2和Th17细胞相关细胞因子IL-13和IL-17的分泌,但不影响Th1细胞相关细胞因子IFN-γ的分泌。这与本研究结果一致,即RSV感染能引起IL-33细胞因子的表达升高,阻断IL-33/ST2信号通路能降低Th2和Th17细胞反应,而对Th1细胞的效应细胞因子IFN-γ的表达无明显作用。有研究显示,IL-33与Th1细胞的分化有关,在流感病毒感染的体内外实验中发现,IL-33的升高与炎性细胞因子[如肿瘤坏死因子α (tumor necrosis factor α,TNF-α)、IFN-γ、IL-1β和IL-6]的表达升高明显相关[14]。Komai-Koma等[15]发现,IL-33并不能单独促进Th1细胞的分化,而是通过IL-12的作用介导人和小鼠T细胞受体(T-cell receptor,TCR)刺激的CD4+ T细胞中Th1细胞分化和IFN-γ的分泌。而本研究结果提示,单纯RSV感染组和支气管哮喘组小鼠的IFN-γ在mRNA和蛋白水平均无明显变化,但当RSV诱导支气管哮喘急性加重时IFN-γ表达明显升高,提示IL-33的增加可以协同产生IFN-γ,然而阻断IL-33并不能完全影响IFN-γ的表达。
IL-33与Treg和Th17细胞的功能密切相关。Schiering等[16]发现,结肠组织中Treg细胞持续表达IL-33受体ST2,IL-33可通过多种途径加强Treg细胞在炎症反应过程中的作用和功能。首先,IL-33能增强转化生长因子β1(transforming growth factor beta 1,TGF-β1)介导的Treg细胞分化;其次,在炎症组织中它为Treg细胞聚集和维持提供了必不可少的信号。Alvarez等[17]发现,IL-33更倾向于维持Treg细胞的抑制功能:在没有ST2存在的情况下,Treg细胞容易缺失Foxp3的表达,同时获得RORγt和IL-1R1的表达。本研究结果提示,哮喘组小鼠Foxp3的表达较对照组明显下降,而在RSV感染诱导哮喘急性加重的过程中,Treg细胞Foxp3的表达升高,这可能与其参与抑制Th2细胞型炎症反应有关[18],阻断IL-33后Foxp3的表达受到了明显抑制。IL-33也能影响Th17细胞的分化,体外实验中浆细胞可通过IL-33/ST2轴促进Th17细胞分化[19]。IL-33能增强早期CD69标记的T细胞活化,提高Th17细胞转录因子RORγt的表达水平,但IL-33不直接影响CD4+T细胞的分化或增加Th17细胞的极化,其可通过IL-1β和IL-6的作用促进Th17细胞的反应[20]。Vocca等[21]发现,给予健康人外周血单个核细胞(peripheral blood mononuclear cell,PBMC)重组细胞因子IL-33刺激后,可以观察到CD3+T细胞内IL-31和IL-17A细胞因子的表达,提示IL-33可以促进Th2/IL-31和Th17细胞免疫反应。本研究结果显示,Th17细胞的转录因子RORγt在RSV感染导致的哮喘急性发作过程中存在高表达,阻断IL-33后可起到抑制作用。
Liu等[22]的研究结果表明,支气管哮喘小鼠肺组织内Th2型细胞因子IL-4、IL-13和“警报素”IL-33的表达明显升高,当阻断IL-33的作用后3个细胞因子的表达都有所下降,且肺组织炎症细胞浸润也下降。本研究发现RSV感染哮喘小鼠后能诱导哮喘急性加重,相应的肺组织炎性病变更为明显,IL-33、IL-4和IL-13不论在基因转录水平还是在蛋白水平的表达都有增加趋势。本文推测RSV感染能通过IL-33的分泌增强Th2型细胞免疫反应,从而导致哮喘的急性加重。同时,IL-33的阻断也通过不同途径影响Th17和Treg细胞调控转录因子表达,以达到减轻炎症反应的目的。本研究同样证实了阻断IL-33能减轻哮喘急性加重小鼠肺组织的炎性反应,提示IL-33在哮喘的发病及急性加重过程中均起着至关重要的作用。但IL-33通过何种途径影响Th1、Th2、Th17和Treg细胞亚群的表达及其具体的信号通路还须进一步研究。
总之,通过阻断IL-33能减轻哮喘急性发作小鼠肺组织炎症反应,减少Th2类细胞因子的分泌。这些研究结果提示IL-33在哮喘急性发作过程中发挥了重要作用,将为支气管哮喘急性发作的控制提供新的治疗方向。
| [1] |
Sigurs N, Aljassim F, Kjellman B, Robinson PD, Sigurbergsson F, Bjarnason R, Gustafsson PM. Asthma and allergy patterns over 18 years after severe RSV bronchiolitis in the first year of life[J]. Thorax, 2010, 65(12): 1045-1052.
[DOI]
|
| [2] |
Schmitz J, Owyang A, Oldham E, Song Y, Murphy E, McClanahan TK, Zurawski G, Moshrefi M, Qin J, Li X, Gorman DM, Bazan JF, Kastelein RA. IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines[J]. Immunity, 2005, 23(5): 479-490.
[DOI]
|
| [3] |
Licona-Limón P, Kim LK, Palm NW, Flavell RA. TH2, allergy and group 2 innate lymphoid cells[J]. Nat Immunol, 2013, 14(6): 536-542.
[DOI]
|
| [4] |
Mirchandani AS, Salmond RJ, Liew FY. Interleukin-33 and the function of innate lymphoid cells[J]. Trends Immunol, 2012, 33(8): 389-396.
[DOI]
|
| [5] |
Liu Q, Turnquist HR. Implications for interleukin-33 in solid organ transplantation[J]. Cytokine, 2013, 62(2): 183-194.
[DOI]
|
| [6] |
Kim YH, Yang TY, Park CS, Ahn SH, Son BK, Kim JH, Lim DH, Jang TY. Anti-IL-33 antibody has a therapeutic effect in a murine model of allergic rhinitis[J]. Allergy, 2012, 67(2): 183-190.
[DOI]
|
| [7] |
Liu X, Li M, Wu Y, Zhou Y, Zeng L, Huang T. Anti-IL-33 antibody treatment inhibits airway inflammation in a murine model of allergic asthma[J]. Biochem Biophys Res Commun, 2009, 386(1): 181-185.
[DOI]
|
| [8] |
Jurak LM, Xi Y, Landgraf M, Carroll ML, Murray L, Upham JW. Interleukin 33 selectively augments rhinovirus-induced type 2 immune responses in asthmatic but not healthy people[J]. Front Immunol, 2018, 9: 1895.
[DOI]
|
| [9] |
陈家君, 冯净净, 施天昀, 陈鸿军, 揭志军. IL-33在呼吸道合胞病毒(RSV)感染致哮喘急性发作中的作用[J]. 复旦学报(医学版), 2020, 47(1): 59-65. [DOI]
|
| [10] |
Werder RB, Zhang V, Lynch JP, Snape N, Upham JW, Spann K, Phipps S. Chronic IL-33 expression predisposes to virus-induced asthma exacerbations by increasing type 2 inflammation and dampening antiviral immunity[J]. J Allergy Clin Immunol, 2018, 141(5): 1607-1619.
[DOI]
|
| [11] |
Han X, Chai R, Qi F, Bai S, Cui Y, Teng Y, Liu B. Natural helper cells mediate respiratory syncytial virus-induced airway inflammation by producing type 2 cytokines in an IL-33-dependent manner[J]. Immunotherapy, 2017, 9(9): 715-722.
[DOI]
|
| [12] |
Cayrol C, Duval A, Schmitt P, Roga S, Camus M, Stella A, Burlet-Schiltz O, Gonzalez-de-Peredo A, Girard JP. Environmental allergens induce allergic inflammation through proteolytic maturation of IL-33[J]. Nat Immunol, 2018, 19(4): 375-385.
[DOI]
|
| [13] |
Zeng S, Wu J, Liu J, Qi F, Liu B. IL-33 Receptor (ST2) signalling is important for regulation of Th2-mediated airway inflammation in a murine model of acute respiratory syncytial virus infection[J]. Scand J Immunol, 2015, 81(6): 494-501.
[DOI]
|
| [14] |
Le Goffic R, Arshad MI, Rauch M, L'Helgoualc'h A, Delmas B, Piquet-Pellorce C, Samson M. Infection with influenza virus induces IL-33 in murine lungs[J]. Am J Respir Cell Mol Biol, 2011, 45(6): 1125-1132.
[DOI]
|
| [15] |
Komai-Koma M, Wang E, Kurowska-Stolarska M, Li D, McSharry C, Xu D. Interleukin-33 promoting Th1 lymphocyte differentiation dependents on IL-12[J]. Immunobiology, 2016, 221(3): 412-417.
[DOI]
|
| [16] |
Schiering C, Krausgruber T, Chomka A, Fröhlich A, Adelmann K, Wohlfert EA, Pott J, Griseri T, Bollrath J, Hegazy AN, Harrison OJ, Owens BMJ, Löhning M, Belkaid Y, Fallon PG, Powrie F. The alarmin IL-33 promotes regulatory T-cell function in the intestine[J]. Nature, 2014, 513(7519): 564-568.
[DOI]
|
| [17] |
Alvarez F, Istomine R, Shourian M, Pavey N, Al-Aubodah TA, Qureshi S, Fritz JH, Piccirillo CA. The alarmins IL-1 and IL-33 differentially regulate the functional specialisation of Foxp3(+) regulatory T cells during mucosal inflammation[J]. Mucosal Immunol, 2019, 12(3): 746-760.
[DOI]
|
| [18] |
Wang J. Kong L, Luo Q, Li B, Wu J, Liu B, Wu X, Dong J.. Dual effects of respiratory syncytial virus infections on airway inflammation by regulation of Th17/Treg responses in ovalbumin-challenged mice[J]. Inflammation, 2014, 37(6): 1984-2005.
[DOI]
|
| [19] |
Cho KA, Suh JW, Sohn JH, Park JW, Lee H, Kang JL, Woo SY, Cho YJ. IL-33 induces Th17-mediated airway inflammation via mast cells in ovalbumin-challenged mice[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 302(4): L429-L440.
[URI]
|
| [20] |
Park SH, Kim MS, Lim HX, Cho D, Kim TS. IL-33-matured dendritic cells promote Th17 cell responses via IL-1β and IL-6[J]. Cytokine, 2017, 99: 106-113.
[DOI]
|
| [21] |
Vocca L, Di Sano C, Uasuf CG, Sala A, Riccobono L, Gangemi S, Albano GD, Bonanno A, Gagliardo R, Profita M. IL-33/ST2 axis controls Th2/IL-31 and Th17 immune response in allergic airway diseases[J]. Immunobiology, 2015, 220(8): 954-963.
[DOI]
|
| [22] |
Liu X, Li M, Wu Y, Zhou Y, Zeng L, Huang T. Anti-IL-33 antibody treatment inhibits airway inflammation in a murine model of allergic asthma[J]. Biochem Biophys Res Commun, 2009, 386(1): 181-185.
[DOI]
|
 2021, Vol. 16
2021, Vol. 16


