栖稻假单胞菌(Pseudomonas oryzihabitans,P. oryzihabitans)是一类非发酵的需氧革兰氏阴性杆菌,该菌广泛存在于自然界,在稻叶上定植,通常存在于水、泥土和潮湿环境中,包括医院环境中的下水道、呼吸机、含水的医疗器械和洗手盆等[1-2]。1977年,Pien[3]从1例硬膜外脑出血患者的血培养中分离发现该菌,这是栖稻假单胞菌作为致病菌首次被临床报道。目前,栖稻假单胞菌作为条件致病菌和院内感染菌,多分离自免疫功能低下、肝脏损伤、肿瘤或慢性肾脏疾病患者[4],在软组织感染、肺炎、心内膜炎和菌血症等[1-2, 5-6]中常见,偶见于特殊病例如假体周围关节感染[7]等。目前,国内外对栖稻假单胞菌感染的临床病例报道相对较少,导致临床医务人员对该菌的认识不足。本文对就诊于三亚市人民医院重症监护治疗病房(intensive care unit,ICU)的1例患者血培养中分离并鉴定出的1株栖稻假单胞菌报道如下。
1 临床资料 1.1 病例患者男性,33岁,黎族,公司职员,家住海南省陵水黎族自治县。该患者于2019年11月17日就诊于陵水县人民医院,就诊前半月余无明显诱因出现双下肢水肿,未予注意;就诊前3 d出现全身乏力、气短、尿少,伴恶心、呕吐等症状,仍未予注意。就诊当天以上症状进一步加重。生化检查:肌酐234.0 μmol/L,血钾6.89 mmol/L;胸部、腹部CT:左肺上叶炎症、心包少量积液、右侧胸腔积液、左侧胸膜增厚、脂肪肝、肝脏形态增大、腹腔积液、双侧肾周渗出改变。县医院考虑患者病情极为危重,于就诊当日便将其转入三亚市人民医院抢救,急诊科以“肾功能衰竭、高钾血症”收入ICU。
入院查体:体温35.8 ℃,脉搏94次/分,血压107/83 mmHg(多巴胺维持下)。双下肢中度水肿,双小腿见散在色素沉着。血常规检查:白细胞17.23×109/L,中性粒细胞比率81.9%,血红蛋白137 g/L,血小板200×109/L;生化检查:肌酐281 μmol/L,降钙素原3.98 ng/mL,谷丙转氨酶996 U/L,血钾7.06 mmol/L;心肌钙蛋白I 1.33 μg/L。患者既往体健,否认高血压、冠心病、糖尿病等病史。
入院诊断:急性肾损伤;肺部感染;脓毒性休克;脂肪肝;肝功能不全;多器官功能障碍综合征。
治疗:入院后告病危,给予静脉滴注亚胺培南西司他丁(泰能)1.0 g,每8 h 1次,联合莫西沙星0.4 g,每日1次,加强抗感染;并加强炎症因子清除、补液抗休克以及纠酸对症支持治疗,但预后极差。患者入院立即送检做血培养,24 h后报告阳性,涂片染色镜检可见革兰阴性杆菌。回报血培养危急值时,临床告知患者已出院。出院原因系患者家属因自身因素主动要求。出院时患者呈昏迷状,血压83/45 mmHg(去甲肾上腺素3.0 μg·kg-1·min-1、肾上腺素3.0 μg·kg-1·min-1维持下),血氧饱和度96%。双侧瞳孔等大等圆2.0 mm,对光反射稍迟钝。
1.2 材料与方法 1.2.1 主要试剂哥伦比亚血琼脂平板、嗜血巧克力琼脂平板、中国蓝琼脂平板和水解酪蛋白琼脂(Mueller-Hinton, MH)培养基购于广州迪景微生物科技有限公司;血液增菌培养瓶购于美国BD医疗器械公司;质谱专用基质(一般细菌)购于生物梅里埃公司;药敏试验纸片购于Oxoid Limited公司;细菌基因组DNA提取试剂盒购于北京天根生化科技公司;PCR Master Mix和2000 Marker购于上海翊圣科技有限公司。质控标准菌株大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 15442由国家卫生健康委员会临床检验中心提供。
1.2.2 主要仪器全自动血培养仪(BDBACET/FX/200)购自美国BD医疗器械公司,迪尔细菌鉴定系统(DL-96Ⅱ)购自珠海迪尔生物工程有限公司,全自动快速微生物质谱检测系统(VITEK MS IVD V3.2)购自生物梅里埃公司,PE基因扩增仪(PE-9700)购自美国应用生物系统公司,高电压电泳仪(PowerPac HV)购自美国Bio-Rad公司,紫外线透射分析仪(UV-3C)购自珠海黑马医学仪器有限公司。
1.2.3 细菌分离培养按照《临床微生物检验标准化操作程序》《实用临床微生物学检验与图谱》等权威著作和执行标准提供的方法[8-9]进行。采集后的血培养标本立即置于全自动血培养仪中35 ℃孵育,24 h后需氧瓶报阳性,立即取出置于生物安全柜内进行分离培养。用无菌注射器抽取需氧瓶中血液标本适量,分别接种于血琼脂平板、巧克力琼脂平板和中国蓝琼脂平板,同时进行涂片及革兰染色镜检。
1.2.4 质谱仪鉴定依据制造商说明书和《中国临床微生物质谱应用专家共识》[10]进行质谱操作和结果判读。分离菌在血琼脂平板生长24 h后,用一次性无菌接种环挑取单个适量菌落,均匀涂布于靶板,用1 μL基质液封板,置室温干燥后使用VITEK MS IVD V3.2对分离菌进行鉴定。以大肠埃希菌ATCC 25922进行质控。
1.2.5 生化试验分离菌在血琼脂平板生长24 h后,挑取单个菌落溶于无菌生理盐水,配置成0.5麦氏浓度的菌悬液,选择迪尔96NE鉴定板,经迪尔细菌鉴定系统DL-96Ⅱ进行生化试验。
1.2.6 药物敏感试验(antimicrobial susceptibility test,AST)参考美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)M100抗菌药物敏感性试验执行标准(2019版)[11]中铜绿假单胞菌药敏试验标准,采用纸片扩散法进行。取0.5麦氏浓度的菌悬液均匀涂布于MH平板,每个平板贴的药敏纸片不超过5个,并将平板置于35 ℃普通培养箱中,24 h后测量抑菌环的直径进行结果判读。以铜绿假单胞菌ATCC 15442进行质控。
1.2.7 16S rRNA测序分析分离菌TS383在血琼脂平板生长48 h后,使用细菌基因组DNA提取试剂盒提取细菌基因组DNA;实验所用16S rRNA通用引物为27F(5′-AGAGTTTGATCCTGGC-TCAG-3′)和1492R(5′-GGTTACCTTGTTACG-ACTT-3′),引物由生工生物工程(上海)股份有限公司合成。聚合酶链反应(polymerase chain reaction,PCR)体系为:25 μL PCR Master Mix,上、下游引物和模板DNA各2 μL,加无核酸水补足至50 μL;反应条件为:94 ℃,30 s;52℃,30 s;72 ℃,90 s,30个循环。扩增产物送北京睿博兴科公司研发部进行TA克隆测序。
1.2.8 系统发育树构建根据16S rRNA测序结果,运用在线Blast软件进行序列比对,选择同源性较高的假单胞菌属部分模式菌株,以醋酸钙不动杆菌(Acinetobacter calcoaceticus,A. calcoaceticus)ATCC 23055作为外群菌株,运用Mega 7.0软件构建系统发育树。所有菌株16S rRNA序列均从美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI) GenBank获取。
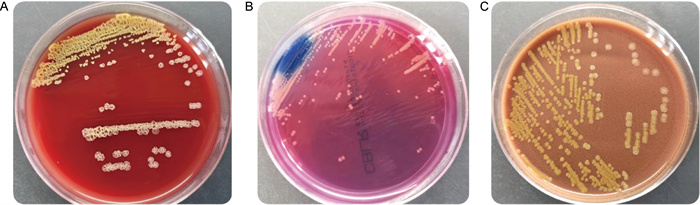
2 结果 2.1 细菌培养特征及生化特征分离株TS383经35 ℃ 24 h培养,在血琼脂平板上可见圆形、皱纹菌落,直径1~2 mm(见图 1A);在中国蓝琼脂平板上为光滑菌落,微凸起,边缘整齐(见图 1B);在巧克力琼脂平板上可见明显的异质性菌落特征(见图 1C);固体培养基上的菌落都具有典型黄色色素。进行涂片染色镜检,显示为革兰氏阴性杆菌,无芽孢,大多散在或成对排列。该菌氧化酶试验阴性,触酶试验阳性,其他生化特征如表 1所示。
|
| A: Cultured on blood agar. B: China blue agar. C: Chocolate agar. 图 1 分离株TS383 24 h培养特征 Fig. 1 Characteristics of P. oryzihabitans TS383 cultured for 24 h |
| Biochemical characteristics | Strain TS383 |
| Acid production: | |
| Glucose (aerobic), Xylose, Fructose, Sucrose, Mannose, Mannitol | + |
| Lactose, Maltose | - |
| Fermentation: | |
| Arabinose | + |
| Glucose (aerobic), Diosaccharide, Rhamnose, Raffinose, Lactose, Maltose | - |
| Cellobiose, Inose, Salicin, Sorbitol, Adonitol, α-Methyl-D-Glycosidase | - |
| Utilization: | |
| Citrate, Malonate, Malate | + |
| Aerogenesis: | |
| H2S | - |
| Assimilation: | |
| Ornithine decarboxylase, Lysine decarboxylase | + |
| Arginine hydrolase, Phenylalanine deaminase | - |
| Reduction: | |
| Nitrate | - |
| Hydrolysis: | |
| Acetamide, Gelatin, Aesculin | - |
| Others: | |
| Oxidase, Urease | - |
| Catalase | + |
经质谱仪VITEK MS IVD V3.2鉴定,分离株TS383为栖稻假单胞菌,置信度为99.9%。
2.3 药物敏感试验分离株TS383对头孢他啶、头孢吡肟、庆大霉素、阿米卡星、左氧氟沙星、环丙沙星、哌拉西林/他唑巴坦、亚胺培南、美罗培南均敏感,对氨曲南、氨苄西林、头孢唑啉、头孢呋辛耐药。
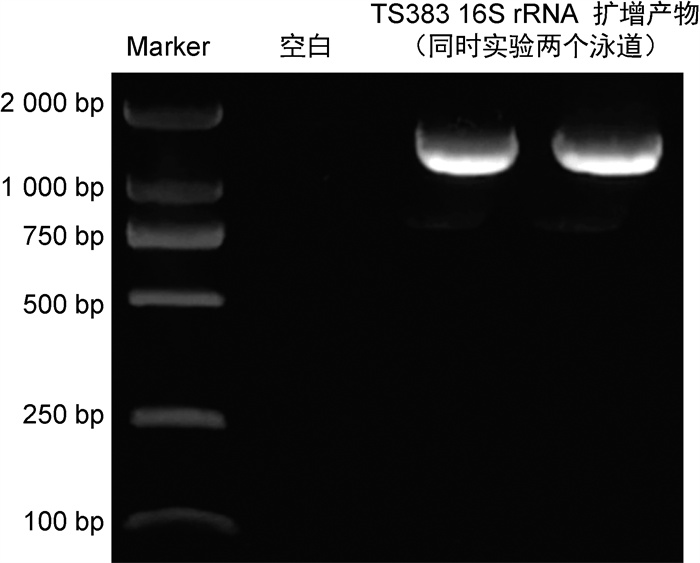
2.4 16S rRNA测序结果PCR产物经琼脂糖凝胶电泳检测为约1.5 kb的单一条带(见图 2),与目的条带相符。经北京睿博兴科公司研发部进行TA克隆测序,将序列递交GenBank,获得序列号MN911431.1,并运用在线Blast软件进行序列比对。经比对,分离株TS383与GenBank中耐冷假单胞菌(Pseudomonas psychrotolerans,P. psychrotolerans)C36T和P. oryzihabitans NBRC 102199T(LMG 7040T)的同源性最高,分别是99.79%和99.73%。
|
| 图 2 分离株TS383的16S rRNA扩增产物电泳图 Fig. 2 Electrophoresis of 16S rRNA amplification products of P. oryzihabitans TS383 |
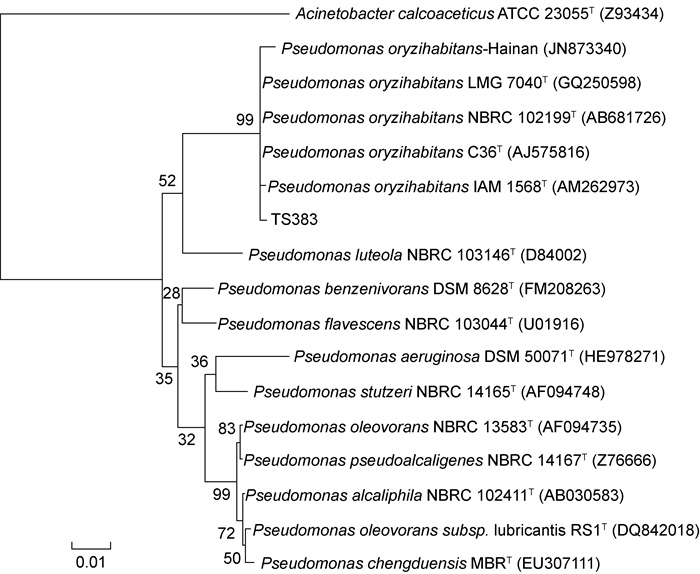
系统发育树如图 3所示。目前假单胞菌属中的有效命名成员多达212个,因此只选择16S rRNA基因序列同源性较高的部分假单胞菌构建系统发育树。模式菌株序列从GenBank获取,选择A. calcoaceticus ATCC 23055作为外群。使用软件Mega 7.0比对序列,手工编辑去除不明确的核苷酸和缺口,并采用最大似然法(maximun likelihood)建树。系统发育树显示,分离株TS383与P. psychrotolerans C36T 以及 P. oryzihabitans NBRC 102199T(LMG 7040T)进化距离最近,自展值为99%,结果可靠;且P. psychrotolerans C36T与已鉴定的5株栖稻假单胞菌归为同一个集群,距离P. oryzihabitans NBRC 102199T(LMG 7040T)分支长度为0,距离P. oryzihabitans IAM 1568T分支长度 < 0.001,可见亲缘关系十分相近。
|
| Maximum likelihood was used to build the tree based on 16S rRNA sequence analysis. The number in the node is the reliability of the bootstrap test for 1 000 times. 图 3 分离株TS383与部分假单胞菌的系统发育树 Fig. 3 Phylogenetic tree of P. oryzihabitans TS383 and some pseudomonas |
由于分类学上存在争议,栖稻假单胞菌命名经过多次修改。1985年,因该菌形态学上类似于假单胞菌并可从稻谷中大量分离得到,Kodama等[12]提出命名为栖稻假单胞菌。1987年, Holmes等[13]基于该菌与假单胞菌DNA杂交的同源性较低,提议新属名黄色单胞菌属,即栖稻黄色单胞菌(Flavimonas oryzihabitans,F. oryzihabitans)。1997年,Anzai等[14]通过16S rRNA系统进化分析方法,发现假单胞菌属、黄色单胞菌属和金色单胞菌属同源性>93.9%,提议三者列为同一属,并入假单胞菌属。原核生物有效命名表(List of Prokaryotic Names with Standing in Nomenclature,LPSN)[15]上注释该菌的正确命名为P. oryzihabitans,F. oryzihabitans为同模异名(homotypic synonym)。
栖稻假单胞菌与假单胞菌属中大部分菌种差异最为显著的一点是,其氧化酶试验阴性,这值得微生物检验人员注意。将本报告分离的TS383株与P. oryzihabitans Hainan[16] 和 P. oryzihabitans NBRC 102199T的生化特征进行对比,部分酶类如鸟氨酸脱羧酶、赖氨酸脱羧酶、尿素酶,部分糖类如麦芽糖、蔗糖等项目,生化反应结果都不尽相同,有时传统的细菌鉴定仪无法准确鉴定。国外有研究者认为,栖稻假单胞菌属于罕见致病菌,各分离株之间的表型特征差异难以鉴定到种的水平,建议采用16S rRNA测序等分子鉴定技术[5, 17]。
3.2 与耐冷假单胞菌(P. psychrotolerans)的亲缘关系耐冷假单胞菌是需氧革兰氏阴性无芽孢杆菌,菌落呈黄色,氧化酶试验阴性、触酶试验阳性,生长温度4~37 ℃,由Hauser等[18]在2004年发表有效命名。Tran等[19]在2017年对373个假单胞菌属细菌的全基因组DNA-DNA杂交进行计算机模拟,将有效模式种的基因组两两比对后发现,P. psychrotolerans DSM 15758T (DSM 15758T =C36T)和 P. oryzihabitans NBRC 102199T存在于同一个基因群(genospecies)中,2个菌株全基因组平均核苷酸一致性(average nucleotide identity,ANI)高达98.5%,意味着这两种菌亲缘关系密切。鉴于 P. oryzihabitans发表时间早于 P. psychrotolerans,本文提出 P. psychrotolerans作为P. oryzihabitans的次定同物异名(junior synonym)。以上结果与本例分离株的系统发育树中所揭示的 P. psychrotolerans C36T 与 P. oryzihabitans NBRC 102199T(LMG 7040T)的亲缘关系结果一致。本例分离株构建的系统发育树仅基于16S rRNA序列,难免有局限性。而ANI分析基于所有直系同源蛋白编码基因比较,克服了DNA-DNA杂交的繁复性和16S rRNA序列分析的保守性,成为目前原核生物分类的金标准[20],以ANI值的95%~96%作为分类阈值,被广泛应用于细菌种属的重新分类以及未知菌的鉴定。
3.3 耐药性本例分离株TS383的AST结果显示对大部分抗菌药敏感,包括头孢他啶、头孢吡肟、庆大霉素、阿米卡星、左氧氟沙星、环丙沙星、哌拉西林/他唑巴坦、亚胺培南、美罗培南;而对氨曲南、氨苄西林、头孢唑啉、头孢呋辛耐药。这与大多数文献报道的结果相似。需要注意的是,国内发现对3代头孢菌素耐药的栖稻假单胞菌分离株,其中头孢曲松和头孢他啶耐药率分别达50%和37.5%[2, 6],因此治疗期间应根据AST结果及时调整用药方案。有报道指出,栖稻假单胞菌并非人体正常菌群[5],根据本例患者的个人信息、入院时的感染指征、血培养分离得到纯菌落以及AST结果,推断该患者社区感染栖稻假单胞菌的可能性大。目前,栖稻假单胞菌感染的病例报道中甚少出现多器官功能衰竭患者,本例患者临床给予泰能联合莫西沙星治疗,但预后极差,可见感染早期使用抗菌药物的必要性。本报道结果提示,微生物检验人员应关注栖稻假单胞菌的案例报道和相关研究,以获取更多资料为临床诊治提供依据。
| [1] |
梁艳冰, 许元文, 唐皓, 陈冬梅, 陈求刚, 马中富. 静脉导管相关性栖稻黄单胞菌脓毒症15例临床研究[J]. 热带医学杂志, 2009, 9(10): 1151-1153. [CNKI]
|
| [2] |
姚晔, 邵淮鲁. 栖稻黄单胞菌致下呼吸道感染的特点和耐药性分析[J]. 临床肺科杂志, 2004, 9(1): 20-22. [DOI]
|
| [3] |
Pien FD. Group VE-2 (Chromobacterium typhiflavum) bacteremia[J]. J Clin Microbiol, 1977, 6(4): 435-436.
[DOI]
|
| [4] |
Silva F. Pseudomonas (Flavimonas) oryzihabitans[J]. Rev Chilena Infectol, 2015, 32(4): 445-446.
[DOI]
|
| [5] |
Keikha M, Soori T, Azadi D, Karami Zarandi M, Daneshpazhooh M, Ali Rahdar H. The first report of Pseudomonas oryzihabitansin infection in a patient with hidradenitis suppurativa[J]. Clinical Case Reports, 2019, 7(8): 1514-1517.
[DOI]
|
| [6] |
王佳, 高辉, 徐益, 彭传梅, 黄云昆, 姚瑶, 朱雯梅. 感染性心内膜炎患者病原菌分布及耐药性分析[J]. 中国抗生素杂志, 2019, 44(8): 958-962. [DOI]
|
| [7] |
Panagopoulos GN, Megaloikonomos PD, Liontos M, Giannitsioti E, Drogari-Apiranthitou M, Mavrogenis AF, Kontogeorgakos V. Pseudomonas oryzihabitans infected total hip arthroplasty[J]. J Bone Jt Infect, 2016(1): 54-58.
[URI]
|
| [8] |
周庭银, 倪语星, 胡继红, 徐英春, 吴文娟. 临床微生物检验标准化操作程序[M]. 上海: 上海科学技术出版社, 2019. [URI]
|
| [9] |
陈东科, 孙长贵. 实用临床微生物学检验与图谱[M]. 北京: 人民卫生出版社, 2011. [URI]
|
| [10] |
中国临床微生物质谱共识专家组. 中国临床微生物质谱应用专家共识[J]. 中华医院感染学杂志, 2016, 26(10): 2149-2152. [CNKI]
|
| [11] |
Clinical and Laboratory Standards Institute. M100 performance standards for antimicrobial susceptibility testing [S]. 29th ed. Wayne, PA: CLSI, 2019. [URI]
|
| [12] |
Kodama K, Kimura N, Komagata K. Two new species of Pseudomonas: P oryzihabitans isolated from rice paddy and clinical specimens and P. luteola isolated from clinical specimens [J]. Int J Syst Bacteriol, 1985, 35(4): 467-474.
[DOI]
|
| [13] |
Holmes B, Steigerwalt AG, Weaver RE, Brenner DJ. Chryseomonas luteola comb. nov. and Flavimonas oryzihabitans gen. nov., comb. nov., Pseudomonas-like species from human clinical specimens and formerly known, respectively, as groups Ve-1 and Ve-2[J]. Int J Syst Bacteriol, 1987, 37(3): 245-250.
[DOI]
|
| [14] |
Anzai Y, Kudo Y, Oyaizu H. The phylogeny of the genera Chryseomonas, Flavimonas, and Pseudomonas supports synonymy of these three genera[J]. Int J Syst Bacteriol, 1997, 47(2): 249-251.
[DOI]
|
| [15] |
List of Prokaryotic names with Standing in Nomenclature. Species Pseudomonas oryzihabitans [EB/OL]. [2020-02-08]. https://lpsn.dsmz.de/species/pseudomonas-oryzihabitans.
|
| [16] |
吴至成, 覃西, 吴琳, 翟英超, 王小娟, 李影林. 一株栖稻假单胞菌海南变种的发现与鉴定[J]. 实用医学杂志, 2012, 28(15): 2595-2597. [DOI]
|
| [17] |
Owusu M, Owusu-Dabo E, Acheampong G, Osei I, Amuasi J, Sarpong N, Annan A, Chiang HY, Kuo CH, Park SE, Marks F, Adu-Sarkodie Y. Pseudomonas oryzihabitans sepsis in a 1-year-old child with multiple skin rashes: a case report[J]. J Med Case Rep, 2017, 11(1): 77.
[DOI]
|
| [18] |
Hauser E, Kämpfer P, Busse HJ. Pseudomonas psychrotolerans sp.Nov[J]. Int J Syst Evol Microbiol, 2004, 54(Pt 5): 1633-1637.
[PubMed]
|
| [19] |
Tran PN, Savka MA, Gan HM. In-silico taxonomic classification of 373 genomes reveals species misidentification and new genospecies within the genus Pseudomonas[J]. Front Microbiol, 2017, 8: 1296.
[DOI]
|
| [20] |
Richter M, RossellóMóra R. Shifting the genomic gold standard for the prokaryotic species definition[J]. Proc Natl Acad Sci U S A, 2009, 106(45): 19126-19131.
[DOI]
|
 2021, Vol. 16
2021, Vol. 16


