2019年12月上旬,湖北省武汉市陆续出现肺炎患者,随后开始在全国各地不断出现。流行病学和病原学研究确认此次肺炎由新型冠状病毒(2019 novel coronavirus,2019-nCoV)引起,且与武汉华南海鲜批发市场密切相关[1]。世界卫生组织(World Health Organization,WHO)于2020年1月30日宣布此次疫情为“国际关注的公共卫生突发事件”(public health emergency of international concern,PHEIC),2020年2月11日将此病命名为coronavirus disease 2019 (COVID-19)。截至2020年2月13日24时,累计确诊患者59 901例,疑似患者13 435例,死亡病例1 368例。自COVID-19暴发以来,来自中国和其他国家的多个团队成功分离出病毒并完成了全基因组测序[1] (图 1),提示2019-nCoV与2003年暴发的严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus, SARS-CoV)同为β属冠状病毒B亚群,为后续疫情防控和临床治疗提供了理论支撑。
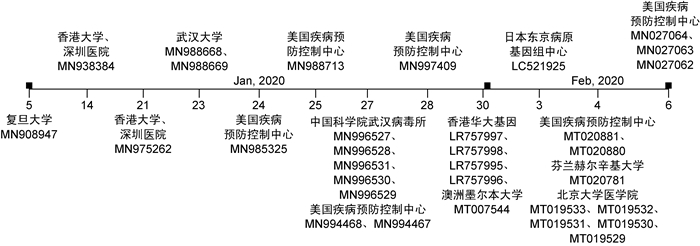
|
| 图 1 全球各机构提交2019-nCoV全基因测序结果时间轴 Fig. 1 Timeline of complete 2019-nCoV genome sequences submitted by global agents |
冠状病毒为正链单链RNA病毒,基因组约为30 kd,是基因组较大的RNA病毒。冠状病毒属于套式病毒目(Nidovirales)、冠状病毒科(Coronaviridae),可划分为4个(α、β、γ和δ)冠状病毒属[2]。2019年12月以前,已知共有6种冠状病毒能感染人类,包括2种α属冠状病毒(HCoV-229E和HKU-NL63)和4种β属冠状病毒(HCoV-OC43、HCoV-HKU1、SARS-CoV和MERS-CoV)。β属冠状病毒又可分为4个亚群(A、B、C和D)。HCoV-OC43与HCoV-HKU1属于A亚群,通常引起轻微的上呼吸道感染症状,抑制免疫活性,偶尔会造成免疫力低下患者或者老年人的下呼吸道严重感染[3]。B亚群的SARS-CoV与C亚群的中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)主要侵袭下呼吸道,引起急性呼吸窘迫综合征以及腹泻、淋巴细胞减少、肝功能紊乱、肾损伤等肺外临床症状[4-5]。2019-nCoV主要侵犯肺泡上皮细胞,感染后潜伏期约为1~14 d,最长可达24 d,引起的临床症状与SARS-CoV和MERS-CoV感染相似,主要以发热、干咳为主。多数病人呈轻症状态,表现为低热、轻微乏力,但无肺炎症状。重症多集中在老年患者或有严重基础疾病的患者,常于感染后1周出现呼吸困难,然后发展为急性呼吸窘迫综合征、脓毒血症等,计算机断层扫描(computed axial tomography,CT)显示,肺呈多发性磨玻璃影和浸润影,甚至肺实变[6]。2019-nCoV以飞沫传播和接触传播为主;但在患者粪便中也已发现病毒核酸阳性,提示存在消化道传播的可能性[7];此外还不能排除2019-nCoV以气溶胶方式传播。2020年2月20日为止,2019-nCoV的感染确诊病例数已超过SARS-CoV和MERS-CoV,但是病死率比SARS-CoV(10%)和MERS-CoV(35%)低[8]。提示,2019-nCoV(与SARS-CoV和MERS-CoV相比)传染性强,但毒力稍弱。
2 2019-nCoV的基因组结构2019-nCoV基因组(GenBank: MN975262)具有典型的冠状病毒结构(图 2),含有29 891个核苷酸,核苷酸G与C占比约40%,编码9 860个氨基酸。基因组5 ′端有帽状结构,3 ′端有多聚A尾,包含两个侧翼非翻译区(untranslated regions,UTR)和整段编码多聚蛋白的开放读码框架(open reading frame,ORF)。约占基因组全长2/3的ORF1a和ORF1b基因编码16个非结构蛋白(non-structural protein,NSP)。ORF1a与ORF1b之间存在移码,翻译产生2种多聚蛋白质(polyprotein,pp)1a/ab,随后在病毒编码的胰凝乳蛋白酶、主蛋白酶和木瓜样蛋白酶催化下裂解成NSP[9-10]。靠近3 ′端占基因组全长1/3的ORF含9个头端保守的小向导RNA(small guide RNA, sgRNA)、9个转录调控序列(transcription-regulatory sequences,TRS)、2个末端UTR。首尾两端的UTR片段与蝙蝠CoV ZXC21、SARS-CoV基因组相比,该区域核苷酸同源性>83.6%[11]。

|
| A: 2019-nCoV, SARS-CoV and MERS-CoV belong to β-coronavirus, with a genome of about 30 kb. The sequences of all genomes are of 5 ′ UTR-ORF1ab-structural protein encoding gene (S-E-M-N)-3 ′ UTR. ORF1ab encodes 16 non-structural proteins. Structural protein encoding gene mainly encodes spike (S) protein, envelope (E) protein, membrane (M) protein and nucleocapsid (N) protein. The differences among 2019-nCoV, SARS-CoV and MERS-CoV mainly are in spike protein (S) gene, ORF3 and ORF8. B: Diagram of structure of 2019-nCoV particle. The N protein envelops the genome of 2019-nCoV, which is surrounded by N protein, and M protein and S protein are attached on the viral surface. 图 2 2019-nCoV、SARS-CoV、MERS-CoV基因组比对及2019-nCoV结构示意图 Fig. 2 Comparison of 2019-nCoV, SARS-CoV, MERS-CoV genomes and diagram of structure of 2019-nCoV particle |
对多种冠状病毒基因组序列比对发现,非结构蛋白和结构蛋白编码区的同源性分别为58%与43%,在全基因组水平上同源性为54%,这表明非结构蛋白序列偏保守,而结构蛋白序列为适应环境而高变[12]。2019-nCoV基因组与SARS-CoV的同源性约为80%,与蝙蝠CoV ZC45和蝙蝠CoV ZXC21基因组的同源性约89%[8],而与蝙蝠CoV RaTG13同源性最高,达到96%[13];对基因组的系统进化分析也提示2019-nCoV很可能来源于蝙蝠。
3 2019-nCoV的蛋白功能2019-nCoV基因组序列为5 ′ UTR-ORF1a/b-结构蛋白基因〔刺突(spike,S)蛋白-包膜(envelope,E)蛋白-膜(membrane,M)蛋白-核衣壳(nucleocapsid,N)蛋白〕-3 ′ UTR(图 2A)。冠状病毒的非结构蛋白序列相对比较保守,ORF1a与ORF1b分别编码多聚蛋白pp1a或pplab,随后裂解产生16个非结构蛋白。
NSP1主要诱导宿主胞内mRNA降解,抑制转录,阻滞细胞周期;NSP2可能与宿主胞内环境的改变有关;NSP3为木瓜样蛋白酶,而NSP5包含胰凝乳蛋白酶和主蛋白酶,两者共同裂解多聚蛋白而产生非结构蛋白;NSP4与NSP6共同作用,促进双层膜囊泡(double-membrane vesicle,DMV)的形成,在病毒复制早期发挥作用。此外NSP6为6次跨膜蛋白,诱导自噬与内质网穿孔;NS7和NS8能与NS12结合(进行共定位),NS8还具有引物酶活性;NSP9、NSP10具有部分复制酶活性,NSP9可形成二聚体,增强与核酸结合的亲和力;NSP11具体功能未知;NSP12具有RNA依赖的RNA聚合酶活性;NSP13具有解旋酶活性;NSP14具有核酸外切酶活性,NSP15具有核酸内切酶活性;NSP16是RNA帽子结构,可抑制先天性免疫[12]。2019-nCoV与SARS-CoV在非结构蛋白序列区域具有高度的相似性,几乎无区别;而在ORF3b、S蛋白、ORF8片段,序列存在明显差异,特别是S蛋白与ORF8序列[11]。
2019-nCoV的主要结构蛋白包括S蛋白、E蛋白、M蛋白和N蛋白。此外,不同冠状病毒还编码特殊的结构蛋白或辅助蛋白。例如β属冠状病毒B亚群通常编码血凝素酯酶(hemagglutinin esterase,HE),但2019-nCoV无HE(图 2B)。
3.1 S蛋白S蛋白介导病毒识别宿主细胞受体,促进膜融合,并诱导免疫反应产生中和抗体。S蛋白由两个亚基S1与S2组成。S1亚基包含1个信号肽、N末端结构域(N-terminal domain,NTD)和受体结合域(receptor-binding domain,RBD),而S2亚基包含融合肽(fusion peptide,FP)、七肽重复序列(heptad repeat,HR)1和2、跨膜结构域和胞内结构域。2019-nCoV的S1亚基序列与蝙蝠SL-CoV ZXC21、蝙蝠SL-CoV ZC45和SARS-CoV相比,同源性约70%。RBD是与宿主细胞受体直接结合的部分,在病毒吸附、进入宿主细胞过程中发挥重要作用。2019-nCoV与SARS-CoV相比,S蛋白RBD序列同源性为73%,SARS-CoV的S蛋白已被证实能直接与血管紧张素酶2(angiotensin converting enzyme 2,ACE2)结合, 且结合序列位点与2019-nCoV高度一致[11]。最新报道发现,2019-nCoV能通过ACE2受体感染人类、蝙蝠和猪[13],这说明2019-nCoV的S蛋白也是通过与ACE2受体结合,参与病毒入侵过程。研究发现,与2019-nCoV和SARS-CoV相比,大多数蝙蝠SARSr-CoVs的S蛋白RBD有两段序列的缺失,而RBD序列不缺失的云南株WIV1也能结合ACE2而入侵细胞[11],表明S蛋白的RBD某段特定序列在病毒与ACE2结合、吸附宿主细胞过程中发挥重要作用。因此,S1亚基的RBD可作为抗2019-nCoV药物和疫苗研发的重要作用靶点。在S1亚基RBD与宿主细胞结合后,S2亚基FP插入宿主细胞膜表面,并在HR1与HR2之间形成超螺旋结构,发生构象变化,实现病毒与细胞膜融合,随后病毒基因组释放,进入胞内后复制。来自于SARS-CoV S蛋白HR2区域的多肽SC1能与HR1区域结合,阻断病毒与细胞的融合[14]。鉴于2019-nCoV的HR2区域序列与SARS-CoV完全一致,推测多肽SC1可能会有效抑制2019-nCoV感染。2019-nCoV的S2亚基序列高度保守,与蝙蝠SL-CoV ZXC21、蝙蝠SL-CoV ZC45和SARS-CoV序列有99%的同源性[6],因此广谱抗S2药物可能有治疗效果。
3.2 E蛋白E蛋白包含疏水结构域和跨膜α螺旋结构域,是病毒包膜组成部分,并参与病毒颗粒组装和释放[15-16]。2019-nCoV的E蛋白序列与SARS CoV相比,同源性高达95%。SARS-CoV的E蛋白还能以五聚体结构形式发挥离子通道作用[16],这也提示E蛋白在2019-nCoV病毒复制和致病过程中的功能多样性。
3.3 M蛋白M蛋白含有3个跨膜结构域和1个保守结构域,是病毒包膜的组成部分,参与病毒颗粒的组装和释放[15-16]。2019-nCoV的M蛋白序列与SARS CoV相比,同源性高达91%。SARS CoV的M蛋白只在内质网和高尔基体表达,其保守结构域,通过蛋白-蛋白的相互作用参与病毒装配和出芽过程。此外,M蛋白存在两种构象变化,对其他结构蛋白(S、E、N蛋白)的结构稳定和功能表达起到重要作用[15]。
3.4 N蛋白N蛋白序列保守程度高,在病毒复制过程中发挥重要作用。N蛋白与病毒RNA结合形成复合体,随后在M蛋白和E蛋白的共同作用下,包裹后进入病毒衣壳中。N蛋白含有Nl和N2表位,表位Nl能刺激机体产生高亲和力的抗体,但是一般没有中和活性[17]。研究发现,β属冠状病毒B亚群的N蛋白能发生血清交叉反应[18]。与SARS-CoV相比,2019-nCoV的N蛋白同源性高达90%,因此,COVID-19患者血清有可能会识别SARS-CoV的N蛋白,可用于临床检测无症状的2019-nCoV携带者。
此外,2019-nCoV的ORF3b片段中发现一段含有4个螺旋结构的特异性蛋白,且与SARS-CoV不存在同源序列[11]。研究发现,ORF3b缺失的SARS-CoV复制能力与野生型无差别,说明ORF3b在SARS-CoV复制过程中可有可无[19]。但转染表达ORF3b的Vero细胞会发生坏死和凋亡现象[20]。有研究结果表明,ORF3b能抑制β干扰素信号通路,且不依赖蛋白质核定位。因此,2019-nCoV的ORF3b片段中的特异性蛋白所起的作用值得深入研究[11]。与SARS-CoV序列对比,2019-nCoV的ORF8片段也存在明显差异,其不含功能性结构域或基序。而SARS-CoV的ORF8片段能激活胞内应激信号和引起NLRP3炎症反应[21]。根据二级结构分析预测,2019-nCoV的ORF8片段能形成α螺旋和β折叠,该空间结构的功能有待进一步研究[11]。
4 展望2019-nCoV与SARS-CoV、MERS-CoV有相似之处,溯源分析发现,2019-nCoV基因组序列与蝙蝠来源的冠状病毒相似性最高,其中与蝙蝠CoV RaTG13同源性达到96%。结合系统进化分析,可以确定2019-nCoV来源于蝙蝠。2019-nCoV与SARS-CoV在非结构蛋白序列区域具有高度的相似性,因此靶向复制酶蛋白的特异性酶抑制剂可能会抑制病毒的复制。鉴于2019-nCoV S蛋白S2亚基序列与其他冠状病毒同源性达99%,靶向冠状病毒S2亚基的药物也应纳入基础和临床研究中。此外,2019-nCoV S蛋白S1亚基的RBD序列与SARS-CoV高度相似,能与ACE2结合,并能诱导免疫反应产生抗体,因此S1亚基的RBD可作为抗2019-nCoV药物和疫苗研发的重要靶点。高度保守的N蛋白能刺激机体产生高亲和力的交叉反应性抗体,可用于临床诊断,也为核酸检测假阴性患者提供另一检测方案。
总之,2019-nCoV基因组结构与蛋白功能的研究进展促进了对病毒复制和致病免疫机制的认识,推动了病毒溯源、检测诊断以及药物和疫苗研发,正在并必将为目前COVID-19疫情的防控提供有力的理论支撑。
| [1] |
Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, Zhao X, Huang B, Shi W, Lu R, Niu P, Zhan F, Ma X, Wang D, Xu W, Wu G, Gao GF, Tan W. China Novel Coronavirus Investigating and Research Team.A Novel Coronavirus from Patients with Pneumonia in China, 2019[J]. N Engl J Med, 2020.
[DOI]
|
| [2] |
戚中田. 病毒学[M]. 戚中田.医学微生物学(第三版). 北京: 科学出版社, 2014.
|
| [3] |
Woo PC, Lau SK, Chu CM, Chan KH, Tsoi HW, Huang Y, Wong BH, Poon RW, Cai JJ, Luk WK, Poon LL, Wong SS, Guan Y, Peiris JS, Yuen KY. Characterization and complete genome sequence of a novel coronavirus, coronavirus HKU1, from patients with pneumonia[J]. J Virol, 2005, 79(2): 884-895.
[DOI]
|
| [4] |
Peiris JS, Lai ST, Poon LL, Guan Y, Yam LY, Lim W, Nicholls J, Yee WK, Yan WW, Cheung MT, Cheng VC, Chan KH, Tsang DN, Yung RW, Ng TK, Yuen KY. SARS study group.Coronavirus as a possible cause of severe acute respiratory syndrome[J]. Lancet, 2003, 361(9366): 1319-1325.
[DOI]
|
| [5] |
Yeung ML, Yao Y, Jia L, Chan JF, Chan KH, Cheung KF, Chen H, Poon VK, Tsang AK, To KK, Yiu MK, Teng JL, Chu H, Zhou J, Zhang Q, Deng W, Lau SK, Lau JY, Woo PC, Chan TM, Yung S, Zheng BJ, Jin DY, Mathieson PW, Qin C, Yuen KY. MERS coronavirus induces apoptosis in kidney and lung by upregulating Smad7 and FGF2[J]. Nat Microbiol, 2016, 1: 16004.
[DOI]
|
| [6] |
Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, Zhang L, Fan G, Xu J, Gu X, Cheng Z, Yu T, Xia J, Wei Y, Wu W, Xie X, Yin W, Li H, Liu M, Xiao Y, Gao H, Guo L, Xie J, Wang G, Jiang R, Gao Z, Jin Q, Wang J, Cao B. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, pii: S0140-6736(20): 30183-5.
[DOI]
|
| [7] |
Holshue ML, DeBolt C, Lindquist S, Lofy KH, Wiesman J, Bruce H, Spitters C, Ericson K, Wilkerson S, Tural A, Diaz G, Cohn A, Fox L, Patel A, Gerber SI, Kim L, Tong S, Lu X, Lindstrom S, Pallansch MA, Weldon WC, Biggs HM, Uyeki TM, Pillai SK. Washington State 2019-nCoV Case Investigation Team.First case of 2019 novel coronavirus in the United States[J]. N Engl J Med, 2020.
[DOI]
|
| [8] |
Gralinski LE, Menachery VD. Return of the coronavirus: 2019-nCoV[J]. Viruses, 2020, 12(2): pii: E135.
[DOI]
|
| [9] |
Masters PS. The molecular biology of coronaviruses[J]. Adv Virus Res, 2006, 66: 193-292.
[DOI]
|
| [10] |
Ziebuhr J, Snijder EJ, Gorbalenya AE. Virus-encoded proteinases and proteolytic processing in the Nidovirales[J]. J Gen Virol, 2000, 81(Pt 4): 853-879.
[URI]
|
| [11] |
Chan JF, Kok KH, Zhu Z, Chu H, To KK, Yuan S, Yuen KY. Genomic characterization of the 2019 novel human-pathogenic coronavirus isolated from a patient with atypical pneumonia after visiting Wuhan[J]. Emerg Microbes Infections, 2020, 9(1): 221-236.
[DOI]
|
| [12] |
Chen Y, Liu Q, Guo D. Emerging coronaviruses: genome structure, replication, and pathogenesis[J]. J Med Virol, 2020.
[DOI]
|
| [13] |
Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, Si HR, Zhu Y, Li B, Huang CL, Chen HD, Chen J, Luo Y, Guo H, Jiang RD, Liu MQ, Chen Y, Shen XR, Wang X, Zheng XS, Zhao K, Chen QJ, Deng F, Liu LL, Yan B, Zhan FX, Wang YY, Xiao GF, Shi ZL. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature, 2020.
[DOI]
|
| [14] |
Liu S, Xiao G, Chen Y, He Y, Niu J, Escalante CR, Xiong H, Farmar J, Debnath AK, Tien P, Jiang S. Interaction between heptad repeat 1 and 2 regions in spike protein of SARS-associated coronavirus: implications for virus fusogenic mechanism and identification of fusion inhibitors[J]. Lancet, 2004, 363(9413): 938-947.
[DOI]
|
| [15] |
Neuman BW, Kiss G, Kunding AH, Bhella D, Baksh MF, Connelly S, Droese B, Klaus JP, Makino S, Sawicki SG, Siddell SG, Stamou DG, Wilson IA, Kuhn P, Buchmeier MJ. A structural analysis of M protein in coronavirus assembly and morphology[J]. J Struct Biol, 2011, 174(1): 11-22.
[DOI]
|
| [16] |
Verdia-Baguena C, Nieto-Torres JL, Alcaraz A, DeDiego ML, Torres J, Aguilella VM, Enjuanes L. Coronavirus E protein forms ion channels with functionally and structurally-involved membrane lipids[J]. Virology, 2012, 432(2): 485-494.
[DOI]
|
| [17] |
Liu C, Kokuho T, Kubota T, Watanabe S, Inumaru S, Yokomizo Y, Onodera T. DNA mediated immunization with encoding the nucleoprotein gene of porcine transmissible gastroenteritis virus[J]. Virus Res, 2001, 80(1-2): 75-82.
[DOI]
|
| [18] |
Wang N, Li SY, Yang XL, Huang HM, Zhang YJ, Guo H, Luo CM, Miller M, Zhu G, Chmura AA, Hagan E, Zhou JH, Zhang YZ, Wang LF, Daszak P, Shi ZL. Serological evidence of bat SARS-related coronavirus infection in humans, China[J]. Virol Sin, 2018, 33(1): 104-107.
[URI]
|
| [19] |
Yount B, Roberts RS, Sims AC, Deming D, Frieman MB, Sparks J, Denison MR, Davis N, Baric RS. Severe acute respiratory syndrome coronavirus group-specific open reading frames encode nonessential functions for replication in cell cultures and mice[J]. J Virol, 2005, 79(23): 14909-14922.
[DOI]
|
| [20] |
Khan S, Fielding BC, Tan TH, Chou CF, Shen S, Lim SG, Hong W, Tan YJ. Over-expression of severe acute respiratory syndrome coronavirus 3b protein induces both apoptosis and necrosis in Vero E6 cells[J]. Virus Res, 2006, 122(1-2): 20-27.
[DOI]
|
| [21] |
Shi CS, Nabar NR, Huang NN, Kehrl JH. SARS-coronavirus open reading frame-8b triggers intracellular stress pathways and activates NLRP3 inflammasomes[J]. Cell Death Discov, 2019, 5: 101.
[DOI]
|
 2020, Vol. 15
2020, Vol. 15


