2. 首都儿科研究所,北京 100020
2. Capital Institute of Pediatrics, Beijing 100020, China
鼠疫是一种严重危害人类健康且极易造成大流行的自然疫源性疾病,具有发病急、病死率高的特点,是《中华人民共和国传染病防治法》[1]中规定的甲类传染病。近年来,全球人间鼠疫疫情呈上升趋势,在一些静息了近30年的鼠疫疫源地又出现了流行[2]。2017年,非洲马达加斯加肺鼠疫暴发,引起了世界性的恐慌。2019年,蒙古国发生了人间鼠疫疫情,同年我国内蒙古2例鼠疫患者输入至北京[3]。这些情况表明鼠疫疫情从静息转入活跃,从边远地区向城市人口密集区逼近。
鼠疫由鼠疫耶尔森菌(Yersinia pestis)引起,该菌通过染疫媒介叮咬或接触染疫动物而传播给人类。因此,为了有效控制动物间疫情避免波及人间,加强鼠疫疫源地动物间鼠疫的监测是预警预测的重要手段。近年来,鼠疫的活跃疫源地大多位于贫困、偏僻地区,现场实验条件简陋,因此研究一种快速、特异、简便,特别是适用于野外现场使用的诊断方法对于鼠疫防治工作具有重要意义。
环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术为恒温核酸扩增方法,其原理是针对靶基因的6个区域设计4条特异引物,进行核酸扩增反应[4]。有研究报道,3a作为鼠疫耶尔森菌特异的染色体序列,可以特异性扩增鼠疫耶尔森菌3个生物型中的所有试验菌株[5],因此可考虑将其用于鼠疫耶尔森菌的检测。
我国有11个鼠疫自然疫源地[6],不同疫源地的鼠疫耶尔森菌的宿主、生态地理环境及基因组有所不同。为考察LAMP是否能够检测我国不同疫源地鼠疫耶尔森菌的所有基因组型,本研究对基于3a靶序列设计特异性引物的LAMP技术检测鼠疫耶尔森菌的敏感性和特异性进行观察。选取我国各疫源地分离的野生鼠疫耶尔森菌65株,进行LAMP检测,同时将与鼠疫耶尔森菌近源的假结核耶尔森菌、小肠结肠炎耶尔森菌及非近源的大肠埃希菌作为对照菌以评价其特异性,判断其是否可用于基层现场鼠疫监测,从而为早期发现动物间鼠疫及防止疫情波及人间提供科学数据。
1 材料与方法 1.1 材料 1.1.1 试剂及仪器LAMP与聚合酶链反应(polymerase chain reaction,PCR)引物由北京擎科生物有限公司合成。LoopampⓇ朗報ⓇDNA扩增试剂盒(批号98004)、Loopamp荧光目视检测试剂盒(批号98002)由北京成志科为生物科技有限公司提供;鼠疫胶体金免疫层析试纸(批号202001)由中国人民解放军军事医学科学院微生物流行病研究所提供;Taq DNA聚合酶(批号:G326KA4962)、DNA Marker(批号:G320KA4962)由上海生工生物工程股份有限公司提供;中国细菌浊度标准管(批号2018-1)由中国药品生物制品检定所提供。恒温水浴箱ZC-22Q购于杭州卓驰仪器有限公司,PCR扩增仪购于德国Eppendorf公司,多用电泳仪购于北京六一仪器厂。
1.1.2 实验菌株测试菌株为65株鼠疫耶尔森菌株,分别从我国11个鼠疫自然疫源地不同宿主动物中分离获得;减毒菌株EV76由鼠疫耶尔森菌专业实验室提供,特异性结果如表 1所示。对照菌株为小肠结肠炎耶尔森菌4种血清型、假结核耶尔森菌15种血清型及1株大肠埃希菌ATCC 9610,均由鼠疫耶尔森菌专业实验室提供(见表 1)。
| Strain | Strain code | Plague foci | Host | Distribution area | Number of strains | Positive number (rate) (%) | |||
| RIHA | RGICA | PCR | LAMP | ||||||
| Y. pestis | 54006 | Plague natural focus of Citellus dauricus in Songliao Plain | Citellus dauricus | Heilongjiang, Jilin, Liaoning, Inner Mongolia | 5 | 5(100) | 5(100) | 5(100) | 5(100) |
| 124032 | Plague natural focus of Meriones unguiculatus in Inner Mongolia Plateau | Meriones unguiculatus | Inner Mongolia, Ningxia | 5 | 5(100) | 5(100) | 5(100) | 5(100) | |
| 12002 | Plague natural focus of Marmota himalayana in Qinghai-Tibet Plateau | Marmota himalayana | Inner Mongolia, Ningxia | 5 | 5(100) | 5(100) | 5(100) | 5(100) | |
| 160042 | Plague natural focus of Marmota himalayana in Qinghai-Tibet Plateau | Marmota himalayana | Inner Mongolia, Ningxia | 5 | 5(100) | 5(100) | 5(100) | 5(100) | |
| 39001 | Plague natural focus of Marmota longtail in Pamir Plateau | Marmota longtail | Xinjiang | 5 | 5(100) | 5(100) | 5(100) | 5(100) | |
| 41015 | Plague natural focus of Marmota baibacina-Citellus undulatus | Marmota baibacina | Xinjiang | 3 | 3(100) | 3(100) | 3(100) | 3(100) | |
| 42003 | Citellus undulatus | Xinjiang | 2 | 2(100) | 2(100) | 2(100) | 2(100) | ||
| 140136 | Plague natural focus of Citellus alaschanicus in Gan-Ning Loess Plateau | Citellus alaschanicus | Gansu, Ningxia | 5 | 5(100) | 5(100) | 5(100) | 5(100) | |
| 90072 | Plague natural focus of Microtus brandti in Xilingol Plateau | Microtus brandti | Inner Mongolia | 5 | 5(100) | 5(100) | 5(100) | 5(100) | |
| 84035 | Plague natural focus of Apodemus chevrieri-Eothenomys miletus in Mountainous area in Western Yunnan | Apodemus chevrieri | Yunnan | 3 | 3(100) | 3(100) | 3(100) | 3(100) | |
| 80003 | Eothenomys miletus | Yunnan | 2 | 2(100) | 2(100) | 2(100) | 2(100) | ||
| 0010036 | Plague natural focus of Rattus flavipectus in Minguang coastal residential area in Western Yunnan | Rattus flavipectus | Guizhou, Yunnan | 5 | 5(100) | 5(100) | 5(100) | 5(100) | |
| 18012 | Plague natural focus of Microtusfuscus in Qinghai-Tibet Plateau | Microtusfuscus | Qinghai, Sichuan | 5 | 5(100) | 5(100) | 5(100) | 5(100) | |
| 1200001 | Plague natural focus in Junggar Basin | Rhombomys opimus | Xinjiang | 5 | 5(100) | 5(100) | 5(100) | 5(100) | |
| Y.pseudotuberculosis | 53518 | Serotype O: 1a | 15 | 0(0) | 0(0) | 0(0) | 0(0) | ||
| 53519 | Serotype O: 2c | ||||||||
| Y.enterocolitica | 52 302-2 | Serotype O: 9 | 4 | 0(0) | 0(0) | 0(0) | 0(0) | ||
| 52006 | Serotype O: 3 | ||||||||
| E. coli | ATCC | Serotype O157: H7 | 1 | 0(0) | 0(0) | 0(0) | 0(0) | ||
| 25922 | |||||||||
分别取65株野生鼠疫耶尔森菌纯培养物制备菌悬液,按照鼠疫诊断标准(WS297-2008)[7]中的方法进行RIHA。
1.2.2 鼠疫胶体金免疫层析法(colloidal gold immunochromatography assay,RGICA)取上述菌悬液的上清液200 μL,加入胶体金免疫层析试纸条检测孔内,15 min后观察结果。阳性结果为可见2条显色带,阴性结果为仅见1条显色带,同时做空白对照。
1.2.3 PCR取细菌培养物0.5 mL,12 000 r/min离心2 min,用0.5 mL灭菌纯水重悬沉淀物,100 ℃加热10 min,12 000 r/min离心3 min,取上清液作为DNA模板,按照鼠疫诊断标准(WS297-2008)[7]中的方法,采用PCR检测鼠疫耶尔森菌并判定结果,以鼠疫耶尔森菌EV76为内部对照。PCR体系含10×Buffer 3.0 μL、10 mmol/L dNTP 0.1 μL、5 U/μL Taq DNA聚合酶0.2 μL、10 μmol/L配对引物1.0 μL、模板DNA(2 ng/μL)5.0 μL,最后用去离子水补足至30 μL。PCR扩增条件:95 ℃预变性3 min,95 ℃变性40 s,56 ℃退火40 s,72 ℃延伸40 s,30个循环,72 ℃终延伸3 min。PCR引物序列如下:F1上游引物为5′-GGAACCACTAGCACATCTGTT-3′;下游引物为5′-ACCTGCTGCAAGTTTACCGCC-3′。目的片段长度为249 bp。
1.3 LAMP技术优化及菌株检测根据美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库公布的鼠疫耶尔森菌3a基因序列(GenBank登录号AF350075),用PrimerExplorer version 4在线软件设计LAMP引物,包括外引物F3、B3,内引物FIP、BIP以及相应的环引物(见表 2)。各菌株DNA模板的制备同上。
| Primer | Sequence |
| 3a-F3 | ACTACCATCCCCTCAAGGTT |
| 3a-B3 | GAGGGCGTTTTGGTAGAGAA |
| 3a-FIP | CACCCGCGTTATCTCATCCCGTTTT- CGAGTAGGGTTAGGTGGGC |
| 3a-BIP | CATGGACGTATGGCGGGTCATTTT- GTGATGCCGTCCAATGCA |
| 3a-LF | ACCGCCATGAAATGGACAATG |
LAMP反应体系及反应条件优化如下:反应体系包括2×Reaction Mix 12.5 μL、混合引物1 μL(引物F3、B3浓度均为5 pmol/L,引物BIP、FIP浓度均为40 pmol/L)、Bst DNA聚合酶1 μL、DNA模板2 μL、荧光染料1 μL,用灭菌纯水补至25 μL,恒温水浴加热。温度按60 ℃、65 ℃、70 ℃递增,反应时间按30、60、90 min递增,确定最佳反应温度和反应时间。
敏感性实验:根据比浊法测定EV76菌液密度。将菌液10倍倍比稀释至1.0×104/L,取各密度菌液制备模板(方法同1.2.3)用于LAMP检测,反应结束后直接观察颜色变化以进行结果判定。
特异性实验:取65株鼠疫耶尔森菌菌株和对照菌株(小肠结肠炎耶尔森菌4种血清型、假结核耶尔森菌15种血清型及1株大肠埃希菌ATCC9610)菌液制备模板(方法同1.2.3),使用LAMP技术进行检测,反应结束后直接观察颜色变化以进行结果判定。
结果判定:以钙黄绿素作为荧光指示剂,反应结束后肉眼观察反应管内颜色变化,进行结果判定,绿色为阳性结果,橘红色为阴性结果。
2 结果 2.1 常规检测法结果经常规检测法(包括RIHA、RGICA和PCR)检测,65株鼠疫耶尔森菌均为阳性,而小肠结肠炎耶尔森菌4种血清型、假结核耶尔森菌15种血清型和1株大肠埃希菌ATCC 9610均为阴性。
2.2 LAMP技术优化利用EV76菌株摸索LAMP的反应条件。根据引物Tm值确定优化反应的温度按60、65、70 ℃递增,反应时间按30、60、90 min递增,经重复试验证明65 ℃为最佳反应温度,最佳反应时间为60 min。
2.3 LAMP技术的敏感性将EV76菌株进行梯度稀释,采用LAMP技术检测,每个反应体系含菌量由高到低依次为2×104/mL、2×103/mL、2×102/mL和20/mL,另有一体系含细菌DNA 2 pg/mL。目视LAMP荧光检测最低能检出20个菌/L(见图 1)。

|
| Amount of bacteria in each tube: 2×104/mL in tube 1, 2×103/mL in tube 2, 2×102/mL in tube 3, 20/mL in tube 4. There was 2 pg/mL of bacterial DNA in tube 5. Tube 6 was set as blank control and tube 7 as positive control. 图 1 LAMP检测鼠疫耶尔森菌的敏感性 Fig. 1 Sensitivity of LAMP in detection of Y. pestis |
结果显示,65株鼠疫耶尔森菌反应管均呈绿色,为阳性结果;其他菌株反应管呈橘红色,为阴性结果,表明LAMP检测鼠疫耶尔森菌具有良好的特异性(见表 1)。各疫源地鼠疫耶尔森菌代表株的检测结果如图 2所示。
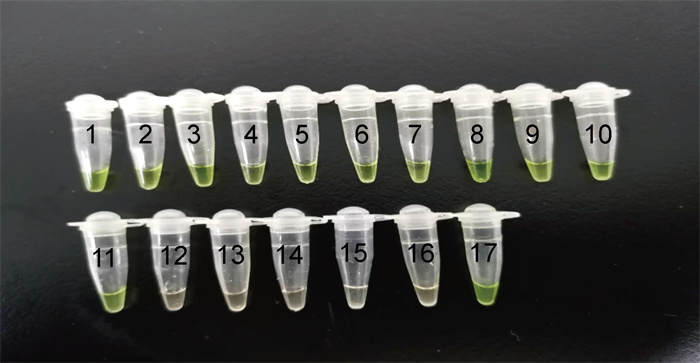
|
| In tubes 1-11, there were the representative strains of Y. pestis from 11 plague natural foci in China. In tubes 12 and 13, there were Y. enterocolitica and Y. pseudotuberculosis strains. PTB17 was in tube 14 and E. coli ATCC 25922 was in tube 15. Tube 16 was set as blank control, and tube 17 as positive control. 图 2 LAMP检测鼠疫耶尔森菌的特异性 Fig. 2 Specificity of LAMP in detection of Y. pestis |
鼠疫监测是我国鼠疫防治的主要措施,但目前基层应用的鼠疫耶尔森菌传统诊断方法存在繁琐、费时、使用精密仪器受条件限制等不足,导致漏检,不能有效反映动物鼠疫流行情况。因此,为提高动物鼠疫监测效力,探索建立一种操作简便、特异性强、敏感性高的鼠疫耶尔森菌快速检测方法是非常必要的。
LAMP是Notomi等[4]于2000年研发的恒温核酸扩增方法,其工作原理是针对靶基因的6个区域设计4条特异引物,进行核酸扩增反应。于学东等[5]曾评价3a作为鼠疫耶尔森菌特异的染色体序列,可以特异扩增鼠疫耶尔森菌3个生物型中的所有实验菌株,为此本研究使用3a靶序列设计合成4条LAMP引物(包括环引物),利用链置换DNA聚合酶于65 ℃保温60 min,完成核酸扩增反应。鼠疫耶尔森菌为肠杆菌科耶尔森菌属,与同属的假结核耶尔森菌和小肠结肠炎耶尔森菌的DNA部分同源[8],在形态、培养特性、抗原结构等方面非常相似,鉴别较为困难,而且这3种菌都可感染人和动物,往往在鼠疫自然疫源地发生或流行[9-10]。因此,本研究选取与鼠疫耶尔森菌近源的假结核耶尔森菌、小肠结肠炎耶尔森菌及非近源的大肠埃希菌作为对照菌株来验证LAMP法的特异性。结果表明,65株鼠疫耶尔森菌的检测结果均为阳性,而相关的近源株和非近源株的检测结果均为阴性,提示LAMP法具有较高的特异性,能够用于我国不同鼠疫疫源地野生菌株的检测。
目前,鼠疫耶尔森菌的常规检测方法主要有传统细菌培养、血清学检测、PCR法等,但它们非特异性较高,敏感性较低,在实验标准化方面也存在一些问题[11],而且耗时(需要3~5 d),不适于快速诊断。普通PCR是实验室检测鼠疫耶尔森菌的常规技术,其以鼠疫耶尔森菌的纤维蛋白溶酶原活性因子pla基因和FI抗原基因为目的基因,通过体外扩增,结合DNA探针技术而建立。但有研究发现,鼠疫耶尔森菌的3个毒力质粒在自然分离株中均有丢失现象,因此基于质粒上抗原或DNA的检测方法可能存在漏检[12],而且PCR等分子生物学方法在诊断时需要特殊仪器,模板热变性及长时间温度循环也不利于鼠疫监测时大量样本的筛查应用[13]。RIHA和RGICA是鼠疫诊断标准(WS297-2008)[7]中规定的鼠疫诊断方法,本研究也表明LAMP与RIHA、RGICA、PCR等方法均可特异性检出鼠疫耶尔森菌,符合率为100%。胶体金法因快速、结果易判而被广泛应用,但资料提示现用的检测鼠疫抗原的胶体金免疫层析试纸条都是以FI单克隆抗体为基础发展起来的,如遇现场材料缺失FI抗原则易漏检[14]。研究表明,GICA检测鼠疫耶尔森菌最低菌液浓度为6.0×104 /mL,RIHA检测最低菌液浓度为1.3×105 /mL[15],而本研究采用的LAMP敏感性很高,最低可测出20个菌/mL,与文献报道一致[16]。在其反应体系中加入荧光染料,根据颜色可肉眼判定结果[17-18],不需要精密仪器,无须对PCR产物进行电泳等后续处理,提取DNA加LAMP检测全过程可于1 h内完成。
综上所述,LAMP技术具有快速、简便、敏感性高、特异性强等优点,克服了PCR技术的种种缺陷与不确定因素,适用于大规模流行病学调查,可用于鼠疫监测工作和快速检测,但其用于鼠疫耶尔森菌现场检测的效果还有待进一步评估。
| [1] |
中华人民共和国传染病防治法[J]. 中国卫生法制, 2004, 12(5): 38-44. [URI]
|
| [2] |
林桂强, 朱汉荣, 姚若东. 近年全球几种主要传染病疫情概况[J]. 中国国境卫生检疫杂志, 2001, 24(4): 248-250. [DOI]
|
| [3] |
Wang YM, Zhou L, Fan MG, Wang QY, Li JY, Li Q, Feng ZJ, Gao GF, Xu C, Chen LJ, Li W, Zhang YP. Isolated cases of plague—Inner Mongolia-Beijing, 2019[J]. China CDC Weekly, 2019, 1(1): 13-16.
[DOI]
|
| [4] |
Notomi T, Okayama H, Masubuchi H, Yonekawa T, Watanabe K, Amino N, Hase T. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28(12): E63.
[DOI]
|
| [5] |
于学东, 裴德翠, 周东生, 宋亚军, 郭兆彪, 王津, 杨瑞馥. PCR快速鉴定鼠疫耶尔森氏菌[J]. 生物技术通讯, 2003, 14(6): 569-572. [DOI]
|
| [6] |
辛有权, 魏柏青, 杨晓燕, 魏荣杰, 祁美英, 熊浩明, 靳娟, 李存香, 李翔. 中国11个鼠疫自然疫源地鼠疫耶尔森菌质粒谱类型及其分布特征[J]. 中华预防医学杂志, 2015, 49(1): 9-12. [DOI]
|
| [7] |
中国疾病预防控制中心传染病预防控制所, 中国疾病预防控制中心鼠疫布鲁菌病防治基地, 中国人民解放军军事医学科学院. 鼠疫诊断标准WS 279-2008 [S]. 北京: 卫生部传染病标准专业委员会, 2008(2008-02-28). http://yccdc.com.cn/jkzt/crb/shuyi/6088.html.
|
| [8] |
Cui Y, Yu C, Yan Y, Li D, Li Y, Jombart T, Weinert LA, Wang Z, Guo Z, Xu L, Zhang Y, Zheng H, Qin N, Xiao X, Wu M, Wang X, Zhou D, Qi Z, Du Z, Wu H, Yang X, Cao H, Wang H, Wang J, Yao S, Rakin A, Li Y, Falush D, Balloux F, Achtman M, Song Y, Wang J, Yang R. Historical variations in mutation rate in an epidemic pathogen, Yersinia pestis[J]. Proc Natl Acad Sci U S A, 2013, 110(2): 577-582.
[DOI]
|
| [9] |
姚颖波, 马伟泉, 陈连球, 曾丽萍, 王树坤, 景怀琦, 王鑫, 肖玉春. 云南省新平县家鼠鼠疫疫源地小肠结肠炎耶尔森菌的调查分析[J]. 中国微生态学杂志, 2013, 25(10): 1123-1127. [CNKI]
|
| [10] |
纪树立. 鼠疫[M]. 北京: 人民卫生出版社, 1988. [URI]
|
| [11] |
王鹏, 郭英, 吴明寿, 杜春红, 钟佑宏, 黄鹏, 董珊珊, 于国林. 胶体金免疫层析试纸条对云南鼠疫现场材料的检测[J]. 地方病通报, 2006, 21(3): 11-13. [DOI]
|
| [12] |
冯娜, 周亚洲, 范艳晓, 汪琼, 毕玉晶, 韩延平, 杨瑞馥, 周育森, 王效义. 环介导恒温扩增技术快速检测鼠疫耶尔森菌[J]. 军事医学, 2015, 39(11): 868-872. [CNKI]
|
| [13] |
吴斌, 张宏, 苗克军, 葛亚俊, 郭丽民, 徐大琴, 达文平, 陈国娟, 穆洮霞, 席进孝. 鼠疫菌检测技术在鼠疫监测工作的应用效果分析[J]. 中国地方病防治杂志, 2010, 25(6): 441-443. [CNKI]
|
| [14] |
王鹏, 张建中. 鼠疫免疫学检测的研究进展[J]. 中国人兽共患病学报, 2009, 25(10): 996-999. [DOI]
|
| [15] |
王丽, 于守鸿, 谢辉, 王梅, 杨永海, 祁芝珍, 王津. 检测鼠疫抗原金标层析试剂盒的研制及应用[J]. 地方病通报, 2006, 21(5): 14-16. [DOI]
|
| [16] |
魏东, 汪洁英, 王国治. 鼠疫耶尔森氏菌环介导等温扩增检测方法的建立[J]. 中国卫生检验杂志, 2012, 22(9): 2074-2077. [CNKI]
|
| [17] |
Hill J, Beriwal S, Chandra I, Paul VK, Kapil A, Singh T, Wadowsky RM, Singh V, Goyal A, Jahnukainen T, Johnson JR, Tarr PI, Vats A. Loop-mediated isothermal amplification assay for rapid detection of common strains of Escherichia coli[J]. J Clin Microbiol, 2008, 46(8): 2800-2804.
[DOI]
|
| [18] |
Goto M, Honda E, Ogura A, Nomoto A, Hanaki K. Colorimetric detection of loop-mediated isothermal amplification reaction by using hydroxy naphthol blue[J]. Biotechniques, 2009, 46(3): 167-172.
[DOI]
|
 2021, Vol. 16
2021, Vol. 16


