B细胞免疫应答产生的抗体对于人类多种急、慢性病毒(如新型冠状病毒、流感病毒、乙型肝炎病毒等)感染的病原清除及持续保护至关重要[1-3],应答过程涉及众多基因的差异表达,但这些基因如何在其中起作用仍不完全清楚[4]。通过构建基因敲除小鼠鉴定基因功能的经典方法耗时、耗力,无法快速确立相关功能,而在体外B细胞系水平的研究又不能完全代表其在体内正常免疫反应中的功能[5-6],因此,建立一种体外有效敲低原代B细胞中目的基因表达并通过过继转移至小鼠体内鉴定基因功能的方法具有重要意义。目前已有较为成熟的基于反转录病毒感染的T细胞转导方法[7-9],经单次感染即可达到60%~65%的转导效率[8],但缺乏一种高效转导B细胞以敲低目的基因并进一步回输体内观察其增殖和分化情况的方法[10-11]。究其原因,主要存在以下几个方面的问题:①表达短发夹核糖核酸(short hairpin RNA,shRNA)的反转录病毒滴度较低,导致B细胞的感染率较低; ②缺乏既能增殖B细胞,又能维持B细胞自身属性的体外培养系统; ③悬浮的原代B细胞不易被病毒感染; ④经体外转导后的B细胞,过继转移到小鼠体内后较难收获足够多的增殖和分化的B细胞以供表型分析。
为此,本研究基于pLMpd-Ametrine载体和plat-E细胞包装系统,通过共转染Drosha酶特异性小分子干扰RNA(small interfering RNA,siRNA),增加反转录病毒RNA稳定性来提高病毒滴度。使用抗CD180抗体(α-CD180)增殖原代B细胞,在B细胞处于活跃的增殖活化状态下经2次离心感染(spin infection)转导反转录病毒,使B细胞可获得超过30%的转导效率。最后,利用上述优化方案,成功敲低并验证了B细胞功能基因Bcl6的抗凋亡功能。
1 材料与方法 1.1 材料 1.1.1 病毒、载体及细胞水疱性口炎病毒(vesicular stomatitis virus,VSV)由本室保存,其诱导的体液免疫应答在病毒感染的清除中起重要作用,是一种被广泛应用于抗病毒体液免疫研究的模式病毒。使用Vero细胞扩增,用BHK21细胞做空斑形成实验,测定滴度后于-80 ℃保存[12]。反转录病毒包装载体pLMpd-Ametrine(加利福尼亚大学Jason Cyster教授惠赠)携带Ametrine标签,可直接用流式细胞仪进行检测[13-14]。plat-E细胞(南京医科大学王晓明教授惠赠)基于293T细胞构建,通过EF1α启动子启动病毒结构基因gag-pol和env的表达,可稳定、高效产生反转录病毒[15]。pLMpd-Ametrine载体经plat-E细胞包装产生携带特定基因片段的反转录病毒。NIH/3T3细胞由复旦大学邓强教授惠赠。
1.1.2 实验小鼠VSV特异性B细胞(VI10 B)取自VI10YEN小鼠(圣拉斐尔科学研究所Matteo Iannacone教授惠赠)。VI10YEN小鼠携带转基因的轻链和基因敲入的重链,使B细胞可特异性识别VSV并对其产生应答,在抗病毒体液免疫反应的研究中得到了广泛的应用[16-18],饲养在复旦大学实验动物中心。C57BL/6小鼠(SPF级)购自上海灵畅生物科技有限公司。小鼠6~12周龄,实验设计符合复旦大学实验动物伦理要求。
1.1.3 主要试剂DMEM细胞培养基和RPMI 1640培养基购自Corning公司,磷酸盐缓冲液(phosphate buffered saline,PBS)和胎牛血清(fetal bovine serum,FBS)购自Biological Industries公司,PrimeSTAR HS DNA Polymerase购自Takara公司,B细胞阴性选择试剂盒购自Biolegend公司,转染试剂Lipofectamine 2000和CD180抗体购自Thermo Scientific公司,流式抗体购自Biolegend和eBioscience公司,Bcl6(D412V)XP兔单克隆抗体购自Cell Signaling Technology公司。
B细胞培养基配方:RPMI 1640、FBS(10%)、非必需氨基酸(1:100)、双抗(Pen/Strep,100 IU/100 μg/mL)、β-巯基乙醇(55 μM)、丙酮酸(1 mmol/L)、谷氨酸(2 mmol/L)、羟乙基哌嗪乙磺酸(hydroxyethyl piperazineethanesulfonic acid,HEPES)缓冲液(10 mmol/L)。
流式细胞分选(fluorescence activated cell sorting,FACS)缓冲液为含2%FBS的PBS。
1.2 方法 1.2.1 反转录病毒载体的构建Bcl6是一种转录抑制蛋白,在B细胞生发中心反应中高表达,可通过抑制p53肿瘤抑制基因的表达,调节生发中心B细胞中DNA损伤诱导的凋亡反应[19]。因此,选择了已被证明有敲低效率的Bcl6 shRNA对系统进行验证[20],以靶向海肾荧光素酶(Renilla Luciferase,ren.713)的shRNA作为无关shRNA对照。靶向Ren.713和Bcl6的shRNA寡核苷酸[20-21]序列如下。
Ren.713:
C T C G A G A A G G T A T A T T G C T G T T G A C A-GT G A G C G C A G G A A T T A T A A T G C T T A T C T A-T A G T G A A G C C A C A G A T G T A T A G A T A A G C-A T T A T A A T T C C T A T G C C T A C T G C C T C G G A-ATTC
Bcl6-1:
T G C T G T T G A C A G T G A G C G C G G C A A G T-CC C T A A T G A G T A T A T A G T G A A G C C A C A G A-T G T A T A T A C T C A T T A G G G A C T T G C C T T G C-CTACTGCCTCGGA
Bcl6-2:
T G C T G T T G A C A G T G A G C G G C T G T C A A-AG A G A A G G C T T T A T A G T G A A G C C A C A G A T-GT A T A A A G C C T T C T C T T T G A C A G C T G C C T A-CTGCCTCGGA
以上寡核苷酸经生工生物工程(上海)股份有限公司合成后,用5′ primer:5′-CAGAAGGC-T C G A G A AGGTATATTGCTGTTGACAGTGA-GCG-3′,3′ primer:5′-CTAAAGTAGCCCCTT-GAATTCCGAGGCAGTAGGCA-3′扩增寡核苷酸[22],聚合酶链反应(PCR)产物胶回收后用XhoⅠ和EcoRⅠ双酶切,连入pLMpd-Ametrine质粒,通过测序进行验证。经3T3/NIH细胞筛选得到以上2个有效的Bcl6 shRNA,B细胞转导相关实验展示数据由Bcl6 shRNA-1完成。
1.2.2 转染plat-E细胞产生病毒plat-E细胞铺板后至汇合度约为80%时,用lipo 2000转染pLMpd-Ametrine质粒。因细胞内自身存在降解shRNA的Drosha酶,转录形成的含有miR-shRNA的病毒会被内源性Drosha酶剪切,进而导致能够包装成病毒的shRNA数目减少,因此共同转染Drosha的siRNA可提高plat-E细胞内病毒RNA的稳定性[23-24],从而增加B细胞的转导效率。后续实验使用摸索得到的最佳浓度siRNA Drosha与pLMpd-Ametrine质粒共转染。转染8 h后,更换培养液。分别在更换培养液后的24 h和48 h收集病毒上清液,添加HEPES(终浓度10 mmol/L)和聚凝胺(polybrene)(终浓度5 μg/mL)。
1.2.3 B细胞培养转染当天,在无菌条件下取含CD45.1/2的VI10YEN小鼠脾脏,阴性选择B细胞,调整细胞浓度至1×106/ml,加入CD180抗体(1:4 000)置于37 ℃培养。
1.2.4 B细胞转导经CD180抗体活化的VI10 B细胞无刹车离心5 min,去除培养液后加入由plat-E细胞包装得到的新鲜反转录病毒,混匀后室温无刹车模式2 450 rpm(1 100×g)离心90 min。离心结束后吸去病毒上清液,用含CD180抗体的B细胞培养基继续培养。第1次离心感染后24 h,再次收集反转录病毒上清液,重复离心感染一次。
1.2.5 小鼠VSV感染在第1次离心感染当天,给将要接受过继转移VI10 B细胞的C57BL/6小鼠(CD45.2)尾静脉注射VSV,每只2×106 pfu(plaque forming unit, PFU)。
1.2.6 转导B细胞过继转移至C57BL/6小鼠将1.2.4中离心感染2次后的VI10 B细胞用RPMI 1640洗涤、重悬并经小鼠眼眶下静脉注射过继转移(adoptive transfer)至1.2.5中预先感染VSV的C57BL/6小鼠。
1.2.7 转导B细胞增殖、分化情况的检测体外观察刺激剂对B细胞的影响,阴性选择后的B细胞直接加相应刺激剂培养至指定时间后流式细胞染色即可,涉及的染色抗体:anti-CD80_APC、anti-CD86_BV605和anti-CD138_PE。对于体内增殖的转导B细胞,在过继转移后相应天数处死小鼠取脾制备单细胞悬液,按以下配色方式进行细胞表面染色:anti-GL-7_PE、anti-B220_PerCP-Cy5.5、anti-FAS_APC、APC-eFluor 780、anti-CD45.1_Pacific Blue,以上抗体均为1:200加入(APC-eFluor 780以1:1 000加入),冰上孵育40 min,FACS缓冲液洗涤2次后,使用流式细胞仪Attune NxT Flow Cytometer(Thermo Scientific)进行检测。
1.2.8 统计学方法与作图流式细胞仪数据用FlowJ_V10软件分析,免疫印迹试验(Western Blot)数据用Image J进行灰度分析。以上数据均使用GraphPad Prism5软件统计整理。组间比较采用t检验,P<0.05表示差异有统计学意义。
2 结果本研究将携带shRNA的片段克隆进pLMPd-Ametrine质粒后转染plat-E细胞,获得反转录病毒。用病毒上清液对VSV特异性B细胞进行2次离心感染,最终可获得30%以上的转导效率。这些B细胞过继转移至预先感染VSV的小鼠后可强烈增殖和分化。转导靶向B细胞分化过程中重要抗凋亡转录因子Bcl6的shRNA导致分化过程中转导B细胞数量减少。
2.1 CD180抗体能刺激原代B细胞大量增殖并维持其自身属性B细胞增殖后在体外进行转导,然后过继转移到小鼠体内再分化,是鉴定目的基因功能的理想方法。但是目前很多体外培养系统在刺激B细胞增殖的同时,也会使B细胞进一步分化为浆细胞[10]。CD180为Toll样蛋白[25],本研究发现CD180抗体刺激可使B细胞相同程度地形成集落增殖灶(结果未显示),且活化标志物CD80、CD86的表达显著高于未接受刺激的B细胞(图 1A); 尽管经脂多糖(LPS)刺激的B细胞能被激活并增殖(图 1A),但是约有30%的CD138表达阳性,即分化为浆细胞,而α-CD180激活的B细胞则未见明显分化(图 1B)。因此,本研究通过CD180抗体刺激成功构建了原代B细胞的体外培养系统,在这一培养系统中B细胞可在维持B细胞自身属性的情况下强烈增殖。
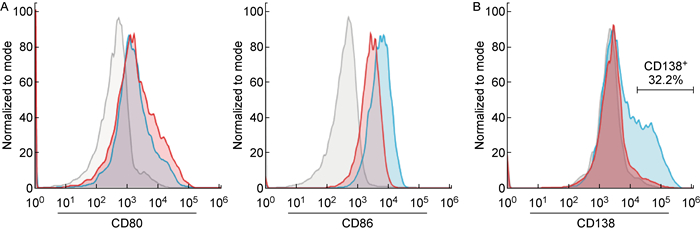
|
| A: Relative expression of B-cell surface markers (CD80 and CD86) on B cells following cultured 24 h with α-CD180 or LPS. B: Relative expression of plasma cell surface markers (CD138) of cultured B cells following cultured 72 h with α-CD180 or LPS (Gray: Naive B cell. Blue: Stimulated with LPS. Red: Stimulated with α-CD180). 图 1 CD180抗体刺激后B细胞体外活化和分化情况 Fig. 1 B cell activation and differentiation after α-CD180 stimulates in vitro |
制备高滴度的反转录病毒是高效转导的前提[26]。包装shRNA的反转录病毒转录后产生的RNA因携带发卡结构而易被plat-E包装细胞中的Drosha酶切割,使得病毒滴度极大降低[24]。为消除细胞内Drosha酶对反转录病毒RNA稳定性的影响,在转染pLMpd-Ametrine的同时,共转染了不同浓度的Drosha酶特异性siRNA,浓度在10~100 pmol均可有效敲低plat-E细胞中Drosha酶的表达(图 2A)。进一步将由共转染Drosha酶特异性siRNA所获得的反转录病毒感染B细胞,发现共转染20 pmol Drosha酶特异性siRNA可使B细胞获得较高的感染效率(图 2B、C)。因此,通过在病毒包装细胞中干扰Drosha酶的表达解决了表达shRNA的反转录病毒滴度较低的问题。

|
| A: Efficiency of Drosha specific siRNA was detected by Western Blot in plat E cells. B and C: Transduction efficiency of B cells using retrovirus packaged without or with gradient concentration of Drosha specific siRNA during transfection. Transduced B cell showed as Ametrine+. 图 2 反转录病毒包装载体共转染Drosha酶特异性siRNA对B细胞转导效率的影响 Fig. 2 Co-transfection of Drosha enzyme-specific siRNA with retroviral packaging vector improves B cell transduction efficiency |
与原代T细胞相比,B细胞在体外很难被病毒有效转导。T细胞在体外单次离心感染即可获得30%以上的感染效率[8],而原代B细胞单次感染效率非常低。本研究尝试重复离心感染以提高B细胞的感染效率,结果发现重复离心感染使B细胞转导效率在共转Drosha酶特异性siRNA的基础上约增加1倍,即从现有的5%~15%提高到30%以上(图 3)。
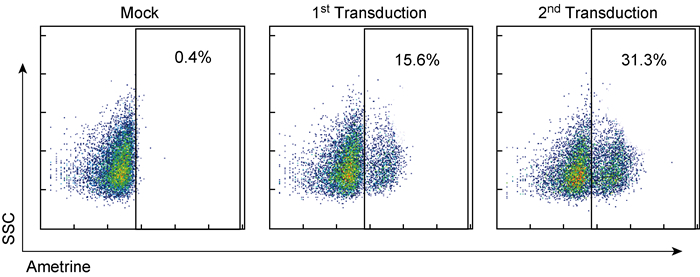
|
| Transduced B cell showed as Ametrine+. 图 3 B细胞1次和2次感染后的转导效率 Fig. 3 Transduction efficiency of B cells after once and twice infections |
VI10小鼠繁殖较为困难,因此B细胞体外转导后,如何尽可能少地过继转移B细胞是提升实验效率的关键环节[27]。VI10YEN小鼠的B细胞特异性识别VSV抗原,过继转移至野生型受体小鼠后,可在VSV感染时强烈增殖和分化,最终产生特异性抗体[28]。以往研究都是在过继转移的同时或之后用VSV感染受体鼠,考虑到B细胞增殖和分化是一个连续的过程,本实验尝试在VSV预先感染受体鼠后再过继转移病毒转导的B细胞。如图 4所示,在过继转移前预先感染VSV的小鼠(pre-infection)脾脏中,可检测到的VI10YEN B细胞数量持续高于过继转移同时感染(syn-infection)的小鼠。因此,受体鼠预感染可收获更多增殖、分化的B细胞以供后续表型分析,如此极大节省了实验材料并减轻了工作量。
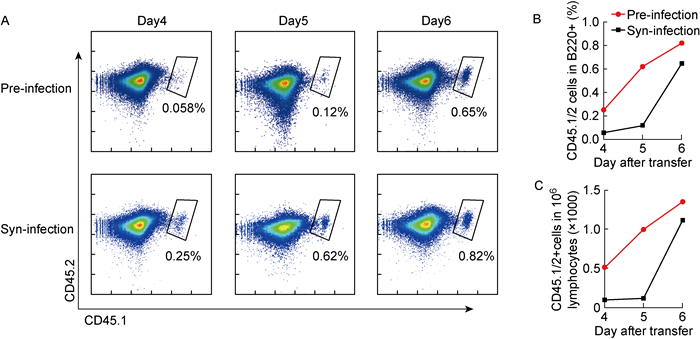
|
| A: VI10 B cells (CD45.1/2) were transferred to pre-infected mice(Pre-infection) or to mice infect VSV simultaneously (Syn-infection). Detect the CD45.1/2 cells at different time points. B: The proportion and total number of CD45.1/2 cells in all lymphocytes (100, 000 total) are shown in (B) and (C), respectively. 图 4 体外活化的VI10 B细胞在体内增殖的情况 Fig. 4 Proliferation of activated VI10 B cells in vivo after transfer |
经过以上环节的优化,用NIH/3T3细胞在体外筛选得到了2个有效敲低B细胞抗凋亡分子Bcl6的shRNA(图 5A)。使用相同方法转导B细胞后将其过继转移至受体鼠,6 d后进行检测,实验流程如图 5B。发现过继转移前后,转导Bcl6 shRNA的VI10YEN B细胞(Ametrine阳性)与对照shRNA相比在总过继转移的B细胞中占比稍有下降,但在免疫6 d后,其比例下降尤其显著(图 5C),3次实验结果显示差异有统计学意义(图 5D)。这一结果与之前报道的Bcl6在B细胞分化过程中抗凋亡的作用相一致[19]。
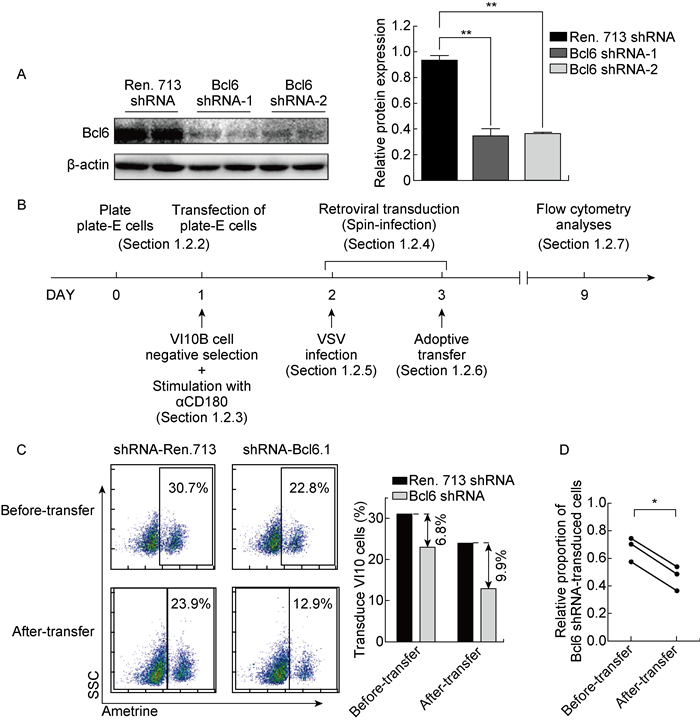
|
| A: Expression of Bcl6 in transduced NIH/3T3 cells was detected by Western Blot **:P < 0.001. B: Schematic diagram of the experiment. C: Analysis of transduced cells proportion before and after adoptive transfer. D: Proportion of Bcl6 shRNA-transduced cells relative to Ren.713 shRNA-transduced cells. *:P < 0.05 图 5 Bcl6表达水平检测及转导B细胞过继转移前后占比的变化 Fig. 5 Bcl6 expression detection and Proportion changes of transduced B cells before and after adoptive transfer |
为探究抗病毒体液免疫反应中众多未被阐明的基因功能,本研究构建了一种通过反转录病毒转导的shRNA对原代B细胞进行功能基因敲低的方法。通过共转染Drosha酶特异性siRNA制备携带shRNA的反转录病毒,2次离心感染CD180抗体激活的VSV特异性原代B细胞,最终可获得约30%的转导效率。这些转导细胞在过继转移至预先使用VSV感染的C57BL/6小鼠后可在体内增殖、分化并表现出目的基因敲低的表型。
本研究提供的原代B细胞转导方法相较之前的研究有以下几个方面的改进。①为提高含有shRNA的反转录病毒RNA的稳定性,在包装病毒时共转染了Drosha酶特异性siRNA,这可以显著提高B细胞的转导效率。②对维持B细胞增殖活化的刺激剂进行了改进。B细胞只有在增殖的情况下才能被反转录病毒感染,目前激活B细胞的方式有LPS、IL4+CD40L、anti-IgM F(ab) BCR交联以及CD180抗体与B细胞共培养[10],但只有CD180抗体是较为合适的刺激剂[25],它可以在体外通过Toll样受体(toll-like receptor,TLR)4有效激活B细胞并维持B细胞存活,但不使其分化为浆细胞,适用于体外激活原代B细胞; 值得注意的是,高营养的培养基也对原代B细胞增殖至关重要[29]。③对B细胞而言,离心感染2次可显著提高其转导效率。④为保持B细胞在体内最大的增殖能力,对VSV感染小鼠和过继转移细胞的先后次序进行了探究。结果表明,预先免疫可使过继转移的B细胞有更强烈的增殖,也可获得更多数量的转导B细胞以供分析。这可能是由于预先感染VSV可激活体内其他辅助细胞,如CD4+ T细胞等,为B细胞的增殖和分化提供了必要的辅助因子。
综上所述,通过对以上步骤的改良,系统地建立了一种有效敲低原代B细胞中目的基因表达以快速鉴定基因功能的方法。该方法可用于B细胞增殖、分化过程中基因功能的鉴定,也可作为较大规模基因敲除小鼠构建前功能基因的初步筛选,为研究病毒感染中B细胞的增殖、分化机制及其存在的缺陷打下了良好基础。
| [1] |
Zhang Y, Xiao M, Zhang S, Xia P, Cao W, Jiang W, Chen H, Ding X, Zhao H, Zhang H, Wang C, Zhao J, Sun X, Tian R, Wu W, Wu D, Ma J, Chen Y, Zhang D, Xie J, Yan X, Zhou X, Liu Z, Wang J, Du B, Qin Y, Gao P, Qin X, Xu Y, Zhang W, Li T, Zhang F, Zhao Y, Li Y, Zhang S. Coagulopathy and antiphospholipid antibodies in patients with Covid-19[J]. N Engl J Med, 2020, 382(17): e38.
[DOI]
|
| [2] |
Krammer F. The human antibody response to influenza A virus infection and vaccination[J]. Nat Rev Immunol, 2019, 19(6): 383-397.
[DOI]
|
| [3] |
Vyas AK, Jindal A, Hissar S, Ramakrishna G, Trehanpati N. Immune balance in hepatitis B infection: present and future therapies[J]. Scand J Immunol, 2017, 86(1): 4-14.
[DOI]
|
| [4] |
Murin CD, Wilson IA, Ward AB. Antibody responses to viral infections: a structural perspective across three different enveloped viruses[J]. Nat Microbiol, 2019, 4(5): 734-747.
[DOI]
|
| [5] |
Anastasov N, Klier M, Koch I, Angermeier D, Höfler H, Fend F, Quintanilla-Martinez L. Efficient shRNA delivery into B and T lymphoma cells using lentiviral vector-mediated transfer[J]. J Hematop, 2009, 2(1): 9-19.
[DOI]
|
| [6] |
Davis RE, Ngo VN, Lenz G, Tolar P, Young RM, Romesser PB, Kohlhammer H, Lamy L, Zhao H, Yang Y, Xu W, Shaffer AL, Wright G, Xiao W, Powell J, Jiang JK, Thomas CJ, Rosenwald A, Ott G, Muller-Hermelink HK, Gascoyne RD, Connors JM, Johnson NA, Rimsza LM, Campo E, Jaffe ES, Wilson WH, Delabie J, Smeland EB, Fisher RI, Braziel RM, Tubbs RR, Cook JR, Weisenburger DD, Chan WC, Pierce SK, Staudt LM. Chronic active B-cell-receptor signalling in diffuse large B-cell lymphoma[J]. Nature, 2010, 463(7277): 88-92.
[DOI]
|
| [7] |
Choi YS, Crotty S. Retroviral vector expression in TCR transgenic CD4+ T cells[J]. Methods Mol Biol, 2015, 1291: 49-61.
[URI]
|
| [8] |
Kurachi M, Kurachi J, Chen Z, Johnson J, Khan O, Bengsch B, Stelekati E, Attanasio J, McLane LM, Tomura M, Ueha S, Wherry EJ. Optimized retroviral transduction of mouse T cells for in vivo assessment of gene function[J]. Nat Protoc, 2017, 12(9): 1980-1998.
[DOI]
|
| [9] |
Costa GL, Benson JM, Seroogy CM, Achacoso P, Fathman CG, Nolan GP. Targeting rare populations of murine antigen-specific T lymphocytes by retroviral transduction for potential application in gene therapy for autoimmune disease[J]. J Immunol, 2000, 164(7): 3581-3590.
[DOI]
|
| [10] |
Lin KI, Calame K. Introduction of genes into primary murine splenic B cells using retrovirus vectors[J]. Methods Mol Biol, 2004, 271: 139-148.
[URI]
|
| [11] |
Yang Z, Allen CDC. Expression of exogenous genes in murine primary B cells and B cell lines using retroviral vectors[J]. Methods Mol Biol, 2018, 1707: 39-49.
[URI]
|
| [12] |
Khairnar V, Duhan V, Maney SK, Honke N, Shaabani N, Pandyra AA, Seifert M, Pozdeev V, Xu HC, Sharma P, Baldin F, Marquardsen F, Merches K, Lang E, Kirschning C, Westendorf AM, Häussinger D, Lang F, Dittmer U, Küppers R, Recher M, Hardt C, Scheffrahn I, Beauchemin N, Göthert JR, Singer BB, Lang PA, Lang KS. CEACAM1 induces B-cell survival and is essential for protective antiviral antibody production[J]. Nat Commun, 2015, 6: 6217.
[DOI]
|
| [13] |
Xiao N, Eto D, Elly C, Peng G, Crotty S, Liu YC. The E3 ubiquitin ligase Itch is required for the differentiation of follicular helper T cells[J]. Nat Immunol, 2014, 15(7): 657-666.
[DOI]
|
| [14] |
Chen R, Belanger S, Frederick MA, Li B, Johnston RJ, Xiao N, Liu YC, Sharma S, Peters B, Rao A, Crotty S, Pipkin ME. In vivo RNA interference screens identify regulators of antiviral CD4+ and CD8+ T cell differentiation[J]. Immunity, 2014, 41(2): 325-338.
[URI]
|
| [15] |
Morita S, Kojima T, Kitamura T. Plat-E: an efficient and stable system for transient packaging of retroviruses[J]. Gene Ther, 2000, 7(12): 1063-1066.
[DOI]
|
| [16] |
Hangartner L, Senn BM, Ledermann B, Kalinke U, Seiler P, Bucher E, Zellweger RM, Fink K, Odermatt B, Bürki K, Zinkernagel RM, Hengartner H. Antiviral immune responses in gene-targeted mice expressing the immunoglobulin heavy chain of virus-neutralizing antibodies[J]. Proc Natl Acad Sci USA, 2003, 100(22): 12883-12888.
[DOI]
|
| [17] |
Kalinke U, Bucher EM, Ernst B, Oxenius A, Roost HP, Geley S, Kofler R, Zinkernagel RM, Hengartner H. The role of somatic mutation in the generation of the protective humoral immune response against vesicular stomatitis virus[J]. Immunity, 1996, 5(6): 639-652.
[DOI]
|
| [18] |
Bergthaler A, Flatz L, Verschoor A, Hegazy AN, Holdener M, Fink K, Eschli B, Merkler D, Sommerstein R, Horvath E, Fernandez M, Fitsche A, Senn BM, Verbeek JS, Odermatt B, Siegrist CA, Pinschewer DD. Impaired antibody response causes persistence of prototypic T cell-contained virus[J]. PLoS Biol, 2009, 7(4): e1000080.
[DOI]
|
| [19] |
Phan RT, Dalla-Favera R. The BCL6 proto-oncogene suppresses p53 expression in germinal-centre B cells[J]. Nature, 2004, 432(7017): 635-639.
[DOI]
|
| [20] |
Milner JJ, Toma C, Yu B, Zhang K, Omilusik K, Phan AT, Wang D, Getzler AJ, Nguyen T, Crotty S, Wang W, Pipkin ME, Goldrath AW. Runx3 programs CD8+ T cell residency in non-lymphoid tissues and tumours[J]. Nature, 2017, 552(7684): 253-257.
[DOI]
|
| [21] |
Zuber J, McJunkin K, Fellmann C, Dow LE, Taylor MJ, Hannon GJ, Lowe SW. Toolkit for evaluating genes required for proliferation and survival using tetracycline-regulated RNAi[J]. Nat Biotechnol, 2011, 29(1): 79-83.
[DOI]
|
| [22] |
Paddison PJ, Cleary M, Silva JM, Chang K, Sheth N, Sachidanandam R, Hannon GJ. Cloning of short hairpin RNAs for gene knockdown in mammalian cells[J]. Nat Methods, 2004, 1(2): 163-167.
[DOI]
|
| [23] |
Brandl A, Wittmann J, Jäck HM. A facile method to increase titers of miRNA-encoding retroviruses by inhibition of the RNaseⅢ enzyme Drosha[J]. Eur J Immunol, 2011, 41(2): 549-551.
[DOI]
|
| [24] |
Park HH, Triboulet R, Bentler M, Guda S, Du P, Xu H, Gregory RI, Brendel C, Williams DA. DROSHA knockout leads to enhancement of viral titers for vectors encoding miRNA-adapted shRNAs[J]. Mol Ther Nucleic Acids, 2018, 12: 591-599.
[DOI]
|
| [25] |
Kikuchi J, Kuroda Y, Koyama D, Osada N, Izumi T, Yasui H, Kawase T, Ichinohe T, Furukawa Y. Myeloma cells are activated in bone marrow microenvironment by the CD180/MD-1 complex, which senses lipopolysaccharide[J]. Cancer Res, 2018, 78(7): 1766-1778.
[DOI]
|
| [26] |
Chang K, Marran K, Valentine A, Hannon GJ. Packaging shRNA retroviruses[J]. Cold Spring Harb Protoc, 2013, 2013(8): 734-737.
[DOI]
|
| [27] |
Siekevitz M, Kocks C, Rajewsky K, Dildrop R. Analysis of somatic mutation and class switching in naive and memory B cells generating adoptive primary and secondary responses[J]. Cell, 1987, 48(5): 757-770.
[DOI]
|
| [28] |
Hangartner L, Zinkernagel RM, Hengartner H. Antiviral antibody responses: the two extremes of a wide spectrum[J]. Nat Rev Immunol, 2006, 6(3): 231-243.
[DOI]
|
| [29] |
Haniuda K, Nojima T, Kitamura D. In vitro-induced germinal center B cell culture system[J]. Methods Mol Biol, 2017, 1623: 125-133.
|
 2020, Vol. 15
2020, Vol. 15


