戊型肝炎病毒(hepatitis E virus, HEV)主要经粪-口途径传播,通常引起急性病毒性肝炎。其临床症状类似于甲型肝炎,但病死率高。流行病学调查显示,HEV在世界各地广泛流行[1]。我国是HEV的高发地区,对献血志愿者中的抗HEV IgG筛查结果显示,阳性率约为23%~40%[2-3]。Nimgaonkar等[1]的研究提示,HEV还可以通过胎盘垂直传播以及输血传播。在一些抵抗力低下的特殊人群中,如器官移植者、免疫缺陷者等,戊型肝炎还可能发展为慢性肝炎。
目前,发现的HEV主要基因型有1~4型、兔HEV、禽HEV以及鼠HEV等[4]。我国人群中流行的主要为HEV 1型和4型,其中HEV 1型只能感染人,HEV 4型为人畜共患,猪是其主要宿主[5]。近年来,我国新增的戊型肝炎患者多为HEV 4型。HEV为正链单链RNA病毒,虽然经由粪便排出的病毒颗粒不具有包膜,但最近的研究提示患者血液中的病毒颗粒以及细胞培养产生的病毒均具有包膜形式[6]。
HEV分离至今已有30余年,但由于缺乏稳定的体外培养系统,其感染细胞的机制尚未研究清楚[7]。PLC/PRF/5细胞(人肝癌亚历山大细胞)是目前国内外最常用的HEV培养用细胞系,有研究提示氯化镁的加入可以促进PLC/PRF/5细胞产生病毒[7]。另外,乙型肝炎病毒(hepatitis B virus, HBV)、丙型肝炎病毒(hepatitis C virus, HCV)与肝细胞的结合也在一定程度上具有钙离子依赖性[8-9]。本研究通过改变该培养体系中的钙离子、镁离子含量,观察2种离子对于HEV结合细胞以及HEV感染后PLC/PRF/5细胞产生病毒的影响,期望增加病毒产量,以提高获得病毒的效率,为研究病毒发病机制提供实验数据和工具。
1 材料与方法 1.1 细胞及毒株PLC/PRF/5细胞来源于美国模式培养物集存库(American Type Culture Collection,ATCC),由中国食品药品检定研究院细胞资源保藏中心保藏。将PLC/PRF/5细胞置于37 ℃、5%CO2的孵育箱中,用含有10%胎牛血清(fetal bovine serum,FBS)+1%青、链霉素的最低必需培养基(minimum essential medium,MEM)培养。用0.25%胰酶+乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)消化细胞进行传代,维持细胞指数生长。实验中所用HEV为本室分离的4型HEV,来源于人体粪便,经由PLC/PRF/5细胞培养扩增后,收获培养上清液为毒种(GenBank Acc No:AJ272108)。
1.2 主要试剂MEM购自中国浙江吉诺生物公司。胎牛血清购自美国Hyclone公司。HEV抗原检测试剂盒(酶联免疫法)购自北京万泰生物药业有限公司。病毒基因组DNA/RNA快速提取试剂盒购自北京庄盟生物科技有限公司。戊型肝炎核酸检测试剂盒(荧光定量PCR法)购自北京金豪制药股份有限公司。
1.3 PLC/PRF/5细胞病毒感染实验将PLC/PRF/5细胞铺于24孔板中,待细胞密度达到80%~90%时,加入HEV毒种(RNA浓度1×106拷贝/mL),并换用含2% FBS的MEM。同时在钙离子实验组加入20 mmol/L CaCl2;在镁离子实验组加入30 mmol/L MgCl2;混合实验组同时加入20 mmol/L CaCl2和30 mmol/L MgCl2;在金属离子螯合剂EDTA组加入10 mmol/L EDTA;在乙二醇二乙醚二胺四乙酸(ethylene glycol tetraacetic acid, EGTA)组加入10 mmol/L EGTA;对照组除加入病毒外,不进行其他处理。分别于感染1 h和24 h时,将细胞用无血清MEM洗5遍,收获细胞,提取细胞内核酸,检测细胞内HEV核酸含量。另于感染24 h后,用无血清MEM洗5遍,加入新鲜的维持培养基于37 ℃、5%CO2的孵育箱中培养。之后每7 d换1次培养液,从2周起收取上清液,检测细胞培养上清液中HEV的核酸含量和开放读码框(open reading frame,ORF)2蛋白含量。
1.4 HEV抗原(ORF2)检测按照HEV抗原检测试剂盒说明书进行,步骤如下:在预包被的96孔板中,按100 μL/孔加入待测样品和阴性、阳性对照,于37 ℃孵育1 h。以磷酸盐吐温缓冲液(phosphate buffered saline with Tween-20,PBST)为洗液,用洗板机洗板5次后,加入酶标试剂100 μL/孔,于37 ℃孵育30 min。再次洗板5次后,加入显色液A和B(各50 μL/孔),混匀后于37 ℃孵育15 min。加入终止液(50 μL/孔),混匀后用酶标仪读数(吸光度值,A450)。计算S/Co值,即待测样品A值/阴性对照平均值。
1.5 HEV核酸检测首先,按照病毒基因组提取试剂盒说明书进行病毒核酸提取。分别向200 μL的病毒上清液或全细胞混悬液中加入400 μL裂解液,充分涡旋振荡混匀后,加入450 μL无水乙醇,振荡混匀并加入吸附柱中,13 000转/min离心1 min。分别加入500 μL去蛋白液漂洗1次,漂洗液漂洗2次后,13 000转/min离心2 min,弃尽残余液,加30 μL无RNA酶的水洗脱获得病毒RNA。接着用HEV RNA荧光PCR检测试剂盒进行RNA定量检测。主要步骤如下:在无核酸酶的离心管中先后加入20 μL×n的HEV反应液,0.60 μL×n的Taq聚合酶,0.20 μL×n的反转录酶(n为待反应管数+1),振荡混匀后13 000 rpm离心30 s,以20 μL/管分装至荧光PCR专用检测管。向检测管中分别加入10 μL待检测RNA,放入荧光PCR仪中进行检测。RNA反转录及变性后,先经过5个循环的预扩增,再进行扩增并于55 ℃收集羧基荧光素(carboxyfluorescein)荧光信号。该方法为本研究室前期建立,扩增ORF 3蛋白,引物为F: 5′-CGGTGGTTTCTGGGGT-GA-3′,R: 5′-GCGAAGGGGTTGG-TTGGA-3′;探针为5′-FAM-TGATTCTCAGCCCTTCGCT-AMRA-3′。实验中采用pcDNA3.1-ORF 3质粒作为阳性对照质粒[10]。
1.6 统计学方法用Graphpad prism 8进行作图及统计学分析,数值以均数±SEM的形式表示。用单因素方差(ANOVA)分析及t检验比较各实验组与对照组间的差异。P < 0.05代表有显著性差异。
2 结果 2.1 钙离子和镁离子促进HEV结合进入细胞细胞内HEV RNA检测结果显示,病毒加入1 h后,钙离子实验组与对照组相比,细胞内HEV核酸拷贝数由2.1×104/mL增加到1.65×105/mL,增加了7.8倍(见图 1A)。病毒加入24 h后,细胞内HEV的拷贝数由1.3×105/mL增加到1.11×106/mL,增加了8.2倍(见图 1B)。该结果提示,CaCl2能够促进HEV感染细胞。同样,镁离子实验组在感染HEV 1 h后,细胞内HEV的核酸拷贝数为7.0×104/mL,与对照组相比增加了3.3倍(见图 1A)。24 h后细胞内核酸拷贝数为2.9×105/mL,与对照组相比增加了2.1倍(见图 1B)。镁离子对于HEV感染细胞的促进作用弱于钙离子。此外,试验设立了金属离子螯合剂EDTA组和EGTA组。细胞内HEV RNA检测结果显示,病毒加入1 h后,EGTA组与对照组相比细胞内HEV核酸拷贝数几乎不变,而EDTA组细胞内HEV拷贝数增加了3.0倍(见图 1A)。病毒加入24 h后, EGTA组细胞内HEV的拷贝数由1.3×105/mL降低到4.0×104/mL,而EDTA组降低到3.0×104/mL,均降低了约2/3(见图 1B)。该结果显示金属离子螯合剂能够抑制HEV感染,间接支持钙离子、镁离子促进HEV感染细胞的作用。
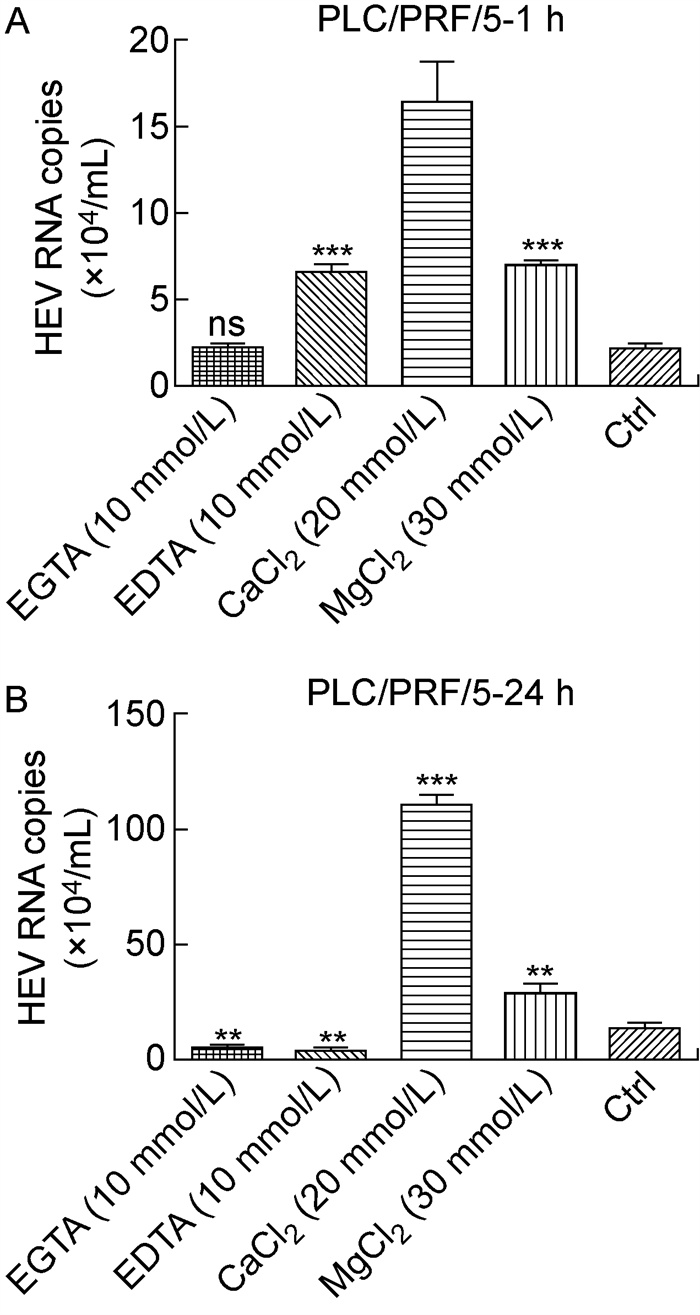
|
| After PLC/PRF/5 cells were incubated with HEV for 1 hour (A) or 24 hours (B), the copies of HEV nucleic acid in the cells were detected by qPCR. t-test was used to analyze the difference between the test group and the control group. *P<0.05, **P<0.01, ***P < 0.005, and ns for no significant difference. 图 1 钙离子、镁离子及金属螯合剂对HEV进入PLC/PRF/5细胞的影响 Fig. 1 Effect of calcium, magnesium and metal chelators on HEV entering PLC/PRF/5 cells |
为了观察钙离子、镁离子对于PLC/PRF/5细胞的长期影响,在实验组HEV感染细胞的维持培养液中加入钙离子(20 mmol/L CaCl2)或镁离子(30 mmol/L MgCl2),于感染后不同时期,收集细胞培养上清液分别检测HEV核酸含量以及ORF 2蛋白含量。结果显示,HEV感染后2周,钙离子实验组细胞培养上清液中的病毒拷贝数与对照组相比增加了3.0倍,且于感染后3~4周保持相同趋势(见图 2A)。与之相对应的是,酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)结果显示钙离子实验组ORF 2蛋白含量于感染后2周增加了3.0倍,且感染后2~5周该趋势保持不变(见图 2B)。同样,镁离子的加入也使得细胞培养上清液中的HEV核酸和ORF 2蛋白量有所增加,但其增加的程度不如钙离子组,分别为HEV核酸拷贝数增加了1.8倍(见图 2A),ORF 2蛋白分泌增加了1.7倍(见图 2B)。而在钙离子、镁离子混合实验组中,已感染HEV的PLC/PRF/5细胞扩增病毒的能力高于镁离子组,但是不如钙离子组(见图 2A和2B)。该结果提示钙离子、镁离子对于HEV感染后长期培养的PLC/PRF/5细胞的产毒能力均具有促进作用,其中钙离子的作用强于镁离子,但二者并无协同作用。采用ANOVA分析提示,无论是荧光定量PCR检测HEV核酸拷贝数(P=0.033 9),还是ELISA检测ORF 2蛋白含量(P=0.006 6),各实验组结果与对照组相比都具有统计学差异(P < 0.05)。
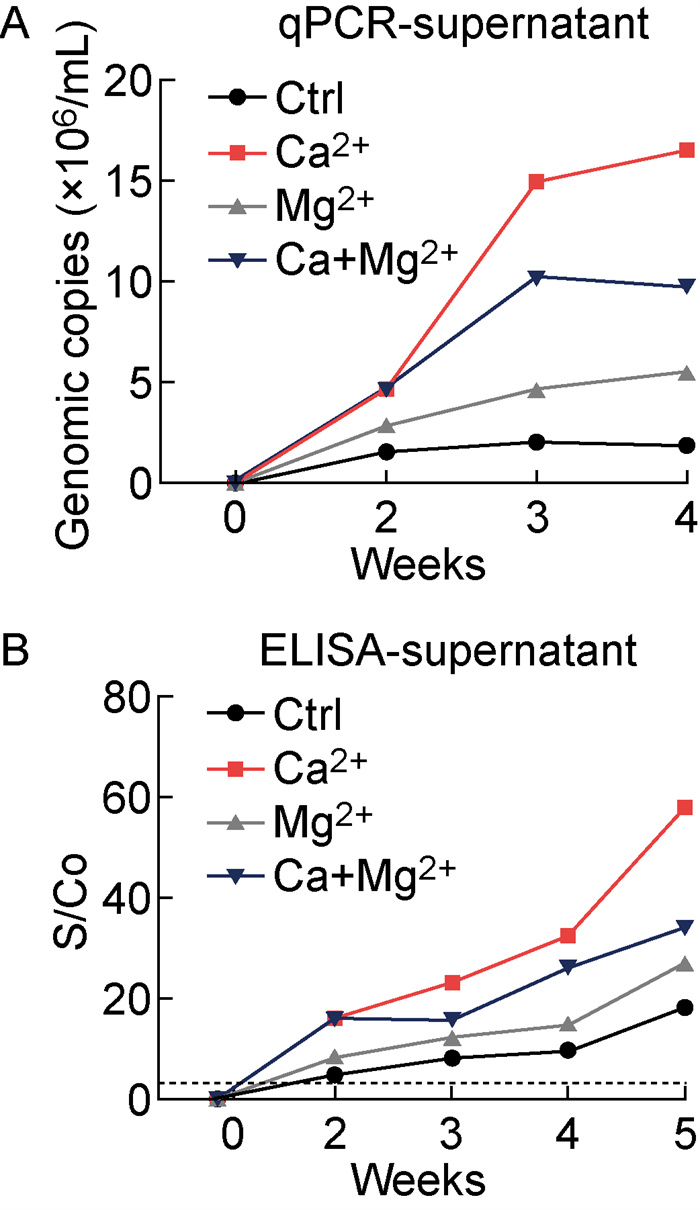
|
| The examination of HEV virus level in the supernatant of PLC/PRF/5 cells at different stages after HEV infection. A: qPCR results of copies of HEV nucleic acid. B. ELISA results of HEV ORF2 protein. 图 2 钙离子、镁离子对HEV在长期培养的PLC/PRF/5细胞中生长的影响 Fig. 2 Effect of calcium and magnesium on HEV production in long-term cultured PLC/PRF/5 cells |
高效稳定的体外培养体系是研究HEV结构、特性及致病机制的基础。自HEV被发现以来,科学家们曾多次尝试体外培养HEV,先后尝试了一些细胞系包括2BS、A549、HepG2以及非人灵长类的原代肝细胞,但一直很难获得较高滴度的HEV[11]。直到2007年,日本科学家Okamoto等[12]首次在PLC/PRF/5细胞及A549细胞中成功培养了来自人粪便的3型HEV病毒株HE-JF5/15F。此后,该研究小组利用相同体系先后从暴发性肝病患者粪便中成功分离培养了HEV 4型病毒,从1、3和4型HEV患者血清中分别分离出相应型别的HEV[13]。
Purcell等[14]对HEV培养进行了探索,该课题组并不能很好地重复Okamoto等的研究成果,但建立了以HepG2细胞为基础的培养体系,并成功构建了感染性克隆,发现了一段包含174个核苷酸的来自人核糖体蛋白的插入序列,这对于HEV的适应性培养至关重要。
本课题组在借鉴前期研究结果的基础上,成功培养了来自恒河猴粪便的4型HEV,发现在低血清情况下,PLC/PRF/5细胞处于不增殖的状态,细胞的形态和生长状态亦无明显变化。在低血清维持培养基培养1个月左右,可在培养上清液中检测到HEV。通过对病毒接种浓度、接种时间、接种温度和培养基成分的探索,对培养条件做了进一步的优化。优化后,病毒可以被检测到的时间为感染后15~21 d,病毒分泌高峰时上清液中HEV RNA浓度可高达1×108拷贝/mL[15]。而本研究则在此基础上探讨钙、镁离子的作用。结果显示,HEV感染细胞后1~24 h,钙离子、镁离子的加入能够促进病毒与细胞的结合。HEV感染后2~5周,钙离子、镁离子均能够增加PLC/PRF/5细胞培养上清液中产生的病毒,其中钙离子的促进作用更加显著。结果提示,钙离子、镁离子对于HEV感染后长期培养的PLC/PRF/5细胞的产毒能力均具有促进作用,其中钙离子的作用强于镁离子,但二者无协同作用。
钙离子作为细胞内的第二信使,能与多种钙结合通道及受体结合,发挥信号传导等非常重要的作用[16]。本课题组前期发现的能够促进HEV感染细胞的辅助性受体去唾液酸糖蛋白受体(asialoglycoprotein receptor,ASGPR), 即为钙依赖受体,钙离子的存在为该受体发挥作用所必需。钙离子通过增强该受体发挥作用,可能是其促进HEV感染细胞的原因之一[17]。另有研究报道,钙离子可以通过促进HBV核心蛋白的组装来提高HBV在细胞内的复制能力[18]。但钙离子在HEV的复制过程中是否也通过类似机制发挥促进作用,仍须实验证明。
EDTA与EGTA同为金属离子螯合剂,能够结合游离的钙离子、镁离子,阻止它们与细胞的结合。本研究发现,在加入后1 h,EDTA能促进HEV结合细胞。而加入24 h后,EGTA与EDTA均能够抑制HEV与PLC/PRF/5细胞的结合。原因可能与EDTA和EGTA的作用机制不同相关。EGTA具有相对较强的钙离子结合能力,而其结合镁离子的能力弱于EDTA。另外,二者都能结合其他金属离子,因此不排除钙离子、镁离子外其他金属离子对HEV感染细胞的影响。
综上所述,本研究发现在HEV细胞培养体系中加入钙离子和镁离子,不仅能在病毒感染早期增加病毒与细胞的吸附、进入,还能在被感染细胞的长期培养过程中,促进病毒的产生,且钙离子的作用强于镁离子。这一结果不仅解释了文献报道的HEV培养基中添加镁离子的原因,也为今后HEV培养体系的优化提供了新的线索和依据。然而钙离子、镁离子发挥作用的机制以及离子浓度的进一步优化仍有待深入研究。
| [1] |
Nimgaonkar I, Ding Q, Schwartz RE, Ploss A. Hepatitis E virus: advances and challenges[J]. Nat Rev Gastroenterol Hepatol, 2018, 15(2): 96-110.
[DOI]
|
| [2] |
Denner J, Pischke S, Steinmann E, Blumel J, Glebe D. Why all blood donations should be tested for hepatitis E virus (HEV)[J]. BMC Infect Dis, 2019, 19(1): 541.
[DOI]
|
| [3] |
张黎, 王佑春. 警惕输血引起的慢性戊型肝炎[J]. 传染病信息, 2013, 26(6): 327-330. [CNKI]
|
| [4] |
Kenney SP. The current host range of hepatitis E viruses[J]. Viruses, 2019, 11(5): 452.
[DOI]
|
| [5] |
Geng Y, Wang Y. Epidemiology of hepatitis E[J]. Adv. Exp Med Biol, 2016, 948: 39-59.
[DOI]
|
| [6] |
Qi Y, Zhang F, Zhang L, Harrison T J, Huang W, Zhao C, Kong W, Jiang C, Wang Y. Hepatitis E virus produced from cell culture has a lipid envelope[J]. PloS One, 2015, 10(7): e0132503.
[DOI]
|
| [7] |
Meister TL, Bruening J, Todt D, Steinmann E. Cell culture systems for the study of hepatitis E virus[J]. Antiviral Res, 2019, 163: 34-49.
[DOI]
|
| [8] |
Owada T, Matsubayashi K, Sakata H, Ihara H, Sato S, Ikebuchi K, Kato T, Azuma H, Ikeda H. Interaction between desialylated hepatitis B virus and asialoglycoprotein receptor on hepatocytes may be indispensable for viral binding and entry[J]. J Viral Hepat, 2006, 13(1): 11-18.
[DOI]
|
| [9] |
Saunier B, Triyatni M, Ulianich L, Maruvada P, Yen P, Kohn LD. Role of the asialoglycoprotein receptor in binding and entry of hepatitis C virus structural proteins in cultured human hepatocytes[J]. J Virol, 2003, 77(1): 546-559.
[DOI]
|
| [10] |
Zhao C, Li Z, Yan B, Harrison T J, Guo X, Zhang F, Yin J, Yan Y, Wang Y. Comparison of real-time fluorescent RT-PCR and conventional RT-PCR for the detection of hepatitis E virus genotypes prevalent in China[J]. J Med Virol, 2007, 79(12): 1966-1973.
[DOI]
|
| [11] |
Zhang F, Wang Y. HEV Cell Culture[J]. Adv Exp Med Biol, 2016, 948: 143-159.
[PubMed]
|
| [12] |
Tanaka T, Takahashi M, Kusano E, Okamoto H. Development and evaluation of an efficient cell-culture system for Hepatitis E virus[J]. J Gen Virol, 2007, 88(Pt 3): 903-911.
[URI]
|
| [13] |
Takahashi M, Tanaka T, Takahashi H, Hoshino Y, Nagashima S, Jirintai, Mizuo H, Yazaki Y, Takagi T, Azuma M, Kusano E, Isoda N, Sugano K, Okamoto H. Hepatitis E Virus (HEV) strains in serum samples can replicate efficiently in cultured cells despite the coexistence of HEV antibodies: characterization of HEV virions in blood circulation[J]. J Clin Microbiol, 2010, 48(4): 1112-1125.
[DOI]
|
| [14] |
Shukla P, Nguyen HT, Torian U, Engle RE, Faulk K, Dalton HR, Bendall RP, Keane FE, Purcell RH, Emerson SU. Cross-species infections of cultured cells by hepatitis E virus and discovery of an infectious virus-host recombinant[J]. Proc Natl Acad Sci U S A, 2011, 108(6): 2438-2443.
[DOI]
|
| [15] |
Zhang F, Qi Y, Harrison TJ, Luo B, Zhou Y, Li X, Song A, Huang W, Wang Y. Hepatitis E genotype 4 virus from feces of monkeys infected experimentally can be cultured in PLC/PRF/5 cells and upregulate host interferon-inducible genes[J]. J Med Virol, 2014, 86(10): 1736-1744.
[DOI]
|
| [16] |
Gaspers LD, Thomas AP. Calcium signaling in liver[J]. Cell Calcium, 2005, 38(3/4): 329-342.
[URI]
|
| [17] |
Zhang L, Tian Y, Wen Z, Zhang F, Qi Y, Huang W, Zhang H, Wang Y. Asialoglycoprotein receptor facilitates infection of PLC/PRF/5 cells by HEV through interaction with ORF2[J]. J Med Virol, 2016, 88(12): 2186-2195.
[DOI]
|
| [18] |
Choi Y, Gyoo Park S, Yoo J H, Jung G. Calcium ions affect the hepatitis B virus core assembly[J]. Virology, 2005, 332(1): 454-463.
[DOI]
|
 2021, Vol. 16
2021, Vol. 16


