2. 安徽医科大学微生物学教研室,安徽 合肥 230032
2. Department of Microbiology, Anhui Medical University, Hefei 230032, Anhui Province, China
炎症是多种疾病的病理学基础,其中病毒、细菌等多种病原微生物的感染是炎症最常见病因。目前临床上对于这些病原微生物感染导致的急、慢性炎症虽有激素和一些非甾体类抗炎药物进行有效地治疗与控制,但往往在取得一定疗效的同时也会给机体带来较大的副作用[1-2]。临床上还存在如病理性瘢痕、神经炎症、动脉粥样硬化和各种关节炎症等目前尚缺乏有效治疗手段的疾病。针对这一现状,人们逐渐开始寻找一种可以在有效缓解炎症的同时又不会对机体造成严重损害的药物。随着研究进展,发现肿瘤坏死因子α刺激基因/诱导蛋白-6(tumor necrosis factor alpha stimulated gene/inducible protein 6, TSG-6)在机体抗炎中发挥着重要作用,并引起高度重视。
TSG-6是Lee等[3]在筛选肿瘤坏死因子(tumor necrosis factor, TNF)干预的人纤维细胞cDNA表达文库时首次发现的一个基因。近年来,大量研究表明,该基因是一个具有保护性作用的炎性反应基因;TSG-6是该基因所编译的炎症相关的分泌蛋白,它在某些具有高度代谢活性的重要器官(如脑、胰腺的胰岛)或者受支配于环境刺激的组织(肺、皮肤)中呈组成性表达;在多种炎性疾病中发挥抗炎、细胞外基质重塑及保护局部微环境等作用。目前越来越多的证据表明,TSG-6可以直接影响组织细胞的基质结构,调节细胞外信号分子与基质相互作用,进而在炎症和组织保护中发挥效应。其功能的多样性来源于TSG-6能与许多配体结合,如糖胺聚糖(glycosaminoglycans, GAGs)、蛋白多糖(proteoglycan, PG)核心蛋白和其他基质成分。除此之外,它还能直接与多种趋化因子和骨形成蛋白(bone morphogenetic proteins, BMPs)结合,在关节炎症的修复过程中发挥着重要的作用[4-5]。近年研究发现,TSG-6在抑制病理性瘢痕形成,减轻神经系统的炎症反应以及抗动脉粥样硬化中也发挥着重要作用。本文主要就TSG-6在病理性瘢痕、神经炎症、动脉粥样硬化和关节炎中的作用作一综述,期望对临床抗炎治疗提供参考。
1 TSG-6的主要生物学特性tsg-6基因位于人染色体2q23.3,其mRNA全长1 440 bp,开放阅读框为77~910,编码1个由277个氨基酸残基组成的分泌性蛋白质,相对分子质量为35×103左右。TSG-6蛋白由短的N末端片段、相邻的Link和CUB(complement protein subcomponents C1r/C1s, urchin embryonic growth factor and bone morphogenetic protein 1)模块端区域组成;氨基酸序列在脊椎动物物种之间是非常保守的,例如人类和老鼠的tsg-6基因有大约93%的相似度[6]。虽然对于N末端或C末端区域没有可用的结构信息,但是Link和CUB模块的基本结构信息都已经被确定。Link模块位于TSG-6蛋白前体的第37~128氨基酸残基,由两个α螺旋和两个反向平行的β折叠绕着一个疏水核组成,属于连接组件超家族成员,可与透明质酸(hyaluronic acid, HA)、硫酸软骨素、蛋白多糖以及聚集蛋白聚糖的G1链结合[7]。CUB模块位于129~250氨基酸残基, 结构域高度保守,其功能尚不清楚。
研究表明,TSG-6主要通过它的Link区与HA和间-α-蛋白酶抑制剂(inter-α-inhibitor, IαI)结合进而发挥抗炎作用。IαI是一种丝氨酸蛋白酶抑制剂,含有3个多肽链,即重链1 (heavy chain 1, HC1)、重链2 (HC2)和bikunin链,其中bikunin链与IαI的抑制效应有关。TSG-6可以通过形成TSG-6·HC1和TSG-6·HC2中间体催化HC1和HC2向HA的转移,并通过形成的两种共价复合物提高IαI抗纤维蛋白溶酶活性,进而调节蛋白酶网络,参与炎症过程[8]。
2 TSG-6的抗炎作用及其机制目前已知TSG-6直接通过与HA结合促使HA更易与HA的结合蛋白(如CD44蛋白等)结合,进而发挥相应的抗炎作用。其中CD44是HA的主要细胞表面受体且广泛存在于多种细胞中,但CD44与HA结合功能受到严格的调控,因此它一般不与HA呈结构性结合。与CD44不同,TSG-6与HA有更高的亲和力,而且TSG-6与HA结合后会导致HA的构象发生改变,使得HA更易于与细胞表面的CD44相结合,并有利于介导淋巴细胞向炎症部位的迁移和黏附[9-10]。TSG-6的抗炎作用机制见图 1。
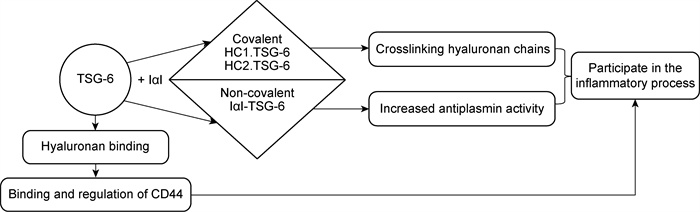
|
| 图 1 TSG-6的作用机制 Fig. 1 The mechanism of the function of TSG-6 |
近期的研究发现,TSG-6与CD44结合后通过两个方面发挥抗炎作用:一是通过其介导淋巴细胞向炎症部位移动;二是由CD44调节相关炎性因子的产生并激活相关信号通路启动抗炎效力。Kui等[11]采用体外人浆细胞样树突状细胞(plasmacytoid dendritic cells, pDCs)进行CD44阻断实验,以观察在此过程中TSG-6的下游信号通路发生的变化。结果发现,TSG-6可通过CD44抑制下游信号通路中干扰素调节因子-7(interferon regulatory factor-7, IRF-7)的磷酸化,进而抑制炎症细胞因子TNF-α和α干扰素(interferon-α,IFN-α) 的产生,导致炎症反应明显减弱。Choi等[12]曾在酵母聚糖诱导的老鼠腹膜炎模型中发现,TSG-6可通过与巨噬细胞表面的CD44受体相互作用后进入细胞,继之胞内形成的一种负反馈循环调节现象导致Toll样受体2 (Toll like receptor 2,TLR2)/核因子κB(nuclear factor-κB,NF-κB)信号通路活力减弱,最终使得酵母聚糖所诱导的一连串炎症级联反应逐渐消失,使受损组织得到了相应保护。
TSG-6由于其独特的抗炎作用被科研人员广泛用于各种当下难以解决的以炎症为主要病理学基础的疾病模型中,通过实验发现,TSG-6在修复病理性瘢痕,治疗神经炎症、动脉粥样硬化和各种关节炎症中都能起到很好的效果。经过进一步的探索,近期对于TSG-6发挥抗炎作用的具体机制也有了更明确的认识。这使得目前缺乏有效治疗手段的上述4种疾病有望有效地控制病情或者得到治愈。
2.1 TSG-6在修复病理性瘢痕中的作用皮肤伤口愈合过程中,由于炎症细胞和细胞因子(如IL-1β、IL-6和TNF-α)参与了炎症过度反应,促进成纤维细胞增殖和胶原沉积,导致病理性瘢痕形成[13]。近年研究表明,TSG-6能够抑制炎症反应中细胞因子的生成,并通过体内外实验进一步发现,TSG-6在病理性瘢痕的修复中发挥重要的作用。
Wang等[14]以兔耳模型进行研究并评价了TSG-6对瘢痕疙瘩成纤维细胞(keloid fibroblasts, KFs)的影响。他们在12只兔耳上作6个7 mm全厚度圆形伤口,并将TSG-6和磷酸盐缓冲液(phosphate buffer solution,PBS)(即空白对照)分别注射在右侧和左侧耳廓伤口内,检测KFs炎症因子IL-1β、IL-6、TNF-α及Ⅰ、Ⅲ型胶原表达的变化,并进一步评估TSG-6对病理性瘢痕形成的影响。结果显示,经TSG-6处理的KFs凋亡率增高,病理性瘢痕形成显著减少。除了动物模型,张苏文等[15]通过在体外培养人KFs细胞发现,培养液中加入TSG-6的KFs细胞增殖速度明显减慢,凋亡率也显著提高。进一步实验发现,TSG-6可能是通过抑制增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)基因表达以及促进细胞凋亡相关蛋白p53、caspase-3表达来实现这一作用。
为研究TSG-6抑制病理性瘢痕形成的具体机制,王佳妮等[16]将分离得到的KFs用重组人TSG-6(rhTSG-6)处理后发现,KFs的增殖明显受到抑制,细胞的凋亡率显著升高,并且细胞内的NF-κB DNA结合活性也明显降低。田小雨[17]等通过构建含TSG-6的重组质粒并转染相应的KFs发现,在TSG-6过表达组中细胞增殖减缓,凋亡显著增加;蛋白质印迹法(Western blotting)检测发现PI3K、Akt、MDM2、Bcl-2的mRNA及蛋白表达明显受到抑制。Li等[18]通过类似的实验方法发现,在经转染后表达TSG-6的KFs内自杀相关因子(factor associated suicide, Fas)、自杀相关因子配体(factor associated suicide ligand, FasL)以及半胱天冬酶的表达含量显著上升,这些物质能够促进细胞凋亡,进而达到瘢痕修复的目的。以上这些研究表明,TSG-6在病理性瘢痕修复中的作用涉及PI3K /Akt-Bcl-2、NF-κB、Fas/FasL等多条信号通路,使得相应的炎症细胞因子减少或促进细胞凋亡的物质增加从而起到修复瘢痕的作用,但这些信号通路在TSG-6影响下是否具有相应的协同作用还有待进一步探索。
2.2 TSG-6在抗神经炎症中的作用神经炎症是外伤性脑损伤、病毒性脑炎和细菌性脑膜炎等常见中枢神经系统疾病的重要病理过程。小神经胶质细胞是中枢神经系统中一类重要的免疫细胞,在启动和维持神经炎症反应中起着至关重要的作用。与巨噬细胞相似,小神经胶质细胞具有可塑性,可向经典的M1或M2表型分化[19]。M1型的小神经胶质细胞具有使炎性细胞因子水平增加(包括TNF-α、IL-1β、IL-6)、增加诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)和CD16水平的作用,这会加重神经元损伤,阻碍细胞修复。相反,M2型的小神经胶质细胞可以保护神经细胞,促进恢复和重塑[20]。Liu等[21]在体外建立脂多糖(lipopolysaccharide, LPS)诱导的BV2小神经胶质细胞(一种永生化的小鼠小胶质细胞,其经反转录病毒介导转染了v-raf/v-myc基因)[22]激活模型,证明了间充质干细胞(mesenchymal stem cells, MSCs)可以通过TSG-6调节小胶质细胞的激活,且TSG-6可以减弱活化的小胶质细胞的炎症级联反应。在此基础上,他们又通过进一步的实验证明了MSCs是通过分泌TSG-6促进小神经胶质细胞向M2型分化,从而具有抗神经炎症作用[23]。
早期炎症反应在脑梗死发生、发展过程中也起到关键作用。高迁移率族蛋白B1(high mobility group box-1 protein, HMGB1)是脑梗死早期重要的炎症介质之一,其通过激活Toll样受体4 (Toll like receptor 4, TLR4)可增加基质金属蛋白酶-9(matrix metallo proteinase-9, MMP-9)的表达量并放大炎症反应,加剧血-脑屏障损伤,促进神经功能恶化[24-25]。刘扬等[26]采用外源性补充TSG-6的方法,观察TSG-6对脑梗死小鼠模型早期炎症反应和血-脑屏障的影响。实验结果显示,TSG-6可显著减少HMGB1、TLR4表达和中性粒细胞浸润,进而减低MMP-9的表达发挥血-脑屏障保护作用,减轻脑水肿和脑梗死体积,促进神经功能的恢复。
2.3 TSG-6在抗动脉粥样硬化中的作用动脉粥样硬化是动脉壁损伤的慢性炎症反应。它以血管内皮损伤、单核细胞聚集并黏附于内皮细胞(endothelial cells, ECs)、巨噬细胞源性泡沫细胞的脂质沉积、血管平滑肌细胞(vascular smooth muscle cell, VSMCs)的迁移和增殖及细胞外基质(extracellular matrix, ECM)重构相伴随为特征[27]。TSG-6能抑制内皮细胞、中性粒细胞和巨噬细胞的炎症反应,抑制巨噬细胞泡沫细胞的形成和VSMCs的迁移和增殖[28-30]。
Watanabe等[31]发现非冠心病患者的正常冠状动脉和冠心病患者(没有发生狭窄)的冠状动脉里几乎都没有TSG-6的表达。但是在冠心病患者发生狭窄的冠状动脉中,TSG-6在动脉粥样硬化的纤维帽中高度表达。并经过进一步实验证明,TSG-6可通过降低血浆总胆固醇水平、ECs和巨噬细胞的炎症反应、巨噬细胞泡沫细胞的形成以及VSMCs的迁移和增殖来减缓动脉粥样硬化病变的发展,并通过降低巨噬细胞/VSMC比率(比率增加为斑块不稳定的标志)促进纤维帽中的VSMCs产生胶原蛋白来增加斑块的稳定性[32]。这为临床上动脉粥样硬化的治疗提供了又一种可行的方案。
2.4 TSG-6在抗关节炎症中的作用目前临床上常见的多种关节炎症已经成为使患者丧失劳动能力的主要疾病,给家庭和社会带来沉重的经济负担。但针对这些疾病的治疗手段匮乏,疗效不佳,并且还出现了激素滥用的现象。因此寻找新的有效的治疗方法迫在眉睫,近些年来TSG-6被广泛研究,其具有抗炎作用的蛋白功效受到众多科学家的重视。
Bayliss等[33]采用重组TSG-6作为抗原免疫产生的多克隆抗体对骨关节炎和类风湿关节炎的患者进行检测发现,关节炎患者的关节滑膜、软骨细胞以及周围基质中的TSG-6含量明显升高。Szánto和Bárdos等[34-35]将BALB/c系小鼠的TSG-6相关基因敲除后发现,这些小鼠发生由蛋白多糖诱导关节炎的严重程度明显增加,病程进展更加迅速。同时在发病的早期,其关节滑膜内的白细胞数以及血清中IL-6等炎性细胞因子的含量也明显高于没有敲除该基因的小鼠。并且随着损伤关节局部的炎性介质的增加,实验组体内的受累关节逐渐发生软骨降解、关节强直和畸形等现象。但通过给予病情较重的小鼠静脉注射重组鼠TSG-6后发现,其体内的关节水肿明显减轻,经过长期治疗后其体内的软骨损伤和骨质破坏都得到进一步的控制。由此判断,TSG-6在促使炎症局限以及保护软骨和骨质方面可以起到较好的效果。有研究发现,TSG-6在关节炎中发挥的作用具有双重性:一方面是保护性作用,它可以通过直接与NF- κ B受体活化因子配体(receptor activator of NF- κ B ligand, RANKL)结合来抑制关节炎中RANKL所诱导的骨侵蚀;另一方面是平衡稳态的作用,它能与骨形态发生蛋白-2(bone morphogenetic protein-2, BMP-2)和RANKL相互作用,有助于平衡成骨细胞的钙化和破骨细胞的骨吸收,并有利于调节关节炎症中的骨重塑过程[36]。
2.5 TSG-6在其他疾病中的抗炎作用TSG-6对肺支气管发育不全(bronchopulmonary dysplasia, BPD)的早产儿具有保护作用。机械通气不足、氧中毒和病原微生物感染引起的炎症是早产儿发生BPD的关键因素,同时也是导致其肺发育异常和肺重塑的主要原因之一。BPD的主要特征是肺泡简化和血管生成紊乱,发病时患儿体内pH值变化也是导致其高发病率和高死亡率的重要因素。Bryan等[37]将新生幼鼠暴露在高氧环境下制备成BPD动物模型。在此模型上,向其气管内注射能过表达TSG-6蛋白的重组腺病毒悬液并进行详细的系列观察,发现TSG-6能显著减轻肺部炎症,改善肺部结构,减少细胞凋亡,并稳定pH值与抑制BPD血管重构。这可能与TSG-6抑制炎症细胞释放相关炎性细胞因子有关。Chaubey等[38]也通过相似的实验发现,在新生鼠模型中,MSCs能够通过TSG-6减缓高氧诱导发生的BPD,但具体的作用机制仍然不清楚。总的来说,TSG-6有望成为有效治疗早产儿BPD的一个重要突破口。
Jha等[39]发现来自脂肪组织源性间充质干细胞(adipose tissue-derived mesenchymal stem cells, ASC-CCM)的浓缩条件培养基可以限制冲击波对视网膜的损伤,而被敲除TSG-6基因的ASC-CCM对视网膜的保护作用却显著降低。由此推测,TSG-6可能通过神经、血管的调节来保护机体免受外伤引起的视觉缺陷。此外还有研究表明,TSG-6在MSCs治疗缺血/再灌注损伤诱导的急性肾损伤中起关键作用。经TSG-6治疗的实验组小鼠在肾功能和组织的恢复上明显好于对照组小鼠,这可能是TSG-6抑制中性粒细胞向受损部位渗透并且通过调节炎症反应促进了肾小管上皮细胞增殖[40]。
3 结语与展望TSG-6主要通过Link模块与HA和IαI结合参与炎症的发生、发展与结局,并且还可通过CD44介导淋巴细胞向炎症部位移动、调控相关炎性细胞因子的产生和相关炎性信号通路达到抗炎目标。在临床治疗方面,大量研究表明,TSG-6在病理性瘢痕、神经炎症、动脉粥样硬化和关节炎等多种疾病模型中,通过不同途径发挥抗炎作用,使得相应的临床症状得以缓解并且没有明显的副作用。
但在TSG-6的作用机制研究方面,目前只观察到其能影响某些炎性信号通路,而具体影响的环节以及究竟起到怎样的作用还有待进一步确证。目前TSG-6的CUB模块的具体作用仍然不是很明确,它是否能够加强TSG-6的抗炎作用?或者能否通过对其做相应的基因修饰以增强TSG-6的抗炎作用都有待进一步研究。
由于目前的研究都停留在体外细胞模型和动物实验上,缺乏相应临床试验的佐证,故TSG-6的有效性和安全性还有待进一步验证。总体来说,TSG-6在炎症调节方面的作用具有重要的研究价值和临床应用价值。病毒、细菌、真菌、立克次体、螺旋体等多种病原微生物感染人体时会引起一系列的炎症反应,如近期的新型冠状病毒感染引起的肺部及全身性炎症,对人类健康造成巨大危害。那么TSG-6能否抑制这些病原微生物在机体内的增殖以及能否对这些病原微生物感染引起的炎症反应起到很好的治疗效果还需要进一步的研究。
| [1] |
Bindu S, Mazumder S, Bandyopadhyay U. Non-steroidal anti-inflammatory drugs (NSAIDs) and organ damage: A current perspective[J]. Biochem Pharmacol, 2020, 180: 114147.
[DOI]
|
| [2] |
Joseph RM, Hunter AL, Ray DW, Dixon WG. Systemic glucocorticoid therapy and adrenal insufficiency in adults: A systematic review[J]. Semin Arthritis Rheum, 2016, 46(1): 133-141.
[DOI]
|
| [3] |
Lee TH, Lee GW, Ziff EB, Vilcek J. Isolation and characterization of eight tumor necrosis factor-induced gene sequences from human fibroblasts[J]. Mol Cell Biol, 1990, 10(5): 1982-1988.
[PubMed]
|
| [4] |
Milner CM, Day AJ. TSG-6: a multifunctional protein associated with inflammation[J]. J Cell Sci, 2003, 116(Pt 10): 1863-1873.
[URI]
|
| [5] |
Milner CM, Higman VA, Day AJ. TSG-6: a pluripotent inflammatory mediator[J]. Biochem Soc Trans, 2006, 34(Pt 3): 446-450.
[URI]
|
| [6] |
Day AJ, Milner CM. TSG-6: A multifunctional protein with anti-inflammatory and tissue-protective properties[J]. Matrix Biol, 2019, 78-79: 60-83.
[DOI]
|
| [7] |
Kohda D, Morton CJ, Parkar AA, Hatanaka H, Inagaki FM, Campbell ID, Day AJ. Solution structure of the link module: a hyaluronan-binding domain involved in extracellular matrix stability and cell migration[J]. Cell, 1996, 86(5): 767-775.
[DOI]
|
| [8] |
Tan KT, Baildam AD, Juma A, Milner CM, Day AJ, Bayat A. Hyaluronan, TSG-6, and inter-alpha-inhibitor in periprosthetic breast capsules: reduced levels of free hyaluronan and TSG-6 expression in contracted capsules[J]. Aesthet Surg J, 2011, 31(1): 47-55.
[DOI]
|
| [9] |
Lesley J, Gál I, Mahoney DJ, Cordell MR, Rugg MS, Hyman R, Day AJ, Mikecz K. TSG-6 modulates the interaction between hyaluronan and cell surface CD44[J]. J Biol Chem, 2004, 279(24): 25745-25754.
[DOI]
|
| [10] |
McDonald B, McAvoy EF, Lam F, Gill V, de la Motte C, Savani RC, Kubes P. Interaction of CD44 and hyaluronan is the dominant mechanism for neutrophil sequestration in inflamed liver sinusoids[J]. J Exp Med, 2008, 205(4): 915-927.
[DOI]
|
| [11] |
Kui L, Chan GC, Lee PP. TSG-6 downregulates IFN-Alpha and TNF-Alpha expression by suppressing IRF7 phosphorylation in human plasmacytoid dendritic cells[J]. Mediators Inflamm, 2017, 2017: 7462945.
[DOI]
|
| [12] |
Choi H, Lee RH, Bazhanov N, Oh JY, Prockop DJ. Anti-inflammatory protein TSG-6 secreted by activated MSCs attenuates zymosan-induced mouse peritonitis by decreasing TLR2/NF- κ B signaling in resident macrophages[J]. Blood, 2011, 118(2): 330-338.
[DOI]
|
| [13] |
Shaw TJ, Kishi K, Mori R. Wound-associated skin fibrosis: mechanisms and treatments based on modulating the inflammatory response[J]. Endocr Metab Immune Disord Drug Targets, 2010, 10(4): 320-330.
[DOI]
|
| [14] |
Wang H, Chen Z, Li XJ, Ma L, Tang YL. Anti-inflammatory cytokine TSG-6 inhibits hypertrophic scar formation in a rabbit ear model[J]. Eur J Pharmacol, 2015, 751: 42-49.
[DOI]
|
| [15] |
张苏文, 李小静, 陈钊, 王晖. TSG-6对人病理性瘢痕成纤维细胞增殖与凋亡的影响[J]. 安徽医科大学学报, 2016, 51(1): 102-105. [CNKI]
|
| [16] |
王佳妮, 李小静, 李涛, 王瑜. TSG-6促进瘢痕疙瘩成纤维细胞凋亡及其NF- κ B信号通路影响的实验研究[J]. 安徽医科大学学报, 2017, 52(9): 1266-1270. [CNKI]
|
| [17] |
田小雨, 李小静, 李心怡, 李涛. TSG-6调控PI3K/Akt-Bcl-2通路影响人瘢痕疙瘩凋亡机制的研究[J]. 安徽医科大学学报, 2018, 53(4): 563-567. [CNKI]
|
| [18] |
Li XY, Li T, Li XJ, Wang JN, Chen Z. TSG-6 induces apoptosis of human hypertrophic scar fibroblasts via activation of the Fas/FasL signalling pathway[J]. Folia Biol (Praha), 2018, 64(5-6): 173-181.
[PubMed]
|
| [19] |
Boche D, Perry VH, Nicoll JA. Review: activation patterns of microglia and their identification in the human brain[J]. Neuropathol Appl Neurobiol, 2013, 39(1): 3-18.
[DOI]
|
| [20] |
Hu X, Leak RK, Shi Y, Suenaga J, Gao Y, Zheng P, Chen J. Microglial and macrophage polarization—new prospects for brain repair[J]. Nat Rev Neurol, 2015, 11(1): 56-64.
[DOI]
|
| [21] |
Liu Y, Zhang R, Yan K, Chen F, Huang W, Lv B, Sun C, Xu L, Li F, Jiang X. Mesenchymal stem cells inhibit lipopolysaccharide-induced inflammatory responses of BV2 microglial cells through TSG-6[J]. J Neuroinflammation, 2014, 11: 135.
[DOI]
|
| [22] |
Blasi E, Barluzzi R, Bocchini V, Mazzolla R, Bistoni F. Immortalization of murine microglial cells by a v-raf/v-myc carrying retrovirus[J]. J Neuroimmunol, 1990, 27(2-3): 229-237.
[DOI]
|
| [23] |
Liu Y, Zeng R, Wang Y, Huang W, Hu B, Zhu G, Zhang R, Li F, Han J, Li Y. Mesenchymal stem cells enhance microglia M2 polarization and attenuate neuroinflammation through TSG-6[J]. Brain Res, 2019, 1724: 146422.
[DOI]
|
| [24] |
Qiu J, Nishimura M, Wang Y, Sims JR, Qiu S, Savitz SI, Salomone S, Moskowitz MA. Early release of HMGB-1 from neurons after the onset of brain ischemia[J]. J Cereb Blood Flow Metab, 2008, 28(5): 927-938.
[DOI]
|
| [25] |
Caso JR, Pradillo JM, Hurtado O, Lorenzo P, Moro MA, Lizasoain I. Toll-like receptor 4 is involved in brain damage and inflammation after experimental stroke[J]. Circulation, 2007, 115(12): 1599-1608.
[DOI]
|
| [26] |
刘扬, 余列, 卜淑芳, 刘喜灿. 肿瘤坏死因子- α刺激基因-6蛋白对脑梗死早期炎症反应和血脑屏障的影响[J]. 中华神经医学杂志, 2015, 14(5): 443-447. [DOI]
|
| [27] |
Hansson GK, Libby P. The immune response in atherosclerosis: a double-edged sword[J]. Nat Rev Immunol, 2006, 6(7): 508-519.
[DOI]
|
| [28] |
Cao TV, La M, Getting SJ, Day AJ, Perretti M. Inhibitory effects of TSG-6 link module on leukocyte-endothelial cell interactions in vitro and in vivo[J]. Microcirculation, 2004, 11(7): 615-624.
[DOI]
|
| [29] |
Dyer DP, Thomson JM, Hermant A, Jowitt TA, Handel TM, Proudfoot AE, Day AJ, Milner CM. TSG-6 inhibits neutrophil migration via direct interaction with the chemokine CXCL8[J]. J Immunol, 2014, 192(5): 2177-2185.
[DOI]
|
| [30] |
Ye L, Mora R, Akhayani N, Haudenschild CC, Liau G. Growth factor and cytokine-regulated hyaluronan-binding protein TSG-6 is localized to the injury-induced rat neointima and confers enhanced growth in vascular smooth muscle cells[J]. Circ Res, 1997, 81(3): 289-296.
[DOI]
|
| [31] |
Watanabe R, Sato Y, Ozawa N, Takahashi Y, Koba S, Watanabe T. Emerging roles of tumor necrosis factor-stimulated gene-6 in the pathophysiology and treatment of atherosclerosis[J]. Int J Mol Sci, 2018, 19(2): 465.
[DOI]
|
| [32] |
Watanabe R, Watanabe H, Takahashi Y, Kojima M, Konii H, Watanabe K, Shirai R, Sato K, Matsuyama TA, Ishibashi-Ueda H, Iso Y, Koba S, Kobayashi Y, Hirano T, Watanabe T. Atheroprotective effects of tumor necrosis factor-stimulated gene-6[J]. JACC Basic Transl Sci, 2016, 1(6): 494-509.
[DOI]
|
| [33] |
Bayliss MT, Howat SL, Dudhia J, Murphy JM, Barry FP, Edwards JC, Day AJ. Up-regulation and differential expression of the hyaluronan-binding protein TSG-6 in cartilage and synovium in rheumatoid arthritis and osteoarthritis[J]. Osteoarthritis Cartilage, 2001, 9(1): 42-48.
[DOI]
|
| [34] |
Szántó S, Bárdos T, Gál I, Glant TT, Mikecz K. Enhanced neutrophil extravasation and rapid progression of proteoglycan-induced arthritis in TSG-6-knockout mice[J]. Arthritis Rheum, 2004, 50(9): 3012-3022.
[DOI]
|
| [35] |
Bárdos T, Kamath RV, Mikecz K, Glant TT. Anti-inflammatory and chondroprotective effect of TSG-6 (tumor necrosis factor-α-stimulated gene-6) in murine models of experimental arthritis[J]. Am J Pathol, 2001, 159(5): 1711-1721.
[DOI]
|
| [36] |
Mahoney DJ, Mikecz K, Ali T, Mabilleau G, Benayahu D, Plaas A, Milner CM, Day AJ, Sabokbar A. TSG-6 regulates bone remodeling through inhibition of osteoblastogenesis and osteoclast activation[J]. J Biol Chem, 2008, 283(38): 25952-25962.
[DOI]
|
| [37] |
Bryan C, Sammour I, Guerra K, Sharma M, Dapaah-Siakwan F, Huang J, Zambrano R, Benny M, Wu S, Young K. TNF α-stimulated protein 6 (TSG-6) reduces lung inflammation in an experimental model of bronchopulmonary dysplasia[J]. Pediatr Res, 2019, 85(3): 390-397.
[DOI]
|
| [38] |
Chaubey S, Thueson S, Ponnalagu D, Alam MA, Gheorghe CP, Aghai Z, Singh H, Bhandari V. Early gestational mesenchymal stem cell secretome attenuates experimental bronchopulmonary dysplasia in part via exosome-associated factor TSG-6[J]. Stem Cell Res Ther, 2018, 9(1): 173.
[DOI]
|
| [39] |
Jha KA, Pentecost M, Lenin R, Gentry J, Klaic L, Del Mar N, Reiner A, Yang CH, Pfeffer LM, Sohl N, Gangaraju R. TSG-6 in conditioned media from adipose mesenchymal stem cells protects against visual deficits in mild traumatic brain injury model through neurovascular modulation[J]. Stem Cell Res Ther, 2019, 10(1): 318.
[DOI]
|
| [40] |
Chen Y, Tang X, Li P, Zhou Y, Xue T, Liu J, Yu C. Bone marrow derived mesenchymal stromal cells ameliorate ischemia/reperfusion injury-induced acute kidney injury in rats via secreting tumor necrosis factor-inducible gene 6 protein[J]. Biomed Res Int, 2019, 2019: 9845709.
[DOI]
|
 2021, Vol. 16
2021, Vol. 16


