2. 复旦大学附属中山医院消化科,上海 200032;
3. 复旦大学上海医学院上海市肝病研究所, 上海 200032
2. Department of Gastroenterology & Hepatology, Zhongshan Hospital of Fudan University, Shanghai 200032, China;
3. Shanghai Institute of Liver Diseases, Fudan University Shanghai Medical College, Shanghai 200032, China
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是一类包含非酒精性单纯性脂肪肝(nonalcoholic fatty liver,NAFL)、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)及其相关肝硬化等临床病理症候群。NAFLD是在排除长期大量饮酒和其他肝损因素所引起,以甘油三酯等在肝细胞中蓄积为病理改变的代谢性疾病。NAFLD病因多样,可能同时受到脂毒性、氧化应激、炎症、胰岛素抵抗(insulin resistance,IR)、表观遗传修饰等多种因素影响[1]。流行病学资料显示,NAFLD已成为最常见的肝脏疾病之一,全球患病率为25.2%[2],亚洲患病率为27.4%[3],而我国平均患病率为15%,有些地区高达29%[4]。对于NAFLD的发生机制,比较流行的是“多重打击”学说[5],在各种因素相互作用下,形成“脂质积蓄→肝脂毒性→代谢紊乱→炎症应答→胰岛素抵抗→代谢紊乱加重”的恶性循环。肠道菌群失调可参与对肝脏的多重打击,在NAFLD发病过程中起关键作用。肠道与肝脏通过门静脉相连,肠道细菌及其代谢物可以通过门静脉进入肝脏,影响其病理生理过程。因此,肠道菌群的改变及其代谢产物被认为是肠肝对话的分子基础或信息载体[2, 6]。目前,对NAFLD发病机制的认识仍较为有限,且尚无有效治疗药物。NAFLD的干预措施侧重于饮食和生活方式的改变,但由于患者依从性差,治疗效果不满意。在NAFLD的发展过程中,NASH进一步发展成肝纤维化以及肝硬化,干预NASH也就成为治疗NAFLD的突破点。目前可用于治疗NASH的药物仅限于胰岛素增敏剂(如吡格列酮)和维生素E。这两种药物在早期Ⅱ期临床试验中显示对部分人群有效[7]。随着对NAFLD患者肠道菌群的深入研究,学者们提出了一些干预肠道菌群的治疗新策略,比如补充益生菌及益生元、粪菌移植(fecal microbial transplantation,FMT)、肠道菌群靶向疗法(microbiome-targeted therapies,MTT)等[8]。调节、改造、重建肠道菌群或能成为NASH治疗中的一种个性化干预手段。因此,深入探索肠道菌群的改变是研究NAFLD发生发展机制的重要组成部分,也是挖掘新治疗手段的工具。本综述重点介绍肠道菌群异常时影响NAFLD发生发展的过程和机制,并针对这些异常探讨潜在的干预措施。
1 肠道菌群与菌群失调肠道菌群是一组生存在肠道、与宿主共生的微生物群。肠道菌群数量众多,总量达10万亿~100万亿,以细菌为主,并包括古细菌、真菌、原虫、病毒等[9-10]。菌种的数量和类型处于动态平衡,是人体内稳态的一部分。细菌丰度和组成从胃到结肠递增,表现出更高的多样性,并且受到遗传、年龄、生活方式、药物和饮食的影响[8]。它们与人体共生,在食物消化及营养吸收过程中发挥重要作用,例如可以分解复杂多糖,合成多种维生素,参与胆汁酸的肠肝循环等[11]。细菌的产物在机体建立自主免疫过程中也发挥重要作用。婴儿在出生时会获得母体粪便或会阴菌群,初乳和母乳也是活细菌的丰富来源,具有菌群重建、免疫系统发育、食物新陈代谢和营养供应等重要的有益作用[12]。肠道菌群多样性随着年龄的增长而逐渐降低,老年人因衰老、体力、胃肠功能下降、营养失衡以及过度使用抗生素,其肠道菌群发生改变[13]。有研究表明,这种肠道菌群多样性的变化会引起促炎代谢物如氧化三甲胺(trimethylamine N-oxide,TMAO)的产生,其与衰老并发的认知衰退、精神障碍等有关[14]。研究肠道菌群的常用方法主要有:16S核糖体RNA(ribosomal RNA,rRNA)基因测序、DNA全基因组测序、基因组学等。可用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,real-time qPCR)检测目的基因mRNA转录水平,还可以通过蛋白质组学、代谢组学、液相色谱法等方法研究细菌代谢产物及微生物的组成。分离健康成人或患者粪便微生物进行特定菌系的比较也是常用手段[7, 12-13, 15-16]。
菌群失调是指正常的肠道菌群数量或构成比即内稳态被破坏,环境、免疫或宿主因素改变都可能导致菌群失调[17]。菌群失调可能会直接影响脂肪因子、促炎和抗炎细胞因子以及脂肪酸β-氧化的水平[12]。大量研究表明,肠道菌群在体重调节、能量代谢、炎症和免疫应答等诸多病理生理过程中发挥重要作用,提示肠道菌群可能在NAFLD发生、发展中起重要作用[1, 7, 18-21]。
2 肠道菌群影响非酒精性脂肪性肝病的机制 2.1 NAFLD相关的肠道菌群异常大量研究表明,NAFLD患者会出现肠道菌群组成比例改变或菌群失调,有研究发现NAFL儿童粪便样本中γ-变形菌(γ-Proteobacteria)和普雷沃菌(Prevotella)数量明显较多。在NAFL组中,厚壁菌和拟杆菌的比例比健康人群低,而乳杆菌属在健康人群中比例较高,提示菌种间的比例失调[1]。还有研究报道,NASH患者中粪便拟杆菌、大肠杆菌、瘤胃球菌增多,而有益菌群如乳杆菌、双歧杆菌减少[22]。粪便胆汁酸(bile acid,BA)检测可反映两条胆汁酸代谢通路,即“甘氨酸、丝氨酸和苏氨酸代谢”与“牛磺酸和次牛磺酸代谢”的途径改变。参与牛磺酸和甘氨酸代谢的细菌埃希杆菌属(Esherichia)、嗜胆菌属(Bilophila)和红细菌属(Rhodbacter)在NASH患者粪便中明显富集[23]。与疾病早期的患者相比,NASH进展伴中度纤维化(F≥2)患者的肠道菌群有明显不同[18]。另有研究显示,60%的NAFLD患者其发病与感染高产酒精肺炎克雷伯菌(high alcohol Klebsiella pneumoniae,HiAlc-Kpn)相关,从NASH患者粪便分离出HiAlc-Kpn菌株移植到小鼠体内会诱发小鼠NAFLD[24]。这说明肠道菌群的改变参与NAFL、NASH发生以及其向肝硬化进展的病理过程。因研究对象及手段的差异,不同研究所发现的菌群比例变化结果常不一致。
菌群易位(bacterial translocation,BT)指胃肠道内寄生菌穿过黏膜,进入通常无菌的组织或器官[18]。从器官活检标本、患者外周血中提取特定细菌的DNA片段,扩增后测序,可确定有无肠道细菌易位。NAFLD起始和发展过程中,肠道黏膜屏障受损,肠道通透性增加,诱发肠道菌群易位,进而越来越多的细菌代谢产物、细菌成分和其他化合物等可通过门静脉进入肝脏,引起炎症反应、氧化应激和脂质堆积,最终导致脂肪性肝损伤和肝纤维化加速[7]。有研究通过原位杂交发现,高脂饲料(high fat diet,HFD)模型小鼠肝脏中有细菌存在;进一步使用相对分子质量为5×105的异硫氰酸荧光素葡聚糖(fluorescein isothiocyanate dextran,FITC-Dextran)进行活体探针共聚焦显微镜成像及小鼠血清FITC-Dextran荧光强度测定,发现肠道通透性明显增加,说明肠道通透性增加会引起更多细菌及细菌代谢产物进入肝脏[25]。而NASH患者肝脏内是否有细菌存在还有待证实,故认为细菌产物影响NAFLD的作用更为明确。菌群易位也是肠道免疫状态改变的影响因素之一[18]。促炎细胞因子,如α干扰素(interferon-α,IFN-α)、IFN-γ和白细胞介素-6(interleukin,IL-6),已被证明可以干扰肠道屏障通透性,允许肠腔抗原通过肠道屏障[19],菌群易位也会导致门脉或肝内内毒素水平增加,病原体相关模式分子(pathogen-associated molecular pattern,PAMP)在门静脉循环中积聚,从而促进肝脏炎症和NASH的发展,形成恶性循环[22]。细菌易位增加还会产生过量脂多糖(lipopolysaccharides, LPS),刺激内皮细胞Toll样受体4(Toll-like receptor-4,TLR4)和树突状细胞TLR9,诱导炎性小体和促炎细胞因子产生,进一步破坏肠道黏膜通透性和降低肝脏的胰岛素敏感性,从而增加内脏和皮下脂肪[20]。
2.2 肠道菌群异常对NAFLD发病过程的影响 2.2.1 影响胆汁酸代谢及法尼醇X受体、G蛋白偶联胆汁酸受体信号通路通过干扰胆汁酸代谢,菌群异常可间接影响回肠和肝脏中的法尼醇X受体(farnesoid X receptor,FXR)和G蛋白偶联胆汁酸受体1(G protein-coupled bile acid receptor 1,Gpbar1,又称Takeda G protein-coupled receptor 5,TGR5)发挥作用,进而引起肝脏脂质代谢紊乱、炎症和纤维化[12]。肠道菌群异常会改变胆汁酸的组成和比例,其中次级胆汁酸如FXR拮抗剂脱氧胆酸(deoxycholic acid,DCA)的相对含量显著增加,而初级胆汁酸如FXR激动剂鹅去氧胆酸(chenodeoxycholic acid,CDCA)的相对含量显著降低[26]。同时肠道处于炎症状态,其屏障功能紊乱会降低肠道FXR的表达。FXR拮抗剂增加及FXR低表达会引起肝脏脂质堆积和血浆甘油三酯升高,并影响极低密度脂蛋白(very low-density lipoprotein,VLDL)的清除过程[21]。胆汁酸增多还会诱导巨噬细胞TGR5信号,导致促炎细胞因子的产生[27]。TGR5可激活腺苷酸环化酶-cAMP和表皮生长因子受体(epidermal growth factor receptor,EGFR)-src激酶途径,src激活引起蛋白激酶C(protein kinase C,PKC)的激活。因此,依赖PKC的TGR5激活导致核因子-κB(nuclear factor-κB,NF-κB)激活,促炎细胞因子IL-1β、IL-6和肿瘤坏死因子(tumor necrosis factor,TNF-α)表达增加,加重了肝脏的炎症免疫反应[28]。
2.2.2 影响脂肪累积研究发现,伴随着肠道菌群失调,NAFLD和肥胖使机体从饮食中获取能量的能力增强,增加了脂肪累积。将高脂饲料所致肥胖小鼠的粪便微生物移植给正常饲料喂养的普通小鼠,发现它们比移植正常饮食小鼠粪便微生物的小鼠获得了更多的脂肪沉积[23]。肠道菌群构成的变化会导致机体吸收更多的脂质,促进脂肪酸的生物合成[1]。肠道菌群还可以通过短链脂肪酸(short chain fatty acids,SCFAs)或胆汁酸诱导或抑制血管生成素样蛋白4(angiopoietin-like protein-4,AGTPL-4)介导脂蛋白脂酶(lipoprotein lipase,LPL)活性,进而影响肝外脂肪的分解及肝内脂肪的蓄积[21]。改变肠道菌群的构成可以缓解NAFL向NASH发展。近期研究发现,乳酸菌可通过减少宿主肠道脂肪酸吸收从而减轻肝脏脂肪累积[29]。
2.2.3 诱发或促进胰岛素抵抗普雷沃菌和寻常型杆菌(Bacillus vulgaris)在胰岛素抵抗患者中检出率增加[30],提示肠道菌群变化与胰岛素抵抗有关。研究表明细菌壁外膜上的LPS可通过TRL4作用于脂肪细胞和巨噬细胞,释放多种炎症细胞因子,从而诱发胰岛素抵抗[4]。胰岛素敏感度下降使血液中葡萄糖的利用率下降,β胰岛细胞处于代偿性高分泌状态,导致高胰岛素血症。而高胰岛素血症进一步损害肝脏中的胰岛信号通路,形成恶性循环[31]。胰岛素抵抗会引起血糖水平紊乱、损害糖原合成,将葡萄糖作为脂肪合成的底物[30];还可促进甘油三酯(triacylglycerol,TG)积聚,引起肝细胞损伤、炎症及纤维化[32],从而加重NAFLD。
2.2.4 影响胆碱代谢肠道菌群失调会改变胆碱代谢,降低宿主胆碱的生物利用度[33]。革兰氏阴性γ蛋白细菌和产芽孢菌(Erysipelotrichi)的水平升高会导致胆碱缺乏、TMAO产生增加,并引起脂肪变性[8]。胆碱生物利用度的降低可导致机体无法合成磷脂酰胆碱(phosphatidylcholine,PC),而PC对VLDL的组装和分泌极为重要[23]。PC缺乏会促使脂肪酸合成,从而导致甘油三酯增加。缺乏PC的脂滴表面活性会降低,容易形成较大脂滴,并难以被脂蛋白脂酶分解[21]。总之,菌群失调会影响一碳代谢,减少宿主的胆碱库,使机体处于胆碱缺乏状态,VLDL分泌减少,导致肝脏脂肪堆积[33]。这也是蛋氨酸胆碱缺乏饲料(methionine/choline-deficient diet,MCD diet)引起脂肪性肝炎的机制。
2.2.5 细菌代谢产物对机体的影响菌群失调或菌群组成紊乱后,许多肠道微生物成分或代谢物,如肽聚糖[7]、三甲胺[21]、次级胆汁酸[27]、短链脂肪酸[12]、支链氨基酸[27]、乙醇[22]等发生改变,进入血液循环系统,发挥促炎、改变基因表达、代谢修饰和毒性等多重作用,并调节肝脏脂肪合成,影响NAFLD的发生和进展[27]。
高脂饮食降低了食物多样性,纤维素摄取减少导致肠道来源的SCFAs分泌减少,而SCFAs是维持稳态的重要因素[34]。SCFAs可以激活L细胞(肠道内分泌细胞的一种)表面G蛋白偶联受体(G protein-coupled receptor,GPCRs)GPR41和GPR43,通过多种途径影响NAFLD的发生[12]。当SCFAs中丁酸比例下降时,脂肪因子(adipokine)的释放增加,碳水化合物反应原件结合蛋白(carbohydrate response element-binding protein, ChREBP)和胆固醇调节原件结合蛋白-1(cholesterol-regulatory element-binding protein-1, SREBP-1)的活性因失去丁酸的抑制作用而增强,从而促进脂肪合成及脂质沉积[12, 35]。SCFAs对抗炎、维持肠上皮屏障的完整性很重要[34]。SCFAs的减少使其难以抑制特定病原菌的繁殖,机体胰岛素敏感性降低,导致肠道黏膜通透性增加,加剧了NAFLD的发展进程[36]。
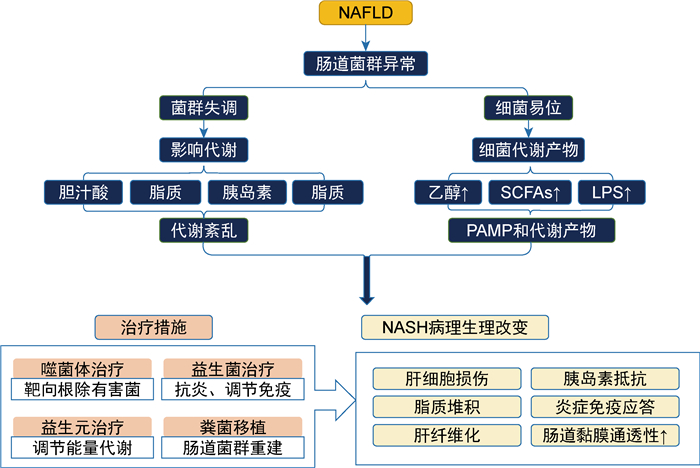
研究发现NASH患者的肠道菌群中产酒精性菌,如HiAlc-Kpn、溶细胞素阳性粪肠球菌增加[37-38]。这两类细菌的过度生长使乙醇产量增加,肠黏膜屏障破坏使乙醇进入血液循环中,进一步加重肝脏炎症、活性氧(reactive oxygen species,ROS)释放和肠道高通透性[39]。酒精在肠道代谢的副产品乙醛也可通过损坏细胞间紧密连接的完整性而削弱肠屏障,导致细菌易位和内毒素血症[22]。肠道通透性的增加促使更多代谢产物及病原微生物进入血液循环,枯否细胞和肝星状细胞被激活,炎性细胞因子大量释放,加重NASH及肝脏纤维化[1]。肠道菌群异常与NASH发病关系的研究已取得显著进展,然而因NASH发病机制的多样性,或因研究手段所限,往往缺乏直接证据证实两者间的因果关系。图 1总结了肠道菌群在NAFLD/NASH发生、发展中的作用。
|
|
NAFLD会导致肠道菌群异常。菌群失调易引起胆汁酸、脂质、胰岛素、胆碱代谢紊乱,与细菌PAMP和代谢产物共同作用于机体,进一步引发NASH病理生理改变。 注:NAFLD:非酒精性脂肪性肝病;SCFAs:短链脂肪酸;LPS:脂多糖;NASH:非酒精性脂肪性肝炎;PAMP:病原体相关分子模式。 图 1 肠道菌群异常影响NASH及治疗措施示意 Fig. 1 The influence of abnormal intestinal flora on NASH and treatment for NASH |
微生物组靶向疗法(microbiome-targeted therapies, MTT)通过使用抗生素、益生菌、益生元或FMT等手段,纠正或重建肠道菌群,达到治疗肠道或其他疾病的目的[40],是治疗NAFLD的新策略。商品化的链球菌、乳杆菌、双歧杆菌可以改善抗炎环境,有助于肠上皮细胞的生长和存活,并可通过调节免疫系统和宿主防御来对抗病原菌[32]。乳酸杆菌和双歧杆菌作为可安全食用的益生菌,能够降低血胆固醇[15]。补充益生元如乳果糖、寡果糖、菊糖可刺激胃肠肽释放,具有调节机体食欲和能量代谢的作用[41]。但值得注意的是,有研究发现给予TLR5基因敲除(TLR5-deficient,T5KO)小鼠富含可溶性纤维素菊糖(7.5%)饮食时,小鼠的胆红素升高。说明过量摄入菊糖可能会引起肝脏损伤,因此应当在医生指导下适当补充益生元,以免对身体造成危害[42]。表 1总结了常用益生菌、益生元干预NAFLD或NASH的临床研究现状。FMT是一种全面调节肠道菌群的方式,已被证明能够有效恢复健康的菌群组成[7],并可用于治疗艰难梭菌相关性腹泻和伪膜性结肠炎,以及其他慢性肠道炎症性疾病,如溃疡性结肠炎、Crohn氏病等[32]。有研究表明,进行FMT后,HFD小鼠肠道菌群紊乱得到纠正,肠道紧密连接蛋白(Zonula occludens-1,ZO-1)增加,NASH明显减轻[50]。但FMT治疗NASH患者的临床研究还未见有报道。
| 研究者 | 人群 | 治疗手段 | 主要结果 | 结论 |
| 益生元治疗 | ||||
| 任习芳和张丽静[43] | 122例中重度NAFLD肠功能紊乱患者 | A组(n=34):基础治疗+多烯磷脂酰胆碱胶囊456 mg,tid,1个月 B组(n=48):A+胰酶肠溶胶囊0.3 g,tid,1个月 C组(n=40):B+双歧杆菌三联活菌胶囊420 mg,tid,1个月 |
A、B、C组腹泻有效率分别为5.9%,50.0%,65.0%,里急后重有效率分别为2.9%,20.8%,30.0%,肛门排气有效率分别为2.9%,22.9%,37.5% (均P<0.05);B组、C组治疗后肠功能紊乱症状明显好转 | 多烯磷脂酰胆碱胶囊+胰酶肠溶胶囊+双歧杆菌三联活菌胶囊联合治疗对NAFLD患者肠功能紊乱有效 |
| Bomhof等[44] | 14例活检确诊为NASH的患者 | 益生元组(n=8)9 g dFOS 12 w+16 g dFOS 24 w;安慰剂组(n=6)等热量的安慰剂36 w | 益生元组总体NAS与治疗前比较明显降低(P<0.05) | 益生元有效改善NASH患者的脂肪变性 |
| 益生菌治疗 | ||||
| 朴善英和徐小达[45] | 97例非酒精性脂肪性肝硬化患者 | 常规治疗+双歧杆菌三联活菌胶囊,pc bid,每次2~4粒,共服用49 d | 糖脂代谢、氧化损伤和肝功能指标均改善 | 联合肠道益生菌辅助治疗可在临床应用并推广 |
| 高琦[46] | 200例非酒精性脂肪性肝硬化患者 | 试验组(n=100)在常规治疗基础上加用双歧杆菌三联活菌胶囊辅助治疗,30 d;对照组采用常规治疗方法,30 d | 脂肪肝分级改善明显(P<0.05),总胆固醇、血糖、SOD、AST、ALT显著降低(P<0.05) | 益生菌可改善患者糖脂代谢和肝功能,减少氧化损伤 |
| Sepideh等[47] | 42例NAFLD患者 | A组(n=21):每天服用益生菌胶囊(干酪乳杆菌、嗜酸乳杆菌、鼠李糖乳杆菌、保加利亚乳杆菌、短双歧杆菌、长双歧杆菌、嗜热链球菌),8 w; B组(n=21):安慰剂治疗,8 w |
益生菌干预组的胰岛素、胰岛素抵抗水平、TNF-α和IL-6显著下降(P<0.05) | 益生菌混合物可降低NAFLD患者的血糖和炎症指标 |
| Famouri等[48] | 64例肥胖儿童 | 益生菌组(n=32):益生菌胶囊(嗜酸乳杆菌、乳酸双歧杆菌、双歧杆菌、鼠李糖乳杆菌)12 w; 安慰剂组(n=32):安慰剂12 w |
益生菌组平均AST、ALT显著下降(P<0.05),胆固醇、TG、腰围、BMI等下降; 肝超声分级评价转阴n(%) 益生菌组 17(53.12) 安慰剂组 5(15.62) |
多株益生菌混合物对改善儿童NAFLD有一定的效果 |
| 凌琳[49] | 70例NAFLD 患者 |
试验组(n=35):UDCA+双歧三联活菌口服治疗; 对照组(n=35):UDCA口服 疗程为16周 |
两组TC、TG、LDL-C、AST、ALT、FBG、肝脏超声积分均明显下降(P<0.05);试验组AST、ALT下降水平均显著低于对照组(P<0.05) | 益生菌联合UDCA治疗NAFLD可减轻肝脏损伤,改善血脂、血糖 |
| 粪菌移植 | ||||
| 目前大多数临床经验都集中在对复发的艰难梭菌感染(Clostridium difficile infection,CDI)或偶尔严重的CDI患者使用 | ||||
| 注:tid:每天3次;dFOS:低聚果糖;bid:每天2次;pc:饭后;SOD:血清超氧化歧化酶;AST:谷草转氨酶;ALT:谷丙转氨酶;TNF-α:肿瘤坏死因子;NAS:NAFLD活动评分;TG:甘油三酯;BMI:身体质量指数;TC:总胆固醇;LDL-C:低密度脂蛋白;FBG:空腹血糖;UDCA:熊去氧胆酸。 | ||||
使用特殊菌群或细菌产物干扰NASH也可能成为新的治疗手段或药物研发方向。有报道称使用黏液阿克曼菌(Akkermansia muciniphila)可改善肝功能、减轻氧化应激、抑制炎症、使肠道菌群正常化,并逆转高脂饮食引起的代谢紊乱[23]。一些次级胆汁酸产生菌如乳杆科菌(Lactobacillaceae)和毛螺科菌(Lachnospiraceae)表现出降低胆固醇的潜力,可以改善高脂饮食下的代谢异常状态[51];还有研究发现,由细菌产生的特定胆汁酸可以调节肠道菌群结构,恢复菌群的平衡状态[7]。
通过研究细菌组成及丰度变化,在确定特定细菌影响NAFLD发生、进展的机制或二者具有因果关系后,可使用靶向特定细菌的噬菌体根除该细菌,消除其对NAFLD患者康复的不利影响,且不会影响其他细菌的正常功能[38]。例如使用噬菌体靶向根除HiAlc-Kpn后可有效缓解NAFLD模型鼠的细菌性自动酿酒综合征及NASH[24]。Nature发表 1项研究称,对酒精性肝炎患者FMT诱导的小鼠肝病模型,使用以溶细胞粪肠球菌为靶点的噬菌体能降低肝脏中的溶细胞素,并消除小鼠的酒精性肝损伤[38]。说明噬菌体治疗可以特异性地消除某种细菌,为精确修饰肠道菌群提供了一种可靠的方法。
4 结语肠道菌群异常会进一步影响NAFLD的发生、进展,甚至形成恶性循环。如何利用肠道菌群改变或阻断NASH的发展进程,寻找细菌及细菌产物作为潜在靶点对干预NASH十分关键。益生菌、益生元、FMT、噬菌体治疗等都是有前景的新策略[52]。然而,特定的微生物菌株或菌群是否与NASH发生有因果关系,并成为其治疗手段还未在机制上得到肯定。整个肠道菌群不能成为精准控制的目标,菌株间的协同效应也缺乏探索。目前研究受到的限制包括:缺乏检测完整肠道菌群及细菌易位的非侵入性方法,肠道特定细菌分离困难且培养要求严格等。但令人振奋的是,肠道菌群对于治疗NASH有巨大的潜能,深入探索肠道菌群组成或将为NAFLD带来新的诊断手段和个性化治疗方法。
| [1] |
Mohammadi Z, Poustchi H, Motamed-Gorji N, Eghtesad S, Hekmatdoost A, Saniee P, Merat S. Fecal microbiota in non-alcoholic fatty liver disease and non-alcoholic steatohepatitis: a systematic review[J]. Arch Iran Med, 2020, 23(1): 44-52.
[PubMed]
|
| [2] |
Wiest R, Albillos A, Trauner M, Bajaj J, Jalan R. Targeting the gut-liver axis in liver disease[J]. J Hepatol, 2017, 67(5): 1084-1103.
[DOI]
|
| [3] |
Younossi ZM, Koenig AB, Abdelatif D, Fazel Y, Henry L, Wymer M. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology, 2016, 64(1): 73-84.
[DOI]
|
| [4] |
刘晓燕, 高卉. 非酒精性脂肪性肝病的研究进展[J]. 湖北科技学院学报(医学版), 2019, 33(4): 364-368. [CNKI]
|
| [5] |
Day CP, James OF. Steatohepatitis: a tale of two "hits"[J]. Gastroenterology, 1998, 114(4): 842-845.
[DOI]
|
| [6] |
Neuschwander-Tetri BA. Hepatic lipotoxicity and the pathogenesis of nonalcoholic steatohepatitis: the central role of nontriglyceride fatty acid metabolites[J]. Hepatology, 2010, 52(2): 774-788.
[DOI]
|
| [7] |
Lechner S, Yee M, Limketkai BN, Pham EA. Fecal microbiota transplantation for chronic liver diseases: current understanding and future direction[J]. Dig Dis Sci, 2020, 65(3): 897-905.
[DOI]
|
| [8] |
Meroni M, Longo M, Dongiovanni P. The role of probiotics in nonalcoholic fatty liver disease: a new insight into therapeutic strategies[J]. Nutrients, 2019, 11(11): 2642.
[DOI]
|
| [9] |
Lozupone CA, Stombaugh JI, Gordon JI, Jansson JK, Knight R. Diversity, stability and resilience of the human gut microbiota[J]. Nature, 2012, 489(7415): 220-230.
[DOI]
|
| [10] |
陈默, 孔银, 王君, 柳鹏程, 王根年, 魏丰贤, 张岭漪. 肠道菌群与非酒精性脂肪肝相关性的研究进展[J]. 中国微生态学杂志, 2015, 27(8): 989-992. [CNKI]
|
| [11] |
Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T, Pons N, Levenez F, Yamada T, Mende DR, Li J, Xu J, Li S, Li D, Cao J, Wang B, Liang H, Zheng H, Xie Y, Tap J, Lepage P, Bertalan M, Batto JM, Hansen T, Le Paslier D, Linneberg A, Nielsen HB, Pelletier E, Renault P, Sicheritz-Ponten T, Turner K, Zhu H, Yu C, Li S, Jian M, Zhou Y, Li Y, Zhang X, Li S, Qin N, Yang H, Wang J, Brunak S, Doré J, Guarner F, Kristiansen K, Pedersen O, Parkhill J, Weissenbach J, MetaHIT Consortium, Bork P, Ehrlich SD, Wang J. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464(7285): 59-65.
[DOI]
|
| [12] |
Leung C, Rivera L, Furness JB, Angus PW. The role of the gut microbiota in NAFLD[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(7): 412-425.
[DOI]
|
| [13] |
Wang N, Li R, Lin H, Fu C, Wang X, Zhang Y, Su M, Huang P, Qian J, Jiang F, Wang H, Jiang L, Yu X, Liu J, Chen Y, Jiang Q. Enriched taxa were found among the gut microbiota of centenarians in East China[J]. PLoS One, 2019, 14(10): e0222763.
[DOI]
|
| [14] |
Shiels PG, Buchanan S, Selman C, Stenvinkel P. Allostatic load and ageing: linking the microbiome and nutrition with age-related health[J]. Biochem Soc Trans, 2019, 47(4): 1165-1172.
[DOI]
|
| [15] |
Liu W, Xi X, Sudu Q, Kwok L, Guo Z, Hou Q, Menhe B, Sun T, Zhang H. High-throughput sequencing reveals microbial community diversity of Tibetan naturally fermented yak milk[J]. Ann Microbiol, 2015, 65(3): 1741-1751.
[DOI]
|
| [16] |
Clarridge JE 3rd. Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases[J]. Clin Microbiol Rev, 2004, 17(4): 840-862.
[DOI]
|
| [17] |
Ley RE, Peterson DA, Gordon JI. Ecological and evolutionary forces shaping microbial diversity in the human intestine[J]. Cell, 2006, 4(124): 837-848.
[PubMed]
|
| [18] |
Chen D, Le TH, Shahidipour H, Read SA, Ahlenstiel G. The role of gut-derived microbial antigens on liver fibrosis initiation and progression[J]. Cells, 2019, 8(11): 1324.
[DOI]
|
| [19] |
Al-Sadi R, Boivin M, Ma T. Mechanism of cytokine modulation of epithelial tight junction barrier[J]. Front Biosci (Landmark Ed), 2009, 14: 2765-2778.
[PubMed]
|
| [20] |
Fei N, Bruneau A, Zhang X, Wang R, Wang J, Rabot S, Gérard P, Zhao L. Endotoxin producers overgrowing in human gut microbiota as the causative agents for nonalcoholic fatty liver disease[J]. mBio, 2020, 11(1): e03263-19.
[DOI]
|
| [21] |
Qian Y, Fan JG. Obesity, fatty liver and liver cancer[J]. Hepatobiliary Pancreat Dis Int, 2005, 4(2): 173-177.
[PubMed]
|
| [22] |
Arab JP, Arrese M, Shah VH. Gut microbiota in non-alcoholic fatty liver disease and alcohol-related liver disease: current concepts and perspectives[J]. Hepatol Res, 2020, 50(4): 407-418.
[DOI]
|
| [23] |
Fukui H. Role of gut dysbiosis in liver diseases: what have we learned so far[J]. Diseases, 2019, 7(4): 58.
[DOI]
|
| [24] |
Yuan J, Chen C, Cui J, Lu J, Yan C, Wei X, Zhao X, Li N, Li S, Xue G, Cheng W, Li B, Li H, Lin W, Tian C, Zhao J, Han J, An D, Zhang Q, Wei H, Zheng M, Ma X, Li W, Chen X, Zhang Z, Zeng H, Ying S, Wu J, Yang R, Liu D. Fatty liver disease caused by high-alcohol-producing klebsiella pneumoniae[J]. Cell Metab, 2019, 30(4): 675-688.
[DOI]
|
| [25] |
Mouries J, Brescia P, Silvestri A, Spadoni I, Sorribas M, Wiest R, Mileti E, Galbiati M, Invernizzi P, Adorini L, Penna G, Rescigno M. Microbiota-driven gut vascular barrier disruption is a prerequisite for non-alcoholic steatohepatitis development[J]. J Hepatol, 2019, 71(6): 1216-1228.
[DOI]
|
| [26] |
Jiao N, Baker SS, Chapa-Rodriguez A, Liu W, Nugent CA, Tsompana M, Mastrandrea L, Buck MJ, Baker RD, Genco RJ, Zhu R, Zhu L. Suppressed hepatic bile acid signalling despite elevated production of primary and secondary bile acids in NAFLD[J]. Gut, 2018, 67(10): 1881-1891.
[DOI]
|
| [27] |
Shama S, Liu W. Omega-3 fatty acids and gut microbiota: a reciprocal interaction in nonalcoholic fatty liver disease[J]. Dig Dis Sci, 2020, 65(3): 906-910.
[DOI]
|
| [28] |
Jia W, Xie G, Jia W. Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis[J]. Nat Rev Gastroenterol Hepatol, 2018, 15(2): 111-128.
[DOI]
|
| [29] |
Jang HR, Park HJ, Kang D, Chung H, Nam MH, Lee Y, Park JH, Lee HY. A protective mechanism of probiotic Lactobacillus against hepatic steatosis via reducing host intestinal fatty acid absorption[J]. Exp Mol Med, 2019, 51(8): 1-14.
[PubMed]
|
| [30] |
Akhtar DH, Iqbal U, Vazquez-Montesino LM, Dennis BB, Ahmed A. Pathogenesis of insulin resistance and atherogenic dyslipidemia in nonalcoholic fatty liver disease[J]. J Clin Transl Hepatol, 2019, 7(4): 362-370.
[PubMed]
|
| [31] |
李兵航, 陆伦根. 胆汁酸结合受体TGR5在非酒精性脂肪性肝病中的作用[J]. 国际消化病杂志, 2018, 38(3): 179-182. [DOI]
|
| [32] |
Wang W, Xu AL, Li ZC, Li Y, Xu SF, Sang HC, Zhi F. Combination of probiotics and salvia miltiorrhiza polysaccharide alleviates hepatic steatosis via gut microbiota modulation and insulin resistance improvement in high fat-induced NAFLD mice[J]. Diabetes Metab J, 2020, 44(2): 336-348.
[DOI]
|
| [33] |
Radziejewska A, Muzsik A, Milagro FI, Martínez JA, Chmurzynska A. One-carbon metabolism and nonalcoholic fatty liver disease: the crosstalk between nutrients, microbiota, and genetics[J]. Lifestyle Genom, 2020, 13(2): 53-63.
[DOI]
|
| [34] |
Ebrahimzadeh Leylabadlo H, Ghotaslou R, Samadi Kafil H, Feizabadi MM, Moaddab SY, Farajnia S, Sheykhsaran E, Sanaie S, Shanehbandi D, Bannazadeh Baghi H. Non-alcoholic fatty liver diseases: from role of gut microbiota to microbial-based therapies[J]. Eur J Clin Microbiol Infect Dis, 2020, 39(4): 613-627.
[DOI]
|
| [35] |
Mao JW, Tang HY, Zhao T, Tan XY, Bi J, Wang BY, Wang YD. Intestinal mucosal barrier dysfunction participates in the progress of nonalcoholic fatty liver disease[J]. Int J Clin Exp Pathol, 2015, 8(4): 3648-3658.
[PubMed]
|
| [36] |
Mcnabney S, Henagan TM. Short chain fatty acids in the colon and peripheral tissues: a focus on butyrate, colon cancer, obesity and insulin resistance[J]. Nutrients, 2017, 9(12): 1348.
[DOI]
|
| [37] |
Zhu L, Baker RD, Zhu R, Baker SS. Gut microbiota produce alcohol and contribute to NAFLD[J]. Gut, 2016, 65(7): 1232.
[DOI]
|
| [38] |
Duan Y, Llorente C, Lang S, Brandl K, Chu H, Jiang L, White RC, Clarke TH, Nguyen K, Torralba M, Shao Y, Liu J, Hernandez-Morales A, Lessor L, Rahman IR, Miyamoto Y, Ly M, Gao B, Sun W, Kiesel R, Hutmacher F, Lee S, Ventura-Cots M, Bosques-Padilla F, Verna EC, Abraldes JG, Brown RS Jr, Vargas V, Altamirano J, Caballería J, Shawcross DL, Ho SB, Louvet A, Lucey MR, Mathurin P, Garcia-Tsao G, Bataller R, Tu XM, Eckmann L, van der Donk WA, Young R, Lawley TD, Stärkel P, Pride D, Fouts DE, Schnabl B. Bacteriophage targeting of gut bacterium attenuates alcoholic liver disease[J]. Nature, 2019, 575(7783): 505-511.
[DOI]
|
| [39] |
Volynets V, Küper MA, Strahl S, Maier IB, Spruss A, Wagnerberger S, Königsrainer A, Bischoff SC, Bergheim I. Nutrition, intestinal permeability, and blood ethanol levels are altered in patients with nonalcoholic fatty liver disease (NAFLD)[J]. Dig Dis Sci, 2012, 57(7): 1932-1941.
[DOI]
|
| [40] |
Sharpton SR, Maraj B, Harding-Theobald E, Vittinghoff E, Terrault NA. Gut microbiome-targeted therapies in nonalcoholic fatty liver disease: a systematic review, meta-analysis, and meta-regression[J]. Am J Clin Nutr, 2019, 110(1): 139-149.
[DOI]
|
| [41] |
刘晓贞, 徐积兄. 肠道菌群与非酒精性脂肪肝关系的研究进展[J]. 中国老年学杂志, 2019, 39(11): 2815-2818. [DOI]
|
| [42] |
Singh V, Yeoh BS, Chassaing B, Xiao X, Saha P, Aguilera Olvera R, Lapek JD Jr, Zhang L, Wang WB, Hao S, Flythe MD, Gonzalez DJ, Cani PD, Conejo-Garcia JR, Xiong N, Kennett MJ, Joe B, Patterson AD, Gewirtz AT, Vijay-Kumar M. Dysregulated microbial fermentation of soluble fiber induces cholestatic liver cancer[J]. Cell, 2018, 175(3): 679-694.
[DOI]
|
| [43] |
任习芳, 张丽静. 益生菌制剂辅助治疗中重度脂肪肝患者肠功能紊乱的临床疗效[J]. 医药导报, 2019, 38(5): 603-606. [CNKI]
|
| [44] |
Bomhof MR, Parnell JA, Ramay HR, Crotty P, Rioux KP, Probert CS, Jayakumar S, Raman M, Reimer RA. Histological improvement of non-alcoholic steatohepatitis with a prebiotic: a pilot clinical trial[J]. Eur J Nutr, 2019, 58(4): 1735-1745.
[PubMed]
|
| [45] |
朴善英, 徐小达. 肠道益生菌辅治对非酒精性脂肪性肝硬化患者糖脂代谢、氧化损伤和肝功能的影响[J]. 中国医学工程, 2019, 27(10): 102-104. [CNKI]
|
| [46] |
高琦. 肠道益生菌辅治对非酒精性脂肪性肝硬化患者糖脂代谢、氧化损伤和肝功能的影响[J]. 微量元素与健康研究, 2019, 36(2): 20-21. [CNKI]
|
| [47] |
Sepideh A, Karim P, Hossein A, Leila R, Hamdollah M, Mohammad E G, Mojtaba S, Mohammad S, Ghader G, Seyed Moayed A. Effects of multistrain probiotic supplementation on glycemic and inflammatory indices in patients with nonalcoholic fatty liver disease: a double-blind randomized clinical trial[J]. J Am Coll Nutr, 2016, 35(6): 500-505.
[PubMed]
|
| [48] |
Famouri F, Shariat Z, Hashemipour M, Keikha M, Kelishadi R. Effects of probiotics on nonalcoholic fatty liver disease in obese children and adolescents[J]. J Pediatr Gastroenterol Nutr, 2017, 64(3): 413-417.
[PubMed]
|
| [49] |
凌琳, 王俊, 但果. 益生菌联合熊去氧胆酸治疗非酒精性脂肪性肝病疗效观察[J]. 检验医学与临床, 2019, 16(23): 3413-3415. [CNKI]
|
| [50] |
Zhou D, Pan Q, Shen F, Cao HX, Ding WJ, Chen YW, Fan JG. Total fecal microbiota transplantation alleviates high-fat diet-induced steatohepatitis in mice via beneficial regulation of gut microbiota[J]. Sci Rep, 2017, 7(1): 1529.
[PubMed]
|
| [51] |
Zeng H, Larson KJ, Cheng WH, Bukowski MR, Safratowich BD, Liu Z, Hakkak R. Advanced liver steatosis accompanies an increase in hepatic inflammation, colonic, secondary bile acids and Lactobacillaceae/Lachnospiraceae bacteria in C57BL/6 mice fed a high-fat diet[J]. J Nutr Biochem, 2020, 78: 108336.
[DOI]
|
| [52] |
Liu C, Wang YL, Yang YY, Zhang NP, Niu C, Shen XZ, Wu J. Novel approaches to intervene gut microbiota in the treatment of chronic liver diseases[J]. FASEB J, 2021, 35(10): e21871.
[DOI]
|
 2021, Vol. 16
2021, Vol. 16


