2. 复旦大学附属儿科医院厦门分院呼吸科,福建 厦门 361006;
3. 国家儿童医学中心,复旦大学附属儿科医院统计与数据管理中心,上海 201102;
4. 国家儿童医学中心,复旦大学附属儿科医院分子生物实验室,上海 201102;
5. 国家儿童医学中心,复旦大学附属儿科医院呼吸科,上海 201102;
6. 中国疾病预防控制中心病毒病预防控制所应急技术中心,北京 102206
2. Respiratory Department, Children's Hospital Xiamen Branch, Xia Men 361006, Fujian Province, China;
3. Department of Statistics and Data Management, Children's Hospital of Fudan University, National Children's Medical Center, Shanghai 201102, China;
4. Virology Department, Children's Hospital of Fudan University, National Children's Medical Center, Shanghai 201102, China;
5. Respiratory Department, Children's Hospital of Fudan University, National Children's Medical Center, Shanghai 201102, China;
6. Key Laboratory of Medical Virology, Ministry of the Health, National Institute for Viral Disease Control and Prevention, China CDC, Beijing 102206, China
肺炎是儿童住院治疗的常见原因,肺炎链球菌(Streptococcus pneumoniae,SP)曾是导致儿童大叶性肺炎的主要病原体。疫苗的接种和抗菌素的普遍使用,可能导致SP不再是儿童实变性肺炎的主要病原体[1-3]。由于肺炎发生时存在于肺部的病原体尚不能明确,因而研究病原谱构成对临床上制订抗感染治疗策略、对疾病进行防控等有直接指导意义。对支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)标本进行检测,能较准确反映肺部病原体的感染情况,但一般只在较严重的肺部感染如肺部实变不张时通过支气管镜诊治时采集[4-6]。对存在肺炎肺实变患儿的BALF标本进行病原学检测与分析,可以了解此类临床表型患儿的肺部病原体构成。本研究依托国家儿童医学中心病原学检测平台,分析2019年1月—2020年1月复旦大学附属儿科医院纤维支气管镜室诊治的住院肺炎病例的BALF标本病原谱,期望供临床和科研参考,并为今后多重聚合酶链反应(multiple polymerase chain reaction,multiple PCR)、二代测序(也称next-generation sequencing,NGS)等新技术平台在临床应用[6-7]提供基础数据。
1 材料和方法 1.1 研究对象以2019年1月—2020年1月在复旦大学附属儿科医院(国家儿童医学中心)纤维支气管镜室接受诊治的291例患儿及其293份BALF标本为研究对象。纳入标椎为研究期间本中心所有行纤维支气管镜检查的病例及对应获取的BALF标本;排除标准为院内呼吸道感染、新生儿、气道异物吸入、肺结核等病例。本研究经复旦大学附属儿科医院伦理委员会批准。病例诊断参照儿童社区获得性肺炎诊疗规范(2019年版)标准[5]。
1.2 研究方法 1.2.1 样本信息采集根据统一的流行病学调查表,由专人采集医院360电子信息系统中样本人群的临床信息,包括影像学检查和病原学资料。临床信息包括患者的年龄、性别、临床诊断和纤维支气管镜手术日期,影像学检查包括胸部X线检查、胸部电子计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)。
病原学资料由两名高年资小儿感染科医师基于临床信息解读。
1.2.2 检测试剂盒将BALF标本进行细菌学培养,同时采用直接免疫荧光法(direct immunofluorescence assay,DFA)检测标本中呼吸道合胞病毒、腺病毒、甲型/乙型流感病毒、副流感病毒1型/2型/3型、人偏肺病毒8种呼吸道病毒。使用美国Chemicon公司的呼吸道病毒诊断试剂盒检测呼吸道合胞病毒、腺病毒、甲型流感与乙型流感病毒、副流感病毒1型/2型/3型;人偏肺病毒检测采用美国HYBRIDS公司Metapneumovirus DFA Reagent试剂盒完成。BALF鼻病毒检测采用湖北朗德医疗科技有限公司人鼻病毒核酸检测PCR-荧光探针法试剂盒完成;BALF肺炎支原体检测使用中山大学达安基因股份有限公司肺炎支原体核酸检测试剂盒完成。上述检测均严格按照试剂盒说明书进行操作。
1.2.3 结核感染T细胞斑点试验(T-cell spot test for tuberculosis infection, T-SPOT)操作按试剂盒说明书及文献报道[8]进行。
1.2.4 支气管肺泡灌洗术患儿家长签署知情同意书,局麻下进行手术。选择患儿病变肺段,将支气管镜置于目的肺叶,使用生理盐水分3次进行灌洗,总量1~3 mL/kg;吸引器以25~100 kPa负压收集BALF于无菌试管,4~8 ℃条件下送中心实验室检测,若不能及时送检则置于-80 ℃冻存。
1.3 统计学分析采用SPSS 23.0统计学软件对数据进行分析。计量资料根据数据的分布特征采用均数±标准差(x±s)进行描述,计数资料以n(%)进行描述。计量资料组间比较采用Student t检验,分类资料组间比较采用χ2检验或Fisher精确概率检验。不同年龄组检出率多重比较采用卡方分割法进行检验。P < 0.05代表差异有统计学意义。
2 结果 2.1 临床信息291例患儿中5例患儿存在气道异物或吸入,共286例患儿纳入研究;每名患儿可采集到1份独立标本,共286份。其中,195例患儿存在肺炎肺实变,对应195份BALF标本(见表 1)。
| 人口统计学特征 |
肺实变(n=195) | 无肺实变(n=91) | 总计病例(n=286) | |
| 年龄(岁) | 平均值 | 5.7 | 4.9 | 5.5 |
| 标准差 | 3.3 | 2.6 | 3.1 | |
| 中位数 | 6.0 | 4.7 | 5.8 | |
| 最小值 | 0.4 | 0.5 | 0.4 | |
| 最大值 | 17.0 | 12.0 | 17.0 | |
| 年龄组(岁),n(%) | < 1 | 12(6.1) | 4(4.4) | 16(5.6) |
| 1~ < 5 | 60(30.8) | 45(49.5) | 105(36.7) | |
| ≥5 | 123(63.1) | 42(46.1) | 165(57.7) | |
| 性别,n(%) | 男性 | 98(50.3) | 45(49.5) | 143(50.0) |
| 女性 | 97(47.7) | 46(50.5) | 143(50.0) | |
| 存在基础性疾病(例),n(%) | 20(10.3) | 15(16.5) | 35(12.2) | |
由患儿信息特征数据可知,12.2%(35/286)的患儿存在基础疾病,分别为免疫缺陷7例(低丙种球蛋白血症1例、无丙种球蛋白血症1例、慢性肉芽肿病1例、PIK3CD基因突变2例、SH2D1A基因突变1例、CD48LG基因突变1例),支气管哮喘6例,支气管狭窄2例,囊性纤维化病伴支气管扩张和胰腺外分泌功能不全1例,癫痫1例,结节性硬化症1例,先天性支气管软化伴漏斗胸1例,Prader-Willi综合征1例,先天性支气管狭窄伴肌性斜颈1例,先天性单肾缺如1例、先天性心脏病(术后)1例,染色体异常伴脑发育不全1例,喉先天性畸形(喉裂术后)1例,胃食管反流1例,系统性血管炎(ANCA相关性血管炎)1例,食管裂孔疝1例,色素失调症伴左侧视网膜摘除术后1例,先天性外耳道闭锁(左侧)1例,先天性半椎体畸形(左侧T3)伴先天性心脏病(继发房缺、卵圆孔未闭)1例,髓质海绵肾1例,幼年特发性关节炎1例,幼年型皮肌炎1例,生长发育迟缓伴房室分离1例。
2.2 病原学检测结果 2.2.1 病原检出情况286份标本中病原总检出率为76.6%(219/286);肺实变和无肺实变肺炎患儿标本病原检出率分别为77.9%(152/195)和73.6%(67/91)。286份标本中,单种病原检出率为61.9%(177/286),其中肺炎支原体单独检出率为52.1%(149/286),混合病原检出率为14.7%(42/286)。前5种检出病原体为肺炎支原体、腺病毒、鼻病毒、呼吸道合胞病毒和副流感病毒3型,检出率分别为65.4%(187/286)、9.8%(28/286)、6.6%(19/286)、2.4%(7/286)和2.4%(7/286);肺实变和无肺实变肺炎患儿标本中前5种病原相同,且检出率差异无统计学意义(P>0.05)。具体如表 2所示。
| 病原体检出n(%) | 肺实变标本(n=195) | 无肺实变标本(n=91) | 总计(n=286) | P | χ2 |
| 总检出 | 152(77.9) | 67(73.6) | 76.6(219) | 0.421 | 0.646 |
| 单一病原检出 | 123(63.1) | 54(59.3) | 177(61.9) | 0.545 | 0.367 |
| 混合病原检出 | 29(14.9) | 13(14.3) | 42(14.7) | 0.869 | 0.017 |
| 肺炎支原体 | 131(67.2) | 56(61.5) | 187(65.4) | 0.350 | 0.872 |
| 腺病毒 | 23(11.8) | 5(5.5) | 28(9.8) | 0.095 | 2.789 |
| 鼻病毒 | 11(5.6) | 8(8.8) | 19(6.6) | 0.319 | 0.993 |
| 呼吸道合胞病毒 | 4(2.1) | 3(3.3) | 7(2.4) | 0.823 | 0.050 |
| 副流感病毒3型 | 3(1.5) | 4(4.4) | 7(2.4) | 0.296 | 1.093 |
| 注:肺炎支原体、腺病毒、鼻病毒、呼吸道合胞病毒、副流感病毒3型为检出最多的5种病原体。 | |||||
286份标本中细菌学培养阳性11份(株):其中肺炎链球菌5株(4株单一感染,1株合并肺炎支原体阳性)、铜绿假单胞菌2株(1株合并肺炎支原体阳性,1株合并肺炎支原体和鼻病毒阳性)、金黄色葡萄球菌(合并肺炎支原体和鼻病毒阳性)、副流感嗜血杆菌(单一感染)、鲍曼不动杆菌(合并肺炎支原体阳性)和嗜麦芽假单胞菌(合并肺炎支原体、鼻病毒和副流感病毒3型阳性)各1株。所有标本真菌培养阴性,且所有病例T-SPOT结果阴性。
肺炎支原体real-time PCR检测阳性判定为肺炎支原体阳性,本研究肺炎支原体阳性检出率为65.4%(187/286)。
2.2.2 各月份病原体检出情况肺炎支原体呈全年高检出表现,在8月份检出率最高,为92.3%(12/13);腺病毒检出率也在8月份达最高,为23.1%(3/13);鼻病毒检出率在10月份最高,为15.0%(3/20)。各病原不同月份检出分布流向如图 1所示。
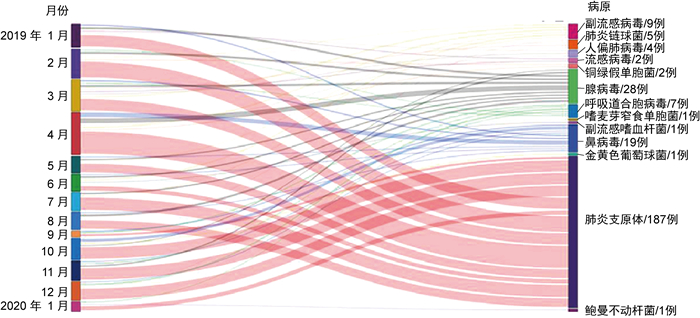
|
| Note: drawned by Power BI software, the widths of the data bars on both sides correspond to the monthly specimen numbers and the positive specimen samples of each pathogen. 图 1 各月份的病原检出分布 Fig. 1 Distribution of pathogens detected in each month |
3个年龄组总病原检出率差异比较:< 1岁、1~ < 5岁、≥5岁患儿中总病原检出率分别为68.8%(11/16)、70.5%(74/105)和81.2%(134/165),各两组间病原检出率差异无统计学意义(P>0.05)。肺炎支原体在各年龄组中的检出率分别为31.3%(5/16)、53.3%(56/105)和77.0%(127/165),各两组间肺炎支原体检出率差异有统计学意义(P < 0.05),且年龄越大,检出率越高;腺病毒、鼻病毒的检出率则随年龄增长而下降。具体如图 2所示。
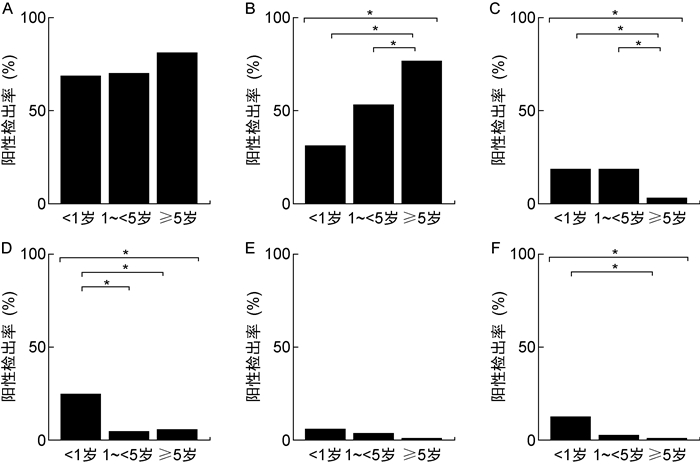
|
| 注:A总病原;B肺炎支原体;C腺病毒;D鼻病毒;E呼吸道合胞病毒;F副流感病毒3型;*P < 0.05。 图 2 各年龄组病原检出率比较 Fig. 2 Pathegon detection in each age group |
各年龄组内有、无肺实变总病原检出率差异比较:< 1岁、1~ < 5岁、≥5岁患儿中有肺实变和无肺实变病例总病原检出率分别为66.7%(8/12)和75.0%(3/4)、71.7%(43/60)和68.9%(31/45)、82.1%(101/123)和78.6%(33/42),检出率差异均无统计学意义(P>0.05)。各年龄组内有、无肺实变患儿之间几种主要病原检出率差异比较:各年龄组患儿无论是否有肺实变,其肺炎支原体、鼻病毒、呼吸道合胞病毒和副流感病毒3型的检出率差异均无统计学意义(P>0.05)。1~ < 5岁有肺实变和无肺实变病例中腺病毒检出率分别为26.7%(16/60)和68.9%(31/45),差异有统计学意义(P < 0.05),< 1岁和≥5岁病例中,有肺实变和无肺实变患儿的腺病毒检出率差异均无统计学意义(P>0.05),具体如图 3所示。
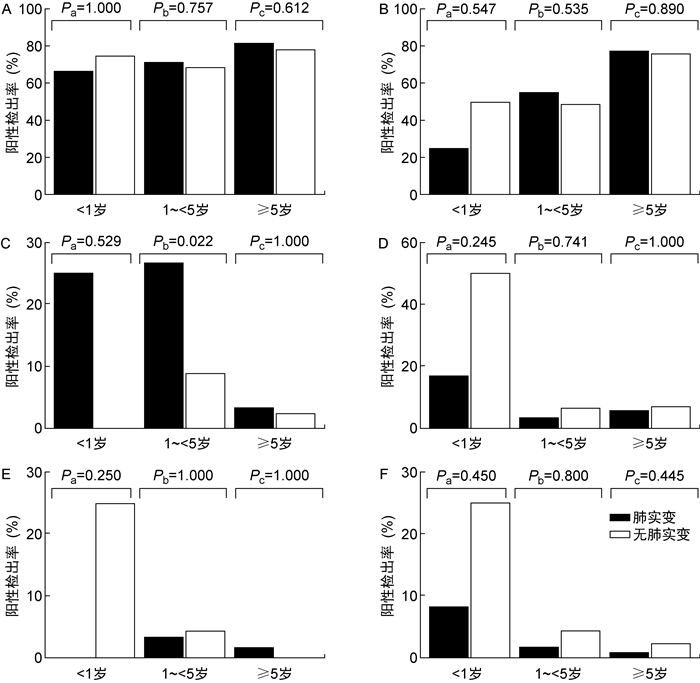
|
| 注:A总病原;B肺炎支原体;C腺病毒;D鼻病毒;E呼吸道合胞病毒;F副流感病毒3型。 Note: ①~⑥The detection rate of total and the top five pathogens in children with or without lung consolidation in three age groups. Pa: Difference in children under 1 year old; Pb: Difference in 1 to 5 years old; Pc: Difference in 5 years and older. 图 3 各年龄组有肺实变和无肺实变患儿病原检出率比较 Fig. 3 Comparison of pathogen detection rates in patients with or without pulmonary consolidation in different age groups |
儿科临床中肺炎肺实变的病例较常见,但典型的肺炎球菌性肺炎(又称大叶性肺炎)发病率已降低[1, 9]。感染性肺炎伴肺实变相对于无实变病例,其抗感染治疗可能相对复杂,并易形成肺空洞、坏死性肺炎等远期并发症。对支气管肺泡灌洗液标本进行病原学检测基本可确定导致肺部炎症的真实病原体[3, 5, 7],明确肺部病原体对临床经验性抗感染治疗有指导作用。本研究基于国家儿童医学中心较成熟的临床微生物实验室平台和感染专科的有利条件,对2019年1月—2020年1月复旦大学附属儿科医院(国家儿童医学中心)的单中心纤维支气管镜手术病例的临床资料进行回顾性分析。在纳入的286例病例中,最小年龄为0.4岁,最大年龄为17岁,平均年龄和中位数分别为5.7岁和6.0岁,提示研究样本人群亦是期间实施纤维支气管镜手术的主要人群,即5岁左右的学龄前期和学龄期儿童。课题组的既往研究发现,上海社区获得性肺炎(community acquired pneumonia,CAP)患儿中,≥5岁患儿由于肺炎支原体感染而导致急性下呼吸道感染的可能性明显升高,同时腺病毒、鼻病毒和呼吸道合胞病毒亦均为本地区儿童急性下呼吸道感染最常见的病原体[10-15]。< 1岁及≥5岁患儿的CAP病原谱与1~ < 5岁患儿相比可能存在差异[1, 2, 10-11, 15],因此本研究按此年龄分层进行分析。肺炎伴肺实变患儿与无肺实变患儿的致病原之间是否存在明显差异是本研究的目的之一。
在本研究中,总病原检出率为76.6%(219/286),明显高于课题组以往研究的急性下呼吸道感染住院患儿标本53.9%的总病原检出率[10]。可能的原因是,一方面本研究检测支气管肺泡灌洗液而非经鼻吸取的深部痰液,可能有更高的病原检出率;另一方面本研究中增加了鼻病毒及人偏肺病毒的检测,两者检出阳性标本数分别为19份和4份,共7份标本是人偏肺病毒及鼻病毒单独检测,贡献了2.4%(7/286)的检出率(结果未显示);而更主要的原因可能是,本研究病例的肺部感染相对较重、存在基础性疾病的患儿较多、需要纤维支气管镜进行诊治。前5种检出病原为肺炎支原体、腺病毒、鼻病毒、呼吸道合胞病毒和副流感病毒3型,检出率分别为65.4%(187/286)、9.8%(28/286)、6.6%(19/286)、2.4%(7/286)和2.4%(7/286),与以往儿童CAP的主要病原学研究结果基本一致[1, 10, 15]。以往的研究发现,在不同的儿童年龄组、不同的地理区域、不同的年份或纳入的不同样本人群中,检测到的CAP病原谱可能不同[1, 7]。
本研究的BALF细菌培养结果表明,肺炎链球菌检出率最高,但阳性率仅为1.7%(5/286);细菌培养时活菌的检出率低,不排除与纤维支气管镜手术前采用抗菌素治疗有关。提示今后应采用其他技术方法,如multiplex PCR、NGS等进一步检测病原体核酸加以验证,这也是课题组未来的研究方向。
由于本研究仅跨度13个月,对各病原体的季节性分布情况研究意义有限。但比较明确的是,肺炎支原体检出率在全年均较高,包括在肺实变患儿中亦是如此;其他病原因样本量较小,很难在病原检出分布流行图上体现其流行季节分布的特点,比如呼吸道合胞病毒共检出7份标本阳性,其中2019年2月、3月、9月、11月和2020年1月分别有1份阳性,2019年12月2份阳性,这可能与以往存在冬季流行高峰[1, 10, 15-16]的研究结果一致。
本研究主要发现:①肺实变和无肺实变肺炎患儿总病原检出率分别为77.9%(152/195)和73.6%(67/91),差异无统计学意义;②在 < 1岁、1~ < 5岁、≥5岁3个年龄组内,肺实变和无肺实变肺炎患儿总病原检出率分别为66.7%(8/12)和75.0%(3/4),71.7%(43/60)和68.9%(31/45),82.1%(101/123)和78.6%(33/42),检出率差异均无统计学意义(P>0.05);③在同一年龄组内,肺实变和无肺实变的肺炎病例中,肺炎支原体、鼻病毒、呼吸道合胞病毒和副流感病毒3型的检出率差异均无统计学意义(P>0.05),1~ < 5岁有肺实变和无实变病例中腺病毒检出率分别为26.7%(16/60)和68.9%(31/45),差异具有统计学意义(P < 0.05),而在 < 1岁和≥5岁病例中,有肺实变和无实变患儿的腺病毒检出率差异均无统计学意义(P>0.05)。这些结果提示,导致肺实变CAP的主要病原体与无肺实变CAP的主要病原体可能基本相同,这对临床经验性抗感染治疗有一定的参考意义。
在本研究中,< 1岁、1~ < 5岁、≥5岁3个年龄组病例的总病原检出率分别为68.8%(11/16)、70.5%(74/105)和81.2%(134/165),各两组间病原检出率差异无统计学意义(P>0.05),提示总病原检出率可能与年龄不相关;肺炎支原体在各年龄组的检出率分别为31.3%(5/16)、53.3%(56/105)和77.0%(127/165),各两组间肺炎支原体检出率差异具有统计学意义(P < 0.05),且年龄越大,检出率越高;腺病毒、鼻病毒则随年龄增长,检出率下降,证实在不同的年龄组内,CAP病原谱可能不同,这与既往的相关研究相符[13, 15]。需要指出的是,本研究中按照此年龄分层得到的所有结果,如扩大样本量或采用不同方法进行年龄分层,可能会有不同的结果,后续的研究须进一步明确。
本研究的特点是利用BALF对导致儿童CAP并肺实变的病原谱进行分析,这对临床有一定的提示意义。但由于单中心、小样本量而未能将病例根据标本采集时的病程或抗感染情况进行分组,且病原学检测方法不统一(综合了DFA、PCR和细菌培养),针对以上研究局限,未来将补充相关的研究。今后,将针对儿童肺实变这类特殊的样本人群,于严重急性呼吸综合征冠状病毒2型等特殊病原体流行期间,开展儿童CAP的病原学研究,利用新的技术推广[17-19]进一步完善儿童肺炎病原谱,理论上均可为临床预防和诊治CAP带来益处。
| [1] |
Jain S, Williams DJ, Arnold SR, Ampofo K, Bramley AM, Reed C, Stockmann C, Anderson EJ, Grijalva CG, Self WH, Zhu Y, Patel A, Hymas W, Chappell JD, Kaufman RA, Kan JH, Dansie D, Lenny N, Hillyard DR, Haynes LM, Levine M, Lindstrom S, Winchell JM, Katz JM, Erdman D, Schneider E, Hicks LA, Wunderink RG, Edwards KM, Pavia AT, McCullers JA, Finelli L, CDC EPIC Study Team. Community-acquired pneumonia requiring hospitalization among U.S children[J]. N Engl J Med, 2015, 372(9): 835-845.
[DOI]
|
| [2] |
Kutty PK, Jain S, Taylor TH, Bramley AM, Diaz MH, Ampofo K, Arnold SR, Williams DJ, Edwards KM, McCullers JA, Pavia AT, Winchell JM, Schrag SJ, Hicks LA. Mycoplasma pneumoniae among children hospitalized with community-acquired pneumonia[J]. Clin Infect Dis, 2019, 68(1): 5-12.
[PubMed]
|
| [3] |
Mackenzie GA, Hill PC, Sahito SM, Jeffries DJ, Hossain I, Bottomley C, Uchendu U, Ameh D, Ndiaye M, Osuorah CD, Adeyemi O, Pathirana J, Olatunji Y, Abatan B, Ahameefula E, Muhammad BS, Fombah AE, Saha D, Mackenzie R, Plumb I, Akano A, Ebruke B, Ideh RC, Kuti B, Githua P, Olutunde E, Ofordile O, Green E, Usuf E, Badji H, Ikumapayi UNA, Manjang A, Salaudeen R, Nsekpong ED, Jarju S, Antonio M, Sambou S, Ceesay L, Lowe-Jallow Y, Sowe D, Jasseh M, Mulholland K, Knoll M, Levine OS, Howie SR, Adegbola RA, Greenwood BM, Corrah T. Impact of the introduction of pneumococcal conjugate vaccination on pneumonia in the Gambia: population-based surveillance and case-control studies[J]. Lancet Infect Dis, 2017, 17(9): 965-973.
[DOI]
|
| [4] |
Miller JM, Binnicker MJ, Campbell S, Carroll KC, Chapin KC, Gilligan PH, Gonzalez MD, Jerris RC, Kehl SC, Patel R, Pritt BS, Richter SS, Robinson-Dunn B, Schwartzman JD, Snyder JW, Telford S 3rd, Theel ES, Thomson RB Jr, Weinstein MP, Yao JD. A guide to utilization of the microbiology laboratory for diagnosis of infectious diseases: 2018 update by the infectious diseases society of America and the American society for microbiology[J]. Clin Infect Dis, 2018, 67(6): 813-816.
[DOI]
|
| [5] |
中华人民共和国国家健康委员会, 国家中医药局. 儿童社区获得性肺炎诊疗规范(2019年版)[J]. 中华临床感染病杂志, 2019, 12(1): 6-13. [DOI]
|
| [6] |
Zar H J, Andronikou S, Nicol M P. Advances in the diagnosis of pneumonia in children[J]. BMJ, 2017, 358: j2739.
[DOI]
|
| [7] |
Zhang N, Wang L, Deng X, Liang R, Su M, He C, Hu L, Su Y, Ren J, Yu F, Du L, Jiang S. Recent advances in the detection of respiratory virus infection in humans[J]. J Med Virol, 2020, 92(4): 408-417.
[DOI]
|
| [8] |
刘珍敏, 赵瑞秋, 许红梅. 结核感染T细胞斑点试验、涂片检查和结核菌素试验在儿童结核病诊断中的价值[J]. 临床儿科杂志, 2019, 37(4): 282-287. [DOI]
|
| [9] |
Hortal M, Estevan M, Laurani H, Iraola I, Meny M; Paysandú/Salto Study Group. Hospitalized children with pneumonia in Uruguay: pre and post introduction of 7 and 13-valent pneumococcal conjugated vaccines into the National Immunization Program[J]. Vaccine, 2012, 30(33): 4934-4938.
[DOI]
|
| [10] |
沈军, 朱启镕, 俞蕙, 王晓红. 急性下呼吸道感染住院儿童病原及临床流行病学分析[J]. 中华传染病杂志, 2009, 27(11): 668-672. [CNKI]
|
| [11] |
沈军, 朱启镕, 曹林峰, 俞蕙, 王晓红. 肺炎支原体和沙眼衣原体致儿童急性下呼吸道感染的研究[J]. 微生物与感染, 2010, 5(2): 73-76. [DOI]
|
| [12] |
Wang Y, Li Y, Lu R, Zhao Y, Xie Z, Shen J, Tan W. Phylogenetic evidence for intratypic recombinant events in a novel human adenovirus C that causes severe acute respiratory infection in children[J]. Sci Rep, 2016, 6: 23014.
[DOI]
|
| [13] |
李亚敏, 刘高山, 周为民, 赵彦杰, 李玉川, 沈军, 谭文杰. 上海市重症急性呼吸道感染儿童中可检出多种型别的人腺病毒[J]. 中华实验和临床病毒学杂志, 2016(1): 10-13. [DOI]
|
| [14] |
Zhao Y, Shen J, Wu B, Liu G, Lu R, Tan W. Genotypic diversity and epidemiology of human rhinovirus among children with severe acute respiratory tract infection in Shanghai, 2013-2015[J]. Front Microbiol, 2018, 9: 1836.
[DOI]
|
| [15] |
Zhao Y, Lu R, Shen J, Xie Z, Liu G, Tan W. Comparison of viral and epidemiological profiles of hospitalized children with severe acute respiratory infection in Beijing and Shanghai, China[J]. BMC Infect Dis, 2019, 19(1): 729.
[DOI]
|
| [16] |
Li J, Tao Y, Tang M, Du B, Xia Y, Mo X, Cao Q. Rapid detection of respiratory organisms with the FilmArray respiratory panel in a large children's hospital in China[J]. BMC Infect Dis, 2018, 18(1): 510.
[DOI]
|
| [17] |
Leber A L, Everhart K, Daly J A, Hopper A, Harrington A, Schreckenberger P, McKinley K, Jones M, Holmberg K, Kensinger B. Multicenter evaluation of biofire filmarray respiratory panel 2 for detection of viruses and bacteria in nasopharyngeal swab samples[J]. J Clin Microbiol, 2018, 56(6): e01945-17.
[DOI]
|
| [18] |
Li J, Tao Y, Tang M, Du B, Xia Y, Mo X, Cao Q. Rapid detection of respiratory organisms with the FilmArray respiratory panel in a large children's hospital in China[J]. BMC Infect Dis, 2018, 18(1): 510.
[DOI]
|
| [19] |
徐佳楠, 潘明, 李天舒, 吴海燕, 童文彬, 何树森, 杨慧萍. 多重PCR技术和呼吸道病原体微流体芯片在诊断儿童急性呼吸道病毒感染中的应用[J]. 中华实验和临床病毒学杂志, 2020, 34(2): 202-206. [DOI]
|
 2021, Vol. 16
2021, Vol. 16


