2. 复旦大学上海医学院基础医学院病原生物学系, 教育部、卫健委、医科院医学分子病毒学重点实验室, 上海 200030
2. Key Laboratory of Medical Molecular Virology (MOE/NHC/CAMS), School of Basic Medical Sciences, Shanghai Medical College, Fudan University, Shanghai 200030, China
肺炎克雷伯菌(Klebsiella pneumoniae,KP)属肠杆菌科克雷伯菌属,是重要条件致病菌,可引起肺炎、血流感染、尿路感染和肝脓肿等疾病[1]。碳青霉烯类抗生素是目前疗效最确切的耐药革兰阴性菌感染治疗药物,但碳青霉烯类耐药肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumonia, CRKP)检出率呈快速上升趋势,且CRKP大多呈现出多重耐药性,更易引起医院内感染的发生,给临床诊疗和感染控制带来了极大的困难[2, 3]。
本研究对上海市某三甲医院就诊患者血标本分离的CRKP菌株进行耐药表型和分子流行病学分析,明确该地区的耐药现状与传播规律,以期对CRKP的临床合理用药及精准防控提供依据。
1 材料和方法 1.1 菌株及鉴定收集上海市某三甲医院2015年4月至2018年3月期间确诊血流感染的住院患者血培养阳性标本中分离的KP临床株。若发生多次血流感染,仅纳入第1次。菌株按常规方法接种、培养和纯化,采用法国生物梅里埃公司VITEK 2 Compact全自动细菌鉴定仪鉴定细菌种属。CRKP定义为对亚胺培南或美罗培南其中一种药物耐药的KP。
1.2 病例资料使用住院患者病史采集系统及联众病史系统,对入组患者临床资料进行收集分析,包括患者性别、年龄、所在科室、住院天数、转科经历、手术及侵入性操作、诊断、住院期间用药及预后等信息[4]。
1.3 药敏试验按照2018年版美国临床和实验室标准化协会(CLSI)推荐的药敏试验要求[5],使用纸片扩散法或琼脂稀释法进行15种抗菌药物的敏感性试验。大肠埃希菌ATCC25922和KP ATCC13883作为质控菌。替加环素的药敏结果按照美国食品药品监督管理局(FDA)的标准进行判读(https://www.fda.gov/drugs/development-resources/antibacterial-susceptibility-test-interpretive-criteria),其他抗菌药物的药敏结果根据2018年版CLSI标准判读[5]。
1.4 耐药基因检测使用聚合酶链反应(polymerase chain reaction,PCR)扩增检测5种碳青霉烯酶基因: blaKPC、blaIMP、blaNDM、blaOXA-48和blaVIM,参考相关文献进行引物设计并设置反应条件[6]。PCR阳性产物的测序序列上传至https://blast.ncbi.nlm.nih.gov/Blast.cgi进行比对。
1.5 多位点序列分型(MLST)参照Diancourt等的方法设计引物并设置反应条件[7],对KP基因组上的7个管家基因(gapA、infB、mdh、pgi、phoE、rpoB、tonB)进行PCR扩增。PCR扩增阳性产物的测序序列上传至MLST数据库(www.pasteur.fr/mlst/Kpneumoniae.html)进行比对分型,并确定序列型(ST)。
1.6 脉冲场凝胶电泳分析按Tenover等人推荐的方法对CRKP临床菌株进行脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)[8],制备好细菌包埋胶块,经裂解、清洗、XbaI酶切后,置于1% SeaKem Gold凝胶中电泳,电泳时间19 h。成像得到的图片使用Bionumerics软件处理,对电泳条带进行聚类分析,比较菌株间的亲缘关系并绘制系统树。采用非加权配对算术平均法(unweighted pair-group method with Arithmetic mean,UPGMA)进行聚类分析,以Dice系数分析比较菌株的同源性,PFGE带型相似性>85%分类为同一簇,相似性100%时认定为同一基因型别(PFGE types,PT)。
2 结果 2.1 CRKP的检出及分布从2015年4月至2018年3月血流感染患者血培养阳性标本中分离到非重复KP 115株。从中筛选到51株CRKP,检出率44.3%。将CRKP菌株命名为K1-K51。
获得的CRKP主要来自该院重症监护病房(intensive care unit,ICU) 14株(27.5%)、感染病科13株(25.5%)、神经外科11株(21.6%)和普外科8株(15.7%),其余来自肾内科2株,泌尿外科、抗生素科和综合科各1株。51例CRKP血流感染患者中,院内感染为39例(76.5%),卫生保健相关的7例(13.7%),社区获得的5例(9.8%)。
时间分布上,每个季度的检出率在0.00~76.9%不等,详见表 1。2015年第3季度未检出,2017年第2季度检出例数最多(10株),检出率也最高(76.9%)。
| 时间 | Carbapenem-resistant Klebsiella pneumonia(n) | Klebsiella pneumoniae(n) | 检出率(%) |
| 2015年第2季度 | 2 | 8 | 25.0 |
| 2015年第3季度 | 0 | 7 | 0.0 |
| 2015年第4季度 | 1 | 7 | 14.3 |
| 2016年第1季度 | 4 | 9 | 44.4 |
| 2016年第2季度 | 4 | 8 | 50.0 |
| 2016年第3季度 | 4 | 9 | 44.4 |
| 2016年第4季度 | 5 | 10 | 50.0 |
| 2017年第1季度 | 7 | 12 | 58.3 |
| 2017年第2季度 | 10 | 13 | 76.9 |
| 2017年第3季度 | 7 | 17 | 41.2 |
| 2017年第4季度 | 5 | 10 | 50.0 |
| 2018年第1季度 | 2 | 5 | 40.0 |
| 总计 | 51 | 115 | 44.3 |
51株CRKP对检测的15种临床常用抗菌药物呈广泛耐药,对其中的哌拉西林、头孢唑啉、头孢吡肟、头孢噻肟、头孢呋辛、头孢他啶、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦和环丙沙星耐药率为100%;对阿米卡星、庆大霉素和复方新诺明的耐药率较高,分别为76.5%、90.2%和62.8%;对替加环素耐药率较低,为3.9%。药敏结果详见表 2。
| 抗菌药物 | 敏感 | 中介 | 耐药 |
| 哌拉西林 | 0(0) | 0(0) | 51(100) |
| 头孢唑啉 | 0(0) | 0(0) | 51(100) |
| 头孢吡肟 | 0(0) | 0(0) | 51(100) |
| 头孢噻肟 | 0(0) | 0(0) | 51(100) |
| 头孢呋辛 | 0(0) | 0(0) | 51(100) |
| 头孢他啶 | 0(0) | 0(0) | 51(100) |
| 头孢哌酮/舒巴坦 | 0(0) | 0(0) | 51(100) |
| 哌拉西林/他唑巴坦 | 0(0) | 0(0) | 51(100) |
| 美罗培南 | 0(0) | 0(0) | 51(100) |
| 亚胺培南 | 0(0) | 0(0) | 51(100) |
| 替加环素 | 46(90.2) | 3(5.9) | 2(3.9) |
| 阿米卡星 | 12(23.5) | 0(0) | 39(76.5) |
| 庆大霉素 | 5(9.8) | 0(0) | 46(90.2) |
| 环丙沙星 | 0(0) | 0(0) | 51(100) |
| 复方新诺明 | 16(31.4) | 3(5.9) | 32(62.6) |
51株CRKP均检测出blaKPC基因,经测序鉴定为blaKPC-2基因,未检测出blaIMP、blaNDM、blaOXA-48和blaVIM基因。
2.3 MLST分型本研究中检测到4种ST型别,以ST11型为主,共43株(84.3%),另有ST15型6株(11.8%)、ST4845型1株及1株新分型,等位基因为(gapA/infB/mdh/pgi/phoE/rpoB/tonB: 3/3/1/234/1/1/4)。
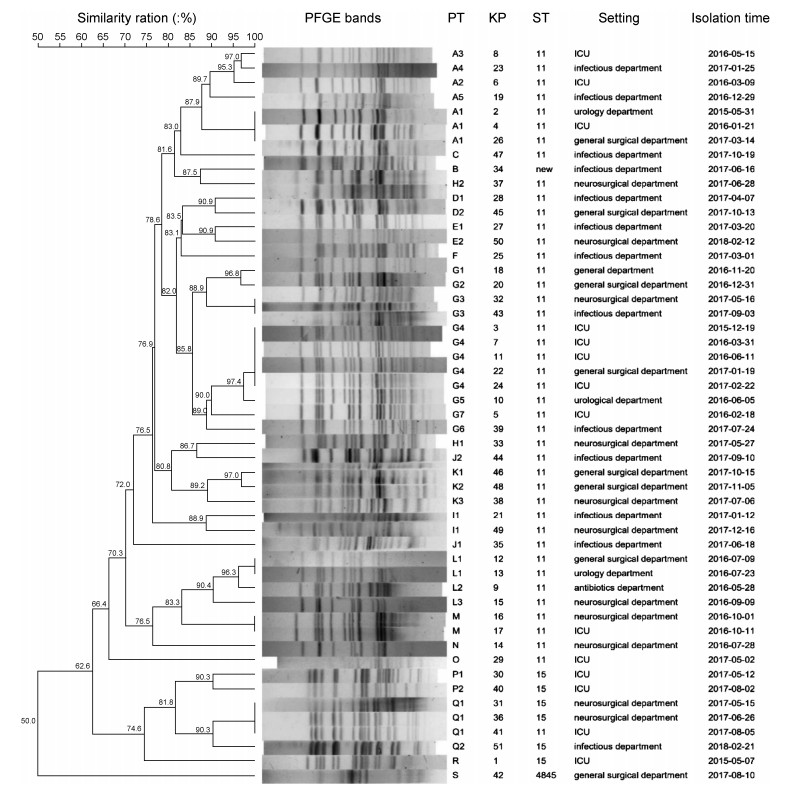
2.4 PFGE聚类分析对CRKP的PFGE图谱进行聚类分析,同源性分析树状图见图 1。51株CRKP的PFGE图谱相似性系数在62.9%~100%,可分为19个簇(A-S簇),每簇分别包含1~12个菌株。其中A簇(13.7%)和G簇(23.5%)包含的菌株相对较多,且MLST分型均为ST11型,为优势簇。G簇包含7个型别,G4型为主要克隆菌株。B、C、F、N、O、R、S一株即为一簇,PFGE条带相似度 < 85%。存在相似性100%的菌株,PT型分别为A1、G3、G4、L1、M和Q1。
|
| 图 1 51株CRKP的PFGE聚类分析 Fig. 1 Cluster analysis based on PFGE patterns of 51 CRKP strains |
KP广泛存在于环境中,可定植于物体表面、人体的肠道、呼吸道及皮肤等部位,在引起院内感染的革兰阴性菌中居第2位[2, 9]。随着抗菌药物被广泛应用,KP耐药问题日益严峻,全国细菌耐药监测网(China antimicrobial resistance surveillance system, CHINET)数据显示,KP对亚胺培南和美罗培南的耐药率分别从2005年的3.0%和2.9%上升到了2019年的25.3%和26.8%[2]。除替加环素、多黏菌素、头孢他啶阿维巴坦和氨曲南阿维巴坦等少数药物外,CRKP对几乎所有常用抗菌药物具有较高的耐药性,为临床治疗带来了巨大的挑战[10]。
本研究中某三甲医院分离的CRKP菌株对头孢菌素类、喹诺酮类和酶抑制剂复方制剂(头孢哌酮/舒巴坦和哌拉西林/他唑巴坦)耐药率达100%,对复方新诺明和氨基糖苷类的耐药率在60%以上,耐药形势严峻。研究发现替加环素的耐药机制与外排泵系统过度表达及单药治疗有关[11]。本研究中检出的CRKP菌株对替加环素耐药率为3.9%,中介率为5.9%,需警惕其在抗生素压力下转变为耐药株的可能。临床上应谨慎、规范地使用抗生素,合理选择联合用药方案,并加强对耐药菌的监测。
在我国,KP对碳青霉烯类耐药的主要原因是碳青霉烯酶的产生,其中KP碳青霉烯酶(Klebsiella pneumoniae carbapenemase,KPC)最为常见,我国主要的流行型别为KPC-2[12]。本研究的51株血标本来源的CRKP中,blaKPC-2基因检出率为100%,与陈君灏等人的研究相符[13],提示上海地区有可能存在携带blaKPC-2的质粒水平传播。有研究表明,ST11型是我国CRKP的主要型别[14]。本研究的血流感染CRKP中,ST11型占比达到84.3%,与文献报道一致。
仅以耐药表型和ST型别不足以区分CRKP菌株间的差异,而PFGE具有重复性好、分辨力高的优点,在分子流行病学研究中广泛运用,对确定感染来源、追踪传播路径、研究遗传演变具有重要意义[15]。本研究的PFGE分析显示,51株CRKP以G簇和A簇为优势群,在2015—2017年均有分布。PFGE结果显示有7个簇相似性<85%,无克隆相关性,为散发流行,遗传背景较为多样,主要为外院带入和社区获得性感染。
本研究中存在6个PFGE型含有2株及以上的菌株,提示该院存在克隆传播,需重视对耐药菌的监测、识别和追踪。其中A1型克隆在不同年份、不同病区检出,提示某些耐药克隆具备传播优势,可在医院中广泛、长期存在,需警惕院内感染的暴发。优势克隆G4型在时间分布上也较为离散,除KP22外均来自ICU。追溯病史发现KP22从普外科患者血培养标本中分离得到,该患者术后立即进入ICU留观,第2天出现高热,当日送检的血标本与伤口分泌物培养到的KP药物敏感性试验表型一致。因此推测,KP22感染与手术相关,由患者在ICU获得,G4型均来自ICU,应当警惕ICU内的克隆传播,加强术后感染防控,警惕由于CRKP感染患者更换床位或病房所导致的播散。此外,K1和K2均来自普外科,分离时间接近,相似性达95%以上,K3更早分离自神经外科,相似性为89.3%,亲缘关系相对较远,提示CRKP在传播中可产生一定程度的遗传变异。
本研究发现,3株Q1型菌株(KP31、KP36和KP41)PFGE脉冲型一致,但ST型不同,属于ST11型和ST15型,2种型别有3个等位基因差异。这可能是由于等位基因所在片段的大小相等或接近,PFGE条带位置及分析软件无法区分,从而造成ST分型和基因分型不一致。同时也提示MLST和PFGE这两种分子分型方法可以互相补充[16]。
由于2017年上半年CRKP检出增多,该院执行了接触隔离,加强手卫生及环境消毒,积极采取预防控制措施[17],有效控制了CRKP的传播,2017年下半年CRKP检出率明显下降。该院感染科、神经外科为优势科室,也是除ICU外CRKP检出较多的科室,应加强重点科室对CRKP的管控,减少危险因素,避免定植现象,切断细菌在院内的传播途径[18]。
综上所述,本研究结果显示,所分离的CRKP对临床多类抗菌药物呈高度耐药,携带blaKPC-2基因,以ST11型克隆为主,优势基因型别为G4,存在小范围的暴发流行和优势克隆的长期传播。由于本研究仅纳入了患者血标本分离的CRKP菌株,未对同时期环境、器物表面及医疗人员手部进行采样,如能将不同时期、不同病区分离到的各类标本来源菌株和环境菌株进行对比,可以更好地了解该院的院内感染情况及对CRKP进行追踪,以防控院内感染的发生。
| [1] |
Paczosa MK, Mecsas J. Klebsiella pneumoniae: Going on the offense with a strong defense[J]. Microbiol Mol Biol Rev, 2016, 80(3): 629-661.
[DOI]
|
| [2] |
胡付品, 郭燕, 朱德妹, 汪复, 蒋晓飞, 徐英春, 张小江, 张朝霞, 季萍, 谢轶, 康梅, 王传清, 王爱敏, 徐元宏, 黄颖, 孙自镛, 陈中举, 倪语星, 孙景勇, 褚云卓, 田素飞, 胡志东, 李金, 俞云松, 林洁, 单斌, 杜艳, 郭素芳, 魏莲花, 邹凤梅, 张泓, 王春, 胡云建, 艾效曼, 卓超, 苏丹虹, 郭大文, 赵金英, 喻华, 黄湘宁, 刘文恩, 李艳明, 金炎, 邵春红, 徐雪松, 鄢超, 王山梅, 楚亚菲, 张利侠, 马娟, 周树平, 周艳, 朱镭, 孟晋华, 董芳, 郑红艳, 胡芳芳, 沈瀚, 周万青, 贾伟, 李刚, 吴劲松, 卢月梅, 李继红, 段金菊, 康建邦, 马晓波, 郑燕萍, 郭如意, 朱焱, 陈运生, 孟青. 2019年CHINET三级医院细菌耐药监测[J]. 中国感染与化疗杂志, 2020, 20(3): 233-243. [CNKI]
|
| [3] |
Bassetti M, Giacobbe DR, Giamarellou H, Viscoli C, Daikos GL, Dimopoulos G, De Rosa FG, Giamarellos-Bourboulis EJ, Rossolini GM, Righi E, Karaiskos I, Tumbarello M, Nicolau DP, Viale PL, Poulakou G. Critically Ill Patients Study Group of the European Society of Clinical Microbiology and Infectious Disease (ESCMID); Hellenic Society of Chemotherapy (HSC) and Società Italiana di Terapia Antinfettiva (SITA). Management of KPC-producing Klebsiella pneumoniae infections[J]. Clin Microbiol Infect, 2018, 24(2): 133-144.
[DOI]
|
| [4] |
Munoz-Price LS, Poirel L, Bonomo RA, Schwaber MJ, Daikos GL, Cormican M, Cornaglia G, Garau J, Gniadkowski M, Hayden MK, Kumarasamy K, Livermore DM, Maya JJ, Nordmann P, Patel JB, Paterson DL, Pitout J, Villegas MV, Wang H, Woodford N, Quinn JP. Clinical epidemiology of the global expansion of Klebsiella pneumoniae carbapenemases[J]. Lancet Infect Dis, 2013, 13(9): 785-796.
[DOI]
|
| [5] |
Clinical and Laboratory Standards Institute. M100; Performance Standards For Antimicrobial Susceptibility Testing, 28th Edition[S]. Pennsylvania: Clinical and Laboratory Standards Institute, 2018. http://iacld.ir/DL/public/CLSI-2018-M100-S28.pdf
|
| [6] |
Poirel L, Walsh TR, Cuvillier V, Nordmann P. Multiplex PCR for detection of acquired carbapenemase genes[J]. Diagn Microbiol Infect Dis, 2011, 70(1): 119-123.
[DOI]
|
| [7] |
Diancourt L, Passet V, Verhoef J, Grimont PA, Brisse S. Multilocus sequence typing of Klebsiella pneumoniae nosocomial isolates[J]. J Clin Microbiol, 2005, 43(8): 4178-4182.
[DOI]
|
| [8] |
Tenover FC, Arbeit RD, Goering RV, Mickelsen PA, Murray BE, Persing DH, Swaminathan B. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial strain typing[J]. J Clin Microbiol, 1995, 33(9): 2233-2239.
[DOI]
|
| [9] |
Navon-Venezia S, Kondratyeva K, Carattoli A. Klebsiella pneumoniae: a major worldwide source and shuttle for antibiotic resistance[J]. FEMS Microbiol Rev, 2017, 41(3): 252-275.
[DOI]
|
| [10] |
Pitout JD, Nordmann P, Poirel L. Carbapenemase-producing Klebsiella pneumoniae, a key pathogen set for global nosocomial dominance[J]. Antimicrob Agents Chemother, 2015, 59(10): 5873-5884.
[DOI]
|
| [11] |
Potter RF, D'Souza AW, Dantas G. The rapid spread of carbapenem-resistant Enterobacteriaceae[J]. Drug Resist Updat, 2016, 29: 30-46.
[DOI]
|
| [12] |
Hu F, Guo Y, Yang Y, Zheng Y, Wu S, Jiang X, Zhu D, Wang F. China Antimicrobial Surveillance Network (CHINET) Study Group. Resistance reported from China antimicrobial surveillance network (CHINET) in 2018[J]. Eur J Clin Microbiol Infect Dis, 2019, 38(12): 2275-2281.
[DOI]
|
| [13] |
陈君灏, 张雯霞, 陈晨, 李玲霞, 张珏. 肺炎克雷伯菌临床分离株的耐药性与分子流行病学分析[J]. 实用药物与临床, 2020, 23(7): 650-654. [CNKI]
|
| [14] |
Qi Y, Wei Z, Ji S, Du X, Shen P, Yu Y. ST11, the dominant clone of KPC-producing Klebsiella pneumoniae in China[J]. J Antimicrob Chemother, 2011, 66(2): 307-312.
[DOI]
|
| [15] |
Neoh HM, Tan XE, Sapri HF, Tan TL. Pulsed-field gel electrophoresis (PFGE): A review of the "gold standard" for bacteria typing and current alternatives[J]. Infect Genet Evol, 2019, 74: 103935.
[DOI]
|
| [16] |
Fida M, Cunningham SA, Murphy MP, Bonomo RA, Hujer KM, Hujer AM, Kreiswirth BN, Chia N, Jeraldo PR, Nelson H, Zinsmaster NM, Toraskar N, Chang W, Patel R. Antibacterial Resistance Leadership Group. Core genome MLST and resistome analysis of Klebsiella pneumoniae using a clinically amenable workflow[J]. Diagn Microbiol Infect Dis, 2020, 97(1): 114996.
[DOI]
|
| [17] |
Bassetti M, Righi E, Carnelutti A, Graziano E, Russo A. Multidrug-resistant Klebsiella pneumoniae: challenges for treatment, prevention and infection control[J]. Expert Rev Anti Infect Ther, 2018, 16(10): 749-761.
[DOI]
|
| [18] |
陈翔, 高晓东. 《碳青霉烯耐药革兰阴性杆菌感染预防与控制技术指引》解读[J]. 微生物与感染, 2020, 15(2): 71-75. [URI]
|
 2020, Vol. 15
2020, Vol. 15


