结核病由结核分枝杆菌(Mycobacterium tuberculosis, M.tb)感染引起。根据世界卫生组织2020年的全球结核病报告,2019年在全球范围内约有710万结核病新发病例,发病率为130/10万[1]。在单一传染病中,结核病导致的死亡人数最高,仍然是世界上最严重的公共卫生问题之一。我国作为结核病高负担国家,新发病例数为83.3万,位居全球第二,发病率为58/10万[1]。除了活动性结核病,全球还有大量的结核潜伏感染者。结核潜伏感染(latent tuberculosis infection,LTBI)是机体对结核分枝杆菌抗原持续性免疫反应的状态,无活动性结核病临床症状,也无结核病影像学表现[2]。2014年,全球约有17亿人为LTBI,占全球人口总数的23%[3]。2015年中国第一项大规模多中心LTBI的前瞻性队列研究在4个农村研究点进行,共21 022人,结果显示结核潜伏感染者约占13%~20%[4-5]。结核潜伏感染者一生中进展为活动性结核病的概率约为5%~10%[2],是活动性结核病的重要来源。一项系统综述显示,约11%结核抗原免疫反应阳性的LTBI人群在免疫抑制时可进展为结核病,且主要集中在感染后两年内发病[6]。2015年美国通过国家结核病监测和基因分型数据估算近期传播的结核病病例比例,研究表明超过85%的结核病病例源自LTBI的再激活[7]。因此,准确诊断LTBI人群,确定有效的干预方案,可以极大地降低结核发病率和治疗成本,而一个简单易行的标准化LTBI模型对于上述问题的解决将十分重要。鉴于此,本文对近年来LTBI动物模型的研究进展进行综述,期望对结核病防治有所裨益。
1 LTBI动物模型研究现状及定义LTBI是否进展为活动性结核病取决于细菌和宿主免疫系统复杂的相互作用。在大多数情况下,宿主免疫力低下时LTBI状态容易被激活成活动性结核病。目前,对于人感染M.tb后进入潜伏期的机制和再激活的原因仍不清楚,主要因为一方面目前对于LTBI的临床诊断还缺乏金标准[1],另一方面缺乏简单易行的标准化LTBI动物模型[8-9]。已有报道的LTBI动物模型主要分为2类:一类为自然潜伏感染;另一类为干预(抗结核药物或疫苗等)诱导的潜伏感染[10-13]。目前,最常用的动物感染模型为小鼠模型,而豚鼠、兔子和非人灵长类等哺乳动物以及斑马鱼等非哺乳类动物,因各自的优势特点也有颇多研究报道[14-17]。以小鼠模型为例,目前文献中对LTBI动物模型普遍定义为:肺、脾中菌持续存在,但荷菌量稳定;长期无活动性结核病的临床症状(小鼠表现为体重减轻,活跃度降低,出现过度的舔舐、抓挠行为及异常的呻吟,开始出现驼背,呼吸浅快,眼、鼻具有分泌物等症状);长时间内无自发性复发;糖皮质激素等免疫抑制剂可重新激活细菌,转为活动性结核病[10]。
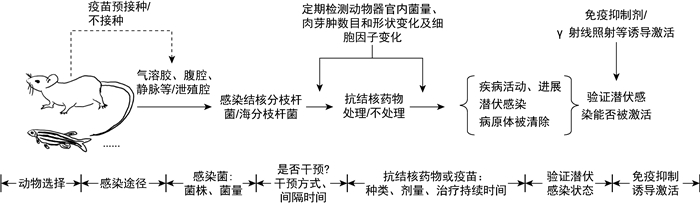
|
| 图 1 干预诱导LTBI动物模型框架 Fig. 1 The establishment of LTBI animal models |
20世纪60年代,Hart和Rees等[18-20]研究抗结核药物在不同感染状态下(急性感染和慢性感染)的杀菌能力时,提出了小鼠结核慢性感染模型,但因接种菌量高(8×106 CFU),24%的小鼠在第5周时即死于进行性发展的活动性结核病。20世纪末,Orme[21]、Phyu等[10]、Arriaga等[22]使用不同菌株(H37Rv或Erdman株等)、不同菌量、通过不同的感染途径感染(C57BL/6×DBA/2)小鼠,对构建LTBI小鼠模型的条件进行了探索(见表 1)。其中Phyu等[10]提出4×104~4×105 CFU H37Rv株腹腔注射感染小鼠,感染后21~52周小鼠无活动性结核病的临床症状(体重减轻、活跃度降低、呼吸浅快等),且肺、脾中能维持稳定的荷菌量,肺脏没有大体形态学改变及病理学改变。53周开始,每天给予口服皮质类固醇激素(初始剂量为最终剂量1.07 mg的25%,按初始剂量服用10周后逐渐加倍,13周达最终剂量),小鼠出现结核急性感染症状,器官荷菌量上升,病理改变逐渐加重,肉眼可见灰色针尖样结节,镜下可见炎症细胞聚集性肉芽肿结构,组织细胞内可见分枝杆菌抗原;而未口服皮质类固醇激素的小鼠存活了100周以上,在107周左右开始进展成活动性结核病[10]。此模型很好地模拟了自发形成潜伏感染的特点,但其潜伏期较长(可长达107周),对于潜伏-复发机制研究,以及利用复发情况来进行药物和疫苗的评价来说研究周期过长。
| Species | Strain | Bacteria (CFU、strain) |
Intervention | Therapy | Lunga (CFU/lung) |
Spleenb (CFU) |
Latent periodc (No. Months/Weeks after infection) |
Culture negative/lowest numberd (No. Months after infection) |
Reference |
| Mouse | (C57BL/6×DBA/2) F1 | 5~10 CFU M. tb Erdman |
Aerosol | -e | 3×103 | - | Month 6~18 | - | [21] |
| 4×104~4×105 CFU M. tb H37Rv |
i.p. | - | 3×103 | 1×104 | Month 5~13/Week 21~52 | - | [10] | ||
| 4×103 CFU M.tb H37Rv |
Intrabronchial instillation |
- | ≤1×105 | - | Month 1~9/Day 30~270 | - | [22] | ||
| Swiss Webster | (1~3)×106 CFU M. tb H37Rv |
i.v. (caudal vein) |
INH+PZA | 0 | 0 | Month 1~7 | - | [11, 23-25] | |
| C57BL/6 | 1×105 CFU M. tb Erdman |
i.v. (caudal vein) |
INH+PZA | 0 | 0 | Month 2~11/Week 8~43 | - | [12] | |
| 30 CFU M. tb H37Rv |
Aerosol | RMP+INH | 0 | 0 | - | - | [27] | ||
| BALB/c | 500 CFU M. tb H37Rv |
Aerosol | BCG (prior aerosol immunization) |
< 1×104 | 0 | - | Month 1.5/Week 6 | [35] | |
| Guinea pig |
Hartley | 107 CFU Streptomycin- auxotrophic M. tb 18b |
i.v. (humeral vein) |
Streptomycin (s.c.) | < 100 | < 100 | - | Month 6/Day 180 | [14] |
| 500 CFU M. tb H37Rv |
s.c. (inguinal region) |
INH+PZA | 0 | 0 | Month 1.5~7/Week 6~28 | - | [38] | ||
| 5×103 CFU M.tb(CMCC95052) |
s.c. (inguinal region) |
INH | - | 0 | - | Month 1.5/Week 6 | [39] | ||
| Rabbit | New Zealand White rabbit | 3×103 CFU M. tb H37Rv |
Aerosol | - | 0 (Right upper Lobe) |
- | - | Month 2.5/Week 10 | [15] |
| 3.2×103 CFU M. tb CDC1551 |
- | 0 | - | - | Month 5/Week 20 | [42] | |||
| Non- human primates |
Cynomolgus macaque |
~25 CFU M. tb Erdman |
Intrabronchial instillation |
- | 0 (BAL fluid)f | - | Month 2~20/Week 8~Month 20 | - | [16] |
| Zebrafish | Wild- type AB |
~35 CFU M. marinum (ATCC 927) |
i.p. | - | 5×105/fish | Month 1~8/Week 4~32 | - | [17] | |
| a. The lowest CFU number in lungs; b. The lowest CFU number in spleens; c. The bacterial loads appeared stable in lungs and spleens, and they show no gross or pathological changes in lungs and spleens; d. It is the point when their organs have lowest CFU or cultured negative. Furthermore, they lack data describing the period with stable bacterial counts; e. No therapy or lack of data; f. BAL-bronchoalveolar lavage. | |||||||||
为缩短建模周期,便于研究结核潜伏感染复发机制等,众多研究者利用抗结核药物或疫苗等对LTBI动物模型进行了改进。
Cornell模型是最经典的小鼠干预诱导形成的LTBI模型,20世纪50年代由McCune及其同事在美国康奈尔大学提出[11, 23-25]。在Cornell模型中,M.tb感染的小鼠喂食含异烟肼(isoniazid, INH)和吡嗪酰胺(pyrazinamide, PZA)的饲料后,组织中可呈现长期无菌状态(低于检测下限),停用抗结核药物一段时间后,结核杆菌可重新激活恢复培养阳性的状态。在该模型中,使用1×106~3×106 CFU H37Rv株静脉注射感染雄性Swiss Webster小鼠,感染后20 min内开始用INH(每日饲料0.0125%)和PZA(每日饲料2%)治疗持续12周。治疗37天后,在肺和脾中均检测不到细菌。但停药后90天,大约1/3受检动物的肺和脾脏中可检测到结核杆菌。治疗完成后使用大剂量可的松会使M.tb重新激活,可的松可导致50%的小鼠恢复培养阳性状态的时间从7个月缩短至2.5个月。
20世纪末21世纪初,Scanga等[12]和Flynn等[26]、Botha和Ryffel[27]基于Cornell模型,在感染菌量、抗结核药物治疗持续时间、药物剂量以及药物停止使用至免疫干预开始的时间间隔方面做了一系列改进,提出了多种Cornell改进模型。其中,Scanga等[12]运用1×105 CFU Erdman株静脉感染小鼠,感染4周后用PZA(8 g/L)和INH(0.1 g/L)治疗12周,治疗后肺、脾匀浆培养呈阴性,之后126天均未观察到LTBI的自发激活;而在完成抗生素治疗11周后进行MP6-XT22(鼠TNF-α抗体)干预组,96天后60%小鼠肺、脾匀浆培养呈阳性,126天全部小鼠可见LTBI重新激活。Botha和Ryffel[27]则用30 CFU H37Rv株以气溶胶途径感染C57BL/6小鼠,感染后2周在饮水中添加RMP(Rifampicin, 0.1 g/L)和INH(Isoniazid, 0.1 g/L)治疗8周,停止治疗20周后给予2.5% (wt/vol) 氨基胍(iNOS抑制剂),干预2周即可见到LTBI重新激活,肺中荷菌量显著上升,而未干预组55周时仍未有自发激活现象,肺匀浆培养仍为阴性。Scanga和Botha的方法均实现了短时间内无自发激活现象但用免疫抑制剂等干预可诱发LTBI再激活的目标,达到大量活菌存留的慢性感染状态和细菌清除的疾病治愈状态之间的平衡。
小鼠Cornell模型及其变体具有极低数量或无法检测到的M.tb,并可维持此状态数周(见表 1),其已被广泛用于抗结核药物治疗方案的有效性评估[28-31]、疫苗评价[32],以及LTBI的免疫学、病原学研究和潜伏感染机制及潜伏-复发机制的研究。但有研究认为,Cornell模型的潜伏期是人为诱导,且在感染后20 min内即开始抗结核治疗,干扰了宿主对感染的自然免疫反应,未关注宿主免疫在维持潜伏感染中的作用,早期免疫机制无法研究。长期抗结核药物治疗可引起M.tb表型发生改变,形态、生长和抗酸染色上具有差异,如在研究Cornell模型变体时发现抗结核药物治疗后运用免疫抑制剂重新激活的结核分枝杆菌在培养基上呈非典型小而光滑的菌落,抗酸染色阴性且无法在7H9中传代培养,但PCR扩增证明其为结核分枝杆菌[12]。
因此,除了运用抗结核药物,美国约翰霍普金斯结核研究中心Nuermberger等[13]提出,运用BCG等疫苗提前免疫小鼠,增强自身免疫控制M.tb感染,使小鼠最终处于潜伏感染状态(< 104 CFU/肺)。其用BCG通过气溶胶(2.3×108 CFU/mL)和静脉途径(5×105 CFU/mL)提前免疫雌性BALB/c小鼠,免疫6周后,气溶胶途径感染500 CFU H37Rv株,感染后第6周,未免疫组小鼠肺中菌落计数比BCG提前免疫组(静脉/气溶胶途径)小鼠高20~200倍,提前免疫组脾中未检出菌,未免疫组脾中菌量仍高达2.75×104 CFU,且未免疫组小鼠肺部病理损伤及肉芽肿改变均比提前免疫组严重。因此,BCG气溶胶途径提前免疫小鼠可使小鼠更能抵抗之后的M.tb攻击。之后,Nuermberger等[33]运用此模型有效评估了多种LTBI治疗方案,得出3HP(利福喷汀联合异烟肼,3个月,每周1次)与6H和9H(异烟肼,6/9个月,每日1次)疗效相当,为制定改进LTBI治疗方案提供了一定的参考。随后,Nuermberger团队[34]进一步改进了此模型,运用免疫原性更强的rBCG30和ticeBCG提前免疫小鼠,使小鼠菌量稳定保持在104CFU以下。C3HeB/FeJ小鼠的研究,表明其能发展出干酪样坏死和缺氧性病变[35],又在上述模型基础上将BALB/c小鼠改进为C3HeB/FeJ小鼠,建立了可以发展成干酪样坏死性肉芽肿的LTBI小鼠模型,并有效验证了多种新型抗结核药物及联合治疗方案的有效性,且证明了C3HeB/FeJ小鼠中疗效与BALB/c小鼠相当[36]。
2.2 其他哺乳动物LTBI模型 2.2.1 豚鼠LTBI模型常见的几种小鼠品系在感染M.tb后肺部不能出现典型的肉芽肿结构,因此曾被认为不适合作为研究肉芽肿相关的动物模型。而豚鼠结核感染模型能够形成与结核病人非常相似的中央干酪样坏死性肉芽肿,因此成为研究肺结核肺部组织病理学的热门选择[37],也有较多研究者利用豚鼠构建LTBI模型。但豚鼠对M.tb的剂量高度敏感,无论是通过静脉还是气溶胶低剂量感染,都易进展成活动性结核病导致体重减轻甚至死亡。为了解决这个问题,Kashino等[14]用链霉素营养缺陷型M.tb菌株18b构建豚鼠潜伏感染模型,此模型豚鼠肺、脾部的菌量降至100 CFU以下,未出现活动性结核病的临床症状,但本实验中未明确证明此豚鼠潜伏感染模型能否重新激活。国内也有构建豚鼠LTBI模型的研究,黎友伦等[38]运用500 CFU H37Rv株通过腹股沟皮下注射感染雌性健康豚鼠,感染2周后用10 mg/kg异烟肼和40 mg/kg吡嗪酰胺灌胃,每周3次,分别治疗4、8和12周停药,停药后继续饲养。8周和12周较长时间的治疗可显著抑制M.tb在豚鼠体内增殖,肺、脾中菌不可检出,长时间停药或经糖皮质激素诱导,可导致部分豚鼠的结核病自然复发或诱导复发。豚鼠在疫苗质量控制、有效性和安全性评估中也具有重要的应用价值。卢锦标等[39]用5×103 CFU M.tb(CMCC95052)经腹股沟皮下注射感染Hartley豚鼠构建潜伏感染状态,并通过此模型验证了AEC/BC02和AEC/BC03两种疫苗在控制脏器菌量和减轻脏器病理改变中的作用[40]。
2.2.2 兔LTBI模型兔在结核分枝杆菌感染后也会形成与结核病人结构相似的肉芽肿结构。并且兔的结核感染模型能够展现出人类感染结核后的多种阶段,如:活动性结核病、自发形成LTBI或随着时间推移细菌清除,疾病消退[41-42]。21世纪初,Manabe等[15]、Subbian等[42]运用H37Rv株或临床分离的M.tb CDC1551株等以气溶胶途径感染雌性新西兰白兔构建兔LTBI模型,两者兔肺中均未检测到M.tb,无自发激活现象,而运用糖皮质激素类药物干预则能激活潜伏感染状态。
2.2.3 非人灵长类LTBI模型非人灵长类具有与人类相似的结核肉芽肿结构,可模拟人类结核病自然潜伏感染的过程,重现人类LTBI的临床特征[43],是人类结核病重要的研究模型。21世纪初,Capuano等[16]将约25 CFU M.tb Erdman株通过支气管镜滴入成年食蟹猴肺中,观察到其中50%~60%的猴子出现慢性活动性感染,最后进展为晚期结核病,约40%的猴子没有发病,呈现出人类LTBI的特点。2010年,该团队又在上述食蟹猴模型的基础上验证了肿瘤坏死因子α(tumor necrosis factor α,TNFα)抑制剂会影响肉芽肿结构,导致活动性结核病进展,出现暴发性和播散性结核,也能重新激活LTBI[44]。和兔模型一样,非人灵长类肺结核模型中不同猴子品种感染不同的M.tb菌株(Erdman株和H37Rv株),通过不同的感染途径,均可导致不同的临床结局[45]。如上述食蟹猴低剂量感染模型表现出人类M.tb感染的全貌,展现了不同的临床结局和组织病理变化。临床结局包括迅速进展的结核病、慢性活动性结核感染和LTBI,组织病理包括干酪性肉芽肿、固体细胞性肉芽肿和纤维钙化性肉芽肿[16]。这些优点结合先进的成像技术和基因编码技术使非人灵长类动物模型成为研究M.tb感染发病机制、宿主与结核分枝杆菌相互作用、活动性结核和LTBI的免疫学变化及肉芽肿组织病理的优势模型[46-47],并在评估新型候选抗结核药物、新型疫苗临床前有效性及安全性,制定和改进抗结核联合治疗方案,评估抗菌药物在预防LTBI再激活的功效中发挥重要作用[48-49]。同时,目前有较多研究使用非人类灵长类LTBI模型研究结核分枝杆菌-人类免疫缺陷病毒(TB-HIV)共感染个体中早期免疫学指标的变化和HIV诱导LTBI重新激活的机制,预测再激活风险的生物学指标,为TB-HIV共感染人群预测再激活风险并及时进行抗结核治疗提供了重要的依据[50-53]。但是,非人灵长类动物M.tb感染模型饲养成本和感染后维护成本非常高,需要使用的大动物P3实验室硬件要求高,较难大规模推广使用。
2.3 非哺乳动物LTBI模型 2.3.1 斑马鱼LTBI模型除上述哺乳动物外,斑马鱼因其遗传学操作便利,且无须使用高等级生物安全实验室的优势,开始逐步运用到宿主与分枝杆菌相互作用的研究。斑马鱼是海分枝杆菌的天然宿主,其感染海分枝杆菌后可形成与人类相似的肉芽肿结构并形成干酪样坏死。斑马鱼LTBI模型的建立最早被Parikka的研究小组报道,Parikka等[17]使用约35 CFU低剂量海分枝杆菌(ATCC 927)腹腔注射感染成年野生型AB斑马鱼,感染4周后形成潜伏感染状态,荷菌量、肉芽肿数量稳定。感染后5个月,给予2次γ射线(25Gy)照射后,斑马鱼陆续死亡,终点死亡率为88%。2018年,该研究小组在上述LTBI模型的基础上改用地塞米松进行免疫抑制,地塞米松也可重新激活LTBI状态,器官内菌量开始增加,肉芽肿数目增多,结构变大、变松,分枝杆菌逸散到组织中[54]。虽然斑马鱼作为LTBI模型的研究目前还比较少,且其免疫学研究相关的抗体等资源商品化产品还不够完善,需要研究者自行开发定制。但斑马鱼LTBI模型的建立成本相对较低,培养周期快,斑马鱼的免疫系统和人相比高度保守,易于进行基因操作,在胚胎及幼虫前期保持透明,可在荧光标记下实时观察细菌和免疫细胞的相互作用,使得该模型在研究宿主-分枝杆菌的相互作用、分枝杆菌潜伏-复发感染的机制等方面具有一定的优势。
3 LTBI模型评估指标在小鼠LTBI模型中,大多依据器官匀浆CFU菌落计数、器官大体形态学改变、组织病理学改变(Ziehl-Neelsen抗酸染色:直接观察组织中结核分枝杆菌载量;HE染色:观察组织器官中肉芽肿数目及结构变化;免疫组织化学:检测结核分枝杆菌抗原或相关细胞因子)来判定小鼠是否处于潜伏感染状态[10-13],部分研究额外进行肺组织结核分枝杆菌DNA原位PCR检测,或检测结核感染相关细胞因子包括IFN-γ(干扰素)、TNF-α、iNOS、IL-1(白细胞介素)等的表达情况[22]。文献中小鼠LTBI状态判定标准一般为小鼠肺、脾(和肝)中检测不到活菌(低于检测下限)或CFU计数保持稳定不增长的状态,肺、脾(和肝)中未见炎症浸润及肉芽肿病理改变或只见细小肉芽肿但长时间内无数量及结构的变化。但Phyu等[10]的研究表明,疾病临床症状严重程度和器官匀浆CFU计数无规律的相关性,而和组织病理学改变的严重程度相关,且从器官匀浆中得到的结核分枝杆菌培养时间较长(2个月以上),表明其从休眠期恢复存在较长的迟滞期。因此,判断小鼠处于LTBI状态须合并小鼠的一般状态(体重、毛发、呼吸等)、器官菌落计数、器官组织病理学表现或脾脏和肝脏重量、大小变化等因素来综合评估。
而在非人灵长类LTBI模型中,由于其与人类在亲缘关系上最为接近,可展现类似人感染M.tb后的多种临床结局,如活动性结核病和LTBI等,可结合临床指标及多种无创影像学检查来判断非人灵长类是否处于LTBI状态。文献中多定义为感染后无活动性结核病临床症状(如体重减轻、咳嗽等),无结核病影像学表现,无病原学证据(如:支气管肺泡灌洗液或胃抽吸物等M.tb培养阴性)及炎症指标正常(红细胞沉降率正常)等[55]。
4 LTBI模型验证在确定已建立的小鼠模型是否为LTBI状态时,常将已建立的小鼠LTBI模型分为2组:一组运用已被广泛认可与结核感染相关的免疫抑制剂[地塞米松、可的松、氨基胍(iNOS抑制剂)、TNF-α抑制剂等];一组则不予干预。验证小鼠LTBI状态在免疫抑制的情况下是否可被激活及短时间内是否有大量的自发激活现象,若感染菌量过少,药物治疗时间过长等导致细菌已被完全清除,免疫抑制状态下也无法诱导激活;或短时间内即有较多小鼠出现自发激活,进入结核急性感染状态,则说明该模型并非处于LTBI状态[10, 12, 27]。
验证非人灵长类LTBI模型,最终尸检时肺部病理进一步支持上述临床评估指标分类方案的有效性,LTBI的非人灵长类模型中病变范围更局限,甚至无肉眼可见的肺部病变,只有淋巴结受累。肺叶及淋巴结中的细菌负荷量比活动性结核病者更低[55]。
5 目前存在的挑战哺乳动物的LTBI模型普遍面临实验周期长、费用昂贵、需要使用动物高等级生物安全实验室等诸多问题。此外,主要通过离体检测组织器官中菌落数量、病理改变(如肉芽肿数目、大小、结构改变等)、炎症因子和细胞因子的改变等区分活动性结核病及LTBI状态。该检测需要在几个不同的时间点处死动物,分离器官,需要大量的实验动物。每个时间点处死不同的动物,无法评估同一动物疾病状态的变化,且结核分枝杆菌生长缓慢,常在4周后才能获得结果,使得相关研究周期较长。另外,动物高等级生物安全实验室对于硬件设施和实验操作人员的专业性要求均较高,而且LTBI模型相关研究周期长,国内很少有团队具备硬件条件和资金开展系统性的研究工作。
然而,科技的进步和多学科的交融也促进了LTBI模型相关的研究。越来越多的先进技术如无创的磁共振成像(MRI)、18氟脱氧葡萄糖(18F-FDG)正电子发射计算机断层扫描(PET/CT)[56-57]和靶向巨噬细胞的放射性碘标记DPA-713(125I-DPA-713)单光子发射计算机断层扫描成像(SPECT/CT)等[58],被用于监测结核病的病程发展。这些无创、非侵入性的操作,所需动物更少,极大地促进了原本费用昂贵的非人灵长类LTBI模型的研究。无创操作还可在不同时间点连续评估同一动物的疾病状态变化,减少个体差异带来的误差。感染剂量的差异及非人灵长类动物个体间的差异,导致传统的检测手段很难确定每个动物个体的复发的时间,而成像技术的发展和运用则为解决此类问题提供了很好的思路。
6 结语目前,因宿主易感性的差异,老年人、儿童、免疫缺陷患者[原发性免疫缺陷和继发性免疫缺陷(HIV感染者)]等感染M.tb的表现有诸多差异。因此,全面认识M.tb感染,判断M.tb感染后所处的疾病状态,了解结核再复发的机制,开发新的抗结核药物及疫苗迫在眉睫,而标准化的动物模型、快速准确的评价方式在研究中具有关键作用。
| [1] |
World Health Organization. Global tuberculosis report 2020[R]. Geneva: World Health Organization, 2020.
|
| [2] |
World Health Organization. WHO consolidated guidelines on tuberculosis: tuberculosis preventive treatment[R]. Geneva: World Health Organization, 2020.
|
| [3] |
Houben RM, Dodd PJ. The global burden of latent tuberculosis infection: a re-estimation using mathematical modelling[J]. PLoS Med, 2016, 13(10): e1002152.
[DOI]
|
| [4] |
Gao L, Li X, Liu J, Wang X, Lu W, Bai L, Xin H, Zhang H, Li H, Zhang Z, Ma Y, Li M, Feng B, Du J, Sui H, Zhao R, Su H, Pan S, Guan L, Shen F, He J, Yang S, Si H, Cheng X, Xu Z, Tan Y, Chen T, Xu W, Peng H, Wang Z, Zhu T, Chen X, Zhou X, Guan X, Jin Q. Incidence of active tuberculosis in individuals with latent tuberculosis infection in rural China: follow-up results of a population-based, multicentre, prospective cohort study[J]. Lancet Infect Dis, 2017, 17(10): 1053-1061.
[DOI]
|
| [5] |
Gao L, Lu W, Bai L, Wang X, Xu J, Catanzaro A, Cárdenas V, Li X, Yang Y, Du J, Sui H, Xia Y, Li M, Feng B, Li Z, Xin H, Zhao R, Liu J, Pan S, Shen F, He J, Yang S, Si H, Wang Y, Xu Z, Tan Y, Chen T, Xu W, Peng H, Wang Z, Zhu T, Zhou F, Liu H, Zhao Y, Cheng S, Jin Q. Latent tuberculosis infection in rural China: baseline results of a population-based, multicentre, prospective cohort study[J]. Lancet Infect Dis, 2015, 15(3): 310-319.
[DOI]
|
| [6] |
Behr MA, Edelstein PH, Ramakrishnan L. Is Mycobacterium tuberculosis infection life long?[J]. BMJ, 2019, 367: l5770.
[DOI]
|
| [7] |
France AM, Grant J, Kammerer JS, Navin TR. A field-validated approach using surveillance and genotyping data to estimate tuberculosis attributable to recent transmission in the United States[J]. Am J Epidemiol, 2015, 182(9): 799-807.
[DOI]
|
| [8] |
Parrish N M, Dick J D, Bishai W R. Mechanisms of latency in Mycobacterium tuberculosis[J]. Trends Microbiol, 1998, 6(3): 107-112.
[DOI]
|
| [9] |
Dutta N K, Karakousis P C. Latent tuberculosis infection: myths, models, and molecular mechanisms[J]. Microbiol Mol Biol Rev, 2014, 78(3): 343-371.
[DOI]
|
| [10] |
Phyu S, Mustafa T, Hofstad T, Nilsen R, Fosse R, Bjune G. A mouse model for latent tuberculosis[J]. Scand J Infect Dis, 1998, 30(1): 59-68.
[DOI]
|
| [11] |
Mccune RM Jr., Mcdermott W, Tompsett R. The fate of Mycobacterium tuberculosis in mouse tissues as determined by the microbial enumeration technique. Ⅱ. The conversion of tuberculous infection to the latent state by the administration of pyrazinamide and a companion drug[J]. J Exp Med, 1956, 104(5): 763-802.
[DOI]
|
| [12] |
Scanga CA, Mohan VP, Joseph H, Yu K, Chan J, Flynn JL. Reactivation of latent tuberculosis: variations on the Cornell murine model[J]. Infect Immun, 1999, 67(9): 4531-4538.
[DOI]
|
| [13] |
Nuermberger EL, Yoshimatsu T, Tyagi S, Bishai WR, Grosset JH. Paucibacillary tuberculosis in mice after prior aerosol immunization with Mycobacterium bovis BCG[J]. Infect Immun, 2004, 72(2): 1065-1071.
[DOI]
|
| [14] |
Kashino SS, Napolitano DR, Skobe Z, Campos-Neto A. Guinea pig model of Mycobacterium tuberculosis latent/dormant infection[J]. Microbes Infect, 2008, 10(14/15): 1469-1476.
[PubMed]
|
| [15] |
Manabe YC, Kesavan AK, Lopez-Molina J, Hatem CL, Brooks M, Fujiwara R, Hochstein K, Pitt ML, Tufariello J, Chan J, Mcmurray DN, Bishai WR, Dannenberg AM Jr, Mendez S. The aerosol rabbit model of TB latency, reactivation and immune reconstitution inflammatory syndrome[J]. Tuberculosis (Edinb), 2008, 88(3): 187-196.
[DOI]
|
| [16] |
Capuano SV 3rd, Croix DA, Pawar S, Zinovik A, Myers A, Lin PL, Bissel S, Fuhrman C, Klein E, Flynn JL. Experimental Mycobacterium tuberculosis infection of cynomolgus macaques closely resembles the various manifestations of human M. tuberculosis infection[J]. Infect Immun, 2003, 71(10): 5831-5844.
[DOI]
|
| [17] |
Parikka M, Hammaren MM, Harjula SK, Halfpenny NJ, Oksanen KE, Lahtinen MJ, Pajula ET, Iivanainen A, Pesu M, Ramet M. Mycobacterium marinum causes a latent infection that can be reactivated by gamma irradiation in adult zebrafish[J]. PLoS Pathog, 2012, 8(9): e1002944.
[DOI]
|
| [18] |
Hart PD, Rees RJ. Enhancing effect of cortisone on tuberculosis in the mouse[J]. Lancet, 1950, 2(6630): 391-395.
[PubMed]
|
| [19] |
Hart PD, Rees RJ. Effect of macrocyclon in acute and chronic pulmonary tuberculous infection in mice as shown by viable and total bacterial counts[J]. Br J Exp Pathol, 1960, 41(4): 414-421.
[PubMed]
|
| [20] |
Rees RJ, Hart PD. Analysis of the host-parasite equilibrium in chronic murine tuberculosis by total and viable bacillary counts[J]. Br J Exp Pathol, 1961, 42(1): 83-88.
[PubMed]
|
| [21] |
Orme IM. A mouse model of the recrudescence of latent tuberculosis in the elderly[J]. Am Rev Respir Dis, 1988, 137(3): 716-718.
[DOI]
|
| [22] |
Arriaga AK, Orozco EH, Aguilar LD, Rook GA, Hernández Pando R. Immunological and pathological comparative analysis between experimental latent tuberculous infection and progressive pulmonary tuberculosis[J]. Clin Exp Immunol, 2002, 128(2): 229-237.
[DOI]
|
| [23] |
Mccune RM, Feldmann FM, Lambert HP, Mcdermott W. Microbial persistence. I. The capacity of tubercle bacilli to survive sterilization in mouse tissues[J]. J Exp Med, 1966, 123(3): 445-468.
[DOI]
|
| [24] |
Mccune RM, Feldmann FM, Mcdermott W. Microbial persistence. Ⅱ. Characteristics persistence. Ⅱ. Characteristics of the sterile state of tubercle bacilli[J]. J Exp Med, 1966, 123(3): 469-486.
[DOI]
|
| [25] |
Mccune RM Jr., Tompsett R. Fate of Mycobacterium tuberculosis in mouse tissues as determined by the microbial enumeration technique. I. The persistence of drug-susceptible tubercle bacilli in the tissues despite prolonged antimicrobial therapy[J]. J Exp Med, 1956, 104(5): 737-762.
[DOI]
|
| [26] |
Flynn JL, Scanga CA, Tanaka KE, Chan J. Effects of aminoguanidine on latent murine tuberculosis[J]. J Immunol, 1998, 160(4): 1796-1803.
[PubMed]
|
| [27] |
Botha T, Ryffel B. Reactivation of latent tuberculosis by an inhibitor of inducible nitric oxide synthase in an aerosol murine model[J]. Immunology, 2002, 107(3): 350-357.
[DOI]
|
| [28] |
Dhillon J, Allen BW, Hu YM, Coates AR, Mitchison DA. Metronidazole has no antibacterial effect in Cornell model murine tuberculosis[J]. Int J Tuberc Lung Dis, 1998, 2(9): 736-742.
[PubMed]
|
| [29] |
Hu Y, Pertinez H, Ortega-Muro F, Alameda-Martin L, Liu Y, Schipani A, Davies G, Coates A. Investigation of elimination rate, persistent subpopulation removal, and relapse rates of mycobacterium tuberculosis by using combinations of first-line drugs in a modified cornell mouse model[J]. Antimicrob Agents Chemother, 2016, 60(8): 4778-4785.
[DOI]
|
| [30] |
Liu Y, Pertinez H, Davies GR, Gillespie SH, Coates AR, Hu Y. Moxifloxacin replacement in contemporary tuberculosis drug regimens is ineffective against persistent mycobacterium tuberculosis in the cornell mouse model[J]. Antimicrob Agents Chemother, 2018, 62(7): e00190-18.
[DOI]
|
| [31] |
Miyazaki E, Chaisson RE, Bishai WR. Analysis of rifapentine for preventive therapy in the Cornell mouse model of latent tuberculosis[J]. Antimicrob Agents Chemother, 1999, 43(9): 2126-2130.
[DOI]
|
| [32] |
Miyata T, Cheigh CI, Casali N, Goodridge A, Marjanovic O, Kendall LV, Riley LW. An adjunctive therapeutic vaccine against reactivation and post-treatment relapse tuberculosis[J]. Vaccine, 2012, 30(2): 459-465.
[DOI]
|
| [33] |
Nuermberger E, Tyagi S, Williams KN, Rosenthal I, Bishai WR, Grosset JH. Rifapentine, moxifloxacin, or DNA vaccine improves treatment of latent tuberculosis in a mouse model[J]. Am J Respir Crit Care Med, 2005, 172(11): 1452-1456.
[DOI]
|
| [34] |
Zhang T, Zhang M, Rosenthal IM, Grosset JH, Nuermberger EL. Short-course therapy with daily rifapentine in a murine model of latent tuberculosis infection[J]. Am J Respir Crit Care Med, 2009, 180(11): 1151-1157.
[DOI]
|
| [35] |
Dutta NK, Illei PB, Jain SK, Karakousis PC. Characterization of a novel necrotic granuloma model of latent tuberculosis infection and reactivation in mice[J]. Am J Pathol, 2014, 184(7): 2045-2055.
[DOI]
|
| [36] |
Lanoix JP, Betoudji F, Nuermberger E. Novel regimens identified in mice for treatment of latent tuberculosis infection in contacts of patients with multidrug-resistant tuberculosis[J]. Antimicrob Agents Chemother, 2014, 58(4): 2316-2321.
[DOI]
|
| [37] |
Ordway DJ, Shanley CA, Caraway ML, Orme EA, Bucy DS, Hascall-Dove L, Henao-Tamayo M, Harton MR, Shang S, Ackart D, Kraft SL, Lenaerts AJ, Basaraba RJ, Orme IM. Evaluation of standard chemotherapy in the guinea pig model of tuberculosis[J]. Antimicrob Agents Chemother, 2010, 54(5): 1820-1833.
[DOI]
|
| [38] |
黎友伦, 陈保文, 徐苗, 罗永艾, 王国治, 沈小兵, 苏城. 结核分枝杆菌潜伏感染豚鼠模型的建立[J]. 中华结核和呼吸杂志, 2010, 33(9): 684-687. [DOI]
|
| [39] |
卢锦标, 邓海清, 陈保文, 都伟欣, 杨蕾, 沈小兵, 苏城, 徐苗, 王国治. 结核分枝杆菌潜伏感染豚鼠模型的建立和验证[J]. 中华微生物学和免疫学杂志, 2013(12): 900-905. [DOI]
|
| [40] |
Wang C, Lu J, Du W, Wang G, Li X, Shen X, Su C, Yang L, Chen B, Wang J, Xu M. Ag85b/ESAT6-CFP10 adjuvanted with aluminum/poly-IC effectively protects guinea pigs from latent mycobacterium tuberculosis infection[J]. Vaccine, 2019, 37(32): 4477-4484.
[DOI]
|
| [41] |
Lurie MB. Thefate of human and bovine tubercle bacilli in various organs of the rabbit[J]. J Exp Med, 1928, 48(2): 155-182.
[DOI]
|
| [42] |
Subbian S, Tsenova L, O'brien P, Yang G, Kushner NL, Parsons S, Peixoto B, Fallows D, Kaplan G. Spontaneous latency in a rabbit model of pulmonary tuberculosis[J]. Am J Pathol, 2012, 181(5): 1711-1724.
[DOI]
|
| [43] |
Walsh GP, Tan EV, Dela Cruz EC, Abalos RM, Villahermosa LG, Young LJ, Cellona RV, Nazareno JB, Horwitz MA. The Philippine cynomolgus monkey (Macaca fasicularis) provides a new nonhuman primate model of tuberculosis that resembles human disease[J]. Nat Med, 1996, 2(4): 430-436.
[DOI]
|
| [44] |
Lin PL, Myers A, Smith L, Bigbee C, Bigbee M, Fuhrman C, Grieser H, Chiosea I, Voitenek NN, Capuano SV, Klein E, Flynn JL. Tumor necrosis factor neutralization results in disseminated disease in acute and latent Mycobacterium tuberculosis infection with normal granuloma structure in a cynomolgus macaque model[J]. Arthritis Rheum, 2010, 62(2): 340-350.
[PubMed]
|
| [45] |
Scanga CA, Flynn JL. Modeling tuberculosis in nonhuman primates[J]. Cold Spring Harb Perspect Med, 2014, 4(12): a018564-a018564.
[DOI]
|
| [46] |
Lin PL, Maiello P, Gideon HP, Coleman MT, Cadena AM, Rodgers MA, Gregg R, O'malley M, Tomko J, Fillmore D, Frye LJ, Rutledge T, Difazio RM, Janssen C, Klein E, Andersen PL, Fortune SM, Flynn JL. PET CT identifies reactivation risk in cynomolgus macaques with latent M. tuberculosis[J]. PLoS Pathog, 2016, 12(7): e1005739-e1005739.
[DOI]
|
| [47] |
Martin CJ, Cadena AM, Leung VW, Lin PL, Maiello P, Hicks N, Chase MR, Flynn JL, Fortune SM. Digitally barcoding Mycobacterium tuberculosis reveals in vivo infection dynamics in the macaque model of tuberculosis[J]. mBio, 2017, 8(3): e00312-17.
[PubMed]
|
| [48] |
Foreman TW, Buc an AN, Mehra S, Peloquin C, Doyle LA, Russell-Lodrigue K, Gandhi NR, Altman J, Day CL, Ernst JD, Blumberg HM, Rengarajan J, Kaushal D. Isoniazid and rifapentine treatment eradicates persistent Mycobacterium tuberculosis in macaques[J]. Am J Respir Crit Care Med, 2020, 201(4): 469-477.
[DOI]
|
| [49] |
Lin PL, Dartois V, Johnston PJ, Janssen C, Via L, Goodwin MB, Klein E, Barry CE 3rd, Flynn JL. Metronidazole prevents reactivation of latent Mycobacterium tuberculosis infection in macaques[J]. Proc Natl Acad Sci U S A, 2012, 109(35): 14188-14193.
[DOI]
|
| [50] |
Diedrich CR, Rutledge T, Maiello P, Baranowski TM, White AG, Borish HJ, Karell P, Hopkins F, Brown J, Fortune SM, Flynn JL, Ambrose Z, Lin PL. SIV and Mycobacterium tuberculosis synergy within the granuloma accelerates the reactivation pattern of latent tuberculosis[J]. PLoS Pathog, 2020, 16(7): e1008413.
[DOI]
|
| [51] |
Buc an AN, Chatterjee A, Singh DK, Foreman TW, Lee TH, Threeton B, Kirkpatrick MG, Ahmed M, Golden N, Alvarez X, Hoxie JA, Mehra S, Rengarajan J, Khader SA, Kaushal D. Mechanisms of reactivation of latent tuberculosis infection due to SIV coinfection[J]. J Clin Invest, 2019, 129(12): 5254-5260.
[DOI]
|
| [52] |
Mattila JT, Diedrich CR, Lin PL, Phuah J, Flynn JL. Simian immunodeficiency virus-induced changes in T cell cytokine responses in cynomolgus macaques with latent Mycobacterium tuberculosis infection are associated with timing of reactivation[J]. J Immunol, 2011, 186(6): 3527-3537.
[DOI]
|
| [53] |
Kuroda MJ, Sugimoto C, Cai Y, Merino KM, Mehra S, Araínga M, Roy CJ, Midkiff CC, Alvarez X, Didier ES, Kaushal D. High turnover of tissue macrophages contributes to tuberculosis reactivation in simian immunodeficiency virus-infected rhesus macaques[J]. J Infect Dis, 2018, 217(12): 1865-1874.
[DOI]
|
| [54] |
Myllymäki H, Niskanen M, Luukinen H, Parikka M, Rämet M. Identification of protective postexposure mycobacterial vaccine antigens using an immunosuppression-based reactivation model in the zebrafish[J]. Dis Model Mech, 2018, 11(3): dmm033175.
[DOI]
|
| [55] |
Lin PL, Rodgers M, Smith LK, Bigbee M, Myers A, Bigbee C, Chiosea I, Capuano SV, Fuhrman C, Klein E, Flynn JL. Quantitative comparison of active and latent tuberculosis in the cynomolgus macaque model[J]. Infect Immun,, 2009, 77(10): 4631-4642.
[DOI]
|
| [56] |
Coleman MT, Maiello P, Tomko J, Frye LJ, Fillmore D, Janssen C, Klein E, Lin PL. Early changes by (18)fluorodeoxyglucose positron emission tomography coregistered with computed tomography predict outcome after Mycobacterium tuberculosis infection in cynomolgus macaques[J]. Infect Immun, 2014, 82(6): 2400-2404.
[DOI]
|
| [57] |
Davis SL, Nuermberger EL, Um PK, Vidal C, Jedynak B, Pomper MG, Bishai WR, Jain SK. Noninvasive pulmonary[18F]-2-fluoro-deoxy-D-glucose positron emission tomography correlates with bactericidal activity of tuberculosis drug treatment[J]. Antimicrob Agents Chemother, 2009, 53(11): 4879-4884.
[DOI]
|
| [58] |
Ordonez AA, Pokkali S, Demarco VP, Klunk M, Mease RC, Foss CA, Pomper MG, Jain SK. Radioiodinated DPA-713 imaging correlates with bactericidal activity of tuberculosis treatments in mice[J]. Antimicrob Agents Chemother, 2015, 59(1): 642-649.
[DOI]
|
 2021, Vol. 16
2021, Vol. 16


