由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)引起的结核病(Tuberculosis,TB)仍然是全球公共卫生的主要威胁之一[1]。结核病的治疗受到耐多药(multidrug-resistant,MDR)和广泛耐药(extensively drug-resistant,XDR)结核分枝杆菌的影响。Mtb对抗结核药物的耐药性成为抗结核治疗的难题之一[2]。结核分枝杆菌的耐药性是由其基因决定的,在药物选择压力下,耐药菌株成为优势菌。结核分枝杆菌产生耐药性的主要原因有4个,包括靶基因突变、药物降解、药物灭活和药物外排[3]。其原理是结核分枝杆菌细胞壁的异常结构以及细胞外排泵(efflux pumps,EPs)的过度表达限制了各类抗生素在细胞内的积累[4]。
外排泵是一种能够将药物外排出细胞膜的蛋白质,参与了结核分枝杆菌多药耐药发生机制,降低了药物在细菌体内的浓度。外排泵在维持细胞内、外物质交换和细胞内稳态方面发挥着关键作用,它们能够识别各种具有广泛物理和化学性质的物质,这使得耐药菌株成为优势菌[2]。根据结核分枝杆菌的细胞壁结构特征和生物能量学,外排泵被分为初级转运蛋白和次级转运蛋白。初级转运蛋白是利用三磷酸腺苷(adenosine triphosphate, ATP)水解产生的能量输出底物,主要为ATP结合盒超家族(ATP-binding cassette,ABC)转运蛋白[5]; 次级转运蛋白由跨膜离子梯度中捕获的电化学能量驱动底物运输,次级转运蛋白可分为主要易化子超家族(major facilitator superfamily,MFS)、耐受小节分裂区家族(resistance-nodulation-division,RND)、小耐多药性家族(small multidrug resistance,SMR)、多药和有毒化合物排出家族(multidrug and toxic compound extrusion family,MATE)、药物/代谢产物转运蛋白(drug/metabolite transporter, DMT)家族[5]。
Mtb含有大量的药物外排泵基因,目前已在Mtb中发现了MFS、ABC、RND和SMR家族的外排泵[2]。本综述对结核分枝杆菌的上述外排泵家族的结构、功能以及外排泵抑制剂相关研究进展进行阐述,希望对结核病的治疗有所帮助。
1 ABC外排泵 1.1 ABC外排泵结构ABC转运蛋白在原核生物和真核生物中均有发现,并构成了大量的多亚基通透酶超家族,它们可跨膜转运氨基酸、抗生素和多糖[6]。ABC转运蛋白是已知最大的外排泵超家族,编码2.5%的Mtb基因组,是一组具有通道结构和胞质ATP结合位点的跨膜蛋白。P-糖蛋白是该家族中最具代表性的外排泵,具体如图 1[2]所示。P-糖蛋白由2个疏水跨膜结构域(transmembrane domain, TMD) TMD1和TMD2、2个核苷酸结合区(nucleotide-binding domain, NBD) NBD1和NBD2[2]组成。TMD含有6个疏水α螺旋,形成底物识别位点和运输管道。DrrABC复合体(Rv2936/2937/2938)是结核分枝杆菌ABC家族转运蛋白之一。DrrA包含2个NBD,DrrB包含6个α螺旋,其结构和功能与P-糖蛋白同源[2]。
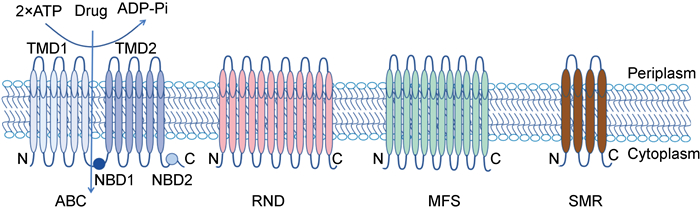
|
| 图 1 结核分枝杆菌中ABC、RND、MFS、SMR外排泵系统的结构 Fig. 1 Schematic structures of efflux pump systems ABC, RND, MFS and SMR in Mycobacterium tuberculosis |
在结核分枝杆菌中已鉴定出一些ABC转运蛋白,如Rv0194、Rv1218c、DrrAB、Rv2688c、PstB、Rv1218c、Rv2686c-Rv2687c-Rv2688c和Rv1456c-Rv1457c-Rv1458c、Rv1473,它们可以转运不同的底物。Rv0194可以转运氨苄西林、氯霉素、链霉素、四环素、万古霉素、红霉素、新生霉素、乙锭等药物,Rv0194输出脂质与Rv0194表达菌株耐药性增加有关,外膜中大量的特定脂质可能会减少抗生素的摄取,从而间接引起分枝杆菌耐药[7]; Rv1218c能够转运吡啶酮、联芳基-哌嗪、联氨基苯并嘧啶、吡咯等药物[8]; DrrAB能够转运阿霉素、溴化乙锭等药物,该泵将亲脂性代谢物或疏水性化合物输出到细胞外部,在抵抗疏水性药物方面发挥作用[9]。DrrAB、PstB与氟喹诺酮类药物耐药相关[10],磷酸盐转运体Pst在多种微生物中被发现,主要参与磷酸盐运输,胞内氟喹诺酮外排也与其有关。PstB是Pst系统中的核苷酸结合亚基,含有ATP酶的活性。PstB基因突变导致PstB对磷酸盐的摄取量提高,而PstB失活将使其丧失对磷酸盐的高度亲和力,导致菌株对氟喹诺酮非常敏感。“氟喹诺酮类药物输出ATP结合蛋白Rv2688c(fluoroquinolones export ATP-binding protein,FEAB)”属于ABC转运蛋白家族,参与氟喹诺酮外排。FEAB使药物分子从Mtb的细胞质中流出,与Rv2686c、Rv2687c结合并与FEAB的终止密码子形成操纵子。ATP与FEAB结合,形成二磷酸腺苷(adenosine diphosphate,ADP)并释放能量。释放的能量负责将底物和药物分子从细胞质外排到细胞外间隙[5]。FEAB操纵子的过度表达赋予了结核分枝杆菌对氟喹诺酮类药物如环丙沙星、诺氟沙星和链霉素的耐药性[5]。有研究发现,Rv2686c-Rv2687c-Rv2688c参与了无机磷酸盐的转运,其mRNA过表达与结核杆菌对氟喹诺酮类药物的耐药性有关[11]。Rv1473是一种新型ATP结合盒外排泵,Rv1473与ctpD跨膜蛋白协同作用,导致大环内酯类化合物从细胞质流出细胞外。这一发现将有助于研发抑制结核分枝杆菌的新型抗生素[12]。
1.3 ABC外排泵运输机制ABC转运蛋白的运输机制是一种“交替进入”机制,该机制使构象状态在向内开放、闭塞和向外开放之间切换,从而使底物跨膜转移(见图 2)[13]。ABC转运蛋白的TMD包含底物结合口袋和NBD,通过结合并水解ATP以驱动转运。构象变化与NBD的二聚化和解离有关,这种二聚化和解离是由ATP的结合和水解介导的[13]。
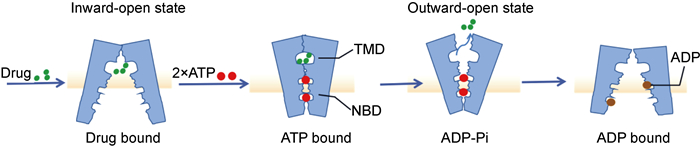
|
| 图 2 ATP结合盒(ABC)转运蛋白转运机制 Fig. 2 Schematics of the transport mechanism for ATP-binding cassette (ABC) transporters |
MFS外排泵是二级转运蛋白中最大的一类,是一组跨膜转运蛋白,可与渗透离子梯度响应,促进目标底物的跨膜转移[1]。特征明确的MFS转运蛋白具有一个共同的α螺旋折叠,并且可通过单向、共向或反向转运来运输多种底物。Du等[14]报道,在结核分枝杆菌H37Rv中鉴定了30种MFS蛋白; 大多数MFS成员的长度为400~600个氨基酸残基,并具有12或14个反式跨膜螺旋。在MFS转运蛋白中鉴定出几种保守的氨基酸序列,大多数MFS蛋白的结构特征为基序A(GrLaDrfGrRRv)、基序B(LvaaRvlQGxGA)和基序C(gxxxGPxxGGxl)[1]。除了类似的初级序列基序外,MFS成员在二级结构上也有相似之处(见图 1),其特征是共有12个跨膜片段,氨基端和羧基端均位于细胞膜的细胞质侧,同时还发现含有非典型跨膜片段的MFS蛋白[1]。典型的12-TMS MFS蛋白的结构被组织成2个结构对称的束,每一束由6个连续的TMS组成,TMS1~6位于N端结构域,TMS 7~12位于C端结构域,表现为由内腔分离的双重伪对称测量[15]。漏斗结构的空腔形成了底物易位的途径,沿空腔排列的亲水和疏水残基在易位过程中发挥至关重要的作用[1]。
2.2 结核分枝杆菌MFS外排泵的功能在分枝杆菌中,MFS转运蛋白的功能与结核杆菌耐药密切相关。结核分枝杆菌H37Rv基因组中有30种MFS蛋白,MFS蛋白可分为9个亚家族:糖转运蛋白(Rv2209,Rv3331)、唾液酸盐H+转运蛋白(Rv1902c)、阴阳离子交换家族(Rv1672c)、药物H+反向转运蛋白1(Rv0191,Rv0849,Rv2456c,Rv0037c,Rv0842,Rv0876c,Rv1258c)、未知主要易化子家族1(Rv2508c)、药物H+反向转运蛋白2(Rv0783c,Rv1250,Rv1410c,Rv1634,Rv1877,Rv2333c,Rv2459,Rv2846c,Rv3239c,Rv3728)、未知主要易化子家族10(Rv2265)、H+代谢物共转运蛋白(Rv1200,Rv3476c)、硝酸盐/亚硝酸盐转运蛋白(Rv0261c,Rv0267,Rv1737c,Rv2329c,Rv2994)[1]。研究发现,Rv1410C基因编码的P55蛋白属于MFS家族的多药泵,与链霉素和四环素耐药性有关[16-17],P55蛋白利用跨膜质子梯度中的能量来驱动抗生素的转运。氯霉素可以抑制核糖体的蛋白质合成并阻止翻译,Li等[18]研究证明了Rv0191是结核分枝杆菌对氯霉素产生耐药性的主要贡献者; 当Rv0191过表达时会导致吡嗪酰胺对结核分枝杆菌产生耐药性[19]。Rv0037c、Rv0842、Rv0876c、Rv2209、Rv2459、Rv1250、Rv1258c、Rv2459等外排泵基因与利福平的耐药性有关,在利福平单抗结核分枝杆菌中被利福平诱导过度表达[20]。
2.3 MFS外排泵运输机制MFS成员可以根据动力学机制分为单向转运蛋白、同向转运蛋白和反向转运蛋白。单向转运蛋白的特征是单一底物沿浓度梯度移动; 而同向转运和反向转运分别由溶质转移方向相同和相反的电化学梯度驱动[1]。Huang等[21]提出了交替存取模型中的摇杆开关机制,该模型研究显示,MFS转运体通过N和C结构域的刚性转动,经历向内、向外和中间封闭状态的构象转变。在摇杆开关模型的底物/质子同向转运的流入过程中,质子可能会在底物与转运体识别之前与转运体N末端结构域内的某些谷氨酸盐结合,质子化转运体对随后上传的底物显示出更高的亲和力,并且降低了向外和向内相互转换所需的能量值,从而引起向外到向内转变,这得益于保守盐桥相互作用的形成和中心腔内静电环境的改变[21]。在此过程中,位于中心空腔中的底物结合位点交替暴露于膜的一侧,以防止底物泄漏,且发现位于底物结合位点中的不同氨基酸残基决定了底物特异性。值得注意的是,底物转运孔的疏水或亲水性质与特定底物一致,这可能会有利于底物结合,如EmrD的疏水空腔和FucP的两亲空腔在向内取向的确认中,底物被释放到细胞质中,伴随着氢键的断裂和形成,以及随后的去质子化和构象重排以完成循环(见图 3)[1]。
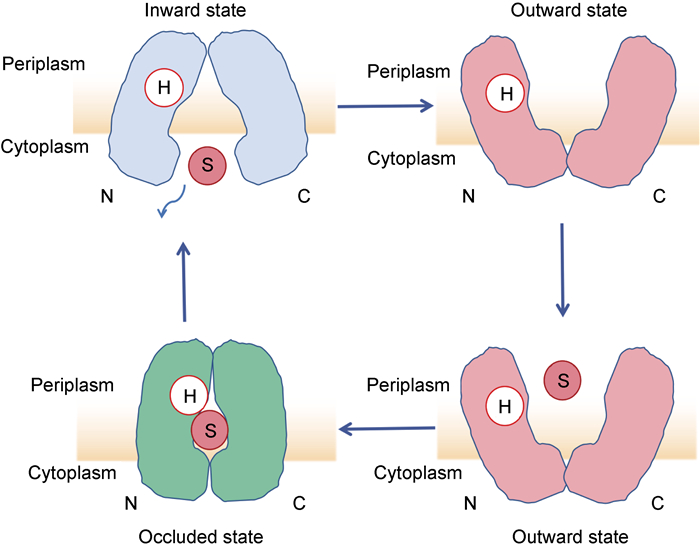
|
| 图 3 MFS外排泵底物/质子同向体构象变化 Fig. 3 Schematics of the conformational change of substrate/proton symporter of the MFS efflux pump |
RND是一个无处不在的外排泵家族,其成员来自细菌、古细菌和真核生物[3]。它们能够识别和调节多种底物的转运,通过质子动力逆转运机制介导底物转运。
3.1 RND外排泵结构RND蛋白形成同源三聚体或异源三聚体[13],每个单体含有12个跨膜结构域和2个可溶性细胞质外环。细菌中的RND转运蛋白通常由3种不同蛋白质的大分子结构组成,它们连接着内膜和外膜,形成穿过2个膜的连续通道。普遍存在的RND超家族还包括具有不同4级结构的成员,如参与胆固醇稳态的单体真核生物C型1类尼曼-匹克蛋白(Niemann-Pick C1,NPC 1)[22],作为蛋白质输出复合体一部分的异二聚体SecD3[23],以及将分子运送到外膜的同源二聚体HpnN[24]。迄今为止,5个可用的RND转运蛋白结构(即AcrB、CusA、MexB、ZneA和MtrD)揭示了同源三聚体,其中每个单体均带有12个跨膜螺旋(TM),分别在TM1和TM2之间以及TM7和TM8之间插入N-端和C-端周质结构域(见图 4)[25]。RND转运体膜蛋白拓扑具有2个周质结构域,每个结构域包含2个转运子结构域和1个对接子结构域,在TM6和TM7之间有一个额外的胞浆螺旋,位于细胞质膜表面附近[25]。
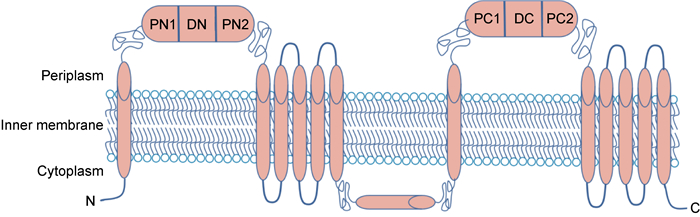
|
| 图 4 RND转运体膜蛋白拓扑结构 Fig. 4 Topological structure of RND transporter membrane protein |
结核分枝杆菌中的RND蛋白被称为分枝杆菌膜蛋白大分子(Mycobacterial membrane protein large,MmpL),其相对分子质量在1.00×105~1.22×105[26]。MmpL家族由13个放线特异性内膜蛋白组成,约有1 000个残基。MmpL蛋白不仅在底物跨膜转运中具有重要的作用,而且可通过影响抗生素从血浆周围的流出使结核分枝杆菌的耐药性发生变化[27]。在结核分枝杆菌H37Rv的基因组序列中发现了14个mmpL基因(见表 1)[3]。MmpL蛋白家族是结核分枝杆菌中RND转运蛋白的重要组成部分之一,共有14个成员,目前已知的是MmpL3、MmpL4、MmpL5、MmpL7、MmpL8和MmpL11,还有8个成员须进一步探索[3],MmpL蛋白与介导跨分枝杆菌膜的底物转运有关。在最近几年中,MmpL3已成为最成功的抗结核药物靶标[25],其对于结核分枝杆菌的生存能力至关重要[28-29]。MmpL3和MmpL11在海藻糖单霉酸酯(trehalose monomycolate,TMM)、单体木霉二酰甘油(monomeromycolyl diacylglycerol,MMDAG)和霉菌酸酯蜡的输出中表现出双重作用,并且均与血红素的输入有关[25]。MmpL5和MmpL7还与药物外流有关,参与抗生素外排的第1个MmpL蛋白是MmpL7。结核分枝杆菌的mmpl7基因在耻垢分枝杆菌中过度表达时,可赋予其异烟肼耐药性。MmpL7和MmpL8蛋白被证明能运输聚酮二茂铁和硫酯蛋白-1[30-33],MmpL8可将脂质从细胞质膜输出到结核分枝杆菌的细胞壁。Mtb中的MmpL5蛋白可以从细胞质中吸收霉菌素并将其释放到周质中,因此MmpL5能够使细胞质中的利奈唑胺和吡嗪酰胺药物外排至周质中[3]。
| Number | Protein | Gene | Protein length (amino acids) | Function |
| 1 | MmpL1 | Rv0402c | 958 | — |
| 2 | MmpL2 | Rv0507 | 968 | Rifampicin resistance[34] |
| 3 | MmpL3 | Rv0206c | 944 | Transportation of mycotic acid[35] |
| 4 | MmpL4 | Rv0450c | 967 | Export MmpS4 carrier[35] |
| 5 | MmpL5 | Rv0676c | 964 | Rifampicin resistance[34-35] |
| 6 | MmpL6 | Rv1557 | 397 | — |
| 7 | MmpL7 | Rv2942 | 920 | Participate in lipid transport[35] |
| 8 | MmpL8 | Rv3823c | 1 089 | Participate in thioester transportation[36] |
| 9 | MmpL9 | Rv2339 | 962 | — |
| 10 | MmpL10 | Rv1183 | 1 002 | Acylated trehalose[36] |
| 11 | MmpL11 | Rv0202c | 966 | Participate in lipid transport[34, 36] |
| 12 | MmpL12 | Rv1522c | 1 146 | — |
| 13 | MmpL13a | Rv1145 | 303 | — |
| 14 | MmpL13b | Rv1146 | 470 | — |
SMR家族蛋白是在原核生物中发现的最小的多药耐药转运体,其利用质子动力运输毒性季铵盐化合物[37]。SMR蛋白运输多种疏水底物,包括抗生素和荧光染料[38]。
4.1 SMR转运蛋白结构SMR转运蛋白是由110个氨基酸组成的小蛋白质[39],只有4个跨膜螺旋结构,但具有同二聚体或异二聚体的功能(见图 1)[13]。SMR家族是14个系统发育不同的次级活性转运蛋白家族之一,属于DMT超家族。SMR家族蛋白的长度较短(100~170个氨基酸),并以4条疏水性α -螺旋跨膜链(transmembrane strands,TMS)跨过质膜[37]。
4.2 SMR转运蛋白功能迄今为止,在结核分枝杆菌中发现的SMR蛋白较少[40]。TBSMR是结核分枝杆菌多药耐药的转运蛋白之一[41]。来自SMR超家族的次级多药/质子反转运蛋白结核分枝杆菌TBsmr[以前称为mmr(Rv3065)]由107个氨基酸组成,与大肠杆菌EmrE的序列同源性约为43%,它是结核分枝杆菌的一种次级活性多药转运体。有研究表明,在耐异烟肼的结核分枝杆菌菌株中,mmr过度表达[42]。
5 结核分枝杆菌的外排泵抑制剂外排泵促使活性药物外排,导致药物敏感性降低,治疗效果变差。可通过改变外排泵的表达或功能组装(生物抑制)、使外排泵能源崩溃或耗尽以及与外排泵的直接相互作用(竞争性和非竞争性抑制)3种方式来调节外排泵。“外排泵抑制剂”一词被广泛用于描述通过上述任何一种机制调节外排活性的化合物,而不一定是指与外排泵直接相互作用的抑制剂[4]。理想的治疗性外排泵抑制剂应该对健康的宿主细胞显示有限的毒性,以获得对靶标细胞或病原体的充分协同化治疗效应。这种选择性毒性可能是通过特异性地抑制其在哺乳动物细胞中不发生(或发生在较低数量的)的外排泵实现的。潜在的抗结核分枝杆菌外排泵药物可分为2类,即合成药物和植物提取物药物。
5.1 合成的外排泵抑制剂外排泵抑制剂中,合成类药物有以下几种:维拉帕米和去甲维拉帕米、质子载体羰基氰化物间氯苯腙(CCCP)、2,4-二硝基苯酚(DNP)等。维拉帕米的药物靶点为ABC(如DrrAB、PstB、Rv2686c-2687c-2688c),MFS(如lfrA、Rv1634、Rv1258c、Rv1877、Rv2846c),RND(如Rv1145、Rv1146、Rv0678),SMR[如Rv3065(mmr)][2]。有研究证明,使用维拉帕米能够降低抗结核药物的最小抑菌浓度(minimum inhibitory concentration, MIC)[43],其被报道是迄今为止最有效的分枝杆菌外排泵抑制剂,能够增强异烟肼和利福平对结核分枝杆菌临床菌株的抑制活性[44]。最近的研究表明,维拉帕米促进的外排抑制可以增强贝达喹啉的活性[44]。
Vianna等[45]研究发现,在脓肿分枝杆菌中,四氢吡啶衍生物是一种比经典抑制剂维拉帕米更有效的外排泵抑制剂。因此,可以把四氢吡啶衍生物推广应用到抗结核分枝杆菌感染中,并观察其治疗效果。羰基氰间氯苯腙(carbonyl cyanide m-chlorophenylhydrazone,CCCP)针对的外排泵是:ABC家族的Rv2936-Rv2937(DrrAB),Rv0933(PstB),Rv2686c-2687c-2688c;MFS家族的LfrA,Rv2459(jefA),Rv1410c(P55),Rv1634,Rv1258c,Rv1410c,Rv1877,Rv2846c;RND家族的Rv1145,Rv1146,Rv0676c-Rv0677c(MmpS5-MmpL5);SMR家族的Rv3065(mmr)。它的主要作用是降低抗结核药物的MIC、降低Mtb对抗结核药物的耐药性、与抗结核药物形成协同作用。2,4-二硝基苯酚(DNP)针对的外排泵包括ABC家族[如Rv2936-Rv2937(DrrAB)、Rv0933(PstB)、Rv2686c-2687c-2688c]和MFS家族(如lfrA、Rv1634、Rv1258c),它能够降低抗结核药物的MIC[46-48]。
5.2 植物提取的外排泵抑制剂植物提取的外排泵抑制剂有:利血平、胡椒碱、小檗碱、槲皮素、粉防己碱、金合欢醇、苯碱丙烷[2]。当存在利血平、胡椒碱时,Rv0191、Rv3756c、Rv3008和Rv1667c过表达引起的吡嗪酰胺耐药性被抑制,使得吡嗪酰胺的MIC降低50%[19]。在外排泵中,ABC家族的Rv2936-Rv2937-Rv2938(DrrABC)、Rv0933(PstB)、Rv2686c-Rv2687c-Rv2688c,RND家族的Rv0678、Rv1145、Rv1146、mmpL7,MFS家族的P55、Rv1877、Rv2846c,SMR家族的Rv3065,都是利血平的作用靶点。利血平能够降低抗结核药物的MIC,降低或逆转结核分枝杆菌对抗结核药物的耐药性,提高结核分枝杆菌中抗结核药物的浓度[2]。胡椒碱的作用靶点是MFS家族的Rv1258c,它可以降低抗结核药物的MIC、上调细胞免疫应答。黄连素能够抑制多药细菌的耐药性,NorA、RamR是其作用靶点。槲皮素能够抑制结核分枝杆菌的生长,其作用靶点是SMR家族的Rv3065(mmr)。粉防己碱能够降低抗结核药物的MIC,与抗结核药物有协同作用,其作用靶点是MFS家族的Rv2459(jefA)、Rv3728,SMR家族的Rv3065(mmr)[49-50]。金合欢醇与抗结核药物具有协同作用,其在外排泵的作用靶点暂时未被测定[51]。苯基丙烷能够降低抗结核药物的MIC,增加抗结核药物在结核分枝杆菌细胞内的积累,其作用靶点是RND家族的Rv1145、Rv1146,MFS家族的Rv1877、Rv2846c,SMR家族的Rv3065(mmr)[2]。外排泵抑制剂的开发在临床上有很大的应用前景,与抗菌药物联用将提高结核病的治愈率。
6 结语与展望结核分枝杆菌能够形成耐药性持留细菌,这是抗生素治疗期间的难题。外排泵是细菌获得耐药性的原因之一。目前,在结核分枝杆菌中发现的外排泵主要有ATP、MFS、RND、SMR四个家族。深入认识结核分枝杆菌外排泵,有助于了解结核分枝杆菌的耐药性,使结核病的治疗更有针对性。在抗结核分枝杆菌感染中,抗结核药物可能会引起外排泵的过度表达,从而使药物排到细胞外,达不到治疗结核病的效果。因此,在治疗结核病时针对性抑制有关外排泵的过度表达,可以阻止有效抗菌药物的排出。外排泵抑制剂与抗菌药物联用有助于改善目前结核病的治疗状况。Ramón-García等[48]在其研究中将外排泵抑制剂CCCP与一线抗结核药物利福平联用,增加了Mtb对利福平的敏感性。外排泵中许多蛋白与疾病相关,这为治疗多耐药结核病提供了药物靶点。通过利用这些靶点,控制底物的运输或基因的表达,从而影响结核分枝杆菌在人体内的生长,这可能给接受抗结核治疗的多耐药结核患者带来治愈的希望。
| [1] |
Li P, Gu Y, Li J, Xie L, Li X, Xie J. Mycobacterium tuberculosis major facilitator superfamily transporters[J]. J Membr Biol, 2017, 250(6): 573-585.
[DOI]
|
| [2] |
Song L, Wu X. Development of efflux pump inhibitors in antituberculosis therapy[J]. Int J Antimicrob Agents, 2016, 47(6): 421-429.
[DOI]
|
| [3] |
Sandhu P, Akhter Y. Evolution of structural fitness and multifunctional aspects of mycobacterial RND family transporters[J]. Arch Microbiol, 2018, 200(1): 19-31.
[DOI]
|
| [4] |
Kapp E, Malan SF, Joubert J, Sampson SL. Small molecule efflux pump inhibitors in mycobacterium tuberculosis: arational drug design perspective[J]. MiniRev Med Chem, 2018, 18(1): 72-86.
[PubMed]
|
| [5] |
Vadija R, Mustyala KK, Malkhed V, Dulapalli R, Veeravarapu H, Malikanti R, Vuruputuri U. Identification of small molecular inhibitors for efflux protein Rv2688c of mycobacterium tuberculosis[J]. Biotechnol Appl Biochem, 2018, 65(4): 608-621.
[DOI]
|
| [6] |
Locher KP. Mechanistic diversity in ATP-binding cassette (ABC) transporters[J]. Nat Struct Mol Biol, 2016, 23(6): 487-493.
[DOI]
|
| [7] |
Danilchanka O, Mailaender C, Niederweis M. Identification of a novel multidrug efflux pump of mycobacterium tuberculosis[J]. Antimicrob Agents Chemother, 2008, 52(7): 2503-2511.
[DOI]
|
| [8] |
Balganesh M, Kuruppath S, Marcel N, Sharma S, Nair A, Sharma U. Rv1218c, an ABC transporter of mycobacterium tuberculosis with implications in drug discovery[J]. Antimicrob Agents Chemother, 2010, 54(12): 5167-5172.
[DOI]
|
| [9] |
Choudhuri BS, Bhakta S, Barik R, Basu J, Kundu M, Chakrabarti P. Overexpression and functional characterization of an ABC (ATP-binding cassette) transporter encoded by the genes drrA and drrB of mycobacterium tuberculosis[J]. Biochem J, 2002, 367(1): 279-285.
[DOI]
|
| [10] |
Sun Z, Xu Y, Sun Y, Liu Y, Zhang X, Huang H, Li C. Ofloxacin resistance in mycobacterium tuberculosis is associated with efflux pump activity independent of resistance pattern and genotype[J]. Microb Drug Resist, 2014, 20(6): 525-532.
[DOI]
|
| [11] |
Oh TS, Kim YJ, Kang HY, Kim CK, Cho SY, Lee HJ. RNA expression analysis of efflux pump genes in clinical isolates of multidrug-resistant and extensively drug-resistant Mycobacterium tuberculosis in South Korea[J]. Infect Genet Evol, 2017, 49: 111-115.
[DOI]
|
| [12] |
Duan W, Li X, Ge Y, Yu Z, Li P, Li J, Qin L, Xie J. Mycobacterium tuberculosis Rv1473 is a novel macrolides ABC efflux pump regulated by WhiB7[J]. Future Microbiol, 2019, 14(1): 47-59.
[DOI]
|
| [13] |
Du D, Wang-Kan X, Neuberger A, van Veen HW, Pos KM, Piddock LJV, Luisi BF. Multidrug efflux pumps: structure, function and regulation[J]. Nat Rev Microbiol, 2018, 16(9): 523-539.
[DOI]
|
| [14] |
Du D, van Veen HW, Murakami S, Pos KM, Luisi BF. Structure, mechanism and cooperation of bacterial multidrug transporters[J]. Curr Opin Struct Biol, 2015, 33: 76-91.
[DOI]
|
| [15] |
Yan N. Structural biology of the major facilitator superfamily transporters[J]. Annu Rev Biophys, 2015, 44: 257-283.
[DOI]
|
| [16] |
Yan N. Structural advances for the major facilitator superfamily (MFS) transporters[J]. Trends Biochem Sci, 2013, 38(3): 151-159.
[DOI]
|
| [17] |
Kanji A, Hasan R, Hasan Z. Efflux pump as alternate mechanism for drug resistance in Mycobacterium tuberculosis[J]. Indian J Tuberc, 2019, 66(1): 20-25.
[DOI]
|
| [18] |
Li X, Li P, Ruan C, Xie LX, Gu Y, Li J, Yi Q, Lv X, Xie J. Mycobacterium tuberculosis Rv0191 is an efflux pump of major facilitator superfamily transporter regulated by Rv1353c[J]. Arch Biochem Biophys, 2019, 667: 59-66.
[DOI]
|
| [19] |
Zhang Y, Zhang J, Cui P, Zhang Y, Zhang W. Identification of novel efflux proteins Rv0191, Rv3756c, Rv3008 and Rv1667c involved in pyrazinamide resistance in Mycobacterium tuberculosis[J]. Antimicrob Agents Chemother, 2017, 61(8): e00940-17.
[DOI]
|
| [20] |
Li G, Zhang J, Guo Q, Wei J, Jiang Y, Zhao X, Zhao LL, Liu Z, Lu J, Wan K. Study of efflux pump gene expression in rifampicin-monoresistant mycobacterium tuberculosis clinical isolates[J]. J Antibiot (Tokyo), 2015, 68(7): 431-435.
[DOI]
|
| [21] |
Huang Y, Lemieux MJ, Song J, Auer M, Wang DN. Structure and mechanism of the glycerol-3-phosphate transporter from Escherichia coli[J]. Science, 2003, 301(5633): 616-620.
[DOI]
|
| [22] |
Gong X, Qian H, Zhou X, Wu J, Wan T, Cao P, Huang W, Zhao X, Wang X, Wang P, Shi Y, Gao GF, Zhou Q, Yan N. Structural insights into the niemann-pick C1 (NPC1)-mediated cholesterol transfer and ebola infection[J]. Cell, 2016, 165(6): 1467-1478.
[DOI]
|
| [23] |
Tsukazaki T, Mori H, Echizen Y, Ishitani R, Fukai S, Tanaka T, Perederina A, Vassylyev DG, Kohno T, Maturana AD, Ito K, Nureki O. Structure and function of a membrane component SecDF that enhances protein export[J]. Nature, 2011, 474(7350): 235-238.
[DOI]
|
| [24] |
Kumar N, Su CC, Chou TH, Radhakrishnan A, Delmar JA, Rajashankar KR, Yu EW. Crystal structures of the burkholderia multivorans hopanoid transporter HpnN[J]. Proc Natl Acad Sci U S A, 2017, 114(25): 6557-6562.
[DOI]
|
| [25] |
Chim N, Torres R, Liu Y, Capri J, Batot G, Whitelegge JP, Goulding CW. The structure and interactions of periplasmic domains of crucial MmpL membrane proteins from mycobacterium tuberculosis[J]. Chem Biol, 2015, 22(8): 1098-1107.
[DOI]
|
| [26] |
Rayasam GV. MmpL3 a potential new target for development of novel anti-tuberculosis drugs[J]. Expert Opin Ther Targets, 2014, 18(3): 247-256.
[DOI]
|
| [27] |
Székely R, Cole ST. Mechanistic insight into mycobacterial MmpL protein function[J]. Mol Microbiol, 2016, 99(5): 831-834.
[DOI]
|
| [28] |
Domenech P, Reed MB, Barry CE. Contribution of the mycobacterium tuberculosis MmpL protein family to virulence and drug resistance[J]. Infect Immun, 2005, 73(6): 3492-3501.
[DOI]
|
| [29] |
Tullius MV, Harmston CA, Owens CP, Chim N, Morse RP, McMath LM, Iniguez A, Kimmey JM, Sawaya MR, Whitelegge JP, Horwitz MA, Goulding CW. Discovery and characterization of a unique mycobacterial heme acquisition system[J]. Proc Natl Acad Sci U S A, 2011, 108(12): 5051-5056.
[DOI]
|
| [30] |
Converse SE, Mougous JD, Leavell MD, Leary JA, Bertozzi CR, Cox JS. MmpL8 is required for sulfolipid-1 biosynthesis and mycobacterium tuberculosis virulence[J]. Proc Natl Acad Sci U S A, 2003, 100(10): 6121-6126.
[DOI]
|
| [31] |
Cox JS, Chen B, McNeil M, Jacobs WR Jr. Complex lipid determines tissue-specific replication of mycobacterium tuberculosis in mice[J]. Nature, 1999, 402(6757): 79-83.
[DOI]
|
| [32] |
Jain M, Cox JS. Interaction between polyketide synthase and transporter suggests coupled synthesis and export of virulence lipid in m tuberculosis[J]. PLoS Pathog, 2005, 1(1): 12-19.
[DOI]
|
| [33] |
Seeliger JC, Holsclaw CM, Schelle MW, Botyanszki Z, Gilmore SA, Tully SE, Niederweis M, Cravatt BF, Leary JA, Bertozzi CR. Elucidation and chemical modulation of sulfolipid-1 biosynthesis in mycobacterium tuberculosis[J]. J Biol Chem, 2012, 287(11): 7990-8000.
[DOI]
|
| [34] |
Narang A, Garima K, Porwal S, Bhandekar A, Shrivastava K, Giri A, Sharma NK, Bose M, Varma-Basil M. Potential impact of efflux pump genes in mediating rifampicin resistance in clinical isolates of Mycobacterium tuberculosis from India[J]. PLoS One, 2019, 14(9): e0223163.
[DOI]
|
| [35] |
Black PA, Warren RM, Louw GE, van Helden PD, Victor TC, Kana BD. Energy metabolism and drug efflux in Mycobacterium tuberculosis[J]. Antimicrob Agents Chemother, 2014, 58(5): 2491-2503.
[DOI]
|
| [36] |
Briffotaux J, Huang W, Wang X, Gicquel B. MmpS5/MmpL5 as an efflux pump in Mycobacterium species[J]. Tuberculosis (Edinb), 2017, 107: 13-19.
[DOI]
|
| [37] |
Bay DC, Turner RJ. Small multidrug resistance efflux pumps[M]// Fahmy A, Srinivasan A, Webber M A. Efflux-mediated antimicrobial resistance in bacteria. Switzerland: Springer International Publishing, 2016: 45-71.
|
| [38] |
Mörs K, Hellmich UA, Basting D, Marchand P, Wurm JP, Haase W, Glaubitz C. A lipid-dependent link between activity and oligomerization state of the M. tuberculosis SMR protein TBsmr[J]. Biochim Biophys Acta, 2013, 1828(2): 561-567.
[DOI]
|
| [39] |
Hernando-Amado S, Blanco P, Alcalde-Rico M, Corona F, Reales-Calderón JA, Sánchez MB, Martínez JL. Multidrug efflux pumps as main players in intrinsic and acquired resistance to antimicrobials[J]. Drug Resist Updat, 2016, 28: 13-27.
[DOI]
|
| [40] |
Liu H, Xie J. Comparative genomics of mycobacterium tuberculosis drug efflux pumps and their transcriptional regulators[J]. Crit Rev Eukaryot Gene Expr, 2014, 24(2): 163-180.
[DOI]
|
| [41] |
Balganesh M, Dinesh N, Sharma S, Kuruppath S, Nair AV, Sharma U. Efflux pumps of mycobacterium tuberculosis play a significant role in antituberculosis activity of potential drug candidates[J]. Antimicrob Agents Chemother, 2012, 56(5): 2643-2651.
[DOI]
|
| [42] |
Rodrigues L, Villellas C, Bailo R, Viveiros M, Aínsa JA. Role of the Mmr efflux pump in drug resistance in Mycobacterium tuberculosis[J]. Antimicrob Agents Chemother, 2013, 57(2): 751-757.
[DOI]
|
| [43] |
Ghajavand H, Kargarpour Kamakoli M, Khanipour S, Pourazar Dizaji S, Masoumi M, Rahimi Jamnani F, Fateh A, Yaseri M, Siadat SD, Vaziri F. Scrutinizing the drug resistance mechanism of multi-and extensively-drug resistant Mycobacterium tuberculosis: mutations versus efflux pumps[J]. Antimicrob Resist Infect Control, 2019, 8: 70.
[DOI]
|
| [44] |
Machado D, Perdigão J, Portugal I, Pieroni M, Silva PA, Couto I, Viveiros M. Efflux activity differentially modulates the levels of isoniazid and rifampicin resistance among multidrug resistant and monoresistant Mycobacterium tuberculosis strains[J]. Antibiotics (Basel), 2018, 7(1): 18.
[DOI]
|
| [45] |
Vianna JS, Ramis IB, Bierhals D, von Groll A, Ramos DF, Zanatta N, Lourenço MC, Viveiros M, Almeida da Silva PE. Tetrahydropyridine derivative as efflux inhibitor in Mycobacterium abscessus[J]. J Glob Antimicrob Resist, 2019, 17: 296-299.
[DOI]
|
| [46] |
Singh M, Jadaun GP, Ramdas, Srivastava K, Chauhan V, Mishra R, Gupta K, Nair S, Chauhan DS, Sharma VD, Venkatesan K, Katoch VM. Effect of efflux pump inhibitors on drug susceptibility of ofllxacin resistant mycobacterium tuberculosis isolates[J]. Indian J Med Res, 2011, 133(5): 535-540.
|
| [47] |
Silva PE, Bigi F, Santangelo MP, Romano MI, Martín C, Cataldi A, Aínsa JA. Characterization of P55, a multidrug efflux pump in mycobacterium bovis and mycobacterium tuberculosis[J]. Antimicrob Agents Chemother, 2001, 45(3): 800-804.
[DOI]
|
| [48] |
Ramón-García S, Martín C, Thompson CJ, Aínsa JA. Role of the mycobacterium tuberculosis p55 efflux pump in intrinsic drug resistance, oxidative stress responses, and growth[J]. Antimicrob Agents Chemother, 2009, 53(9): 3675-3682.
[DOI]
|
| [49] |
Sutter MC, Wang YX. Recent cardiovascular drugs from Chinese medicinal plants[J]. Cardiovasc Res, 1993, 27(11): 1891-1901.
[DOI]
|
| [50] |
Zhang Z, Yan J, Xu K, Ji Z, Li L. Tetrandrine reverses drug resistance in isoniazid and ethambutol dual drug-resistant mycobacterium tuberculosis clinical isolates[J]. BMC Infect Dis, 2015, 15: 153.
[DOI]
|
| [51] |
Jin J, Zhang JY, Guo N, Sheng H, Li L, Liang JC, Wang XL, Li Y, Liu MY, Wu XP, Yu L. Farnesol, a potential efflux pump inhibitor in mycobacterium smegmatis[J]. Molecules, 2010, 15(11): 7750-7762.
[DOI]
|
 2022, Vol. 17
2022, Vol. 17



