皮肤镜是一种非侵入性诊断方法,其观察原理一是放大倍数,二是利用偏振光技术消除皮肤表面反射光,弱化皮肤表面的纹理特征和立体感,选择性地增强一些特定病损的表现特征,如血管性损害、色素性损害等。皮肤镜最初用于色素性疾病尤其是黑色素瘤的诊断,如今推广应用到更广泛的领域[1],如毛发病、甲病等的诊断,在疾病鉴别及降低误诊率方面有重要作用。
皮肤真菌性疾病根据感染部位可分为浅部真菌病、皮下组织真菌病和系统性真菌病,其诊断目前主要依靠真菌镜检、真菌培养及分子鉴定。常规真菌检查较为复杂、费时,需要专业操作人员及实验室,检测结果受多种因素影响,如操作人员水平、培养方式等,因此阳性率低,尤其对着色芽生菌病、组织胞浆菌病等少见真菌病的诊断[2]更是困难; 此外,相关专业人员及设备主要集中在大型综合医院,不利于基层医院开展相关真菌检测。而皮肤镜具有易掌握、耗时短等优点,不少研究者利用它作为辅助诊断工具观察皮肤真菌性疾病。本文主要综述了皮肤镜在皮肤真菌性疾病中的最新应用进展。
1 浅部真菌病 1.1 皮肤癣菌感染根据发病部位不同,皮肤癣菌感染可分为头癣、体癣、股癣、甲癣、足癣等,当滥用激素导致皮损不典型时可转变为难辨认癣,常被误诊为湿疹等其他皮肤疾病。皮肤癣菌感染的皮肤镜表现具有特征性,详见表 1。
| 分类 | 皮肤镜征象 |
| 体癣[3] | 弥漫性红斑,从内向外的脱屑方式——外周鳞屑(最易出现); 毛囊微脓疱,褐色小点周围绕以黄白色的晕圈和卷毛,碎毛,莫尔斯码毛a。 |
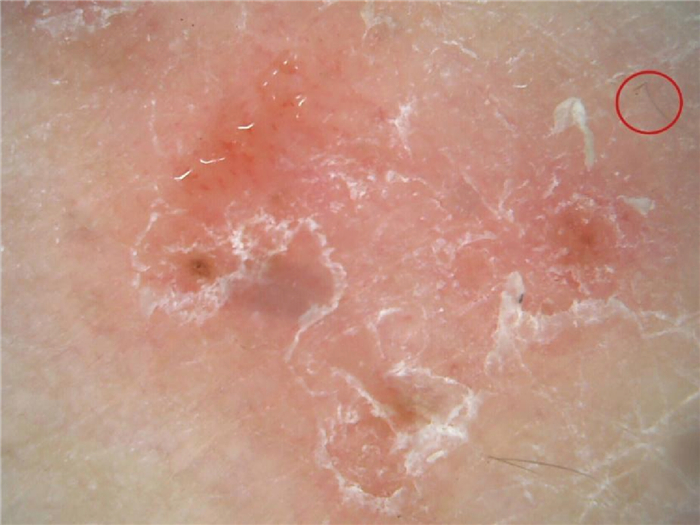
| 股癣[3](见图 1) | 与体癣表现类似,莫尔斯码毛较体癣多; 易变形毛b。 |
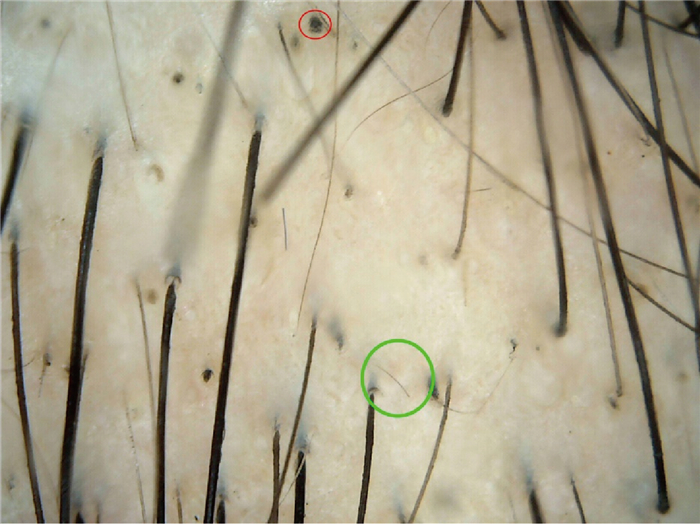
| 头癣[3-4](见图 2) | 逗号毛c、莫尔斯码毛、螺旋毛d、“之”字形毛e、黑点、短毳毛、烟灰发(最易出现,毛发改变具有特征性); 毛囊周围有鳞屑,毛囊微脓疱/存在于脓癣中的脓肿。 |
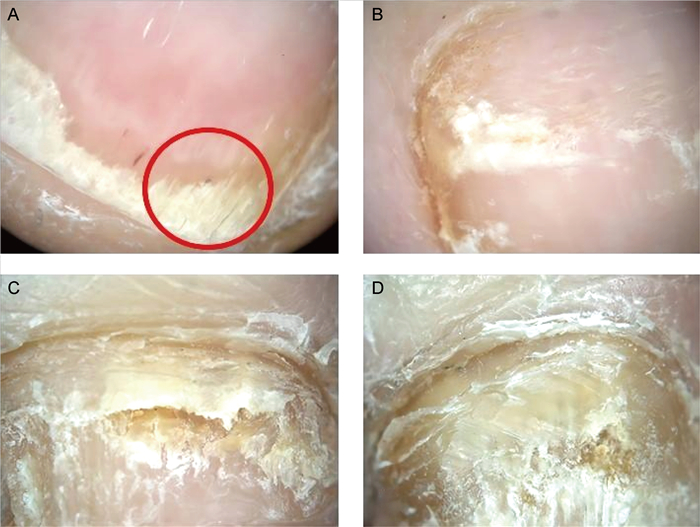
| 甲癣[3, 5-7](见图 3) | 正常甲与病变部位交界处表现为锯齿状边缘,且锯齿尖峰朝向甲近端(最易出现); 病变部位的甲板可见不同颜色的纵向条纹; 病变部位甲的整体颜色暗淡,颜色多变,形态像自然中的“北极光”; 甲下角化过度——废墟样外观; 褐黑色色素沉着和白甲。真菌性黑甲——甲颜色多样,亚光黑,亚光白或者黄褐色色素沉着,黑色素聚集,黑色反三角形,表面横纹,色素沉着外观模糊。 |
| 足癣/手癣[3] (见图 4) | 手掌和足底皱褶处有细小的白色鳞屑(最易出现),褐色鳞片上显示干涸水疱,与银屑病或湿疹无关的强烈红斑。 |
| 难辨认癣[3, 8] | 不规则线状血管,多角形血管网, ≥50%毳毛减少,莫尔斯码毛(最易出现); 毛囊环形隆起,毛囊周黄色晕,毛囊微脓疱,中心区域的红斑被鳞屑分隔,易变形毛。 |
| a:莫尔斯码毛,毛干上有多个规律分布的透明横带。b:易变形毛,看上去脆弱透明,且有不寻常弯曲。c:逗号毛,类似逗号样的短小弯曲毛发。d:螺旋毛,毛发形态呈致密弯曲。e:“之”字形毛,毛干上多个点大幅度弯曲。 | |
皮肤癣菌入侵毛囊会出现特征性的表现,如莫尔斯码毛的产生往往是由于关节孢子大量生成并在毛干间断地聚集(节点),毛干被分成纤细的数个片断,里面可见菌丝生长(栅栏样),大多数毳毛处可看到毛囊微脓疱。炎症反应可导致毳毛脱落,并形成炎症后色素沉着,也就是皮肤镜下见到的褐色小点。炎症后色素减退或形成轻微瘢痕,皮肤镜下表现为白色的晕圈。尤其当毳毛受到影响时,其可能作为真菌入侵的“基地”,导致局部抗真菌治疗效果欠佳,甚至可能在皮肤其他部位出现真菌感染[9]。皮肤镜虽然不能取代真菌检查,但可作为其补充。例如,真菌入侵毳毛可被皮肤镜观察到,但培养时观察不到[10]。
无论是否用过激素,难辨认癣在皮肤镜下仍可见典型的毛发改变:莫尔斯码毛、易变形毛、逗号毛和螺旋毛,以及毛囊周围的鳞屑[11]。有研究观察了49例难辨认癣患者的皮肤镜表现,发现皮损多发于面部、四肢及躯干,毛发多是毳毛。当角质层及毛发被真菌侵袭后,毳毛短而细软,容易脱落,在皮肤镜下较少见到典型的毛发改变。因此,该研究提出多角形血管网、≥50%毳毛减少可作为鉴别难辨认癣与非皮肤癣菌病的皮肤镜征象[8]。
毛囊炎大致分为感染性和非感染性毛囊炎[12],治疗原则与其类型密切相关,皮肤镜对某些类型毛囊炎有很好的辅助诊断作用。在感染性毛囊炎尤其是寄生虫引起的毛囊炎中,皮肤镜有很高的诊断价值(88.7%),其次是真菌性毛囊炎(76.5%),而真菌性毛囊炎主要由马拉色菌引起。Jakhar等[13]对15例马拉色菌毛囊炎患者的皮肤镜征象进行了总结,发现几乎所有病例可见以毛囊为中心的丘疹和脓疱周围围绕红斑; 11例出现鳞屑(73.3%),主要在病灶周围,呈污白色; 8例(53.3%)可见盘状/圈状毛发周围围绕红斑; 9例(60.0%)可见病变部位毛干色素减退,这是真菌孢子侵入毛干所致,皮损改善时周围可见褐色沉着。这些特点可很好地将马拉色菌毛囊炎与痤疮相鉴别。Durdu等研究表明[14],真菌性毛囊炎最重要的皮肤镜征象是病灶周围均匀分布的点状血管,在缺乏其他诊断条件时,该表现具有很高的特异性。
1.3 甲真菌病甲真菌病包括皮肤癣菌、酵母或非皮肤癣菌性真菌引起的甲真菌感染,以皮肤癣菌感染最常见,而对于银屑病、扁平苔藓、外伤所致甲的病变以及缺铁所致甲营养不良等疾病,肉眼并不能将其与甲真菌病鉴别[7]。甲真菌病的典型皮肤镜征象(见表 1)对其诊断具有很好的提示作用。正常甲与病变部位交界处表现为锯齿状边缘(与甲银屑病鉴别的要点),锯齿尖峰朝向甲近端更常见于远端甲下真菌病(distal subungual onychomycosis,DSO),甲下角化过度常见于全甲营养不良性甲真菌病(total dystrophic onychomycosis,TDO),而白甲更常见于近端甲下真菌病(proximal subungual onychomycosis,PSO)。大多数甲真菌病有一个共同的模式——纵向形态,这是由于真菌从甲下皮入侵甲床,而甲下皮是一个低黏附区域,导致真菌沿着纵向网脊入侵、生长。长期持续的DSO可能发展成TDO。“废墟外观”是一个特殊的皮肤镜术语,用来描述甲床角化过度,其定义为甲板内侧凹陷,这是由于真菌入侵过程中导致真皮碎片堆积。另一个甲真菌病的典型皮肤镜表现是甲色素沉着,真菌感染可能导致甲色素沉着和真菌黑甲,需与甲黑色素瘤相鉴别。非纵向模式、逆三角模式、甲床角化过度、多色模式和甲上鳞屑等对诊断真菌黑甲有积极预测作用[5]。
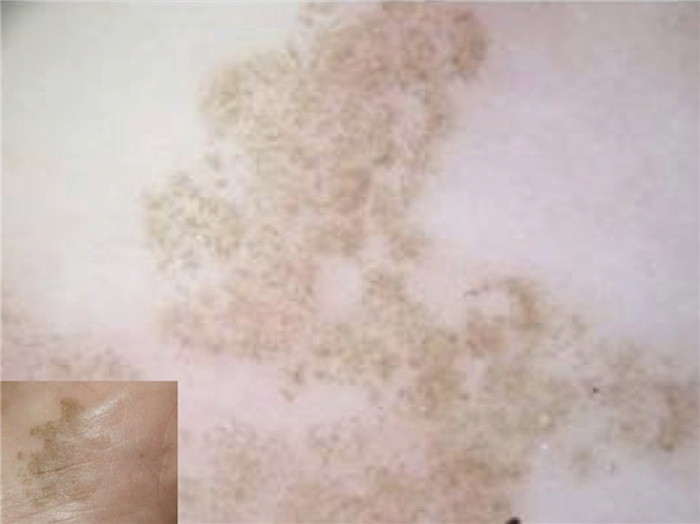
1.4 掌黑癣掌黑癣由威尼克何德霉感染造成。威尼克何德霉主要在热带及亚热带地区传播,青年更易被感染。掌黑癣的临床表现为肢端不规则色素沉着,可能与后天肢端色素痣表现相似。皮肤镜表现可见簇状针尖大小的色素沉着平行分布于皮损边缘(如图 5所示),色素沉着通常并未沿着皮沟和皮嵴,但在一些病例中也可见到皮嵴平行模式,此时很难将其与肢端黑色素瘤区别[15]。
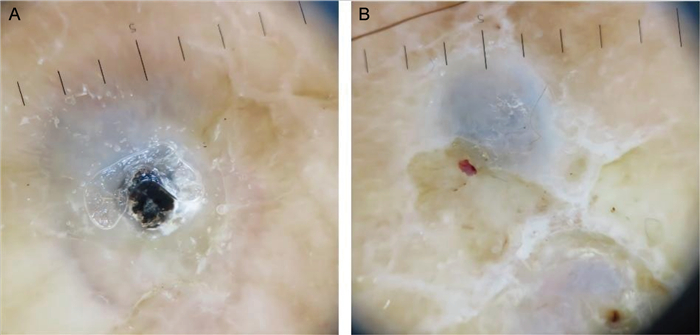
2 皮下组织真菌病 2.1 足菌肿足菌肿是常见的真皮和皮下组织肉芽肿性感染,是由多种真菌、放线菌或细菌引起的临床综合征。典型的临床表现为软组织肿胀、瘘道形成及颗粒排出。颗粒大小差异大,部分肉眼不可见,而皮肤镜能够更好地观察微小颗粒。当黑色颗粒尚不能被临床发现时,其皮肤镜征象表现为无定形的蓝色-白色区域被白色晕圈围绕,且可见多形血管,亦支持足菌肿的诊断。无定形的蓝色-白色区域对应皮下大量着色真菌所产生的色素沉着,皮肤镜可指导皮肤科医师做出足菌肿的临床推断(见图 6),但需进行真菌镜检及培养验证[16]。
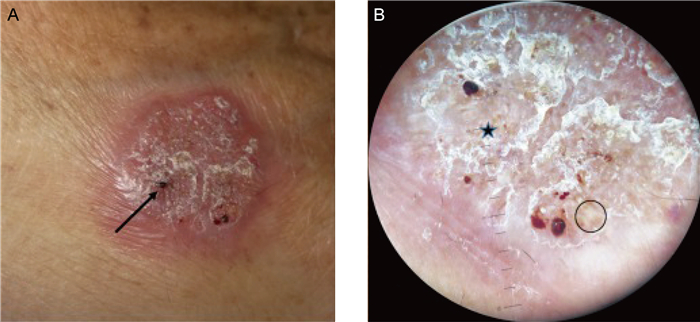
着色芽生菌病的常见致病菌为卡氏枝孢霉、裴氏着色霉等,临床表现为丘疹或结节,逐渐发展成斑块,表面增生呈菜花状。皮肤镜表现为不规则的红黑点,白色、粉色区域上有鳞屑和结痂[17],可见散在的薄鳞屑和不规则的血管。这些红黑点对应临床上的黑点,黑点是由经上皮的炎症细胞、真菌以及血液成分所组成,最终经上皮排出。皮肤镜下不规则红黑点的存在是诊断着色芽生菌病的最有效征象(见图 7)[18],可将其与单独斑块湿疹或银屑病等疾病鉴别。
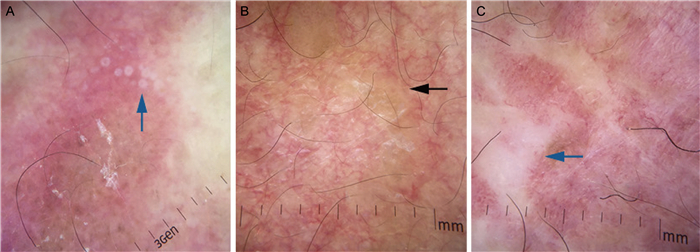
播散性孢子丝菌病与其他皮肤深部真菌病和利什曼病表现相似,可表现为广泛的红斑、黄色无定形区域、树枝状毛细血管扩张和白色瘢痕。其中,黄色无定形区域是中性粒细胞聚集的肉芽肿性炎症常见的皮肤镜特征(见图 8)[19]。
系统性真菌病的感染方式主要是真菌通过呼吸道进入人体,随后随着血液系统和淋巴系统传播至皮肤及其他器官。
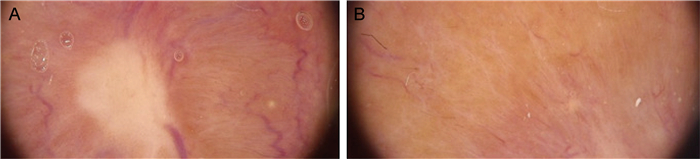
3.1 隐球菌病隐球菌病是由新型隐球菌感染所致,免疫受损人群易感。其早期诊断很重要,未治疗患者的致死率高达70%~80%。皮肤镜下征象为中央白色无结构区域,伴有线状不规则树枝状血管,周围绕以黄色晕圈(见图 9)[20]。黄色晕圈代表皮损的肉芽肿炎症组织成分,白色瘢痕状区域表示皮肤纤维化,血管模式表明新生血管的存在。隐球菌病的皮肤镜征象能有效帮助临床医师对其进行早期诊断和鉴别。
组织胞浆菌病是由双相真菌-荚膜组织胞浆菌引起的系统性感染,其临床皮损无特异性,皮肤镜下可见皮损边缘树枝状毛细血管扩张和表浅鳞屑[21]。
4 结语由于激素滥用或当疾病皮损无特异性时,部分皮肤真菌性疾病不易与其他皮肤病相区分,但皮肤镜下有典型征象,如难辨认癣、甲真菌病等,故皮肤镜在辅助鉴别诊断皮肤真菌性疾病中有重要作用[7, 11, 22]。虽然通过微生物技术找到致病真菌是诊断金标准,但皮肤镜的协助可明显提高诊断准确率,提高医师诊断少见皮肤真菌性疾病的能力。皮肤镜的使用还可避免其他不必要的检查,减少了费用,提供了快速诊断。此外,皮肤镜也给部分不能进行真菌培养等相关真菌检测技术的医院提供了另一选择,并可用于疗效监测。然而,目前皮肤镜在诊断皮肤真菌性疾病中可用的临床样本有限,未来还有很大的探索空间。
| [1] |
Russo T, Piccolo V, Lallas A, Argenziano G. Recent advances in dermoscopy[J]. F1000Res, 2016, 5: F1000 Faculty Rev-184.
[DOI]
|
| [2] |
Friedman DZP, Schwartz IS. Emerging fungal infections: new patients, new patterns, and new pathogens[J]. J Fungi (Basel), 2019, 5(3): 67.
[DOI]
|
| [3] |
Bhat YJ, Keen A, Hassan I, Latif I, Bashir S. Can dermoscopy serve as a diagnostic tool in dermatophytosis? A pilot study[J]. Indian Dermatol Online J, 2019, 10(5): 530-535.
[PubMed]
|
| [4] |
Gómez Moyano E, Crespo Erchiga V, Martínez Pilar L, Martinez García S. Correlation between dermoscopy and direct microscopy of morse code hairs in tinea incognito[J]. Am Acad Dermatol, 2016, 74(1): e7-e8.
|
| [5] |
Ohn J, Choe YS, Park J, Mun JH. Dermoscopic patterns of fungal melanonychia: A comparative study with other causes of melanonychia[J]. J Am Acad Dermatol, 2017, 76(3): 488-493.e2.
[DOI]
|
| [6] |
Yorulmaz A, Yalcin B. Dermoscopy as a first step in the diagnosis of onychomycosis[J]. Postepy Dermatol Alergol, 2018, 35(3): 251-258.
[DOI]
|
| [7] |
Nada EEA, El Taieb MA, El-Feky MA, Ibrahim HM, Hegazy EM, Mohamed AE, El-Amir MI. Diagnosis of onychomycosis clinically by nail dermoscopy versus microbiological diagnosis[J]. Arch Dermatol Res, 2020, 312(3): 207-212.
[DOI]
|
| [8] |
唐芹芹, 陈玉娟, 刘海霞, 徐江媚, 熊心猜. 难辨认癣的皮肤镜特征[J]. 临床皮肤科杂志, 2019, 48(08): 480-485. [DOI]
|
| [9] |
Knöpfel N, Del Pozo L J, Escudero M D M, Martín-Santiago A. Dermoscopic visualization of vellus hair involvement in tinea corporis: a criterion for systemic antifungal therapy?[J]. Pediatr Dermatol, 2015, 32(5): e226-e227.
[DOI]
|
| [10] |
Gómez-Moyano E, Crespo Erchiga V, Martínez Pilar L, Martínez García S, Martín González T, Godoy Diaz D J, Vera Casaño A. Using dermoscopy to detect tinea of vellus hair[J]. Br J Dermatol, 2016, 174(3): 636-638.
[DOI]
|
| [11] |
Sonthalia S, Ankad BS, Goldust M, Jha AK. Dermoscopy-a simple and rapid in vivo diagnostic technique for tinea incognito[J]. An Bras Dermatol, 2019, 94(5): 612-614.
[PubMed]
|
| [12] |
Miguel-Gómez L, Rodrigues-Barata A R, Molina-Ruiz A, Martorell-Calatayud A, Fernández-Crehuet P, Grimalt R, Barco D, Arias-Santiago S, Serrano-Falcón C, Camacho F M, Saceda-Corralo D, Jaén-Olasolo P, Vañó-Galván S. Folliculitis decalvans: Effectiveness of therapies and prognostic factors in a multicenter series of 60 patients with long-term follow-up[J]. J Am Acad Dermatol, 2018, 79(5): 878-883.
[PubMed]
|
| [13] |
Jakhar D, Kaur I, Chaudhary R. Dermoscopy of pityrosporum folliculitis[J]. J Am Acad Dermatol, 2019, 80(2): e43-e44.
[DOI]
|
| [14] |
Durdu M, Errichetti E, Eskiocak AH, Ilkit M. High accuracy of recognition of common forms of folliculitis by dermoscopy: An observational study[J]. J Am Acad Dermatol, 2019, 81(2): 463-471.
[PubMed]
|
| [15] |
Piccolo V. Update on dermoscopy and infectious skin diseases[J]. Dermatol Pract Concept, 2019, 10(1): e2020003.
[DOI]
|
| [16] |
Litaiem N, Midassi O, Zeglaoui F. Detecting subclinical mycetoma's black grains using dermoscopy[J]. Int J Dermatol, 2019, 58(2): 231-232.
[PubMed]
|
| [17] |
Arguello-Guerra L, Gatica-Torres M, Dominguez-Cherit J. Chromomycosis[J]. BMJ Case Rep, 2016, 2016: bcr2016215391.
[DOI]
|
| [18] |
Subhadarshani S, Yadav D. Dermoscopy of chromoblastomycosis[J]. Dermatol Pract Concept, 2017, 7(4): 23-24.
|
| [19] |
Dabas G, Kaur H, Vinay K, Kumaran MS, Shivaprakash MR, Saikia UN, Dogra S. Dermoscopy in disseminated sporotrichosis[J]. J Eur Acad Dermatol Venereol, 2019, 33(1): e33-e35.
[PubMed]
|
| [20] |
Sławińska M, Hlebowicz M, Iżycka-Świeszewska E, Sikorska M, Sokołowska-Wojdyło M, Smiatacz T, Nowicki R, Sobjanek M. Dermoscopic observations in disseminated cryptococcosis with cutaneous involvement[J]. J Eur Acad Dermatol Venereol, 2018, 32(6): e223-e224.
[PubMed]
|
| [21] |
Zattar GA, Cardoso F, Nakandakari S, Soares CT. Cutaneous histoplasmosis as a complication after anti-TNF use-Case report[J]. An Bras Dermatol, 2015, 90(3 Suppl 1): 104-107.
|
| [22] |
Heratizadeh A, Fricke D, Meinhardt-Wollweber M, Roth B, Werfel T. Non-contact remote digital dermoscopy-new perspectives on differential diagnosis of inflammatory skin diseases[J]. J Eur Acad Dermatol Venereol, 2020, 34(3): e125-e126.
[PubMed]
|
 2021, Vol. 16
2021, Vol. 16