21世纪初,首个感染阿米巴原虫的巨型病毒——拟菌病毒的发现[1]使人们重新思考病毒的起源和本质。这些巨型病毒基因组可超过1 Mbp,编码近1 000种蛋白质,远超普通病毒。它们还编码一些其他病毒中罕见的功能基因,特别是与蛋白质合成相关的基因。例如,拟菌病毒科的Tupanvirus和Klosneuvirus的基因组均编码全套20种氨酰tRNA合成酶和数十种翻译因子[2]。
马赛病毒是继拟菌病毒之后被发现的第2类阿米巴巨型病毒。2009年,第一株马赛病毒在法国马赛市一处冷却塔的水样中通过阿米巴共培养被分离[3],之后人们又陆续在突尼斯、塞内加尔、澳大利亚、日本、马来西亚、印度和巴西等地分离出相似病毒[4-11]。2018年,国内首次报道了马赛病毒上海株(Mar-SH2016)[12]。对Mar-SH2016基因组进行注释发现,它和其他马赛病毒一样,编码4种潜在翻译因子,分别是类翻译延伸因子G结构蛋白(ORF110)、真核生物多肽链释放因子eRF1(ORF139)、翻译延伸因子EF1a(ORF173)以及真核翻译起始因子eIF2/eIF5(ORF314),但这些因子在马赛病毒复制过程中的功能尚未得到深入研究。
真核生物蛋白质翻译过程是一个受细胞精密调控的过程,包括起始、延伸和终止3个阶段,其中起始阶段至关重要,需要细胞内一系列物质的参与。真核翻译起始因子通过与核糖体、mRNA以及起始tRNA之间的相互作用控制蛋白翻译的起始,目前已发现了至少12种。Mar-SH2016编码的ORF314基因全长453 bp,编码151个氨基酸(amino acid,aa),蛋白相对分子质量为17.3×103,与宿主卡氏棘阿米巴(Acanthamoeba castellanii)编码的eIF2/eIF5氨基酸序列同源性达60%。
本研究以ORF314基因为研究对象,通过RNA干扰技术降低其在Mar-SH2016感染的卡氏棘阿米巴细胞中的mRNA表达水平,分析其对病毒复制的影响,以期为揭示这些病毒编码的相关潜在翻译因子的功能提供理论基础。
1 材料和方法 1.1 材料 1.1.1 细胞及病毒卡氏棘阿米巴Neff株(ATCC 30010)购自美国菌种保藏中心,用PYG(peptone-yeast extract with glucose)培养基于25 ℃静置培养[13]。马赛病毒上海株Mar-SH2016(GenBank登录号:MG827395)由本实验室分离保存。
1.1.2 引物及抗体根据Mar-SH2016编码的eIF2/eIF5(ORF314)基因序列设计实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)引物,由苏州金唯智生物科技有限公司合成,上游引物为5’-CTTGGTACGAGCTCCGGTTT-3’,下游引物为5’-CCACAACCTCTGCAGGACAT-3’。抗ORF314抗体用本实验室免疫小鼠(上海斯莱克实验动物有限责任公司)制备,辣根过氧化物酶(horseradish peroxidase,HRP)标记兔抗小鼠IgG购自生工生物工程(上海)股份有限公司,基础型化学发光检测试剂购自上海雅酶生物医药科技有限公司。
1.2 方法 1.2.1 靶向ORF314基因的小干扰RNA(small interfering RNA,siRNA)制备根据RNA干扰设计原则,针对Mar-SH2016编码的eIF2/eIF5(ORF314)基因设计3对siRNA,另设计1对无义siRNA为阴性对照(negative control,NC),序列如表 1所示。针对靶基因的siRNA采用5’CY3修饰,由上海吉玛制药技术有限公司合成。
| Target gene | Sense siRNA (5’-3’) | Antisense siRNA (5’-3’) | siRNA code |
| ORF314 | GAACGCGAGGACCUUCUUUTT | AAAGAAGGUCCUCGCGUUCTT | 314-1 |
| CCAUUGAACUUGGUACGAGTT | CUCGUACCAAGUUCAAUGGTT | 314-1.9 | |
| CCAGAGCUUUCAUACGAAGTT | CUUCGUAUGAAAGCUCUGGTT | 314-3 | |
| NC | UUCUCCGAACGUGUCACGUTT | ACGUGACACGUUCGGAGAATT | NC |
将卡氏棘阿米巴于12孔细胞培养板培养至密度为105cell/mL,移除PYG培养基,用PAS盐溶液(按ATCC Meidum 1323标准配方配制)完全浸没细胞,轻轻漂洗2~3次后加入适量新鲜PYG培养基。参照Lipofectamin RNAiMAX(Invitrogen)说明书进行细胞转染,siRNA终浓度为100 nmol/L。转染后于25 ℃静置培养3 h,滴加Mar-SH2016病毒悬液,感染复数(multiplicity of infection,MOI)约为10,1 h后用PAS盐溶液轻轻漂洗细胞,除去未吸附的病毒,重新加入适量PYG培养基,于25 ℃静置培养,定时收集细胞。
1.2.3 转染效率荧光检测将5’CY3修饰的siRNA转染卡氏棘阿米巴细胞4 h后,用CKX41荧光倒置显微镜(Olympus)红色激发光对细胞进行观察,摄影记录转染细胞的比例。
1.2.4 实时定量PCR(real-time quantitative PCR,RT-qPCR)检测ORF314基因mRNA表达水平将卡氏棘阿米巴于12孔细胞培养板用PYG培养基培养(25 ℃)至细胞汇合度为70%~90%(密度约为105 cell/mL),加入Mar-SH2016病毒悬液(MOI约为10),感染1 h后小心移去PYG培养基,用磷酸盐缓冲液(phosphate buffered saline,PBS)轻轻漂洗3次,加入适量新鲜培养基,于25 ℃继续培养。收集不同感染时间的细胞,用RNAiso Plus(TaKaRa)试剂盒抽提细胞总RNA,用PrimeScript RT reagent kit with gDNA eraser(TaKaRa)试剂盒对其进行反转录得到cDNA。以此cDNA为模板,以细胞线粒体细胞色素B基因为内参,用BlasTaqTM 2X qPCR MasterMix(ABM)试剂盒进行RT-qPCR检测。
1.2.5 ORF314基因干扰效果鉴定于4 ℃ 500 g离心5 min,收集siRNA干扰后的卡氏棘阿米巴细胞沉淀,用RNAiso Plus试剂盒抽提细胞总RNA,利用RT-qPCR检测干扰后的ORF314基因mRNA表达水平。用棘阿米巴细胞裂解液[20 mmol/L Tris-HCl,pH 7.6;300 mmol/L NaCl; 20 mmol/L KCl; 6 mmol/L MgCl2; 1% Triton X-100;1 mmol/L苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)]裂解细胞沉淀,提取蛋白,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和蛋白免疫印迹法检测干扰后的ORF314基因蛋白表达水平。
1.2.6 病毒毒力测定Mar-SH2016感染后6 h收集siRNA干扰后的细胞悬液,反复冻融3次,以释放病毒颗粒,离心(500 g,5 min)收集含有病毒的上清液。向96孔板中每孔加入100 μ L细胞悬液,密度约为4×104 cell/mL,于25 ℃细胞培养箱中培养30 min至细胞贴壁,将含有病毒的上清液用PBS进行10倍系列稀释至10-11。吸取100 μ L病毒稀释液,缓慢滴加至含有细胞的孔板中,于25 ℃细胞培养箱内培养5 d,显微镜下观察,以出现明显的滋养体细胞裂解死亡为阳性,用Reed-Muench法计算病毒毒力(TCID50)[14]。
1.3 统计学分析实验均重复3次以上,数据以x±s表示,采用GraphPad Prism软件进行处理及分析,样本比较采用单因数方差分析,P<0.05为有显著统计学差异。
2 结果 2.1 ORF314基因在Mar-SH2016感染细胞中的表达动态Mar-SH2016感染卡氏棘阿米巴(MOI约为10)后一定时间收取阿米巴细胞,采用RT-qPCR分析ORF314基因的转录动态,以细胞线粒体细胞色素B基因为内参。结果显示,ORF314基因在Mar-SH2016感染的宿主细胞中得到表达(见图 1)。感染后1.5 h ORF314基因已有所表达,随后表达水平持续升高,感染后8 h达到峰值,且一直持续至感染后16 h。
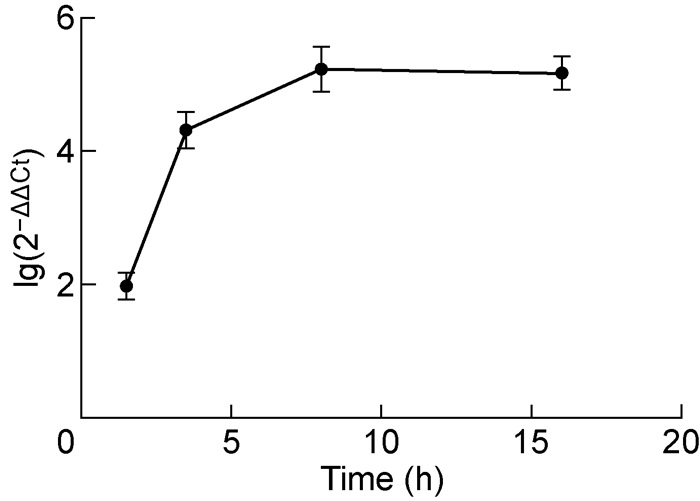
|
| 图 1 Mar-SH2016潜在翻译因子ORF314的转录动态 Fig. 1 Transcription of potential translation factor ORF314 of Mar-SH2016 |
用5’CY3修饰的siRNA转染卡氏棘阿米巴细胞,4 h后在荧光显微镜红色激发光下可以观察到细胞质内分布着一些红色荧光颗粒,细胞外也有一些游离的带有荧光的siRNA复合物(见图 2)。结果显示,1/3以上的细胞成功转染siRNA。
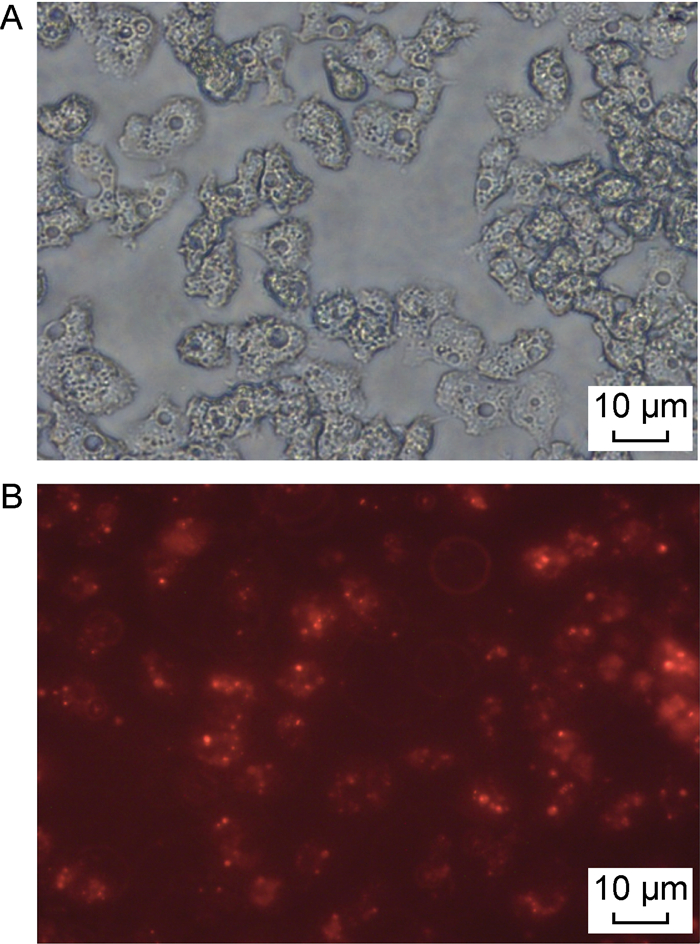
|
| A: Bright field microscopy. B: Florescent microscopy with red excitation light. 图 2 荧光显微镜观察荧光标记的siRNA转染的卡氏棘阿米巴细胞 Fig. 2 Flourescent microscopy of Acanthamoeba castellanii transfected with fluorescence-labeled siRNA |
根据ORF314基因序列设计3对siRNA和1对无义siRNA,转染卡氏棘阿米巴3 h后用Mar-SH2016感染(MOI约为10)。采用RT-qPCR和蛋白免疫印迹法,测定ORF314基因表达水平,结果如图 3所示。与转染无关siRNA的阴性对照相比,靶向ORF314基因的3对siRNA中有2对能显著降低其mRNA表达水平(P < 0.01),编号分别是314-1和314-1.9(见图 3A)。蛋白免疫印迹结果显示,与阴性对照相比,同样是编号为314-1和314-1.9的2对siRNA干扰后的ORF314基因蛋白表达量降低(见图 3B)。
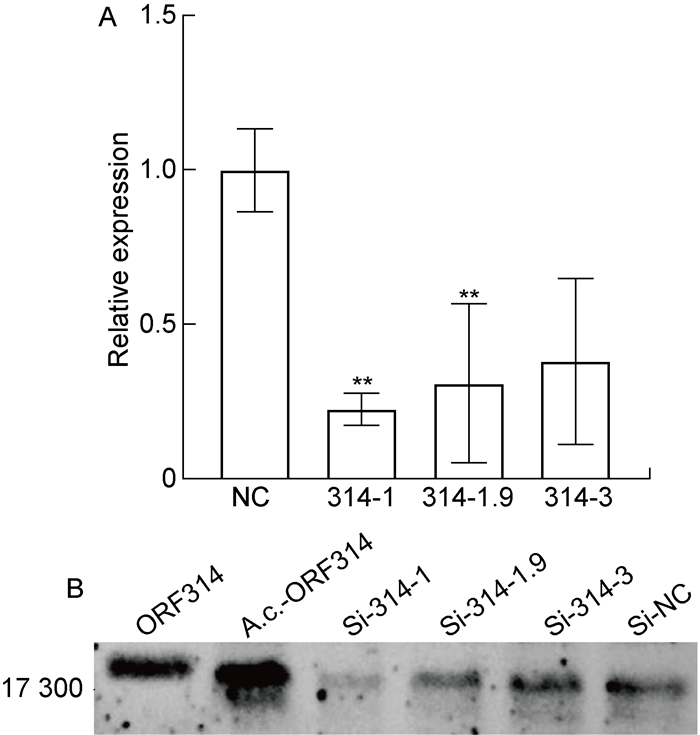
|
| A: Transcriptional level of ORF314 in Mar-SH2016-infected cells after siRNA interference by RT-qPCR (* *P < 0.01 compared with NC). B: Protein expression of ORF314 in Mar-SH2016-infected cells after siRNA interference by Western blotting. ORF314: the purified ORF314 protein expressed in prokaryotic cells; A.c.-ORF314: cell lysates of Acanthamoeba castellanii after virus infection; Si-314-1, Si-314-1.9, Si-314-3 and Si-NC: cell lysates of Acanthamoeba castellanii transfected with three pairs of siRNA against ORF314 and control siRNA, respectively. 图 3 siRNA对Mar-SH2016感染细胞中ORF314基因表达的影响 Fig. 3 Effect of siRNA on expression of ORF314 in Mar-SH2016-infected cells |
将靶向ORF314基因的3对siRNA转染卡氏棘阿米巴,3 h后用Mar-SH2016感染(MOI约为10)。感染后6 h以卡氏棘阿米巴作为宿主细胞测定病毒毒力,结果如图 4所示。与转染无关siRNA的阴性对照相比,3对siRNA中有2对能显著降低Mar-SH2016的毒力(P < 0.01),编号分别是314-1和314-1.9,与干扰ORF314基因转录和蛋白合成的结果一致。Mar-SH2016毒力下降约30%,表明ORF314基因表达被干扰后Mar-SH2016的正常复制受到一定影响。
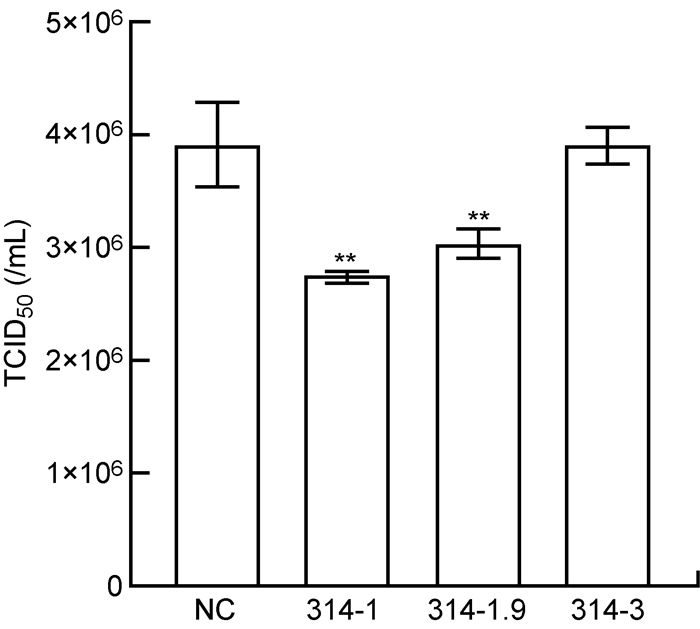
|
| NC: cells treated with control siRNA; 314-1, 314-1.9, 314-3: cells transfected with three pairs of siRNA against ORF314. * *P < 0.01 compared with NC. 图 4 siRNA干扰ORF314基因对Mar-SH2016毒力的影响 Fig. 4 Effect of siRNA on virus production in Mar-SH2016-infected cells |
大部分已知的巨型病毒基因组中超过一半的假定基因尚没有明确的功能注释[15],只有小部分拟菌病毒蛋白的功能得到了研究,包括一些氨基酰-tRNA合成酶[16-17]和参与糖生物合成的蛋白[18]。Sobhy等[19]首次利用RNA干扰技术降低拟菌病毒相关基因的表达,发现拟菌病毒纤毛的形成可能与功能未知的L725蛋白和L829蛋白、注释功能为氧化还原酶的R135蛋白以及属于TPR蛋白超家族[20-22](介导蛋白质与蛋白质、病毒与宿主之间相互作用以及调节病毒复制的一类蛋白质)的R856蛋白有关,敲低这4个基因对拟菌病毒的纤毛形成有影响。Zinoviev等[23]对拟菌病毒科和马赛病毒科病毒编码的潜在翻译延伸因子1家族的GTPase(trGTPase)进行研究发现,前者的trGTPase与GTP结合蛋白1(GTP binding protein 1,GTPBP1)的关系密切,在翻译延伸过程中能将同源氨基酰-tRNA传递到核糖体A位点,而后者的trGTPase与真核生物翻译延伸因子eEF1A、多肽链释放因子eRF3和mRNA检测因子Hbs1的关系更为密切,具有类似于eRF3的功能,可终止翻译进程并促进多肽链的释放。
本研究对马赛病毒上海株Mar-SH2016的真核翻译起始因子eIF2/eIF5(ORF314)进行RNA干扰,用RT-qPCR检测其转录动态。结果显示,在Mar-SH2016感染宿主卡氏棘阿米巴的过程中,ORF314基因呈现动态表达,于约1.5 h内开始表达,感染后8 h表达量达到峰值且持续至感染后16 h。将siRNA转入宿主细胞,用Mar-SH2016感染6 h后ORF314基因表达水平显著下降,且病毒毒力显著降低(P < 0.01),下降近30%,表明病毒的复制受到影响。将siRNA转染卡氏棘阿米巴细胞并延长病毒感染时间至9 h,ORF314基因的表达不再被siRNA显著影响(结果未显示)。这可能是由于siRNA的干扰效果持续时间有限,须进一步加大siRNA用量并设法提高转染效率。
此外,siRNA引起Mar-SH2016毒力降低的幅度远低于ORF314基因转录水平下降的幅度。这可能是因为马赛病毒ORF314基因与宿主棘阿米巴基因组中的氨基酸序列同源性达60%,可以在一定程度上弥补ORF314水平降低对病毒复制的影响。尽管如此,本研究发现siRNA干扰ORF314基因表达能显著抑制Mar-SH2016的早期复制,提示Mar-SH2016在感染早期可能需要ORF314基因的协助来进行自身蛋白质合成,表明从严格意义上来说马赛病毒编码的这些与翻译相关的基因并不是冗余的。
巨型病毒的发现改变了以往人们对病毒的认知,对马赛病毒的一些重要问题开展深入研究有助于了解此类巨型病毒的复制机制,加深对其本质和起源的认识,同时有助于认清其对人类及其他生物的潜在影响,为进一步探究其在生态系统中的地位和作用提供了理论依据。
| [1] |
La Scola B, Audic S, Robert C, Jungang L, De Lamballerie X, Drancourt M, Birtles R, Claverie J M, Raoult D. A giant virus in amoebae[J]. Science, 2003, 299(5615): 2033.
[DOI]
|
| [2] |
Rodrigues RAL, da Silva LCF, Abrahão JS. Translating the language of giants: translation-related genes as a major contribution of giant viruses to the virosphere[J]. Arch Virol, 2020, 165(6): 1267-1278.
[PubMed]
|
| [3] |
Boyer M, Yutin N, Pagnier I, Barrassi L, Fournous G, Espinosa L, Robert C, Azza S, Sun S, Rossmann MG, Suzan-Monti M, La Scola B, Koonin EV, Raoult D. Giant Marseillevirus highlights the role of amoebae as a melting pot in emergence of chimeric microorganisms[J]. Proc Natl Acad Sci U S A, 2009, 106(51): 21848-21853.
[DOI]
|
| [4] |
Thomas V, Bertelli C, Collyn F, Casson N, Telenti A, Goesmann A, Croxatto A, Greub G. Lausannevirus, a giant amoebal virus encoding histone doublets[J]. Environ Microbiol, 2011, 13(6): 1454-1466.
[DOI]
|
| [5] |
Lagier JC, Armougom F, Million M, Hugon P, Pagnier I, Robert C, Bittar F, Fournous G, Gimenez G, Maraninchi M, Trape JF, Koonin EV, La Scola B, Raoult D. Microbial culturomics: paradigm shift in the human gut microbiome study[J]. Clin Microbiol Infect, 2012, 18(12): 1185-1193.
[DOI]
|
| [6] |
Aherfi S, Boughalmi M, Pagnier I, Fournous G, La Scola B, Raoult D, Colson P. Complete genome sequence of Tunisvirus, a new member of the proposed family Marseilleviridae[J]. Arch Virol, 2014, 159(9): 2349-2358.
[DOI]
|
| [7] |
Doutre G, Philippe N, Abergel C, Claverie JM. Genome analysis of the first Marseilleviridae representative from Australia indicates that most of its genes contribute to virus fitness[J]. J Virol, 2014, 88(24): 14340-9.
[DOI]
|
| [8] |
Dornas FP, Assis FL, Aherfi S, Arantes T, Abrahão JS, Colson P, La Scola B. A Brazilian Marseillevirus is the founding member of a lineage in family Marseilleviridae[J]. Viruses, 2016, 8(3): 76-91.
[DOI]
|
| [9] |
Takemura M. Draft Genome Sequence of Tokyovirus, a member of the family Marseilleviridae isolated from the Arakawa River of Tokyo, Japan[J]. Genome Announc, 2016, 4(3): e00429-16.
[DOI]
|
| [10] |
Chatterjee A, Kondabagil K. Complete genome sequence of Kurlavirus, a novel member of the family Marseilleviridae isolated in Mumbai, India[J]. Arch Virol, 2017, 162(10): 3243-3245.
[DOI]
|
| [11] |
Tan YF, Lim CY, Chong CW, Lim PKC, Yap IKS, Leong PP, Voon K. Isolation and quantification of mimivirus-like and marseillevirus-like viruses from soil samples in an aboriginal (Orang asli) village in Peninsular Malaysia[J]. Intervirology, 2018, 61(2): 92-95.
[DOI]
|
| [12] |
夏宇程, 钟江. 马赛病毒上海分离株的分离和全基因组分析[J]. 病毒学报, 2018, 34(05): 591-598. [DOI]
|
| [13] |
Kong HH, Pollard TD. Intracellular localization and dynamics of myosin-Ⅱ and myosin-IC in live Acanthamoeba by transient transfection of EGFP fusion proteins[J]. J Cell Sci, 2002, 115(Pt 24): 4993-5002.
[PubMed]
|
| [14] |
Abrahão JS, Oliveira GP, Ferreira Da Silva LC, Dos Santos Silva LK, Kroon EG, La Scola B. Mimiviruses: replication, purification, and quantification[J]. Curr Protoc Microbiol, 2016, 41: 14 g.1.1-14 g.1.13.
|
| [15] |
Boyer M, Gimenez G, Suzan-Monti M, Raoult D. Classification and determination of possible origins of ORFans through analysis of nucleocytoplasmic large DNA viruses[J]. Intervirology, 2010, 53(5): 310-320.
[DOI]
|
| [16] |
Abergel C, Chenivesse S, Byrne D, Suhre K, Arondel V, Claverie JM. Mimivirus TyrRS: preliminary structural and functional characterization of the first amino-acyl tRNA synthetase found in a virus[J]. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2005, 61: 212-215.
[DOI]
|
| [17] |
Abergel C, Rudinger-Thirion J, Giegé R, Claverie JM. Virus-encoded aminoacyl-tRNA synthetases: structural and functional characterization of mimivirus TyrRS and MetRS[J]. J Virol, 2007, 81(22): 12406-12417.
[DOI]
|
| [18] |
Piacente F, Marin M, Molinaro A, De Castro C, Seltzer V, Salis A, Damonte G, Bernardi C, Claverie JM, Abergel C, Tonetti M. Giant DNA virus mimivirus encodes pathway for biosynthesis of unusual sugar 4-amino-4, 6-dideoxy-D-glucose (Viosamine)[J]. J Biol Chem, 2012, 287(5): 3009-3018.
[DOI]
|
| [19] |
Sobhy H, Scola BL, Pagnier I, Raoult D, Colson P. Identification of giant Mimivirus protein functions using RNA interference[J]. Front Microbiol, 2015, 6: 345-355.
[PubMed]
|
| [20] |
Cortajarena AL, Regan L. Ligand binding by TPR domains[J]. Protein Sci, 2006, 15(5): 1193-1198.
[PubMed]
|
| [21] |
Tani J, Shimamoto S, Mori K, Kato N, Moriishi K, Matsuura Y, Tokumitsu H, Tsuchiya M, Fujimoto T, Kato K, Miyoshi H, Masaki T, Kobayashi R. Ca(2+) /S100 proteins regulate HCV virus NS5A-FKBP8/FKBP38 interaction and HCV virus RNA replication[J]. Liver Int, 2013, 33(7): 1008-1018.
[DOI]
|
| [22] |
Jeshtadi A, Burgos P, Stubbs CD, Parker AW, King LA, Skinner MA, Botchway SW. Interaction of poxvirus intracellular mature virion proteins with the TPR domain of kinesin light chain in live infected cells revealed by two-photon-induced fluorescence resonance energy transfer fluorescence lifetime imaging microscopy[J]. J Virol, 2010, 84(24): 12886-12894.
[DOI]
|
| [23] |
Zinoviev A, Kuroha K, Pestova TV, Hellen CUT. Two classes of EF1-family translational GTPases encoded by giant viruses[J]. Nucleic Acids Res, 2019, 47(11): 5761-5776.
[PubMed]
|
 2021, Vol. 16
2021, Vol. 16


