生殖器疱疹是最常见的性传播疾病之一[1-2],单纯疱疹病毒2型(herpes simplex virus type 2,HSV-2)是其主要病原体[3]。HSV-2属于疱疹病毒科α疱疹病毒亚科,是具有包膜的线性双链DNA病毒[4],可通过性接触传播或新生儿经母体生殖道感染,大大提高了人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染及传播的风险[5]。HSV-2感染所致疾病通常症状轻微或无症状,但对新生儿和免疫功能低下者来说可能危及生命[6]。此外,HSV-2原发性感染后,可在骶神经节中终身潜伏[7],当机体免疫力低下时,其周期性地在神经节内重激活导致复发性感染。HSV-2特异性治疗药物虽能有效控制临床症状,抑制病毒增殖,但不能根除潜伏的HSV-2并控制复发感染。因此,HSV-2感染严重威胁着人类健康。
研究证明,HSV-2核衣壳从装配起始至成熟主要存在A、B、C型衣壳3种形式[8-10]。A型衣壳通常为空衣壳,多见于核衣壳形成的起始阶段。B型衣壳多为发育成熟中的衣壳,其特点为具有UL26.5基因编码蛋白ICP35[11]。ICP35为衣壳支架蛋白,最初形式是衣壳支架蛋白前体ICP35cd(也称pre-VP22a),其肽链内部含有丝氨酸蛋白酶切割位点(M位点),可被UL26基因编码的丝氨酸蛋白酶VP24识别切割,从而产生衣壳支架蛋白ICP35ef(VP22a)[12]。ICP35cd较于ICP35ef在HSV-2衣壳装配中具有更重要的作用。ICP35cd通过其自身部分联结起始衣壳的装配,其C端还形成一个α螺旋结构,可特异作用于UL19编码的主要核衣壳蛋白成分VP5,促使VP5围绕ICP35cd进行装配形成复合物,再由ICP35cd的核定位信号指导该复合物进入细胞核聚合形成支架[13]。此外,ICP35cd与UL6基因编码蛋白之间的相互作用在衣壳形成、DNA进入过程中也发挥重要作用。最后,ICP35cd被磷酸化和水解,形成衣壳支架蛋白ICP35ef。当DNA分子进入B型衣壳后,衣壳内的ICP35ef解体出壳,形成成熟衣壳——C型衣壳。早有研究表明,缺失UL26.5基因的HSV,其大量子代病毒颗粒的衣壳装配失败,不能形成新的成熟病毒颗粒,或者形成的病毒颗粒毒力大大减弱[14-15]。鉴于UL26.5基因编码蛋白ICP35在HSV衣壳装配中的消长特性[即仅在早期(装配起始未形成成熟衣壳)出现,后期(形成成熟衣壳)消失]及重要作用,进一步探讨HSV-2 UL26.5基因功能可以为研究蛋白相互作用、病毒与宿主的相互作用以及筛选药物靶标等工作提供支持。本研究对HSV-2衣壳支架蛋白ICP35进行原核表达、抗体制备,并分析其在病毒增殖中的表达特性。
1 材料与方法 1.1 材料人阴道上皮细胞VK2/E6E7购自美国菌种保藏中心(American Type Culture Collection,ATCC),由中国医学科学院医学生物学研究所病毒免疫室冻存,用含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的高糖DMEM培养液于37 ℃恒温培养箱(5% CO2)中培养。HSV-2(HG52株)购自中国食品药品检定研究院,由中国医学科学院医学生物学研究所病毒免疫室扩增并保存。大肠埃希菌DH5α、BL21(DE3)购自北京擎科新业生物技术有限公司。pET-32a(+)购自北京索莱宝科技有限公司。限制性内切酶EcoR I和Hind Ⅲ、T4 DNA连接酶、DL 15 000 DNA Marker、基因扩增试剂盒PrimeSTAR® HS DNA Polymerase with GC Buffer购自宝生物工程(大连)有限公司,弗氏完全佐剂/弗氏不完全佐剂、异丙基-β-D-硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)购自美国Sigma公司,AxyPrep体液病毒DNA/RNA小量制备试剂盒购自美国Axygen公司,TIANGEN通用型DNA纯化回收试剂盒、TIANGEN无内毒素质粒小提中量试剂盒购自天根生化科技(北京)有限公司,Peroxidase-conjugated AffiniPure Sheep Anti-Rabbit IgG(H+L)购自美国Jackson公司,Alexa Fluor® 488 Goat Anti-Rabbit IgG(H+L)、4′, 6-二脒基-2-苯基吲哚(4′, 6-diamidino-2-phenylindole,DAPI)购自美国Invitrogen公司。
1.2 方法 1.2.1 引物设计及合成根据HSV-2 UL26.5基因序列(Gene ID:1487311)及原核表达载体pET-32a(+)的多克隆位点,利用DNAMAN软件进行限制性内切酶分析,本研究选用EcoR I、Hind Ⅲ两个酶切位点。在设计引物时,正向引物加入EcoR I酶切位点,引物序列为5′-ATAGAATTCA-TGAACCCCGTTTCGGCATC-3′;反向引物加入Hind Ⅲ酶切位点,引物序列为5′-GCGAAGCT-TTTTATTTAAAATATATGAAAACACACA-3′。所用引物由生工生物工程(上海)股份有限公司合成,用去离子水稀释至工作浓度10 μmol/L,-20 ℃保存备用。
1.2.2 HSV-2基因组提取及目的基因扩增HSV-2基因组提取采用AxyPrep体液病毒DNA/RNA小量制备试剂盒,UL26.5基因扩增采用PrimeSTAR® HS DNA Polymerase with GC Buffer试剂盒,具体步骤参照说明书。聚合酶链反应(polymerase chain reaction,PCR)条件为:98 ℃预变性2 min,98 ℃变性15 s,55 ℃退火10 s,68 ℃延伸75 s,40个循环后4 ℃保持。PCR结束后,进行1.5%琼脂糖凝胶电泳。
1.2.3 PCR产物的纯化、酶切及原核表达载体的构建和筛选UL26.5的PCR产物纯化采用TIANGEN通用型DNA纯化回收试剂盒,具体步骤参照说明书。利用限制性内切酶EcoR I和Hind Ⅲ对UL26.5及表达载体pET-32a(+)进行双酶切,以备后续连接。反应体系为:EcoR I 5 μL,Hind Ⅲ 5 μL,DNA 5 μg,CutSmart Buffer(10×)25 μL,用不含RNase的双蒸水加至250 μL。反应条件:37 ℃水浴酶切1 h。将纯化后获得的双酶切目的DNA片段UL26.5与载体DNA按约摩尔比3∶1结合,16 ℃连接过夜,然后取5~10 μL用于大肠埃希菌感受态细胞DH5α的转化,筛选重组质粒,并将鉴定正确的重组质粒命名为pET-32a(+)-UL26.5。
1.2.4 HSV-2 ICP35重组蛋白的诱导表达、纯化及兔多克隆抗体的制备将鉴定正确的重组质粒转化大肠埃希菌感受态细胞BL21(DE3),转化菌涂布于含60 μg/mL氨苄西林的LB平板,倒置培养16 h;挑取携带重组质粒的单克隆菌落,接种于氨苄西林抗性的LB液体培养基,37 ℃,180 r/min振荡培养过夜;次日,按1∶50的比例接种于氨苄西林抗性的LB液体培养基,37 ℃,180 r/min振荡培养6~8 h,当OD600达到0.6左右时,向菌液中加入终浓度为0.2 mmol/L的IPTG溶液,诱导培养6 h;将所得菌液全部收集到50 mL离心管中,用溶菌酶处理菌体沉淀,分离上清及沉淀,进行12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)观察蛋白表达情况,并通过改变IPTG浓度、培养温度和培养时间来确定最佳诱导表达条件。根据重组蛋白表达的情况,本研究采用碧云天His标签蛋白产物纯化试剂盒纯化蛋白,具体步骤参照说明书。将表达纯化的HSV-2 ICP35重组蛋白定量,与完全弗氏佐剂、不完全弗氏佐剂按1: 1的比例混匀,室温缓慢振荡2 h,直至形成均一的油包水乳化剂,免疫新西兰大白兔,每次2 mg /只,共3次。免疫期满,颈动脉采血,分离血清,采用蛋白免疫印迹法检测兔血清抗体的产生情况,并通过间接酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测抗体效价。
1.2.5 免疫荧光检测HSV-2 ICP35在HSV-2增殖中的表达特性将人阴道上皮细胞VK2/E6E7预铺在细胞爬片上,待细胞汇合率约为80%,按感染复数(multiplicity of infection,MOI)为1接种HSV-2,于感染0、4、8、12、16、20 h后收集样品。取出细胞爬片,用0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)洗3次,4%多聚甲醛固定30 min;吸去固定液,用0.01 mol/L PBS洗3次,每次5 min;用0.2% Triton X-100/PBS透化5 min,蒸馏水洗1次;用冰丙酮∶甲醇(体积比7∶3)作用5 min,0.01 mol/L PBS洗3次,每次5 min;吸去多余水分,以4%牛血清白蛋白(bovine serum albumin,BSA)37 ℃封闭30 min;弃封闭液,加一抗,于湿盒内4 ℃过夜;次日用0.01 mol/L PBS洗3次,每次5 min;加荧光标记二抗,37 ℃避光反应30 min;用0.01 mol/L PBS洗3次,每次5 min;用蒸馏水洗1次,DAPI复染5 min,用PBS洗3次,每次5 min;分别用85%、95%、100%乙醇梯度脱水,每次1 min,最后一个乙醇梯度脱水2次,每次1 min;最后用荧光抗淬灭剂封片,于荧光显微镜下观察。
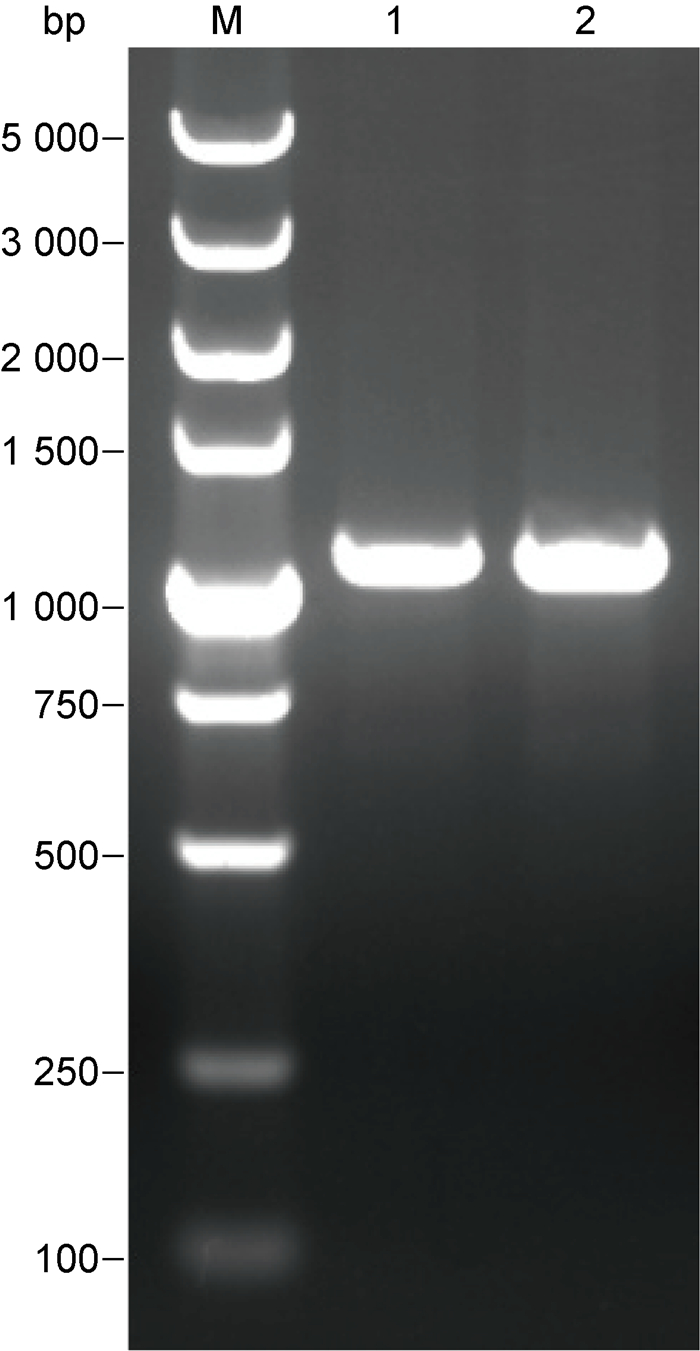
2 结果 2.1 HSV-2 UL26.5基因的PCR扩增以提取的HSV-2基因组DNA为模板,PCR扩增UL26.5基因。在设计PCR引物时加入EcoR I、Hind Ⅲ两个酶切位点,并且在每条引物的5′端加入3 bp的随机保护碱基,因此产物大小约为1 065 bp。PCR扩增结果如图 1所示,与预期结果一致。
|
| M: DL 5 000 DNA Marker; 1 and 2: HSV-2 UL26.5 gene amplified by PCR. 图 1 HSV-2 UL26.5基因的PCR扩增 Fig. 1 PCR amplification of HSV-2 UL26.5 gene |
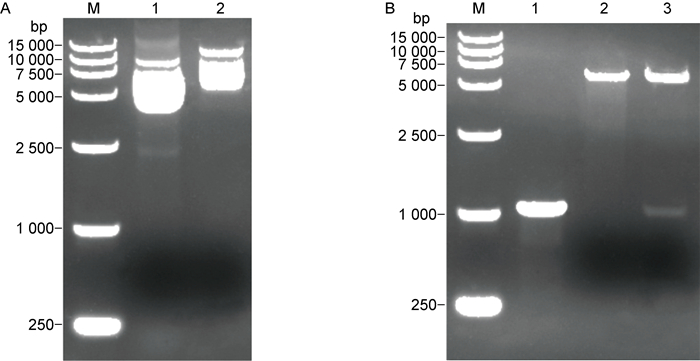
利用限制性内切酶EcoR I和Hind Ⅲ对HSV-2 UL26.5基因的PCR产物及原核表达载体pET-32a(+)进行双酶切,将酶切产物纯化回收,16 ℃连接过夜,用连接产物转化大肠埃希菌感受态细胞DH5α,筛选重组质粒。结果如图 2A所示,可见比空载体pET-32a(+)大的质粒。对筛选得到的重组质粒进行测序和酶切鉴定,大小符合双酶切后的目的DNA片段与载体(见图 2B)。测序结果与数据库中UL26.5基因的序列完全一致,表明载体构建成功,将鉴定正确的重组质粒命名为pET-32a(+)-UL26.5。
|
| M: DL1 5000 DNA Marker; A1: pET-32a(+) plasmid; A2: Recombinant plasmid; B1: Products from UL26.5 gene amplification digested with EcoR I + Hind Ⅲ; B2: Products from pET-32a(+) plasmid digested with EcoR I + Hind Ⅲ; B3: Products from pET-32a(+)-UL26.5 recombinant plasmid digested with EcoR I + Hind Ⅲ. 图 2 HSV-2 UL26.5重组质粒的筛选及鉴定 Fig. 2 Screening and identification of HSV-2 UL26.5 recombinant plasmid |
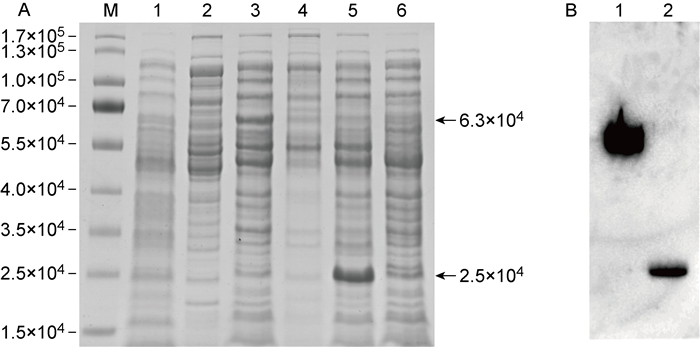
将pET-32a(+)-UL26.5重组质粒转化大肠埃希菌感受态细胞BL21(DE3),挑取单克隆,振荡培养至OD600为0.6左右,加入终浓度为0.2 mmol/L的IPTG溶液,诱导培养6 h,收集菌体沉淀,用溶菌酶处理,分离上清及沉淀,进行12% SDS-PAGE。结果显示,IPTG诱导处理的菌体裂解上清约在相对分子质量为6.3×104处有一蛋白条带(见图 3A3),与衣壳支架蛋白ICP35融合了His标签后的重组蛋白一致,而在IPTG诱导处理的菌体裂解沉淀(见图 3A4)及IPTG未诱导处理的菌体裂解上清(见图 3A1)和沉淀(见图 3A2)中未见到该条带。转化pET-32a(+)空载体的BL21(DE3)菌体裂解上清约在相对分子质量为2.5×104处有一标签蛋白条带(图 3A5)。结果表明,ICP35重组蛋白以可溶性蛋白存在于菌体裂解上清中。采用抗His标签蛋白的抗体进行蛋白免疫印迹检测,结果表明ICP35重组蛋白得到成功表达(见图 3B)。
|
| M: Protein Marker; A1: Non-induced supernatant of pET-32a(+)-UL26.5-transformed E.coli by IPTG; A2: Non-induced precipitation of pET-32a(+)-UL26.5-transformed E.coli by IPTG; A3: IPTG-induced supernatant of pET-32a(+)-UL26.5-transformed E.coli; A4: IPTG-induced precipitation of pET-32a(+)-UL26.5-transformed E.coli; A5: IPTG-induced supernatant of pET-32a(+)-transformed E.coli; A6: IPTG-induced precipitation of pET-32a(+)-transformed E.coli; B1: ICP35 recombinant protein; B2: His-tagged protein. 图 3 ICP35重组蛋白的诱导表达及鉴定 Fig. 3 Induced expression and identification of ICP35 recombinant protein |
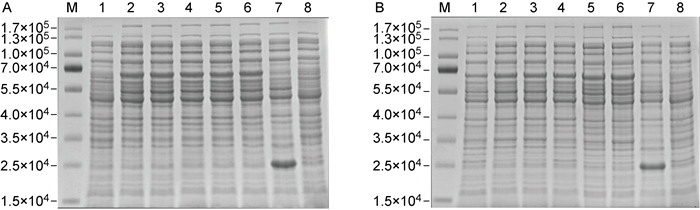
为获得较高丰度的ICP35重组蛋白,本研究通过改变IPTG浓度、培养温度和培养时间来确定最佳诱导表达条件。首先,在37 ℃条件下加入IPTG至其终浓度为0,0.2,0.4,0.6,0.8,1.0 mmol/L,诱导培养6 h,SDS-PAGE结果表明IPTG未诱导组无ICP35重组蛋白产生,其他IPTG浓度诱导组重组蛋白表达量无明显差异,因此选择IPTG终浓度0.2 mmol/L为最佳诱导浓度(见图 4A)。确定了最佳IPTG诱导浓度后,设置33 ℃、35 ℃及37 ℃为培养菌液温度,结果发现33 ℃组ICP35重组蛋白表达量较低,而35 ℃组与37 ℃组重组蛋白表达量无明显差异(见图 4B),因此选择37 ℃为重组蛋白表达的最适温度。在IPTG终浓度为0.2 mmol/L、37 ℃条件下,设置不同菌液诱导培养时间,结果发现分别诱导培养4、6、8 h重组蛋白表达量无明显差异(见图 4B),因此选择4 h为诱导表达重组蛋白的最适时间。
|
| M: Protein Marker; A1-6: 0, 0.2, 0.4, 0.6, 0.8, 1.0 mmol/L IPTG-induced supernatant of pET-32a(+)-UL26.5-transformed E.coli; A7 and B7: 0.2 mmol/L IPTG-induced supernatant of pET-32a(+)-transformed E.coli; A8 and B8: 0.2 mmol/L IPTG-induced precipitation of pET-32a(+)-transformed E.coli; B1-3: Induction at 33 ℃, 35 ℃ and 37 ℃, respectively; B4-6: Induction for 4, 6, 8 h, respectively. 图 4 ICP35重组蛋白诱导表达条件的优化 Fig. 4 Optimization of induced expression conditions for ICP35 recombinant protein |
确定ICP35重组蛋白的最佳诱导表达条件后,对其进行大量表达并纯化。结果如图 5A所示,ICP35重组蛋白经纯化后洗脱产物单一,纯度高。将纯化的HSV-2 ICP35重组蛋白定量后与佐剂混匀,多部位(肌肉、颈、脊部皮下、腹股沟)免疫新西兰大白兔3次,ELISA检测免疫后兔血清抗体效价为1∶32 768。为检测免疫兔血清的抗体产生情况及所产抗体能否特异性识别HSV-2感染过程中的衣壳支架蛋白ICP35,首先将HSV-2浓缩纯化,提取HSV-2颗粒蛋白,进行SDS-PAGE及蛋白免疫印迹检测。结果如图 5B所示,经HSV-2 ICP35重组蛋白免疫后,新西兰大白兔能够产生识别HSV-2感染过程中衣壳支架蛋白前体ICP35cd及衣壳支架蛋白ICP35ef的抗体,为后续采用免疫荧光分析HSV-2 ICP35在病毒增殖中的表达特性奠定了基础。
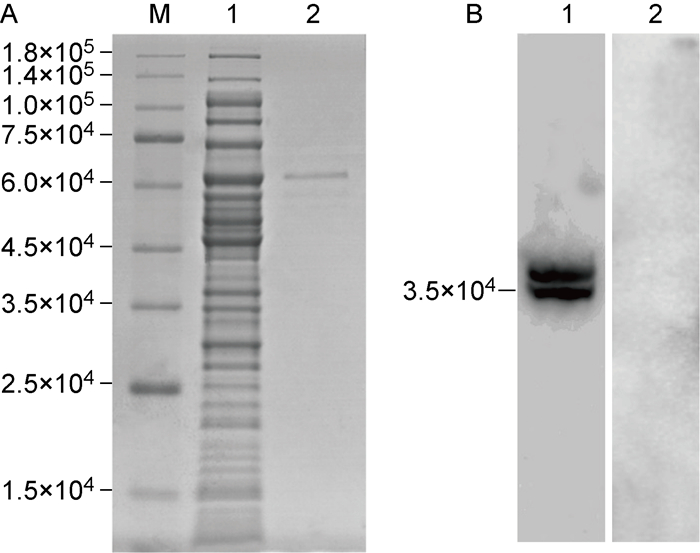
|
| M: Protein Marker; A1: Unpurified ICP35 recombinant protein; A2: Purified ICP35 recombinant protein; B1: Immunized rabbit serum by ICP35 recombinant protein; B2: Unimmunized rabbit serum. 图 5 HSV-2 ICP35重组蛋白的纯化及免疫兔血清的蛋白免疫印迹检测 Fig. 5 Purification of HSV-2 ICP35 recombinant protein and Western-blotting analysis of immunized rabbit serum |
采用免疫荧光检测ICP35在HSV-2感染人阴道上皮细胞VK2/E6E7过程中的表达特性,结果如图 6所示,VK2/E6E7细胞在未感染HSV-2时,细胞核形态规则,轮廓清晰,大小均一(见图 6A1);HSV-2感染4 h时,细胞核出现膨大,核边缘开始不规则,但未检测到HSV-2衣壳支架蛋白ICP35的表达(见图 6B3);HSV-2感染8 h时,部分VK2/E6E7细胞可检测到衣壳支架蛋白ICP35的低表达,并紧密围绕包裹在核周围(见图 6C3);HSV-2感染12 h时,可检测到VK2/E6E7细胞融合形成多核细胞,衣壳支架蛋白ICP35的表达量进一步增加,并出现向核内转运的现象(见图 6D3);HSV-2感染16 h时,病变细胞核膨大更明显,形态更不规则,在细胞质、细胞核内开始检测到聚集成斑点状的衣壳支架蛋白ICP35(见图 6E3),推测其已经参与了病毒核衣壳的装配;HSV-2感染20 h时,可见到更多衣壳支架蛋白ICP35聚集成斑点状的感染细胞(见图 6F3),充分表明ICP35在病毒增殖颗粒装配中发挥着重要作用。
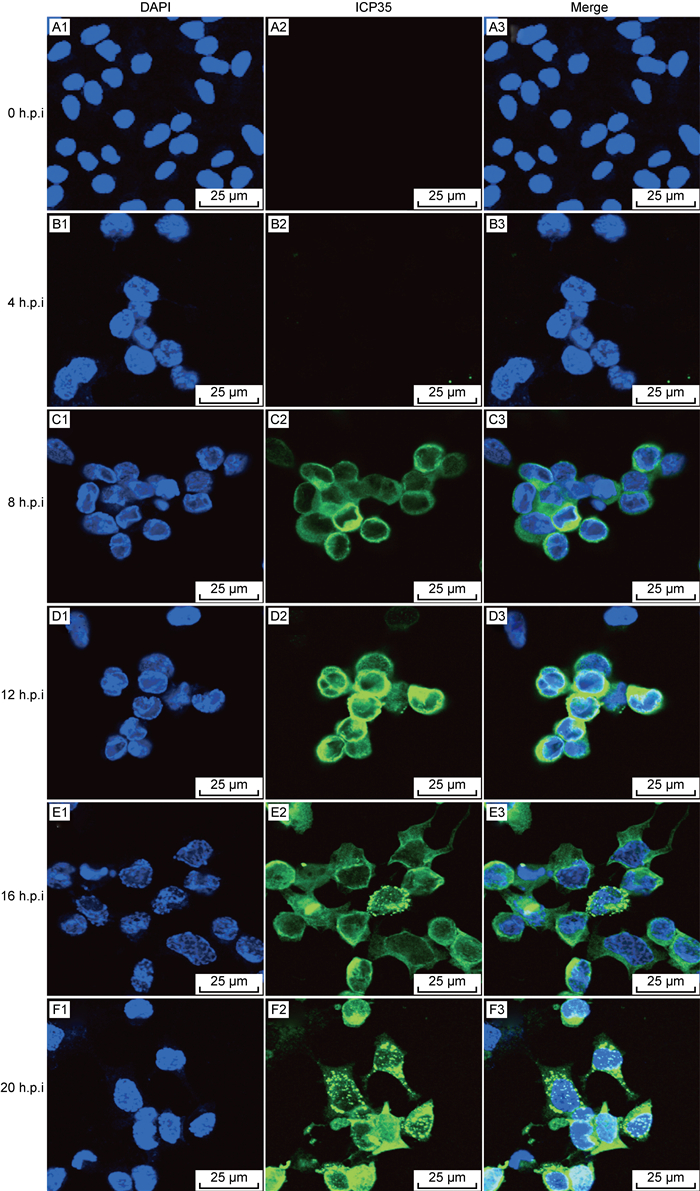
|
| A1-F1: DAPI staining of nucleus; A2-F2: Alexa Fluor® 488 staining of capsid scaffolding protein ICP35; A3-F3: Merged images of DAPI and Alexa Fluor® 488; h.p.i: hours post infection. 图 6 HSV-2 ICP35的免疫荧光检测(400×) Fig. 6 Immunofluorescence detection of HSV-2 capsid scaffolding protein ICP35(400×) |
HSV-2作为目前已知的最大病毒之一,其基因组和结构极其复杂。HSV-2颗粒呈球形,主要有4种结构成分:①最内层为病毒DNA及DNA结合蛋白构成的病毒核心;②核心外是病毒核衣壳;③核衣壳周围为一层被称为皮层(tegument)的不定型蛋白;④皮层外为病毒包膜[16]。其中,衣壳是病毒体的主要组成,可保护病毒核酸免受核酸酶或其他因素的破坏,并能介导病毒核酸进入所感染细胞的细胞核内[17-19]。衣壳最初组装为前体衣壳(B型衣壳),当病毒核酸进入时才转为成熟衣壳[20-22],而B型衣壳的装配需衣壳支架蛋白前体ICP35cd参与。ICP35cd是HSV-2感染机体时UL26.5基因编码的蛋白质[23],相对分子质量约为3.8×104。其肽链内部含有M位点,可被UL26基因编码的丝氨酸蛋白酶VP24识别切割,由此产生相对分子质量约为3.4×104的衣壳支架蛋白ICP35ef和一条由25个氨基酸组成的肽链,当HSV-2 DNA进入时,ICP35ef被挤出壳体而消失[12, 24]。本研究将大量扩增的HSV-2浓缩纯化后提取蛋白,经SDS-PAGE及蛋白免疫印迹检测,发现ICP35重组蛋白免疫兔血清可检测到2条特异性条带,与报道一致,表明HSV-2在感染细胞内的增殖过程中其大量病毒衣壳的装配处于不同阶段。
HSV-2在裂解性感染宿主细胞时,至少需要编码80多种蛋白质以帮助其基因组的复制转录、蛋白质的合成及子代病毒颗粒的组装等[25]。根据HSV-2基因转录的先后顺序,可分为α、β、γ 3类。α基因又称即刻早期基因(immediate-early gene,IE),在细胞内最早表达,于感染后2~4 h达到高峰。α基因编码产物可抑制宿主细胞生物大分子的有序合成,在HSV-2增殖起始中具有重要作用,可反式激活和调控β、γ基因的表达,促进早期蛋白和晚期蛋白的合成。β基因受α基因编码产物刺激后被激活,又称早期基因(early gene,E),一般在HSV-2感染细胞后5~7 h表达达到高峰,主要编码HSV-2的非结构蛋白。γ基因编码的是病毒复制晚期的产物,一般在感染细胞后12~15 h表达达到高峰,所以又称晚期基因(late gene,L),主要编码病毒的结构蛋白。UL26.5基因属于HSV-2晚期基因,其编码蛋白ICP35参与病毒核衣壳的装配。本研究采用免疫荧光检测发现HSV-2衣壳支架蛋白在病毒感染细胞8 h时才有低丰度的表达,感染12 h时表达量进一步增加,证明其属于HSV-2晚期蛋白。此外,本研究还观察到HSV-2衣壳支架蛋白ICP35在合成后紧密围绕在细胞核周围,推测该现象与ICP35合成后需转运入细胞核才能发挥功能有关,与Rixon等[26]早期研究HSV-1的结果一致。随着感染时间延长,ICP35聚集成斑点状并分布于细胞质和细胞核中,推测其可能发生了自我联结,并与其他蛋白质如VP5发生了相互作用,参与了病毒核衣壳的装配。
构建病毒基因表达载体、表达其蛋白,并免疫动物制备其抗体是研究病毒基因功能、分析基因表达特性及病毒蛋白亚细胞定位的重要途径,也是研制病原体亚单位疫苗的常用方法。本研究成功构建了HSV-2衣壳支架蛋白ICP35的原核表达载体,对重组蛋白诱导表达条件进行了优化,通过免疫家兔获得了抗ICP35抗体,并经免疫荧光检测分析了HSV-2感染过程中ICP35的表达特性及亚细胞定位,为后续相关研究提供了物质基础和理论依据。
| [1] |
Koren M, Decker CF. Genital herpes[J]. Dis Mon, 2016, 62(8): 287-293.
[DOI]
|
| [2] |
Gupta R, Warren T, Wald A. Genital Herpes[J]. Lancet, 2007, 370(9605): 2127-2137.
[DOI]
|
| [3] |
Looker KJ, Garnett GP, Schmid GP. An estimate of the global prevalence and incidence of herpes simplex virus type 2 infection[J]. Bull World Health Organ, 2008, 86(10): 805-812.
[DOI]
|
| [4] |
Koelle DM, Norberg P, Fitzgibbon MP, Russell RM, Greninger AL, Huang ML, Stensland L, Jing L, Magaret AS, Diem K, Selke S, Xie H, Celum C, Lingappa JR, Jerome KR, Wald A, Johnston C. Worldwide circulation of HSV-2×HSV-1 recombinant strains[J]. Sci Rep, 2017, 7: 44084.
[DOI]
|
| [5] |
Looker KJ, Elmes JAR, Gottlieb SL, Schiffer JT, Vickerman P, Turner KME, Boily MC. Effect of HSV-2 infection on subsequent HIV acquisition: an updated systematic review and meta-analysis[J]. Lancet Infect Dis, 2017, 17(12): 1303-1316.
[DOI]
|
| [6] |
Westhoff GL, Little SE, Caughey AB. Herpes simplex virus and pregnancy: a review of the management of antenatal and peripartum herpes infections[J]. Obstet Gynecol Surv, 2011, 66(10): 629-638.
[DOI]
|
| [7] |
Thellman NM, Triezenberg SJ. Herpes simplex virus establishment, maintenance, and reactivation: in vitro modeling of latency[J]. Pathogens, 2017, 6(3): 28.
[DOI]
|
| [8] |
Perdue ML, Cohen JC, Kemp MC, Randall CC, O'callaghan DJ. Characterization of three species of nucleocapsids of equine herpesvirus type-1 (EHV-1)[J]. Virology, 1975, 64(1): 187-204.
[DOI]
|
| [9] |
Brown JC, Newcomb WW. Herpesvirus capsid assembly: insights from structural analysis[J]. Curr Opin Virol, 2011, 1(2): 142-149.
[DOI]
|
| [10] |
Wang J, Yuan S, Zhu D, Tang H, Wang N, Chen W, Gao Q, Li Y, Wang J, Liu H, Zhang X, Rao Z, Wang X. Structure of the herpes simplex virus type 2 C-capsid with capsid-vertex-specific component[J]. Nat Commun, 2018, 9(1): 3668.
[DOI]
|
| [11] |
Thomsen DR, Newcomb WW, Brown JC, Homa FL. Assembly of the herpes simplex virus capsid: requirement for the carboxyl-terminal twenty-five amino acids of the proteins encoded by the UL26 and UL26.5 genes[J]. J Virol, 1995, 69(6): 3690-3703.
[DOI]
|
| [12] |
Deckman IC, Hagen M, McCann PJ. Herpes simplex virus type 1 protease expressed in Escherichia coli exhibits autoprocessing and specific cleavage of the ICP35 assembly protein[J]. J Virol, 1992, 66(12): 7362-7367.
[DOI]
|
| [13] |
Nicholson P, Addison C, Cross AM, Kennard J, Preston VG, Rixon FJ. Localization of the herpes simplex virus type 1 major capsid protein VP5 to the cell nucleus requires the abundant scaffolding protein VP22a[J]. J Gen Virol, 1994, 75(Pt 5): 1091-1099.
[DOI]
|
| [14] |
Matusick-Kumar L, Hurlburt W, Weinheimer SP, Newcomb WW, Gao M. Phenotype of the herpes simplex virus type 1 protease substrate ICP35 mutant virus[J]. J Virol, 1994, 68(9): 5384-5394.
[DOI]
|
| [15] |
Tatman JD, Preston VG, Nicholson P, Elliott RM, Rixon FJ. Assembly of herpes simplex virus type 1 capsids using a panel of recombinant baculoviruses[J]. J Gen Virol, 1994, 75(Pt 5): 1101-1113.
[DOI]
|
| [16] |
Wagner EK, Sandri-Goldin RM. Herpes simplex viruses: molecular biology[M]//Mahy BWJ, Van Regenmortel MH. Encyclopedia of Virology. 3rd ed. New York: Academic Press, 2008: 397-405.
|
| [17] |
Ojala PM, Sodeik B, Ebersold MW, Kutay U, Helenius A. Herpes simplex virus type 1 entry into host cells: reconstitution of capsid binding and uncoating at the nuclear pore complex in vitro[J]. Mol Cell Biol, 2000, 20(13): 4922-4931.
[DOI]
|
| [18] |
Pasdeloup D, McElwee M, Beilstein F, Labetoulle M, Rixon FJ. Herpesvirus tegument protein pUL37 interacts with dystonin/BPAG1 to promote capsid transport on microtubules during egress[J]. J Virol, 2012, 87(5): 2857-2867.
[DOI]
|
| [19] |
Yuan S, Wang J, Zhu D, Wang N, Gao Q, Chen W, Tang H, Wang J, Zhang X, Liu H, Rao Z, Wang X. Cryo-EM structure of a herpesvirus capsid at 3.1 Å[J]. Science, 2018, 360(6384): eaao7283.
[DOI]
|
| [20] |
Newcomb WW, Homa FL, Thomsen DR, Booy FP, Trus BL, Steven AC, Spencer JV, Brown JC. Assembly of the herpes simplex virus capsid: characterization of intermediates observed during cell-free capsid formation[J]. J Mol Biol, 1996, 263(3): 432-446.
[DOI]
|
| [21] |
Rixon FJ, Mcnab D. Packaging-competent capsids of a herpes simplex virus temperature-sensitive mutant have properties similar to those of in vitro-assembled procapsids[J]. J Virol, 1999, 73(7): 5714-5721.
[DOI]
|
| [22] |
Newcomb WW, Homa FL, Thomsen DR, Trus BL, Cheng N, Steven A, Booy F, Brown JC. Assembly of the herpes simplex virus procapsid from purified components and identification of small complexes containing the major capsid and scaffolding proteins[J]. J Virol, 1999, 73(5): 4239-4250.
[DOI]
|
| [23] |
Gibson W, Roizman B. Proteins specified by herpes simplex virus. 8. Characterization and composition of multiple capsid forms of subtypes 1 and 2[J]. J Virol, 1972, 10(5): 1044-1052.
[DOI]
|
| [24] |
Trus BL, Booy FP, Newcomb WW, Brown JC, Homa FL, Thomsen DR, Steven A C. The herpes simplex virus procapsid: structure, conformational changes upon maturation, and roles of the triplex proteins VP19c and VP23 in assembly[J]. J Mol Biol, 1996, 263(3): 447-462.
[DOI]
|
| [25] |
Heming JD, Conway JF, Homa FL. Herpesvirus capsid assembly and DNA packaging[J]. Adv Anat Embryol Cell Biol, 2017, 223: 119-142.
[DOI]
|
| [26] |
Rixon FJ, Cross AM, Addison C, Preston VG. The products of herpes simplex virus type 1 gene UL26 which are involved in DNA packaging are strongly associated with empty but not with full capsids[J]. J Gen Virol, 1988, 69(Pt 11): 2879-2891.
[DOI]
|
 2022, Vol. 17
2022, Vol. 17


