2. 海军军医大学海军特色医学中心人因工程与高新技术武器防护研究室, 上海 200433
2. Laboratory of Human Factors of Navigation and Effect Prevention of High Technology Weapons Device, Naval Medical Center, Naval Medical University, Shanghai 200433, China
寨卡病毒(Zika virus,ZIKV)属于黄病毒科黄病毒属,为蚊媒传播病原体,感染机体后会引发寨卡病毒病,多表现为发热、皮疹、关节肌肉痛和结膜炎等临床症状,且与新生儿小头畸形和吉兰-巴雷综合征等并发症有关,因而引起全球广泛关注[1-4]。
ZIKV基因组为长约11 kb的单股正链RNA,内含单一开放阅读框,依次编码3种结构蛋白(衣壳蛋白、膜蛋白前体/膜蛋白和包膜蛋白)和7种非结构蛋白(non-structural protein,NS)(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)[5]。现有研究显示,ZIKV可感染多种类型的细胞并能在靶细胞中实现有效复制,但涉及的机制较为复杂,尤其是有关感染早期病毒与宿主细胞间的相互作用及其分子机制的研究仍很有限。目前,尚无治疗寨卡病毒病的有效药物。因此,针对ZIKV感染机制的研究将有助于寨卡病毒病的防治以及新型抗病毒药物的研发。
细胞自噬是对细胞内长寿蛋白、受损细胞器等内源性底物进行溶酶体依赖的分解代谢过程,有利于胞内物质能量再利用、延缓细胞衰老以及维持细胞稳态。自噬启动时,胞浆内会形成双层膜结构,包裹代谢底物形成自噬体。成熟的自噬体最终与溶酶体融合,形成自噬溶酶体,继而对内容物进行分解代谢[6-7]。在此过程中,自噬标记微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)会发生酯化,从胞浆型LC3(即LC3-Ⅰ)转变为LC3-Ⅱ,锚定于自噬体的膜上。LC3-Ⅱ的点状分布是自噬起始阶段的重要标志,它与自噬体的产生累积密切相关[8]。自噬的另一标记P62蛋白是个多功能蛋白质,可通过自噬溶酶体途径降解,是自噬终末阶段的重要检测指标。LC3-Ⅱ和P62的表达可以反映整个自噬过程或自噬流是否通畅[9]。当细胞受到病毒感染时,自噬可通过降解胞内受损细胞器以保证细胞存活,从而抵抗病毒感染,如单纯疱疹病毒[10];但有些黄病毒(如登革病毒、日本脑炎病毒和丙型肝炎病毒等)能逃避宿主细胞诱导的自噬监测与清除,并反过来利用自噬增强自身复制[11-12]。
调节细胞自噬的信号通路有多种且较为复杂,其中磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)和哺乳动物雷帕霉素靶标(mammalian target of rapamycin,mTOR)通路在自噬调节过程中起着关键作用[13]。mTOR分子是自噬诱导剂雷帕霉素的作用靶点,能与细胞中的不同组分形成2种mTOR复合物,即mTORC1和mTORC2,其中mTORC1是自噬调节的核心因子。当细胞缺乏营养时,细胞中的能量感应器mTORC1和腺苷酸活化蛋白激酶(adenosine 5'-monophosphate-activated protein kinase,AMPK)会直接调节自噬的发生。mTORC1下游底物Vps34(vacuolar protein sorting 34)可以结合Vps15从而被激活,并进一步与Beclin-1结合,形成Vps34-Vps15-Beclin1复合物,这对自噬泡膜的延伸和自噬蛋白向自噬泡的招募至关重要;而且,mTORC1与其他不同调节蛋白结合时,可选择性地参与自噬的不同过程[14]。此外,mTORC1也能磷酸化转录因子EB,抑制其核易位而调节自噬[15]。已有研究显示,ZIKV的NS4A和NS4B蛋白通过激活mTOR信号通路诱导胚胎神经干细胞发生自噬,从而引起神经系统损伤[16]。
多项研究表明,ZIKV可以感染多种细胞,包括胚胎神经干细胞、人脐静脉内皮细胞、人脑微血管内皮细胞、原代人皮肤成纤维细胞、人滋养层细胞等[12, 17-19]。另有研究显示,与ZIKV同属黄病毒属的登革病毒、黄热病毒、丙型肝炎病毒均能侵犯肝组织,导致肝炎等相关肝功能障碍[11]。ZIKV也能感染人肝癌细胞系Huh7,研究者在此细胞感染模型上进一步探究了相关药物的抗病毒作用以及ZIKV的细胞入侵机制[20-23]。本研究围绕ZIKV感染Huh7细胞诱导自噬,分析细胞自噬对ZIKV复制及其信号调节通路的影响,以期为后续基于自噬相关分子研制抗ZIKV药物提供理论与实验依据。
1 材料与方法 1.1 材料ZIKV GZ01株由北京微生物与流行病学研究所秦成峰教授惠赠,本研究室采用C6/36细胞进行病毒扩增后保存于-80 ℃备用。原始的Beclin-1短发夹RNA(short hairpin RNA,shRNA)购自美国Sigma Aldrich公司,mTagRFP-mWasabi-LC3荧光报告质粒由北京大学林健教授惠赠,pLenti-mTagRFP-mWasabi-LC3/Beclin-1 shRNA重组质粒由本研究室构建[17]。LC3抗体购自美国Sigma Aldrich公司,ZIKV NS3抗体购自美国GeneTex公司,P62、GAPDH抗体购自美国Abcam公司,Beclin-1、AMPK、Phospho-AMPK、TSC2、Phospho-TSC2、mTOR、Phospho-mTOR抗体购自美国Cell Signaling Technology公司。
1.2 方法 1.2.1 细胞培养与感染HEK293T(人胚肾细胞)、Vero E6、Huh7细胞均为本教研室保存。细胞培养使用含10%胎牛血清的DMEM完全培养液,并添加1 mmol/L L-谷氨酰胺、100 nmol/L非必需氨基酸和100 U/mL双抗(青霉素和链霉素)。将细胞置于37 ℃、CO2体积分数为5%的细胞培养箱中培养。感染前一天,将Huh7细胞以1×104个/孔接种于24孔板,次日用感染复数(multiple of infection,MOI)为0.5的ZIKV感染1 h,并更换为新鲜的DMEM完全培养液继续培养,分别在6、12、24、36、48 h收集细胞进行检测。对于自噬诱导或抑制实验,先用不同浓度的诱导剂或抑制剂预处理细胞2 h,然后以MOI为0.5的ZIKV感染1 h,更换为新鲜的含或不含上述药物的DMEM完全培养液继续培养,在相应时间点收集细胞培养上清液或裂解细胞进行检测。
1.2.2 慢病毒制备与感染转染前一天,将HEK293T细胞以5×105个/孔接种于6孔板。次日,待细胞密度达90%以上时,用250 μL Opti-MEM共稀释目的质粒pLenti-mTagRFP-mWasabi-LC3/Beclin-1 shRNA 2.22 μg,以及包装辅助质粒MDL 1.11 μg、REV 0.83 μg、VSVG 0.83 μg,混匀,再与10 μL LipofectamineTM 2000轻轻混匀,室温静置20 min。将此复合物逐滴加入细胞培养板中,轻轻摇匀。转染6 h后,更换为新鲜的DMEM完全培养液,分别于转染后48 h、72 h收集细胞培养上清液,3 000 r/min离心5 min。取上清液感染Huh7细胞,48 h后按MOI为0.5感染ZIKV,继续培养24 h。
1.2.3 蛋白免疫印迹检测吸去Huh7细胞培养液,加入适量的含1 mmol/L苯甲基磺酰氟(phenylmethylsulfonyl fluoride, PMSF)和蛋白酶抑制剂cocktail的RIPA裂解液,于冰上裂解细胞20 min,然后与样品缓冲液混合,100 ℃煮沸10 min,高速离心后吸取上清液。将制备的蛋白样品经12.5%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离,采用电转移法转印至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,经5%脱脂牛奶封闭2 h,加入适当稀释的一抗,于4 ℃孵育过夜。次日,经TBS/T(Tris buffered saline/Tween 20)漂洗后,加入相应二抗,室温孵育1 h,再经TBS/T漂洗,采用ChemiScope 6200 Touch一体式化学发光成像系统进行检测。
1.2.4 病毒空斑检测收集感染细胞的培养上清液,1 000 r/min离心5 min,取上清液,经梯度稀释后,加入前一日接种至24孔板中的Vero E6细胞,37 ℃感染1 h,然后吸弃病毒液,用磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤细胞2次,每孔加入含1.3%羟甲基纤维素钠的覆盖液,继续培养6~7 d。吸弃覆盖液,甲醇固定20 min,加入1%结晶紫染色液,染色20 min后,置于轻柔流水下冲洗,计数病毒空斑,并计算病毒滴度,用每毫升空斑形成单位(plaque forming unit,PFU),即PFU/mL表示。
1.2.5 激光共聚焦显微镜检测Huh7细胞经mTagRFP-mWasabi-LC3慢病毒感染48 h,再感染ZIKV 24 h。吸弃细胞培养液,经4%多聚甲醛固定后用DAPI对细胞核进行染色,用Zeiss LSM 800激光共聚焦显微镜观察细胞中LC3双荧光点状分布情况并拍照,统计含LC3点状荧光的细胞数量。
1.3 统计学处理以上实验均重复3次以上,数据以mean±SD的形式表示,用SPSS 19.0软件进行统计学分析,单因素方差分析检测各组数据差异,P < 0.05代表有显著性差异。
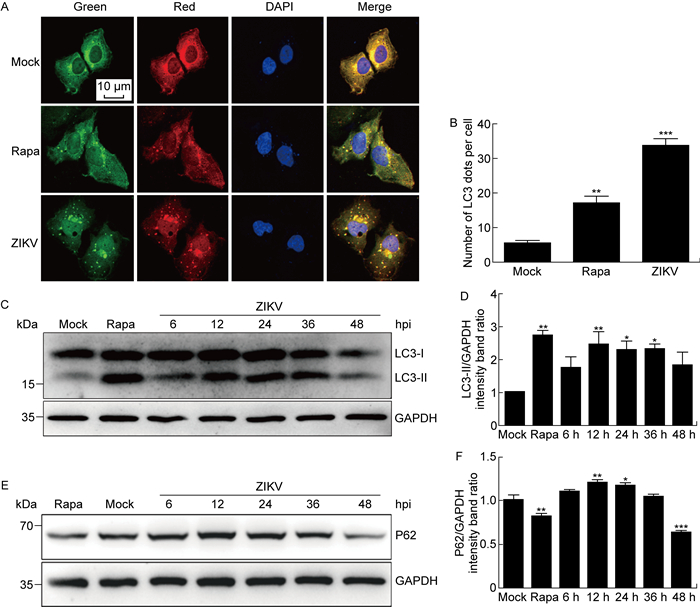
2 结果 2.1 ZIKV感染Huh7细胞能诱导自噬且自噬流通畅为了明确ZIKV感染Huh7细胞能否引起自噬,本研究采用自噬标记LC3双荧光报告系统进行检测。首先,用表达mTagRFP-mWasabi-LC3双荧光报告基因的慢病毒感染Huh7细胞48 h。然后,按MOI为1感染ZIKV 24 h,细胞固定后采用共聚焦显微镜观察。与未感染组细胞相比,ZIKV感染或自噬诱导剂雷帕霉素处理过的细胞中LC3点状荧光分布分别增加了约5.3倍和2.2倍(见图 1A、1B),表明ZIKV感染会促进LC3阳性自噬体的形成。分别于ZIKV感染后6、12、24、36、48 h收集细胞蛋白样品,蛋白免疫印迹检测结果显示,LC3-Ⅰ存在向LC3-Ⅱ转变的趋势。病毒感染后12 h,LC3-Ⅱ的表达较初始时升高了约1.4倍,且这种状态一直持续,病毒感染后36 h,LC3-Ⅱ的表达较初始时仍升高了约1.2倍(见图 1C、1D),这提示ZIKV感染Huh7细胞能诱导细胞自噬。对另一自噬标记P62蛋白进行检测,发现与未感染组细胞相比,P62蛋白在ZIKV感染后12 h和24 h表达水平均有所升高,而在病毒感染后48 h,蛋白表达水平降低约33%(见图 1E、1F),提示ZIKV感染引起的细胞自噬流通畅。
|
|
A: Huh7 cells, expressing mTagRFP-mWasabi-LC3, were treated with rapamycin (Rapa) or ZIKV (MOI=0.5) infection at 24 hpi and then observed by confocal microscopy. Scale bars indicates 10 μm. B: Number of LC3 dots per cell was counted from at least 10 cells for each datum. C: The conversion of LC3-Ⅰ to LC3-Ⅱ detected by Western blotting. D: Quantitative analysis of LC3-Ⅱ relative to GAPDH protein expression using software ImageJ. E: The time course of P62 expression in ZIKV-infected Huh7 cells using Western blotting. F: Quantitative analysis of P62 relative to GAPDH protein expression using software ImageJ. Significance was analyzed with one-way ANOVA. *P < 0.05, **P < 0.01, ***P < 0.001 compared with mock. 图 1 ZIKV感染Huh7细胞诱导细胞自噬 Fig. 1 Autophagy induced by ZIKV infection in Huh7 cells |
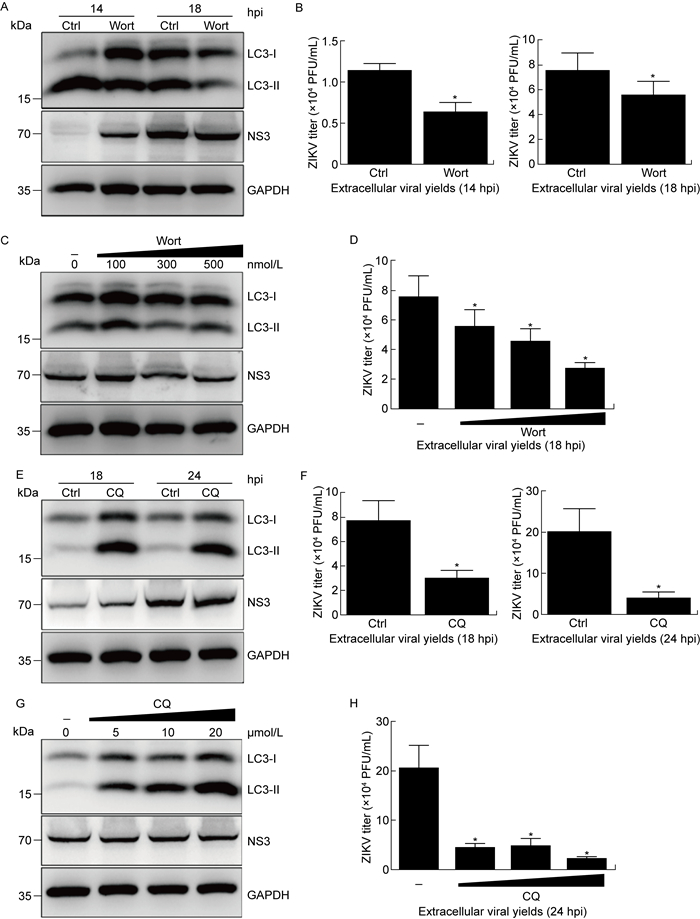
为进一步探究细胞自噬对ZIKV感染的影响,采用自噬抑制剂(包括渥曼青霉素和氯喹)预处理细胞。渥曼青霉素通过调节PI3K信号通路抑制自噬初始阶段,而氯喹主要抑制自噬终末阶段[9]。结果显示,与对照组细胞相比,渥曼青霉素预处理会阻滞细胞的LC3-Ⅰ向LC3-Ⅱ转变,这虽对病毒蛋白NS3的表达影响不大,但显著降低了细胞培养上清液中的子代病毒含量,感染后14 h和18 h的病毒滴度分别下降了约44%和27%,如图 2A~2D所示。氯喹处理显著增加了细胞内LC3-Ⅱ的累积,病毒蛋白NS3的表达未受影响,但胞外子代病毒的产生显著减少,感染后18 h和24 h的病毒滴度分别下降了61%和81%,且不同浓度的抑制剂均能显著降低病毒滴度,如图 2E~2H所示。上述结果表明,在ZIKV感染Huh7细胞的过程中,抑制细胞自噬能显著抑制子代病毒的产生。
|
| Huh7 cells pretreated with DMSO, wortmannin (Wort) or chloroquine (CQ) for 2 h were then infected with ZIKV (MOI=0.5). Cells or culture supernatants were harvested at the indicated time points for Western blotting (A, C, E, G) or plaque assay (B, D, F, H). Significance is analyzed with two-tailed Student's t test or one-way ANOVA. *P < 0.05. 图 2 自噬抑制剂对ZIKV感染和子代病毒滴度的影响 Fig. 2 Effects of autophagic inhibitors on ZIKV infection and progeny viruses |
自噬相关蛋白Beclin-1主要在自噬起始阶段发挥作用,能促进自噬前体的形成,并引导负荷蛋白锚定于自噬前体双层膜上[14]。将表达Beclin-1 shRNA的慢病毒感染Huh7细胞,以干扰细胞中Beclin-1蛋白的表达,然后检测其对ZIKV感染的影响。结果显示,与对照组细胞相比,干扰Beclin-1蛋白后,病毒蛋白NS3的表达减少了40%,释放到胞外的子代病毒含量降低约57%(见图 3)。以上结果表明,在ZIKV感染Huh7细胞的过程中,病毒复制需要自噬的激活,抑制Beclin-1的表达也阻碍了病毒复制,这与上述自噬抑制剂的实验结果相一致。

|
|
Huh 7 cells transduced with empty pLenti-vector (Ctrl) or pLenti-Beclin-1 shRNA were then infected with ZIKV (MOI=0.5). At 24 hpi, cells or culture supernatants were harvested for Western blotting (A) or plaque assay (C), respectively. B: Quantitative analysis of ZIKV NS3 protein expression. Significance is analyzed with two-tailed Student's t test. *P < 0.05 compared with the control group. 图 3 敲减Beclin-1蛋白表达对ZIKV感染的影响 Fig. 3 Effects of Beclin-1 knock-down on ZIKV infection |
既然抑制自噬能减少ZIKV复制,本研究进一步检测了自噬诱导剂雷帕霉素对ZIKV感染的影响。结果显示,雷帕霉素预处理增加了LC3-Ⅰ向LC3-Ⅱ的转变,细胞培养上清液中子代病毒的含量明显增多。病毒感染后24 h,病毒滴度增加了约1.5倍,且随着雷帕霉素浓度的增加,病毒滴度随之增加(见图 4),提示诱导自噬能促进子代病毒的产生,有利于ZIKV复制。

|
|
Huh7 cells pretreated with DMSO (Ctrl) or Rapa for 2 h were then infected with ZIKV (MOI=0.5). Cells or culture supernatants were harvested at the indicated time points for Western blotting (A, C) or plaque assay (B, D). Significance is analyzed with two-tailed Student's t test or one-way ANOVA. *P < 0.05. 图 4 自噬诱导剂雷帕霉素对ZIKV感染和子代病毒滴度的影响 Fig. 4 Effects of autophagic inducers on ZIKV infection and progeny viruses |
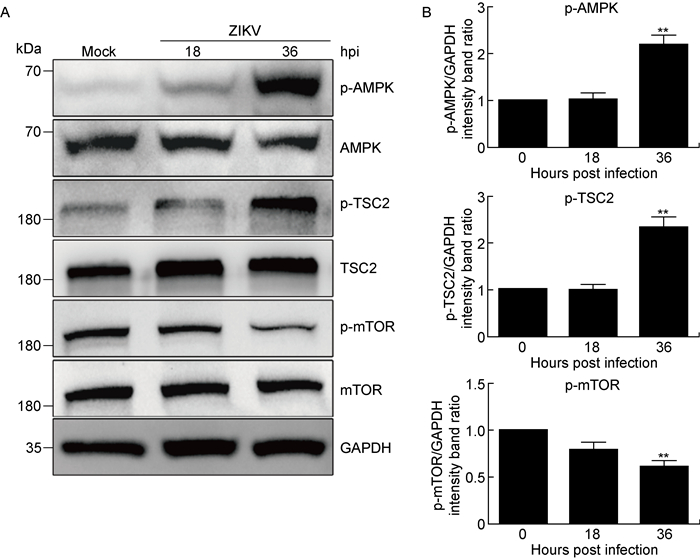
由于自噬诱导剂雷帕霉素的直接作用靶点为mTOR分子,本研究进一步检测了mTOR及其上游信号分子AMPK和TSC2的活化情况。采用MOI为1的ZIKV感染Huh7细胞,分别在感染后18 h和36 h收集细胞蛋白样品。蛋白免疫印迹检测结果显示,与对照组细胞相比,ZIKV感染后18 h和36 h,磷酸化mTOR的表达明显下调,36 h时下降了约40%,而其上游信号分子AMPK和TSC2的磷酸化水平显著上调,36 h时分别增加了约1.2和1.3倍(见图 5),表明ZIKV感染通过激活细胞中的AMPK/TSC2/mTOR信号通路而诱导自噬。
|
|
A: Huh7 cells were infected with ZIKV (MOI=0.5) and harvested at the indicated time points for Western blotting. B: Quantitative analysis of p-AMPK, p-TSC2 and p-mTOR protein expressions. Significance was analyzed with one-way ANOVA. **P < 0.01 compared with 0 hpi. 图 5 ZIKV感染对AMPK/TSC2/mTORC1信号通路的影响 Fig. 5 Effects of ZIKV infection on AMPK/TSC2/mTORC1 signaling pathway |
自噬常被看作细胞在感染病毒后的固有防御反应,但其能被登革病毒、丙型肝炎病毒等黄病毒加以利用,进而躲避宿主细胞的防御监视与清除,并协助病毒实现有效复制[11]。本研究发现,ZIKV感染Huh7细胞后能诱导自噬,并利用自噬促进自身复制和子代病毒的产生。
自噬是一个自噬体形成、融合、降解的动态过程。本研究利用mTagRFP-mWasabi-LC3双荧光报告系统,在共聚焦显微镜下观察发现ZIKV感染能促进LC3阳性自噬体的形成;进一步检测发现,病毒感染后自噬早期标记蛋白LC3的膜型形式(即LC3-Ⅱ)表达水平升高,表明自噬体形成并逐渐累积,自噬启动;而自噬终末期标记蛋白P62表达水平下降,提示其通过自噬溶酶体途径降解,自噬体向自噬溶酶体转变。结果显示,ZIKV感染Huh7细胞不仅能诱导自噬,而且自噬流通畅。
自噬发生的过程中,胞内会出现大量的囊泡状双层膜结构,这些自噬体的形成可能为病毒复制提供了合适的场所;同时,自噬途径降解产物也为病毒复制提供了重要的原材料[24]。Beclin-1作为Vps34复合物的核心部分,在细胞自噬的膜转运和重构过程中起着重要作用[14]。本研究利用2种不同的自噬抑制剂(渥曼青霉素、氯喹)和Beclin-1 shRNA分别阻断自噬的不同阶段,发现它们均能抑制ZIKV感染。渥曼青霉素主要通过调节PI3K信号通路作用于自噬的早期阶段;氯喹通过抑制溶酶体功能从而抑制LC3-Ⅱ降解,导致后者在胞内累积;敲减Beclin-1蛋白表达能干扰自噬早期的启动环节。与对照组相比,自噬抑制剂预处理或干扰Beclin-1表达均能显著降低子代病毒的产生,与本课题组之前在人脐静脉内皮细胞中研究ZIKV感染得到的结果一致[17],提示ZIKV感染所诱导的自噬可能具有较为广泛的促病毒效应。最新研究也发现,严重急性呼吸综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染hACE2转基因小鼠亦能诱导自噬,而自噬抑制剂能抑制SARS-CoV-2的复制并改善病毒相关肺损伤[25],表明基于自噬相关分子研制高效抗病毒药物完全可行,且具有较大的临床应用前景。
细胞自噬的诱导受多种因素的调控,如Ⅰ型和Ⅲ型PI3K信号通路可分别负调控和正调控自噬的发生。研究发现,SARS-CoV-2和丙型肝炎病毒感染可利用自噬体形成过程,抑制Ⅰ型PI3K活性,从而促进病毒自身的复制[26]。虽然Ⅲ型PI3K与Beclin-1形成的复合物可激活细胞自噬,这在自噬体形成的起始阶段起着重要作用,但也有研究报道称,Beclin-1基因敲除小鼠感染ZIKV会导致大脑发育不良和病毒感染加剧[27],提示Beclin-1在小鼠体内的功能并不仅仅局限于自噬激活,可能涉及更为复杂的生物学过程,须进一步研究。ZIKV感染胚胎神经干细胞时,其NS4A和NS4B蛋白会抑制AKT/mTOR信号通路诱导自噬,导致神经系统发育不良[11]。本研究发现,ZIKV感染Huh7细胞是通过激活AMPK/TSC2/mTOR信号通路诱导自噬。这一结果也被mTOR抑制剂——雷帕霉素所证实,它能促进ZIKV子代病毒的产生,达到促病毒感染的效果。此外,最新研究揭示,SARS-CoV-2亦可通过抑制Ⅰ型干扰素反应增强细胞自噬[28-29],表明不同的病毒可通过激活不同的信号通路来调节自噬的诱导过程,这可能与特异性病毒蛋白有关,或与宿主蛋白调节以及病毒与宿主细胞的相互作用模式有关。因此,ZIKV诱导自噬的分子机制仍须进一步阐明。
综上所述,ZIKV感染Huh7细胞能诱导自噬,并利用自噬促进子代病毒的产生。本研究为后续以自噬相关分子作为抗ZIKV感染药物的研制靶点提供了理论基础,也为进一步研究ZIKV入侵、RNA复制、病毒组装与释放等生命周期过程提供了研究平台和细胞模型。
| [1] |
Bhardwaj U, Pandey N, Rastogi M, Singh SK. Gist of Zika virus pathogenesis[J]. Virology, 2021, 560: 86-95.
[DOI]
|
| [2] |
Mwaliko C, Nyaruaba R, Zhao L, Atoni E, Karungu S, Mwau M, Lavillette D, Xia H, Yuan ZM. Zika virus pathogenesis and current therapeutic advances[J]. Pathog Glob Health, 2021, 115(1): 21-39.
[DOI]
|
| [3] |
Broutet N, Krauer F, Riesen M, Khalakdina A, Almiron M, Aldighieri S, Espinal M, Low N, Dye C. Zika Virus as a cause of neurologic disorders[J]. N Engl J Med, 2016, 374(16): 1506-1509.
[DOI]
|
| [4] |
White MK, Wollebo HS, David Beckham J, Tyler KL, Khalili K. Zika virus: an emergent neuropathological agent[J]. Ann Neurol, 2016, 80(4): 479-489.
[DOI]
|
| [5] |
Kuno G, Chang GJ. Full-length sequencing and genomic characterization of Bagaza, Kedougou, and Zika viruses[J]. Arch Virol, 2007, 152(4): 687-696.
[DOI]
|
| [6] |
Mizushima N, Komatsu M. Autophagy: renovation of cells and tissues[J]. Cell, 2011, 147(4): 728-741.
[DOI]
|
| [7] |
Cao W, Li J, Yang K, Cao D. An overview of autophagy: mechanism, regulation and research progress[J]. Bull Cancer, 2021, 108(3): 304-322.
[DOI]
|
| [8] |
Kabeya Y, Mizushima N, Ueno T, Yamamoto A, Kirisako T, Noda T, Kominami E, Ohsumi Y, Yoshimori T. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing[J]. EMBO J, 2000, 19(21): 5720-5728.
[DOI]
|
| [9] |
Zhang XW, Lv XX, Zhou JC, Jin CC, Qiao LY, Hu ZW. Autophagic flux detection: significance and methods involved[J]. Adv Exp Med Biol, 2021, 1208: 131-173.
[DOI]
|
| [10] |
Tallóczy Z, Virgin HW 4th, Levine B. PKR-dependent autophagic degradation of herpes simplex virus type 1[J]. Autophagy, 2006, 2(1): 24-29.
[DOI]
|
| [11] |
McLean JE, Wudzinska A, Datan E, Quaglino D, Zakeri Z. Flavivirus NS4A-induced autophagy protects cells against death and enhances virus replication[J]. J Biol Chem, 2011, 286(25): 22147-22159.
[DOI]
|
| [12] |
Echavarria-Consuegra L, Smit JM, Reggiori F. Role of autophagy during the replication and pathogenesis of common mosquito-borne flavi-and alphaviruses[J]. Open Biol, 2019, 9(3): 190009.
[DOI]
|
| [13] |
Codogno P, Meijer AJ. Autophagy and signaling: their role in cell survival and cell death[J]. Cell Death Differ, 2005, 12(Suppl 2): 1509-1518.
[DOI]
|
| [14] |
Zachari M, Ganley IG. The mammalian ULK1 complex and autophagy initiation[J]. Essays Biochem, 2017, 61(6): 585-596.
[DOI]
|
| [15] |
Martina JA, Chen Y, Gucek M, Puertollano R. MTORC1 functions as a transcriptional regulator of autophagy by preventing nuclear transport of TFEB[J]. Autophagy, 2012, 8(6): 903-914.
[DOI]
|
| [16] |
Liang Q, Luo Z, Zeng J, Chen W, Foo SS, Lee SA, Ge J, Wang S, Goldman SA, Zlokovic BV, Zhao Z, Jung JU. Zika virus NS4A and NS4B proteins deregulate Akt-mTOR signaling in human fetal neural stem cells to inhibit neurogenesis and induce autophagy[J]. Cell Stem Cell, 2016, 19(5): 663-671.
[DOI]
|
| [17] |
Peng H, Liu B, Yves TD, He Y, Wang S, Tang H, Ren H, Zhao P, Qi Z, Qin Z. Zika virus induces autophagy in human umbilical vein endothelial cells[J]. Viruses, 2018, 10(5): 259.
[DOI]
|
| [18] |
Cao B, Parnell LA, Diamond MS, Mysorekar IU. Inhibition of autophagy limits vertical transmission of Zika virus in pregnant mice[J]. J Exp Med, 2017, 214(8): 2303-2313.
[DOI]
|
| [19] |
Hamel R, Dejarnac O, Wichit S, Ekchariyawat P, Neyret A, Luplertlop N, Perera-Lecoin M, Surasombatpattana P, Talignani L, Thomas F, Cao-Lormeau VM, Choumet V, Briant L, Desprès P, Amara A, Yssel H, Missé D. Biology of Zika virus infection in human skin cells[J]. J Virol, 2015, 89(17): 8880-8896.
[DOI]
|
| [20] |
Kim JH, Koh B, Ahn DG, Lee SJ, Park TJ, Park JP. A screening study of high affinity peptide as molecular binder for AXL, tyrosine kinase receptor involving in Zika virus entry[J]. Bioelectrochemistry, 2021, 137: 107670.
[DOI]
|
| [21] |
Chuang FK, Liao CL, Hu MK, Chiu YL, Lee AR, Huang SM, Chiu YL, Tsai PL, Su BC, Chang TH, Lin CC, Shih CC, Yen LC. Antiviral activity of compound L3 against Dengue and Zika viruses in vitro and in vivo[J]. Int J Mol Sci, 2020, 21(11): 4050.
[DOI]
|
| [22] |
Rothan HA, Abdulrahman AY, Khazali AS, Nor Rashid N, Chong TT, Yusof R. Carnosine exhibits significant antiviral activity against Dengue and Zika virus[J]. J Pept Sci, 2019, 25(8): e3196.
[DOI]
|
| [23] |
Tan CW, Huan Hor CH, Kwek SS, Tee HK, Sam IC, Goh ELK, Ooi EE, Chan YF, Wang LF. Cell surface α2, 3-linked sialic acid facilitates Zika virus internalization[J]. Emerg Microbes Infect, 2019, 8(1): 426-437.
[DOI]
|
| [24] |
Lin PW, Chu ML, Liu HS. Autophagy and metabolism[J]. Kaohsiung J Med Sci, 2021, 37(1): 12-19.
[DOI]
|
| [25] |
Shang C, Zhuang X, Zhang H, Li Y, Zhu Y, Lu J, Ge C, Cong J, Li T, Li N, Tian M, Jin N, Li X. Inhibition of autophagy suppresses SARS-CoV-2 replication and ameliorates pneumonia in hACE2 transgenic mice and xenografted human lung tissues[J]. J Virol, 2021, 95(24): e0153721.
[DOI]
|
| [26] |
Twu WI, Lee JY, Kim H, Prasad V, Cerikan B, Haselmann U, Tabata K, Bartenschlager R. Contribution of autophagy machinery factors to HCV and SARS-CoV-2 replication organelle formation[J]. Cell Rep, 2021, 37(8): 110049.
[DOI]
|
| [27] |
Karuppan MKM, Ojha CR, Rodriguez M, Lapierre J, Aman MJ, Kashanchi F, Toborek M, Nair M, El-Hage N. Reduced-Beclin1-expressing mice infected with Zika-R103451 and viral-associated pathology during pregnancy[J]. Viruses, 2020, 12(6): 608.
[DOI]
|
| [28] |
Hui X, Zhang L, Cao L, Huang K, Zhao Y, Zhang Y, Chen X, Lin X, Chen M, Jin M. SARS-CoV-2 promote autophagy to suppress type I interferon response[J]. Signal Transduct Target Ther, 2021, 6(1): 180.
[DOI]
|
| [29] |
Yang L, Xie X, Tu Z, Fu J, Xu D, Zhou Y. The signal pathways and treatment of cytokine storm in COVID-19[J]. Signal Transduct Target Ther, 2021, 6(1): 255.
[DOI]
|
 2022, Vol. 17
2022, Vol. 17


