2. 上海生物制品研究所有限责任公司,上海 201400
2. Shanghai Institute of Biological Products Co., Ltd., Shanghai 201400, China
麻疹是由麻疹病毒(measles virus,MV)引起的一种急性呼吸道传染性疾病,通过呼吸道分泌物传播,好发于儿童,多见于冬春季,人群普遍易感。2019年,全球麻疹病例激增至869 770例,创23年来最高纪录;死亡人数超过207 500例,较2016年上升了50%[1]。预防麻疹的最有效手段是接种麻疹减毒活疫苗,而麻疹减毒活疫苗生产用细胞基质为原代鸡胚细胞。2020年版《中华人民共和国药典》(三部)规定,原代细胞经原始培养或传代少数几代内(一般不超过5代)的细胞可用于病毒性疫苗的生产[2]。原代鸡胚细胞在原代培养及早期传代培养过程中成纤维细胞和上皮细胞同时出现,利用成纤维细胞和上皮细胞对胰蛋白酶的耐受性差异,将原代鸡胚细胞进行传代培养,可达到纯化成纤维细胞的目的,提高疫苗用细胞基质的均一性[3]。另外,将原代鸡胚细胞进行传代可增加细胞外源因子的检测次数,提高外源病毒的检出率[4],有利于实现对疫苗安全性的控制。
本研究将原代鸡胚细胞进行连续传代培养,采用不同代次鸡胚细胞培养麻疹病毒沪191(Shanghai-191,S-191)株,并对病毒收获物进行滴度检测和基因序列测定,为传代培养的鸡胚细胞用于病毒性疫苗生产提供数据支持。
1 材料和方法 1.1 材料 1.1.1 细胞MRC-5细胞(人胚肺成纤维细胞)购自美国模式培养物集存库(American Type Culture Collection,ATCC),A549细胞(人非小细胞肺癌细胞)由上海生物制品研究所有限责任公司保存。
1.1.2 毒种麻疹病毒S-191株由上海生物制品研究所有限责任公司第三研究室保存。
1.1.3 实验动物无特定病原体(specific pathogen free,SPF)级鸡胚蛋购自北京梅里亚维通实验动物技术有限公司,许可证号:SCXK(京)2014-002;4~6周龄BALB/c雌性裸鼠购自上海西普尔-必凯实验动物有限公司,许可证号:SCXK(沪)2014-0016。
1.1.4 主要试剂及仪器M199培养液、青-链霉素、台盼蓝和0.25%胰蛋白酶均购自Gibco公司(美国);新生牛血清购自上海慧人生物科技工程研究所;欧氏液由上海生物制品研究所有限责任公司提供;0.1%苯扎溴铵购自上海运佳黄浦制药有限公司;RNA抽提试剂盒MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0及反转录试剂盒PrimeScriptTM Ⅱ 1 st Strand cDNA Synthesis Kit购自TaKaRa公司(日本)。Countstar自动细胞计数仪购自上海睿钰生物科技有限公司;聚合酶链反应(polymerase chain reaction,PCR)仪购自Eppendorf公司(德国)。
1.2 方法 1.2.1 原代培养取9~11日龄SPF级鸡胚蛋,用0.1%苯扎溴铵消毒后,取出鸡胚,断颈去头,刮除内脏,收获躯干部,用胰蛋白酶消化,制备成细胞悬液,接种至细胞培养瓶,37 ℃、5%体积分数CO2条件下培养。
1.2.2 传代培养待原代鸡胚细胞长至致密单层,用胰蛋白酶消化分散,进行传代培养。将原代细胞代次记为P0,传代1次后记为P1,依此类推。P0传代比率为1∶4,P1~P9传代比率为1∶2。用自动细胞计数仪测定3批次传代培养细胞的收获数量,计算群体倍增水平(population doubling level,PDL)。
1.2.3 细胞增殖动力学分别将P3、P5和P10共3个代次的鸡胚细胞密度调整至(2.0±0.5)×105个/mL,接种于24孔细胞培养板,每隔24 h取样并计数,绘制细胞生长曲线。
1.2.4 细胞冻存及复苏后传代P1代次鸡胚细胞长至致密单层后,收获P1代次细胞并冻存,采用台盼蓝拒染法测定细胞冻存前及复苏后的活率,并将复苏后的细胞按照1∶2的传代比率进行连续传代培养,用自动细胞计数仪测定各代次细胞的收获数量,计算PDL。
1.2.5 细胞染色体检查参照2020年版《中华人民共和国药典》(三部)中关于染色体检查的要求,采用G显带技术,对P5代次鸡胚细胞进行染色体检查和核型分析。
1.2.6 细胞成瘤性检查参照2020年版《中华人民共和国药典》(三部)中关于成瘤性检查的要求,用4~6周龄BALB/c雌性裸鼠对P8代次鸡胚细胞进行成瘤性检查。同时设立A549细胞作为阳性对照,MRC-5细胞作为阴性对照。
1.2.7 病毒培养将麻疹病毒S-191株毒种按照感染复数(multiplicity of infection,MOI)为0.02~0.2分别接种至P0、P3和P5代次鸡胚细胞进行培养,每隔24 h收获病毒。采用半数细胞培养感染量(50% cell culture infective dose,CCID50)法检测3批次病毒收获液的滴度,绘制病毒增殖曲线,比较不同代次鸡胚细胞的产毒水平。
1.2.8 病毒基因序列测定根据美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)建立的DNA序列数据库GenBank中录入的麻疹病毒S-191株(登录号:FJ416067.1)的基因序列,分别针对编码病毒核蛋白(nucleoprotein,N)的基因序列(位于108~1 685,共1 578 bp)和血凝素蛋白(hemagglutinin,H)的基因序列(位于7 271~9 124,共1 854 bp)设计引物,引物序列如表 1所示。对P0、P3和P5代次鸡胚细胞培养的麻疹病毒的N基因和H基因进行PCR扩增,扩增产物送至BioSune公司进行Sanger法测序。
| Name | Sequence (5′-3′) |
| the forward primer for N1 | GGGACAAGAGCAGGATTAGGG |
| the reverse primer for N1 | CCAGCAAATTCATGCAGTCCA |
| the forward primer for N2 | GCCGATTCATGGTCGCTCTA |
| the reverse primer for N2 | AGTGGATGGTTGATGGGCTG |
| the forward primer for H1 | AGCATCAAGCCCACCTGAAA |
| the reverse primer for H1 | GACAAAGGGCTGCGAGTTTG |
| the forward primer for H2 | CAGAAATCCGGGTTTGGGGG |
| the reverse primer for H2 | GGAACCACTTGGACCCTACG |
| The N gene contains N1 and N2 fragments, and the H gene contains H1 and H2 fragments. | |
应用SPSS 22. 0软件进行统计学分析,采用配对t检验进行病毒滴度比较,P<0.05为差异有统计学意义。
2 结果 2.1 细胞形态将P0代次鸡胚细胞连续传代培养至P10代次,在显微镜下观察各代次的细胞形态。P0代次多数为成纤维状细胞,混杂有少量上皮细胞及少部分因消化不完全形成的细胞团块(见图 1A)。经过传代筛选,细胞均一性趋于良好,形态饱满、修长,呈纺锤状整齐排列(见图 1B、1C)。
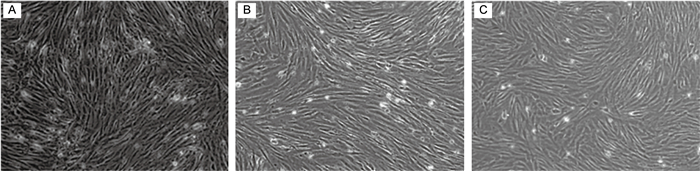
|
| A: P0 chicken embryo cells. B: P5 chicken embryo cells. C: P10 chicken embryo cells. 图 1 不同代次鸡胚细胞形态 Fig. 1 Cell morphology of chick embryo cells at different passages |
将P3、P5和P10代次鸡胚细胞接种至24孔细胞培养板培养,每隔24 h计数,绘制生长曲线。3个代次的鸡胚细胞生长趋势相似,整体呈“S”形,第4天达到平台期,平台期的细胞数为(5.0~6.0)×105个/mL(见图 2)。
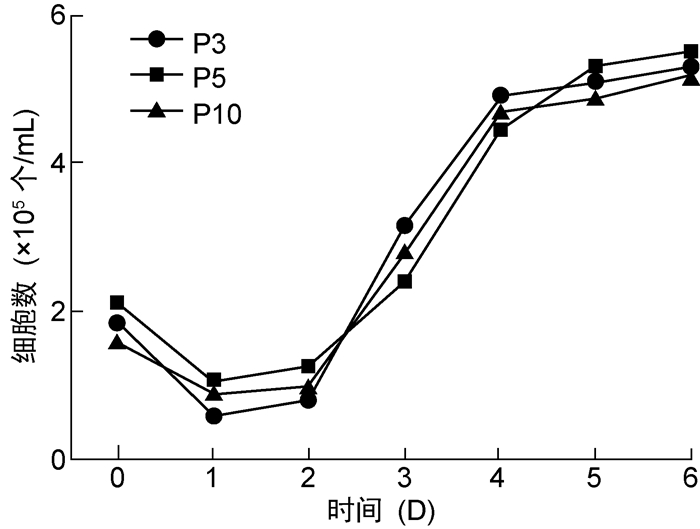
|
| 图 2 不同代次鸡胚细胞生长曲线 Fig. 2 Growth curves of chick embryo cells at different passages |
将P1代次鸡胚细胞连续传代培养至P10代次,3 d左右可长至致密单层,各代次平均细胞收获数量为(4.85±0.31)×105个/mL,平均PDL为0.98±0.05(见图 3)。
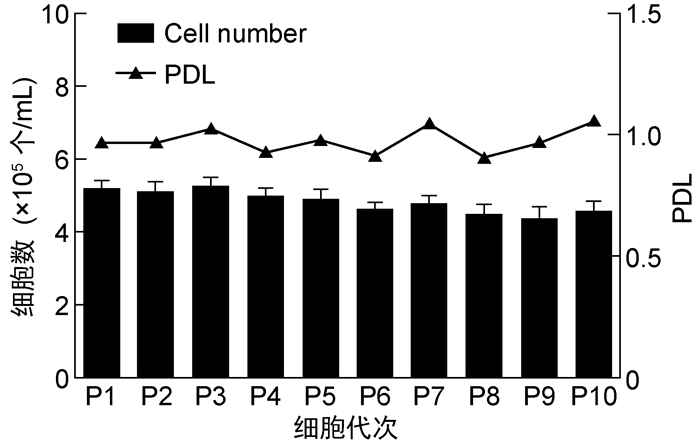
|
| 图 3 不同代次鸡胚细胞的收获数量和PDL Fig. 3 Harvesting density and PDL of chick embryo cells at different passages |
将P1代次鸡胚细胞冻存,复苏后进行连续传代培养。台盼蓝拒染法测定细胞冻存前活率为93.76%~97.09%,复苏后活率为91.56%~95.97%。复苏后传代培养的各代次平均细胞收获数量为(4.76±0.30)×105个/mL,平均PDL为0.96±0.07(见图 4)。

|
| 图 4 冻存复苏后传代培养的鸡胚细胞的收获数量和PDL Fig. 4 Harvesting density and PDL of subcultured chicken embryo cells after cryopreservation and resuscitation |
采用G显带技术对P5代次鸡胚细胞进行染色体检查,结果为正常染色体核型,染色体数目78条,包括9对大染色体和30对微小染色体,大染色体中未发现染色体缺失及多倍体等异常染色体(见图 5)。

|
| 图 5 P5代次鸡胚细胞染色体核型 Fig. 5 Chromosome karyotype of P5 chicken embryo cells |
对P8代次鸡胚细胞进行成瘤性检查,结果显示实验组(P8代次鸡胚细胞)注射部位组织病理切片正常,无肿瘤样细胞。阳性对照组(A549细胞)于第7天注射部位全部出现结节,组织病理学检查为肿瘤细胞。阴性对照组(MRC-5细胞)注射部位未见结节形成,组织病理学检查无肿瘤样细胞(见图 6)。

|
| A: A549 cells. B: MRC-5 cells. C: Chicken embryo cells. 图 6 裸鼠注射部位组织病理切片 Fig. 6 Histopathological slice at injection site in nude mice |
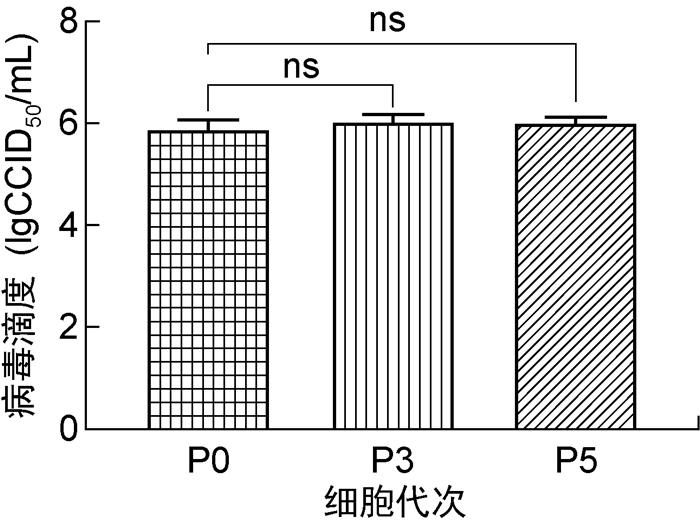
将麻疹病毒S-191株毒种分别接种P0、P3和P5代次鸡胚细胞,测定病毒收获液滴度,结果显示病毒在3个代次鸡胚细胞中的增殖趋势相似(见图 7)。P0代次鸡胚细胞病毒收获液滴度为(5.87±0.21)lgCCID50/mL;P3代次鸡胚细胞病毒收获液滴度为(6.03±0.15)lgCCID50/mL,高于P0代次鸡胚细胞,但无显著性差异(P>0.05);P5代次鸡胚细胞病毒收获液滴度为(6.00±0.10)lgCCID50/mL,高于P0代次鸡胚细胞,但无显著性差异(P>0.05)(见图 8)。
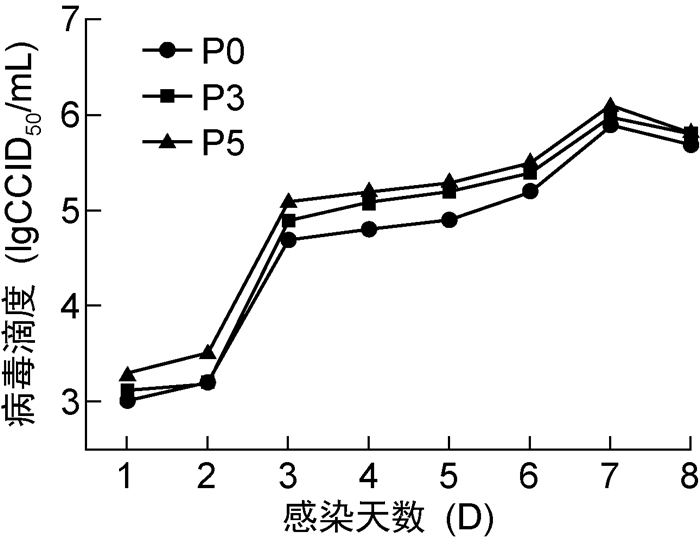
|
| 图 7 麻疹病毒在不同代次鸡胚细胞中的增殖曲线 Fig. 7 Proliferation curve of measles virus in chicken embryo cells at different passages |
|
| 图 8 麻疹病毒在不同代次鸡胚细胞中的产毒水平 Fig. 8 Proliferation levels of measles virus in chick embryo cells at different passages |
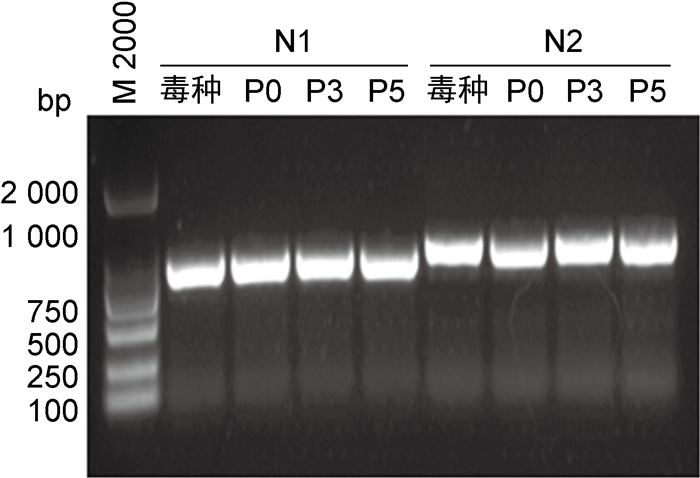
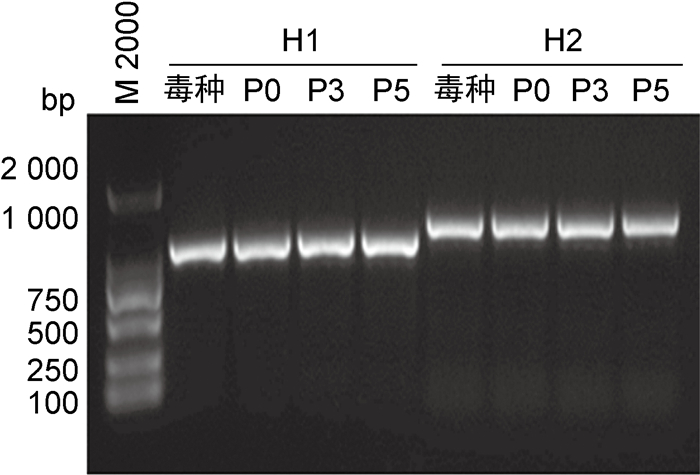
对P0、P3和P5代次鸡胚细胞培养的麻疹病毒分别进行N和H基因序列测定,将PCR产物进行琼脂糖凝胶电泳,结果显示条带N1(900 bp)、N2(1 000 bp)、H1(1 000 bp)、H2(1 200 bp)与理论值N1(902 bp)、N2(995 bp)、H1(992 bp)、H2(1 179 bp)大小相符(见图 9、10)。基因测序结果显示,3个代次鸡胚细胞培养的麻疹病毒N、H基因序列与S-191株毒种完全一致,未发生变异。
|
| 图 9 麻疹病毒N基因PCR产物电泳图 Fig. 9 Electrophoresis of PCR products of N gene of measles virus |
|
| 图 10 麻疹病毒H基因PCR产物电泳图 Fig. 10 Electrophoresis of PCR products of H gene of measles virus |
原代鸡胚细胞可用于多种病毒性疫苗的生产,如麻疹疫苗、腮腺炎疫苗、狂犬病疫苗、黄热病疫苗、新城疫疫苗、流感疫苗等[5-8]。原代鸡胚细胞获取容易,对病毒具有广泛的敏感性,但其也存在固有缺点,如对供体动物需求量大,成本高,制备耗时费力,易污染外源病毒等。原代鸡胚细胞传代5代内可用于病毒性疫苗的生产[2]。
本研究在鸡胚细胞原代培养的基础上,建立了鸡胚细胞的传代培养方法,可将鸡胚细胞稳定传至第10代,细胞均一性趋于良好,各代次细胞生长趋势相似。将第1代鸡胚细胞冻存复苏后进行连续传代培养,可稳定传至第5代,初步为鸡胚细胞建库奠定了基础。染色体检查结果显示,第5代鸡胚细胞为正常染色体核型,染色体数目以及9对大染色体结构保持不变,为传代鸡胚细胞用于疫苗生产提供了遗传稳定性数据。但30对微小染色体过于微小,无法进行染色体结构分析。对传代培养的第8代鸡胚细胞进行成瘤性检查,未见成瘤,表明传代鸡胚细胞安全性良好。将麻疹病毒接种原代、第3代和第5代鸡胚细胞,传代培养的鸡胚细胞与原代鸡胚细胞的产毒水平无显著性差异,收获的病毒经N、H基因测序,发现基因序列未发生改变,为传代培养鸡胚细胞替代原代鸡胚或原代鸡胚细胞生产其他病毒性疫苗提供了数据支撑。
与原代鸡胚细胞生产病毒性疫苗相比,传代培养的鸡胚细胞具有明显的优势。①节约原代鸡胚的使用量,显著提高了鸡胚的利用率,降低生产成本和医疗废弃物处理成本。如果使用传至5代的鸡胚细胞,细胞数量至少可扩大30倍,可显著提高鸡胚的疫苗产量。②鸡胚细胞经过传代培养,细胞均一性增加,可避免因来自不同动物个体而造成的细胞质量和敏感性差异[9],从而提高了疫苗生产用细胞基质的均一性和稳定性。③采用传代培养的鸡胚细胞制备病毒性疫苗无须频繁从鸡胚中制备细胞,不仅可降低由细胞制备程序繁琐费时带来的污染风险,还可降低鸡胚本身可能带来的潜在外源因子污染风险,从而提高了疫苗用细胞基质的安全性。原代鸡胚细胞来源于SPF级鸡胚,其安全性与终产品的安全性密切相关。外源因子污染是影响细胞基质安全性的一个重要因素,用于制备鸡胚细胞的鸡群须经过广泛的外源性因子检测[10]。美国Charles River Laboratories International, Inc.(CRL)公司是全球SPF级鸡和鸡胚的最大供应商,其监测的病原微生物多达32种[11],我国国家标准《SPF鸡微生物学监测总则(GB /T 17999. 1-2008)》中规定必须对19种病原体进行监测[12]。本研究对购自北京梅里亚维通实验动物技术有限公司的SPF级鸡胚进行了21种细菌和病毒检测,包括禽流感病毒、马立克病毒、新城疫病毒等。将鸡胚细胞经过多次传代培养,可增加外源因子的检测次数,延长外源因子污染的观察期,提高外源因子的检出率,继而降低外源因子污染细胞的概率,保证疫苗的安全性。
疫苗的大规模生产需要大量检定合格、质量相同、持续稳定的鸡胚细胞,基于以上传代培养的鸡胚细胞生产病毒性疫苗的优势,传代鸡胚细胞比原代鸡胚细胞更易实现疫苗的规模化生产。因此,可考虑将原代鸡胚细胞传至5代内建立细胞库,按照2020年版《中华人民共和国药典》(三部)中对细胞检定项目的要求进行检定,检定合格后与细胞工厂、微载体、片状载体、固定床等大规模生产技术结合[13-14],用于病毒性疫苗生产。总之,利用检定合格的鸡胚细胞库和大规模培养技术生产疫苗,多批次的疫苗生产用细胞基质来源于同一细胞库,不仅可减少不同批次鸡胚的细胞质量差异,还可降低细胞外源因子污染的风险,同时可提高生产效率,为疫苗生产提供大量稳定、均一、安全的细胞基质,有利于提高疫苗产量与质量。
然而,采用传代鸡胚细胞进行病毒疫苗生产仍然面临较多挑战。①传代鸡胚细胞的安全性有待进一步验证,将鸡胚细胞进行传代培养后,其遗传物质是否会改变,宿主细胞残留蛋白(host cell protein,HCP)、宿主细胞残留DNA是否会因传代增加,尚不清楚。②鸡胚细胞在大规模培养的介质中能否稳定传代,培养介质的改变可能需要改变一系列培养条件才能满足鸡胚细胞的正常生长。如果细胞工厂通气能力有限,常规实验室中5% CO2的培养体系可能不再适用,须对培养条件进行优化,研究出无需CO2环境的鸡胚细胞培养方法。③采用传代鸡胚细胞生产其他病毒性疫苗,可能会对疫苗病毒的基因组和病毒的生物学特性产生影响。病毒能在鸡胚细胞中增殖是因为细胞上有病毒受体。Brandt等[15]研究发现,鸡传染性法氏囊病病毒(infectious bursal disease virus,IBDV)超强毒株无鸡胚成纤维细胞受体,在其传代致弱过程中,VP2基因的几处核苷酸改变导致其细胞嗜性改变,致弱后的毒株可在鸡胚成纤维细胞中增殖,但致弱毒株与鸡胚细胞如何作用及病毒的鸡胚细胞受体还未见相关报道。鸡胚细胞cDNA文库的成功构建,为筛选和研究鸡胚成纤维细胞上的病毒受体及其细胞嗜性提供了理论基础,也为研究其他适于鸡胚细胞生长的病毒与鸡胚细胞的相互作用奠定了基础[16-17]。
本研究建立了原代鸡胚细胞的传代培养方法,传代培养的第3、5代细胞扩增麻疹病毒的能力与原代细胞无显著差异,且未观察到病毒N、H基因序列的变异。然而,采用传代鸡胚细胞进行病毒扩增生产仍面临诸多挑战,本文结论对于采用传代培养鸡胚细胞替代原代鸡胚或原代鸡胚细胞进行病毒疫苗的扩增生产具有重要的参考价值。
| [1] |
World Health Organization. Worldwide measles deaths climb 50% from 2016 to 2019 claiming over 207 500 lives in 2019[EB/OL]. (2020-11-12)[2022-02-14]. https://www.who.int/news/item/12-11-2020-worldwide-measles-deaths-climb-50-from-2016-to-2019-claiming-over-207-500-lives-in-2019.
|
| [2] |
国家药典委员会. 中华人民共和国药典(三部)[S]. 北京: 中国医药科技出版社, 2020: 11-20.
|
| [3] |
朱国坡, 周晓丽, 郭延锋, 李瑞芳, 高均伟, 陈仕均, 王丽荣, 刘兴友. 鸡胚成纤维细胞原代培养及应用[J]. 动物医学进展, 2010, 31(3): 112-114. [DOI]
|
| [4] |
刘晓凡, 邢家强, 魏至栋, 窦强, 林杰, 徐小明. 应用不同代次兔肾细胞培养风疹病毒松叶株的研究[J]. 微生物学免疫学进展, 2013, 41(2): 7-10. [DOI]
|
| [5] |
杨文震, 张芹, 丁文正, 王亮, 赵毅, 许乐燕, 沈坚, 郁佳俊, 徐闻青. 麻疹、腮腺炎、风疹、水痘联合减毒活疫苗的生产工艺研究[J]. 国际生物制品学杂志, 2019, 42(1): 1-5. [DOI]
|
| [6] |
石磊泰, 李玉华. 原代细胞在人用狂犬病疫苗中的应用及研究进展[J]. 中国生物制品学杂志, 2021, 34(9): 1126-1131. [DOI]
|
| [7] |
Hansen CA, Barrett ADT. The present and future of yellow fever vaccines[J]. Pharmaceuticals (Basel), 2021, 14(9): 891.
[DOI]
|
| [8] |
Anam S, Rahman SU, Ali S, Saeed M, Goyal SM. Comparative growth kinetic study of Newcastle disease virus, infectious bursal disease virus and avian influenza virus in chicken embryo fibroblast and DF-1 cell lines[J]. Pol J Vet Sci, 2021, 24(2): 287-292.
[DOI]
|
| [9] |
林杰, 窦强, 邢家强, 张平, 魏至栋. 牛肾细胞的冻存及复苏后连续传代的研究[J]. 中国新药杂志, 2014, 23(9): 1049-1052. [CNKI]
|
| [10] |
Sheridan S, Coughlin J. Comparison of requirements in the European Union and United States of America for pre-clinical viral safety testing of veterinary vaccines[J]. Biologicals, 2010, 38(3): 340-345.
[DOI]
|
| [11] |
韩凌霞, 孟兴, 佟相慧, 陈洪岩. 实验动物SPF鸡质量控制标准介绍[J]. 中国比较医学杂志, 2019, 29(3): 72-78. [DOI]
|
| [12] |
林欢, 韩凌霞, 赵丽丽, 陈洪岩. SPF鸡微生物质量控制标准与监测技术[J]. 实验动物科学, 2017, 34(1): 66-70. [DOI]
|
| [13] |
付永其, 宋艳梅, 高静, 张颖欣, 刘辉, 孙雅, 申亚楠, 律苗, 杨云凯. 细胞工厂在麻腮风系列疫苗生产中的应用[J]. 中国生物制品学杂志, 2018, 31(10): 1049-1054. [CNKI]
|
| [14] |
张家友, 刘洋, 赵巍, 王英, 施金荣, 乐欣如, 韩锡鑫, 邱阿明, 黄晓媛, 杨晓明. 微载体与片状载体培养MDCK-G1细胞的比较[J]. 中国生物制品学杂志, 2020, 33(2): 175-178. [DOI]
|
| [15] |
Brandt M, Yao K, Liu M, Heckert RA, Vakharia VN. Molecular determinants of virulence, cell tropism, and pathogenic phenotype of infectious bursal disease virus[J]. J Virol, 2001, 75(24): 11974-11982.
|
| [16] |
祁小乐, 陈玉明, 张礼洲, 任宪刚, 高立, 高宏雷, 秦立廷, 王永强, 高玉龙, 王笑梅. 鸡胚成纤维细胞cDNA酵母表达文库的构建与鉴定[J]. 中国家禽, 2013, 35(8): 14-16. [DOI]
|
| [17] |
叶丽娜, 谢芝勋, 谢丽基, 王盛, 邓显文, 谢志勤, 范晴, 黄娇玲, 曾婷婷, 张艳芳, 罗思思. 鸡胚成纤维细胞cDNA文库构建及其与禽呼肠孤病毒σA相互作用宿主蛋白的筛选[J]. 南方农业学报, 2019, 50(6): 1362-1368. [DOI]
|
 2022, Vol. 17
2022, Vol. 17


