伤寒沙门菌(Salmonella typhi,S. typhi)是一种革兰氏阴性短杆菌,也是一种食源性致病菌。人们摄入被其污染的食物和水后可能会被感染,出现以高热、全身疼痛、皮肤玫瑰疹、菌血症、肠道穿孔等为主要症状的伤寒热,若未经及时治疗,则致死率较高[1]。人类是伤寒沙门菌的唯一宿主,感染病例遍布全球,尤以发展中国家最为严重,全球每年约有20万人因感染伤寒沙门菌而死亡[1]。
Ⅲ型分泌系统(type Ⅲ secretion system,T3SS)是伤寒沙门菌的重要毒力因子之一。T3SS1分泌的效应蛋白有助于伤寒沙门菌侵入肠道上皮细胞,随后被单核-巨噬细胞等吞噬性细胞摄取,在细胞内的囊泡中生存和繁殖,该囊泡被称为沙门菌液泡(Salmonella-containing vacuole,SCV)[2]。T3SS分泌的效应蛋白对SCV的影响体现在以下两方面:① T3SS是一种“针样注射装置”,其发挥作用时会对SCV膜产生不同程度的损伤,导致自噬蛋白LC3募集至破损的SCV,进而与自噬受体蛋白结合并泛素化,促进吞噬体与溶酶体结合,从而消灭伤寒沙门菌;②伤寒沙门菌能利用T3SS进行SCV自噬损伤的修复,促进其自身在细胞内的生存和复制[3-4]。
SopE属于鸟苷酸交换因子(guanine nucleotide exchange factor,GEF),通过T3SS1进入宿主肠上皮细胞,激活Rho GTPase,导致肌动蛋白F重塑,引起上皮细胞膜褶皱,从而促进细菌入侵[5-8]。有研究发现,SopE的存在增加了伤寒沙门菌胞质的释放,是早期SCV损伤的主要因素[9];SopE除了能促进伤寒沙门菌在感染早期于上皮细胞胞内释放而有利于侵袭外[10],还可定位于SCV膜表面,促进伤寒沙门菌在细胞内的生存及复制[11]。然而,这些研究均集中于SopE对早期SCV稳定性的影响,尚无研究报道其对晚期SCV稳定性的影响。因此,本研究探讨了伤寒沙门菌侵入巨噬细胞后SopE对其胞内生存能力和晚期SCV稳定性的影响,以及SopE能否通过影响自噬而调节晚期SCV的稳定性。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒伤寒沙门菌GIFU10007野生株(wild type,WT)和自杀质粒pGMB151由日本岐阜大学医学部微生物教研室馈赠;sopE突变株(ΔsopE)、突变株的回补株(ΔsopE/pBAD33-SopE,C- ΔsopE)以及表达绿色荧光蛋白(green fluorescent protein,GFP)的WT、ΔsopE和C- ΔsopE(WT/pBAD33∷pET28-sfGFP、ΔsopE/pBAD33∷pET28-sfGFP和C- ΔsopE/pET28-sfGFP)等菌株均由本实验室构建和保存。
1.1.2 主要试剂配制Luria-Bertani(LB)培养基所用的NaCl、蛋白胨、琼脂为美国Thermo公司生产;琼脂糖为法国Biowest公司产品;蔗糖为美国Sigma-Aldrich公司产品;BamHⅠ、XbaⅠ和Hind Ⅲ限制性核酸内切酶,T4 DNA连接酶,以及DL500、DL1000、DL2000 Marker为日本TaKaRa公司产品;氨苄青霉素、氯霉素、硫酸卡那霉素、质粒小量抽提试剂盒、RIPA裂解液试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)变性丙烯酰胺凝胶快速制备试剂盒、鼠抗β -actin、辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG和羊抗鼠IgG为生工生物工程(上海)股份有限公司产品;THP-1细胞购自中国科学院细胞库;反转录试剂、SYBR染料法荧光定量试剂、2×Taq连接酶购自南京诺唯赞生物科技股份有限公司;鼠抗LAMP 1和兔抗LC3B购自美国CST公司;兔抗Gal-8、羊抗兔IgG-Cy3、羊抗鼠IgG-TRITC购自武汉爱博泰克(ABclonal)生物科技有限公司;牛血清白蛋白(bovine serum albumin,BSA)购自美国Sigma公司。
1.1.3 主要仪器数显恒温水浴锅为上海博迅医疗生物仪器股份有限公司产品;普通聚合酶链反应(polymerase chain reaction,PCR)仪、大型台式恒温摇床、二氧化碳细胞培养箱为美国Thermo公司产品;台式高速冷冻离心机为湖南湘仪实验室仪器开发有限公司产品;实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)仪(CFX96)、电穿孔仪Gene PulserⅩ、水平电泳槽、垂直电泳槽和电转印槽为美国Bio-Rad公司产品;核酸紫外检测仪为德国Eppendorf公司产品;超微量分光光度计为美国NanoDrop公司产品;超敏化学发光凝胶成像系统、超高分辨活细胞成像系统为美国GE公司产品;全自动凝胶成像系统为上海勤翔科学仪器有限公司产品。
1.2 方法 1.2.1 sopE缺陷变异株(ΔsopE)的构建根据sopE序列,利用Oligo 7软件设计构建sopE突变株的引物对BF1/BR1和BF2/BR2(见表 1),其中BF1和BR2的5 ′端加入BamHⅠ酶切位点,具体如表 1中下划线所示。PCR扩增获得上游和下游同源片段F1、F2;以F1、F2为模板,用BF1、BR2进行PCR扩增,获得总同源片段F;用BamHⅠ限制性核酸内切酶切割片段F和自杀质粒pGMB151;用T4 DNA连接酶连接,连接产物转化至大肠埃希菌S17,对PCR鉴定的阳性克隆进行测序验证。将已测序验证的重组质粒转化入WT菌株,进而在含氨苄青霉素的LB板上筛选含质粒的菌株,在含5%蔗糖的LB平板上诱导重组,利用BF1/BR2对不同克隆子进行PCR扩增验证,能在LB普通平板上获得完全重组并稳定传3代且序列完全正确的第4代菌株,即为ΔsopE菌株。
| Primer | Sequence (5′-3′) | Length of amplification (bp) |
| BF1 | CGGGATCCTACGACCTTTTGAACGCACCA | 321 |
| BR1 | GAGTGTATTGTGGATTCTAAAATTCTGGGG | |
| BF2 | TTAGAATCCACAATACACTCCCTGAACACA | 706 |
| BR2 | CGGGATCCTTTTTGCCGCCACCAAGTCA | |
| sopE-F | ATTCTAGAACGATCAGCTCACACTCCAT | 1 200 |
| sopE-R | CGAAGCTTTGGATACAGCTAACCCAGAC | |
| T7 | TAATACGACTCACTATAGGG | 1 160 |
| T7T | GCTAGTTATTGCTCAGCGG | |
| pBAD33-F | ATGCCATAGCATTTTTATCC | 205 |
| pBAD33-R | GATTTAATCTGTATCAGG | |
| β-actin-RT-F | TCCTTCCTGGGCATGGAGTC | |
| β-actin-RT-R | GTAACGCAACTAAGTCATAGTC | |
| GAL8-RT-F | ATCTATAACCCGGTAATCCCGTT | |
| GAL8-RT-R | CATGCCCACGTATCACAATCAA | |
| LAMP1-RT-F | TCTCAGTGAACTACGACACCA | |
| LAMP1-RT-R | AGTGTATGTCCTCTTCCAAAAGC | |
| LC3B-RT-F | GATGTCCGACTTATTCGAGAGC | |
| LC3B-RT-R | TTGAGCTGTAAGCGCCTTCTA | |
| The restriction sites are underlined. | ||
以WT菌株的基因组为模板,利用引物对sopE-F(5 ′端加入XbaⅠ酶切位点)和sopE-R (5 ′端加入HindⅢ酶切位点)进行PCR扩增,获得回补片段,用XbaⅠ和HindⅢ消化回补片段和pBAD33载体;T4 DNA连接酶连接,转化入大肠埃希菌DH5 α;PCR筛选出阳性克隆子,并提取重组质粒,进行测序验证。将已测序验证的重组质粒转化入ΔsopE菌株,获得C- ΔsopE菌株。同时,将pBAD33空载体分别转化入WT和ΔsopE菌株,获得对照组WT/pBAD33和ΔsopE/pBAD33,以消除添加氯霉素对实验可能造成的影响。
1.2.3 GFP表达菌株的构建将GFP原核表达质粒pET28-sfGFP电转入WT/pBAD33、ΔsopE/pBAD33和C- ΔsopE菌株,在含硫酸卡那霉素的LB板上筛选含质粒的菌株,用T7/T7T对不同克隆株进行PCR扩增验证,最终能扩增出阳性条带的菌株则为WT/pBAD33∷pET28-sfGFP、ΔsopE/pBAD33∷pET28-sfGFP和C- ΔsopE/pET28-sfGFP菌株。
1.2.4 巨噬细胞THP-1胞内生存能力实验使用含10%胎牛血清的RPMI 1640培养液,将细胞置于37 ℃、CO2体积分数5%的细胞培养箱中静置培养。调整细胞密度至1×105 cells/ mL,将细胞接种于24孔细胞培养板中(每孔1 mL细胞悬液),加入佛波醇乙酯(phorbol-12-myristate-13-acetate,PMA)(终浓度150 ng/mL)诱导分化细胞48 h,贴壁细胞即为巨噬细胞,诱导率约为70%。将WT/pBAD33∷pET28-sfGFP、ΔsopE/pBAD33∷pET28-sfGFP、C- ΔsopE/pET28-sfGFP单克隆分别接种于2 mL含抗生素的LB液体培养基中,37 ℃、250 r/min培养过夜,用作种子液。次日,按1∶100比例转接到20 mL新鲜LB液体培养基中,加入20% L-阿拉伯糖诱导蛋白合成,以同样条件培养至对数生长期(OD600=0.4),以4 000 r/min离心10 min,弃去上清液,用RPMI 1640重悬菌体。实验前1 h,弃去24孔板中的旧培养基,用1×磷酸盐缓冲液(phosphate buffered saline,PBS)洗去残余PMA,每孔加入1 mL新鲜RPMI 1640培养基。将细菌按感染复数(multiplicity of infection,MOI)为10∶1加入24孔板,37 ℃、CO2体积分数5%培养1 h,每孔加入100 μg/mL庆大霉素,以同样条件培养1 h杀死胞外菌。将全部孔数分成2等份,一半孔弃去上清液,用1×PBS洗3次,加入0.5% TritonXTM-100裂解细胞,适当稀释后涂于含抗生素的LB平板,37 ℃培养过夜,计数平板上菌落数量并乘以稀释倍数作为T0。余下一半孔弃去1/2培养液,加入1/2新鲜RPMI 1640培养液(仍为庆大霉素环境)继续培养24 h,用同样的方法计数菌落数作为T24。T24/T0值代表了细菌在巨噬细胞THP-1内的生存能力。按照此方法进行3次生物学重复实验。
1.2.5 细胞免疫荧光实验接种细胞前,将细胞爬片放入24孔板,按1.2.4小节所述方法感染培养24 h,用1×PBS于摇床中清洗细胞爬片3次,每次5 min。加入300 μL 4%多聚甲醛固定和通透细胞30 min,弃去4%多聚甲醛,用1×PBS清洗4次,每次5 min。用5% BSA室温封闭45 min,弃去封闭液,与5% BSA稀释的一抗4 ℃孵育过夜,用1×PBS清洗4次,每次10 min。与1×TBST稀释的二抗于室温避光摇床孵育1 h,用1×PBS清洗4次,每次10 min。用1×TBST稀释的4 ′, 6-二脒基-2-苯基吲哚(4 ′, 6-diamidino-2-phenylindole,DAPI)溶液染核,1×PBS清洗4次,每次10 min。用抗荧光淬灭的封片剂封片,荧光共聚焦显微镜下观察细胞内红色和绿色点状聚集。
1.2.6 RNA提取及qRT-PCR将细胞按2.5×105cells/孔接种于6孔细胞培养板,每孔2.5 mL,按1.2.4小节所述方法感染培养24 h后,每孔加入167 μL TRIzol,提取总RNA并定量。取1 μg总RNA,用反转录试剂盒消化基因组DNA同时反转录成cDNA。用自噬特异性引物(见表 1)进行qRT-PCR,以β -actin为内参基因,使用相对定量法分析不同基因的mRNA表达水平。每组设置3个平行样,并进行3次生物学重复实验。
1.2.7 细胞蛋白提取和蛋白免疫印迹实验将细胞分别接种于3个细胞培养皿(5×105 cells/皿),培养体积6 mL/皿,按1.2.4小节所述方法感染培养24 h后,用RIPA裂解液试剂盒裂解提取蛋白质,加入5×蛋白上样缓冲液,100 ℃煮5 min,于4 ℃以13 000 r/min离心10 min。用SDS-PAGE变性丙烯酰胺凝胶快速制备试剂盒制备凝胶,每孔加入15 μL经处理的蛋白质上清液样本,电泳至目的蛋白充分分离(浓缩胶使用80 V电压,分离胶使用120 V电压)。将聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜在甲醇中浸泡20 min,放入1×转膜缓冲液中平衡2 min,浸润电转所用海绵、滤纸,PVDF膜放好位置后插入电转仪,在250 mA恒流、4 ℃下电转1 h。电转后PVDF膜用5%脱脂奶粉封闭1 h,4 ℃下与一抗孵育过夜,1×TBST洗涤3次,每次10 min,与二抗在室温下摇床孵育1 h,1×TBST洗涤3次,每次10 min。用滤纸将PVDF膜吸干,滴加增强型化学发光(enhanced chemiluminescence,ECL)试剂,在超灵敏化学发光凝胶显像系统下进行曝光。
1.3 统计学分析用Excel表格处理原始数据,采用GraphPad Prism 8.0.2软件进行统计学分析。两组之间均数比较采用t检验,P < 0.05为差异有统计学差异。
2 结果 2.1 成功构建突变株和回补株以WT菌株全基因组DNA为模板,BF1/BR1、BF2/BR2为引物对,通过PCR扩增同源重组的上、下游同源臂。结果如图 1A所示,上、下游同源臂F1和F2的片段大小均与理论一致。F1和F2经纯化、回收、等比例混合后,用作引物对BF1和BR2扩增的模板,可扩增出理论长度为1 027 bp的DNA片段(见图 1B)。利用分子克隆技术将该DNA片段克隆入自杀质粒pGMB151,并转化入WT菌株,进行同源重组以敲除sopE。使用PCR技术对不同克隆子进行验证,发现1株扩增出F片段且能在LB培养板上稳定传3代的菌株,表明其获得了稳定重组(见图 1C)。该重组子经测序验证,证明为ΔsopE菌株。

|
|
M: DNA marker; +: recombinant plasmid as template; -: deionized water as template; F1 and F2: upstream and downstream homologous fragments(using the whole genome as a template); 1 and 2: total homologous fragment F(using F1 and F2 as a template); 3: PCR products of stable recombinant positive bacteria(using monoclonal strains as a template); ALL: negative control for PCR products of genomic DNA of wild type strains; 4: total homologous fragment(using reconstructive pBAD33 as a template); 5 and 6: PCR products of positive bacteria transferred into empty vector(using empty pBAD33 a template). 图 1 突变株和回补株的构建 Fig. 1 Construction of mutant and complementation strains |
以sopE-F/sopE-R为引物,通过PCR扩增获得同源片段S2。利用分子克隆技术将该DNA片段克隆入蛋白表达质粒pBAD33,并转化入ΔsopE菌株。使用PCR技术对不同克隆子进行验证,发现1株扩增出S2片段(见图 1D),测序验证结果表明C- ΔsopE菌株构建成功。同时,电泳结果显示WT/pBAD33和ΔsopE/pBAD33菌株均构建成功(见图 1E、1F)。
2.2 成功构建GFP表达菌株将pET28-sfGFP直接电转入WT/pBAD33、ΔsopE/pBAD33、C- ΔsopE菌株,以T7/T7T为引物进行PCR扩增。电泳结果显示,pET28-sfGFP成功电转(见图 2),表明GFP表达菌株WT/pBAD33∷pET28-sfGFP、ΔsopE/pBAD33∷pET28-sfGFP和C- ΔsopE/pET28-sfGFP构建成功。
|
| M: DNA marker; 1-3: PCR products of positive wild strains; 4-6: PCR product of positive defective strain; 7-8: PCR product of positive complement strain; -: pure water as negative control; +: pure pET28-sfGFP plasmid. 图 2 绿色荧光蛋白表达菌株的构建 Fig. 2 Construction of strains expressing green fluorescent protein |
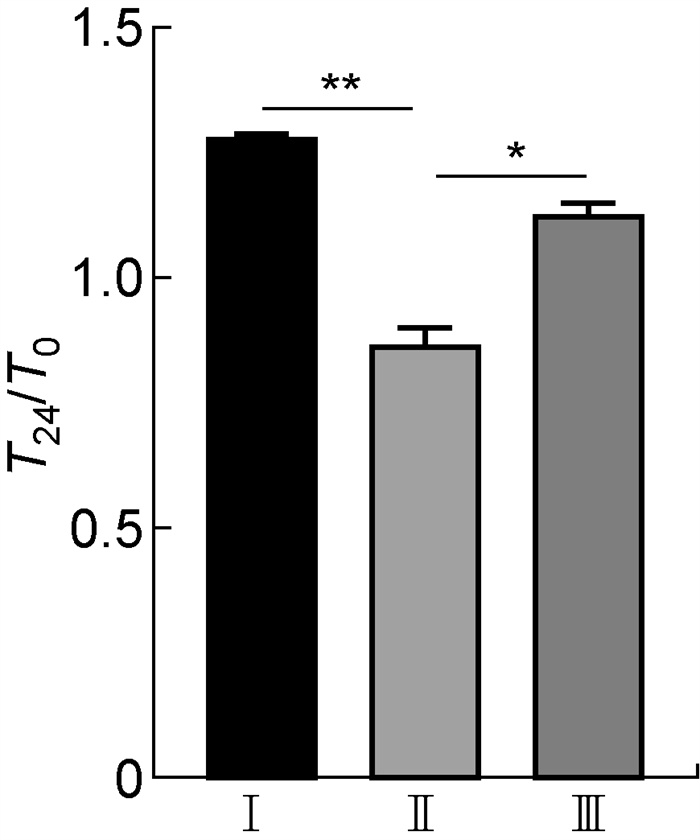
为了研究伤寒沙门菌sopE基因缺失对其在巨噬细胞THP-1内生存能力的影响,用WT/pBAD33∷pET28-sfGFP、ΔsopE/pBAD33∷pET28-sfGFP和C- ΔsopE/pET28-sfGFP菌株进行THP-1胞内生存实验。结果显示,感染24 h后,ΔsopE/pBAD33∷pET28-sfGFP菌株的胞内生存能力比WT/pBAD33∷pET28-sfGFP菌株明显降低,而C- ΔsopE/pET28-sfGFP菌株的胞内生存能力与ΔsopE/pBAD33∷pET28-sfGFP菌株相比有所回升(见图 3),表明SopE能够提高伤寒沙门菌在巨噬细胞内的生存能力。
|
|
Ⅰ: WT/pBAD33∷pET28-sfGFP strain; Ⅱ: ΔsopE/pBAD33∷pET28-sfGFP strain; Ⅲ: C-ΔsopE/pET28-sfGFP strain. *P < 0.05; **P < 0.01. 图 3 SopE提高沙门伤寒菌在巨噬细胞THP-1内的生存能力 Fig. 3 SopE promotes the intracellular viability of S. typhi in THP-1 macrophages |
为了研究sopE基因缺失对巨噬细胞内晚期SCV稳定性的影响,在WT/pBAD33∷pET28-sfGFP、ΔsopE/pBAD33∷pET28-sfGFP和C- ΔsopE/pET28-sfGFP菌株感染巨噬细胞24 h时进行免疫荧光实验,将LAMP1和GAL8与菌株共定位。结果显示,感染24 h时WT/pBAD33∷pET28-sfGFP和C- ΔsopE/pET28-sfGFP菌株在巨噬细胞内形成的SCV膜上的LAMP1蛋白荧光强度,较于ΔsopE/pBAD33∷pET28-sfGFP菌株增强不明显,但GAL8蛋白荧光强度显著减弱(见图 4)。应用qRT-PCR对WT/pBAD33∷pET28-sfGFP、ΔsopE/pBAD33∷pET28-sfGFP和C- ΔsopE/pET28-sfGFP菌株中的目的基因LAMP1、GAL8进行检测,目的基因mRNA水平的变化与其在蛋白水平的荧光检测结果一致(见图 5A)。结果表明,sopE缺陷株SCV的稳定性下降,SopE可能增强了晚期SCV的稳定性。

|
| Ⅰ: WT/pBAD33∷pET28-sfGFP strain; Ⅱ: ΔsopE/pBAD33∷pET28-sfGFP strain; Ⅲ: C-ΔsopE/pET28-sfGFP strain. Blue fluorescence represents nuclear, red fluorescence represents LAMP1 and GAL8, and green fluorescence represents bacteria. The magnification is 600×. 图 4 SopE增强晚期SCV的稳定性 Fig. 4 SopE enhances the stability of late SCV |

|
| Ⅰ: WT/pBAD33∷pET28-sfGFP strain; Ⅱ: ΔsopE/pBAD33∷pET28-sfGFP strain; Ⅲ: C-ΔsopE/pET28-sfGFP strain. **P < 0.01; ***P < 0.001; ****P < 0.000 1. 图 5 SopE抑制自噬相关基因和蛋白 Fig. 5 SopE inhibits autophagy-related genes and proteins |
LC3在自噬的成核和延伸阶段发挥作用,是自噬体膜上的标志性蛋白。自噬受体蛋白与LC3结合,通过泛素化使自噬体与溶酶体结合[10]。为了研究sopE基因缺失对巨噬细胞内晚期SCV稳定性的影响是否与自噬相关,提取WT/pBAD33∷pET28-sfGFP、ΔsopE/pBAD33∷pET28-sfGFP和C- ΔsopE/pET28-sfGFP菌株感染巨噬细胞24 h时的总RNA进行qRT-PCR,并提取总蛋白进行蛋白免疫印迹实验。qRT-PCR结果显示,WT/pBAD33∷pET28-sfGFP和C- ΔsopE/pET28-sfGFP菌株感染巨噬细胞24 h后,LC3B在mRNA水平的表达显著低于ΔsopE/pBAD33∷pET28-sfGFP菌株感染组(见图 5A)。蛋白免疫印迹结果显示,WT/pBAD33∷pET28-sfGFP和C- ΔsopE/pET28-sfGFP菌株感染细胞后,LC3B蛋白的表达水平也显著低于ΔsopE/pBAD33∷pET28-sfGFP菌株感染组(见图 5B)。结果提示,SopE可能在感染晚期抑制自噬。
3 讨论伤寒沙门菌通过沙门菌毒力岛1(Salmonella pathogenicity island 1,SPI-1)编码的T3SS1效应蛋白入侵肠道上皮细胞,被单核-巨噬细胞吞噬后在巨噬细胞内形成SCV,利用SPI-2编码的T3SS2效应蛋白在SCV中生存和复制[12]。伤寒沙门菌被吞噬包裹后,迅速募集Rab5、PI3P、EEA1等早期膜标记形成初期SCV,进而弃去早期标记并募集晚期膜标记Rab7、LAMP1等形成晚期SCV,同时近核移动并酸化,促进T3SS2效应蛋白的产生,通过囊泡运输,不断与无水解酶的晚期内体及溶酶体融合,形成成熟的SCV,从而促进伤寒沙门菌在细胞内的生存和复制[13-16]。LAMP1不仅是晚期SCV的标记,还与SCV膜的完整性相关。晚期SCV会不断募集无水解酶的内体和溶酶体与之融合,确保SCV的稳定性,但此动态变化也会导致SCV的破损。一旦破损,GAL8会迅速识别并在破损处聚集,通过自噬消灭伤寒沙门菌[17-18]。SCV的稳定性对伤寒沙门菌在巨噬细胞内的生存和复制至关重要。被伤寒沙门菌感染后,机体可以诱导自噬,这在消除细菌中起关键作用。SCV中的伤寒沙门菌能够通过T3SS将效应蛋白注入宿主细胞胞质中,使SCV膜产生大小不一的小孔,导致SCV膜破损甚至破裂,从而导致伤寒沙门菌进入胞质。这些伤寒沙门菌和破损的SCV会被泛素化,招募自噬相关蛋白,被溶酶体吞噬消灭[19-20]。与此同时,伤寒沙门菌也进化出了逃逸自噬的能力。研究发现,T3SS1效应蛋白SopB能募集Rab5和PI3P至SCV膜,促进LAMP1及Rab7的募集,并降低早期SCV膜表面的负电荷,抑制SCV与溶酶体融合,增强早期SCV的稳定性[21-22]。T3SS1效应蛋白SopF可与ATP6V0C结合,从而阻断v-ATPase-ATG16L1的相互作用,抑制机体异体自噬,但不影响非选择性自噬[23-25]。
本研究制备了伤寒沙门菌SPI-1效应蛋白SopE的缺陷株和回补株,通过胞内生存能力实验发现SopE在感染晚期能够提高伤寒沙门菌在巨噬细胞THP-1内的生存能力。通过细胞免疫荧光和qRT-PCR实验,发现sopE缺陷株的SCV稳定性下降,提示SopE可能促进晚期SCV的稳定性。巨噬细胞内自噬相关基因的mRNA表达水平和蛋白表达水平的实验结果显示,SopE可能在感染晚期抑制自噬。综上所述,伤寒沙门菌SPI-1效应蛋白SopE可能通过影响自噬而调节晚期SCV的稳定性。以往研究发现,SopE是早期SCV损伤的主要因素,能够促进伤寒沙门菌在感染早期于上皮细胞胞内释放,从而有利于侵袭[9]。因此,SopE在感染早期和晚期发挥的作用可能不尽相同,这为研究伤寒沙门菌效应蛋白的作用提供了新思路,也为后续深入研究其调控机制奠定了基础。
| [1] |
Huang DB, DuPont HL. Problem pathogens: extra-intestinal complications of Salmonella enterica serotype Typhi infection[J]. Lancet Infect Dis, 2005, 5(6): 341-348.
[DOI]
|
| [2] |
Jennings E, Thurston TLM, Holden DW. Salmonella SPI-2 type Ⅲ secretion system effectors: molecular mechanisms and physiological consequences[J]. Cell Host Microbe, 2017, 22(2): 217-231.
[DOI]
|
| [3] |
Cemma M, Brumell JH. Interactions of pathogenic bacteria with autophagy systems[J]. Curr Biol, 2012, 22(13): R540-R545.
[DOI]
|
| [4] |
Owen KA, Casanova JE. Salmonella manipulates autophagy to "serve and protect"[J]. Cell Host Microbe, 2015, 18(5): 517-519.
[DOI]
|
| [5] |
Schlumberger MC, Hardt WD. Triggered phagocytosis by Salmonella: bacterial molecular mimicry of RhoGTPase activation/deactivation[J]. Curr Top Microbiol Immunol, 2005, 291: 29-42.
[PubMed]
|
| [6] |
Lim JS, Shin M, Kim HJ, Kim KS, Choy HE, Cho KA. Caveolin-1 mediates Salmonella invasion via the regulation of SopE-dependent Rac1 activation and actin reorganization[J]. J Infect Dis, 2014, 210(5): 793-802.
[DOI]
|
| [7] |
Bishop AL, Hall A. Rho GTPases and their effector proteins[J]. Biochem J, 2000, 348(Pt 2): 241-255.
[PubMed]
|
| [8] |
Agbor TA, McCormick BA. Salmonella effectors: important players modulating host cell function during infection[J]. Cell Microbiol, 2011, 13(12): 1858-1869.
[DOI]
|
| [9] |
Fattinger SA, Böck D, Di Martino ML, Deuring S, Samperio Ventayol P, Ek V, Furter M, Kreibich S, Bosia F, Müller-Hauser AA, Nguyen BD, Rohde M, Pilhofer M, Hardt WD, Sellin ME. Salmonella Typhimurium discreet-invasion of the murine gut absorptive epithelium[J]. PLoS Pathog, 2020, 16(5): e1008503.
[DOI]
|
| [10] |
Verlhac P, Vire C, Faure M. Dual function of CALCOCO2/NDP52 during xenophagy[J]. Autophagy, 2015, 11(6): 965-966.
[DOI]
|
| [11] |
Röder J, Hensel M. Presence of SopE and mode of infection result in increased Salmonella-containing vacuole damage and cytosolic release during host cell infection by Salmonella enterica[J]. Cell Microbiol, 2020, 22(5): e13155.
[DOI]
|
| [12] |
Vonaesch P, Sellin ME, Cardini S, Singh V, Barthel M, Hardt WD. The Salmonella Typhimurium effector protein SopE transiently localizes to the early SCV and contributes to intracellular replication[J]. Cell Microbiol, 2014, 16(12): 1723-1735.
[DOI]
|
| [13] |
Jennings E, Thurston TLM, Holden DW. Salmonella SPI-2 type Ⅲ secretion system effectors: molecular mechanisms and physiological consequences[J]. Cell Host Microbe, 2017, 22(2): 217-231.
[DOI]
|
| [14] |
Knuff K, Finlay BB. What the SIF is happening-the role of intracellular Salmonella-induced filaments[J]. Front Cell Infect Microbiol, 2017, 7: 335.
[DOI]
|
| [15] |
Marsman M, Jordens I, Kuijl C, Janssen L, Neefjes J. Dynein-mediated vesicle transport controls intracellular Salmonella replication[J]. Mol Biol Cell, 2004, 15(6): 2954-2964.
[DOI]
|
| [16] |
LaRock DL, Chaudhary A, Miller SI. Salmonellae interactions with host processes[J]. Nat Rev Microbiol, 2015, 13(4): 191-205.
[DOI]
|
| [17] |
Sindhwani A, Arya SB, Kaur H, Jagga D, Tuli A, Sharma M. Salmonella exploits the host endolysosomal tethering factor HOPS complex to promote its intravacuolar replication[J]. PLoS Pathog, 2017, 13(10): e1006700.
[DOI]
|
| [18] |
Meunier E, Dick MS, Dreier RF, Schürmann N, Kenzelmann Broz D, Warming S, Roose-Girma M, Bumann D, Kayagaki N, Takeda K, Yamamoto M, Broz P. Caspase-11 activation requires lysis of pathogen-containing vacuoles by IFN-induced GTPases[J]. Nature, 2014, 509(7500): 366-370.
[DOI]
|
| [19] |
Bernal-Bayard J, Ramos-Morales F. Molecular mechanisms used by Salmonella to evade the immune system[J]. Curr Issues Mol Biol, 2018, 25: 133-168.
[PubMed]
|
| [20] |
Wang L, Yan J, Niu H, Huang R, Wu S. Autophagy and ubiquitination in Salmonella infection and the related inflammatory responses[J]. Front Cell Infect Microbiol, 2018, 8: 78.
[DOI]
|
| [21] |
Steele-Mortimer O. The Salmonella-containing vacuole: moving with the times[J]. Curr Opin Microbiol, 2008, 11(1): 38-45.
[DOI]
|
| [22] |
Teo WX, Kerr MC, Teasdale RD. MTMR4 is required for the stability of the Salmonella-containing vacuole[J]. Front Cell Infect Microbiol, 2016, 6: 91.
[DOI]
|
| [23] |
Bakowski MA, Braun V, Lam GY, Yeung T, Heo WD, Meyer T, Finlay BB, Grinstein S, Brumell JH. The phosphoinositide phosphatase SopB manipulates membrane surface charge and trafficking of the Salmonella-containing vacuole[J]. Cell Host Microbe, 2010, 7(6): 453-462.
[DOI]
|
| [24] |
Wen X, Klionsky DJ. How bacteria can block xenophagy: an insight from Salmonella[J]. Autophagy, 2020, 16(2): 193-194.
[DOI]
|
| [25] |
Xu Y, Zhou P, Cheng S, Lu Q, Nowak K, Hopp AK, Li L, Shi X, Zhou Z, Gao W, Li D, He H, Liu X, Ding J, Hottiger MO, Shao F. A bacterial effector reveals the V-ATPase-ATG16L1 axis that initiates xenophagy[J]. Cell, 2019, 178(3): 552-566.
[DOI]
|
 2022, Vol. 17
2022, Vol. 17



