2. 复旦大学附属中山医院肝癌研究所,癌变与侵袭原理教育部重点实验室,上海 200032;
3. 复旦大学基础医学院病原生物学系,教育部/卫健委医学分子病毒学重点实验室,上海 200032
2. Key Laboratory of Carcinogenesis and Cancer Invasion, Ministry of Education, Liver Cancer Institute, Zhongshan Hospital, Fudan University, Shanghai 200032, China;
3. Department of Medical Microbiology and Parasitology, School of Basic Medical Sciences, Fudan University, Shanghai 200032, China
肝脏是机体代谢的重要器官,在脂质代谢(lipid metabolism)中具有重要而独特的作用[1]。大量研究表明,癌基因的异常活化以及抑癌基因的抑制失活会造成细胞代谢水平以及代谢方式的改变,这被称为细胞代谢重编程(metabolism reprogramming)。代谢紊乱常见于肝癌的发生发展过程中,在我国高发肝病的急、慢性乙肝病毒感染过程中也常伴有代谢调节失常,代谢重编程是肝脏炎症向癌症转化的关键步骤[2],研究HBV感染对人肝癌细胞脂类代谢相关蛋白表达的影响对于明确肝脏炎症向癌症转化的分子机制有重要意义。
肿瘤所处的乏氧等恶劣微环境提示肿瘤细胞的代谢与正常组织代谢有一定的差异,肿瘤细胞表现为糖酵解过度活跃,而线粒体有氧代谢受到抑制,如经典的“Warburg效应”[3]。现有研究发现,很多代谢相关酶就是癌基因与抑癌基因,这些基因的异常表达导致了肿瘤代谢重编程[4]。通常代谢酶的失活或过激活导致细胞代谢相关信号的级联反应(signaling cascades)。如甲羟戊酸(mevalonate, MVA) 途径,利用乙酰辅酶A(acetyl-CoA)、NADPH和ATP产生胆固醇和类异戊二烯(isoprenoids),二者对于维持肿瘤的生长至关重要[5]。
在肝脏中,由MVA途径生产的胆固醇占人类全身胆固醇的80%。胆固醇是脂筏(lipid rafts)的组成成分,其快速合成是癌细胞得以快速增殖的必要条件[6-7],而脂筏是细胞膜内外物质交换的微结构域,也是形成信号复合物所必须的结构,对细胞存活具有重要的意义[8]。原发性乳腺癌患者的样本数据库分析也表明,MVA途径代谢物对癌细胞存活至关重要[9],大量的MVA途径酶是多种癌细胞系存活的关键。
编码MVA通路酶的基因转录主要受胆固醇调节元件结合蛋白(sterol-regulatory element binding proteins, SREBPs/SREBFs)调控。SREBPs属于碱性螺旋环螺旋亮氨酸拉链转录因子家族,有3种亚型,分别为SREBP-1a、SREBP-1c和SREBP-2。SREBP-1c和SREBP-2是肝脏和大多数其他完整组织中的主要亚型,SREBP-1c主要增强合成脂肪酸基因的转录,SREBP-2优先激活胆固醇合成所需基因。当细胞内胆固醇水平较高时,SREBPs在内质网处于失活状态;当胆固醇水平降低时,反馈激活胆固醇调节元件结合蛋白裂解激活蛋白(SREBP cleavage-activating protein, SCAP),进一步裂解活化SREBPs,并使其从内质网转移至高尔基体[10]。在高尔基体中,SREBPs被S1P(site-1 protease)和S2P(site-2 protease)2个位点酶剪切,然后转移至细胞核中,与靶基因启动子中的胆固醇调控元件(sterol regulatory elements, SRE)结合,随之启动MVA信号通路的转录,以恢复胆固醇和类异戊二烯水平[10-11]。另外,羟甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-CoA reductase, HMGCR)是MVA信号通路的起始酶,也是体内催化胆固醇从头合成的限速酶,在胆固醇的合成中具有重大意义[12]。同时HMGCR的活性受到别构调节、化学修饰调节和酶含量调节等多方面调控。例如,细胞内的胆固醇能够在转录以及转录后水平调控HMGCR。当细胞内胆固醇水平升高时,一方面它可以与HMGCR直接结合引起其构象改变,抑制HMGCR的活性;另一方面它可以通过抑制SREBP2的激活从而抑制HMGCR基因的转录,通过影响HMGCR的酶含量进而抑制胆固醇合成。另外,胆固醇合成信号通路中的中间产物24, 25-二氢羊毛甾醇能够对HMGCR进行泛素化修饰从而使其降解。且有研究表明,在原代小鼠的胚胎成纤维细胞中过表达HMGCR的催化结构域可与HRASG12V协同促进病灶形成,提示HMGCR是一种代谢癌基因[13]。LDLR是血浆源LDL胆固醇结合和内化最重要的受体,受体活性的改变会影响肝脏对LDL的吸收率,调节血浆LDL浓度[14]。前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin/Kexin type 9, PSCK9),是LDLR的上游调节元件,可通过促进LDLR的降解提高血浆胆固醇水平[15]。
综上所述,本研究将基于HBV感染模型,并综合能量代谢通路的分子生物学研究,围绕胆固醇代谢,研究HBV感染对人肝癌细胞脂类代谢相关蛋白表达的影响,形成肝脏炎症向癌症转化的新认知。
1 材料与方法 1.1 材料 1.1.1 细胞系人肝癌细胞HepG2、Hep3B由本实验室保存,Hep3B细胞表达乙肝表面抗原(HBsAg)。人肝癌细胞HepG2.2.15购自湖南丰晖生物科技有限公司,该细胞由整合HBV基因的HepG2细胞衍生,可稳定进行HBV基因组的复制,细胞上清液也可以测得到HBV DNA。
1.1.2 质粒表达质粒L-HBsAg(HBs质粒)购自北京中源合聚生物科技有限公司。
1.1.3 组织芯片肝癌组织芯片购于上海芯超生物科技有限公司,阵列编号(Cat No.)为HLivH160CS02。本芯片共160位点,来自80例不同的肝癌患者,癌/癌旁各1点,其中45例为HBV阳性肝癌患者(癌和癌旁共占90位点),35例为HBV阴性肝癌患者(癌和癌旁共占70位点)(既往研究显示,HBV阳性肝癌患者,往往癌旁组织也呈现HBV感染)。相关病理参数如表 1所示。
| 指标 | 类别 | n(%) | |||
| 总数(n=80) | HBV(+) | HBV(-) | P值 | ||
| 年龄(岁*) | < 60 | 48(60) | 28(35) | 20(25) | 0.759 4 |
| ≥60 | 31(38.75) | 17(21.25) | 14(17.5) | ||
| 总数 | 45(56.96) | 34(43.04) | |||
| 性别 | 男 | 64(80) | 36(45) | 28(35) | >0.99 |
| 女 | 16(20) | 9(11.25) | 7(8.75) | ||
| 总数 | 45(56.25) | 35(43.75) | |||
| 肿瘤直径(cm) | ≤5 | 39(48.75) | 13(16.25) | 26(32.5) | < 0.0001 |
| >5 | 41(51.25) | 32(40) | 9(11.25) | ||
| 总数 | 45(56.25) | 35(43.75) | |||
| 脉管侵犯 | 有 | 34(42.5) | 9(11.25) | 25(31.25) | < 0.0001 |
| 无 | 46(57.5) | 36(45) | 10(1.25) | ||
| 总数 | 45(56.25) | 35(43.75) | |||
| 神经侵犯 | 有 | 2(2.5) | 0(0) | 2(2.5) | 0.104 4 |
| 无 | 78(97.5) | 45(56.25) | 33(41.25) | ||
| 总数 | 45(56.25) | 35(43.75) | |||
| 病理分级 | Ⅰ-Ⅱ/Ⅱ | 40(50) | 20(25) | 20(25) | 0.259 8 |
| Ⅱ-Ⅲ/Ⅲ | 40(50) | 25(31.25) | 15(18.75) | ||
| 总数 | 45(56.25) | 35(43.75) | |||
| 注:*收集的患者病理资料中,有一例HBV阴性肝癌患者年龄不详,故此处未统计在内。 | |||||
主要试剂包括高糖DMEM培养基(上海翌圣生物科技公司)、胎牛血清(fotal bovine serum, FBS)(以色列Biological Industries)、Trypsin(美国CORNING)、青链霉素混合液(双抗)(武汉Servicebio公司)、乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法)(上海科华生物工程股份有限公司)、TRIzol(美国Invitrogen公司)、逆转录试剂盒(上海翌圣生物科技公司)、SYBR Green PCR试剂盒(上海翌圣生物科技公司)、多重荧光免疫组化染色试剂盒(上海媛禧生物科技有限公司)、抗-SREBP2抗体(上海ABmart公司)、抗-HMGCR抗体(上海ABmart公司)、抗-LDL Receptor抗体(上海ABmart公司)、抗-HBsAg抗体(北京中杉金桥公司)、抗-HBcAg抗体(北京中杉金桥公司)。
1.2 方法 1.2.1 细胞培养HepG2、Hep3B、HepG2.2.15细胞均在含有体积分数为10%的胎牛血清、100 U/mL青霉素、100 μ g /mL链霉素的DMEM培养基中于体积分数为5% 的CO2、37 ℃条件下传代培养,至对数生长期时接种于6孔板,培养24 h后备用。
1.2.2 细胞转染铺对数生长期的HepG2细胞于6孔板中,5% CO2、37 ℃孵育24 h;将1 μ g HBc质粒(或HBs质粒)DNA稀释到125 μ L无血清培养液(Opti-MEM)中;将3 μ L EZ Trans转染试剂稀释到125 μ L Opti-MEM中,轻轻混匀;将稀释好的EZ Trans转染试剂混合物尽快全部加入已稀释好的质粒DNA混合物中,轻轻混匀;室温放置10~15 min,缓慢滴加至含有HepG2细胞和培养液的单孔中;培养箱孵育72 h后收集细胞。
1.2.3 酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)检测HBsAg分别收集上述培养24 h的细胞上清液,即为待测样本。往预先包被HBsAg捕获抗体的包被孔中,依次加入75 μ L待测样本和阴、阳性对照(每样3副孔),用封板膜覆盖反应板,于37 ℃孵育60 min。然后分别加入50 μ L酶结合物,手动轻轻震荡10 s,用封板膜覆盖反应板,置于37 ℃孵育30 min,彻底洗涤反应板5次。洗涤结束后立即加入显色剂A、显色剂B,并混匀,用封板膜覆盖反应板,于37 ℃孵育30 min。分别加入50 μ L终止液,震荡混匀,用酶标仪在450 nm波长下测定吸光度(OD值),计算样品浓度。
1.2.4 RNA提取、逆转录聚合酶链反应(reverse transcription-polymerase chain reaction, RT-qPCR)分别收集上述培养24 h的细胞,用300 μ L TRIzol充分裂解细胞培养物。加入200 μ L氯仿,震荡混匀静置10 min后,4 ℃ 12 800 g离心5 min;取上清液,加入2 μ L Glycoblue和等体积异丙醇,混匀静置15 min后,4 ℃ 12 800 g离心5 min;弃上清液,加入200 μ L预冷的体积分数为75% 的乙醇,悬浮沉淀,放入-20 ℃ 1 h促沉,4 ℃ 12 800 r/min离心5 min;弃上清液,沉淀物于室温干燥10 min,加入RNAase free H2O溶解。
经NanoDrop 2000分光光度计对RNA进行浓度定量,用逆转录试剂盒将RNA反转录成cDNA(37 ℃ 15 min, 85 ℃ 5 s, 降温至4 ℃备用)。cDNA产物稀释5倍后用SYBR Green PCR试剂盒进行荧光定量,预变性95 ℃, 10 min;变性95 ℃, 30 s;扩增60 ℃, 1 min;共进行45个循环。基因表达的相对倍数变化用2-ΔΔCt法进行计算。引物序列如表 2所示。
| Gene | Primer sequences 5′-3′ |
| hHMGCR | F: TGATTGACCTTTCCAGAGCAAG |
| R: CTAAAATTGCCATTCCACGAGC | |
| hSREBP-2 | F: CGTCCACCACCGACAGATGA |
| R: GAAGGCTGGAGACCAGGAAGA | |
| hLDLR | F: GTGCTCCTCGTCTTCCTTTG |
| R: TAGCTGTAGCCGTCCTGGTT | |
| hPCSK9 | F: AGACCCACCTCTCGCAGTC |
| R: GGAGTCCTCCTCGATGTAGTC | |
| hGAPDH | F: GGTCGGAGTCAACGGATTTG |
| R: GGAAGATGGTGATGGGATTTC | |
| F: forward primer; R: reverse primer. | |
根据多重荧光免疫组化染色试剂盒说明书,将玻片置于抗原修复液中,加热约15 min后冷却至室温进行抗原修复;1×TBST浸洗玻片,滴加质量分数为3%的过氧化氢浸没样本区域,灭活10 min;滴加封闭液,室温孵育10 min;分别加入抗-SREBP2、抗-HMGCR、抗-LDL Receptor、抗-HBsAg、抗-HBcAg抗体,室温孵育30 min;加入HRP二抗,室温孵育10 min;滴加1×TSA荧光染料染色工作液,室温孵育10 min,用1×TBST浸洗玻片3次,每次2 min。重复以上步骤,进行后续多轮染色。最后用1×DAPI工作液染核及封片,并用成像设备对染色后的组织片在荧光显微镜下判读。
1.2.6 统计学处理采用SPSS 24.0和GraphPad Prism8软件进行统计学分析和作图。计数资料以n(%) 表示,组间比较采用χ2检验。检验水准(α)为0.05。
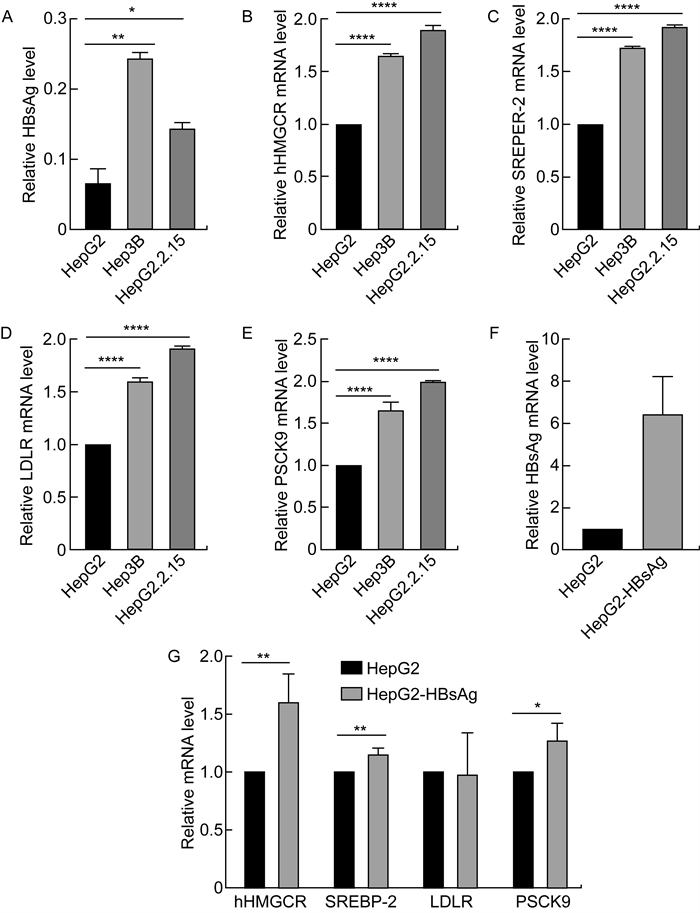
2 结果 2.1 HBV感染上调肝癌细胞脂类代谢相关蛋白表达为初步探索HBV感染对肝癌细胞脂类代谢相关蛋白表达的影响,并针对性研究HBsAg与宿主细胞脂质代谢之间的关系,分别选用稳定表达HBsAg的Hep3B细胞系,稳定表达HBV的HepG2.2.15细胞系,及其对照肝癌细胞系HepG2,通过实时荧光定量PCR检测肿瘤代谢基因转录水平的差异情况。通过ELISA检测以上3种细胞上清液中的HBsAg表达,结果如图 1A所示,HepG2细胞为阴性,Hep3B和HepG2.2.15细胞为阳性,且与对照组HepG2细胞相比均具有统计学差异(P < 0.05)。如图 1B所示,与对照细胞相比,Hep3B细胞中HMGCR的mRNA表达量上调66%,HepG2.2.15细胞中HMGCR的表达量上调了90%。SREBP-2在Hep3B细胞和HepG2.2.15细胞中分别上调73%和93%(见图 1C)。LDLR在Hep3B和HepG2.2.15细胞中的表达分别上调了61%和92%(见图 1D)。PSCK9在Hep3B细胞和HepG2.2.15细胞中分别上调65%和99%(见图 1E)。上述差异表达均具有统计学意义(P < 0.05)。另外,将HBsAg质粒瞬时转染HepG2细胞,HBsAg的mRNA水平相对上调6.5倍(见图 1F),过表达HBsAg使脂类代谢相关蛋白HMGCR、SREBP-2、PSCK9分别上调了1.62、1.16、1.28倍,且与对照组相比均具有显著性差异(P < 0.05),但胆固醇代谢关键分子LDLR与对照组差异不显著(0.99倍,P>0.05)(见图 1G)。
|
| A.通过酶联免疫法检测HepG2、Hep3B、HepG2.2.15三种细胞上清液中的HBsAg表达;B~E.分别为通过RT-PCR法检测Hep3B、HepG2.2.15与HepG2细胞中HMGCR、SREBP-2、LDLR及PSCK9的mRNA表达差异;F.通过RT-PCR法检测过表达HBsAg的相对mRNA水平;G.过表达HBsAg对脂类代谢相关蛋白HMGCR、SREBP-2、LDLR、PSCK9的影响。*、* *和* * *均代表P < 0.05. 图 1 HBV感染对肝癌细胞脂类代谢相关蛋白表达的影响 Fig. 1 Effects of HBV infection on lipid metabolism related protein expressions in hepatocellular carcinoma cells |
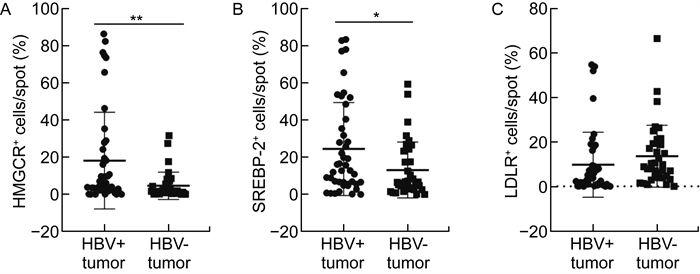
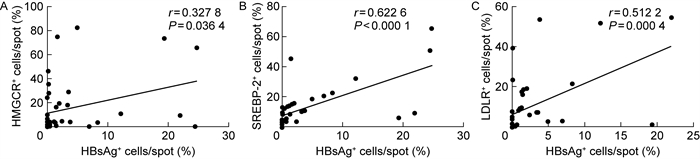
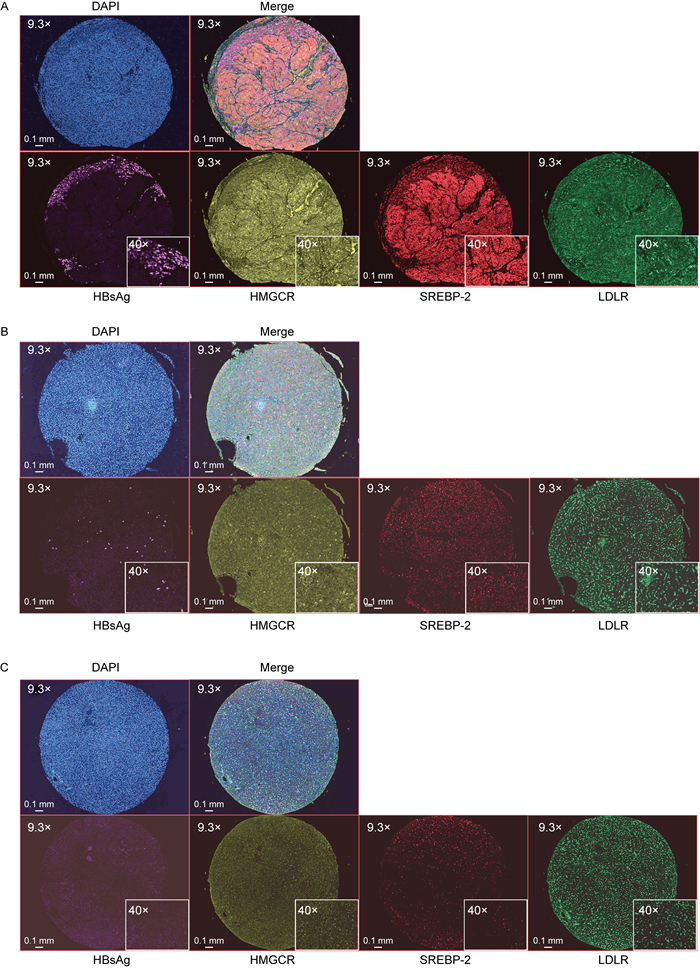
为进一步明确HBV感染及HBV编码的HBsAg对脂质代谢相关基因表达的调控作用,选取包含80例肝癌患者的组织芯片,患者的临床病理特征如表 1所示,HBV感染与否与患者年龄、性别、神经侵犯以及病理分级的相关性无统计学意义,但HBV感染与肿瘤大小(P < 0.000 1)和脉管侵犯(P < 0.000 1)的相关性具有统计学意义。进一步通过免疫荧光对HBV蛋白HBsAg及脂代谢关键调控蛋白HMGCR、SREBP-2、LDLR的表达进行比较,并用ImageJ软件对阳性细胞进行计数,没有着色或<40%的细胞呈细胞膜、细胞质轻度着色记为(-);40%~60%的细胞呈细胞膜、细胞质中等强度着色记为(+);> 60%的细胞呈细胞膜、细胞质高强度着色记为(+ +)。结果显示,与35例非乙肝肝癌患者相比,45例HBV阳性肝癌患者的HMGCR、SREBP-2总体表达水平都相对上调(见图 2A、B),差异均具有统计学意义(P < 0.05)。虽然HBV阳性和阴性肿瘤中LDLR表达的差异不具有统计学意义(样本量或者是HBV感染过程中有其他因素影响)(见图 2C),但是本文进一步聚焦到HBV核心抗原HBsAg对几个酶表达的影响。结果显示,HMGCR、SREBP-2和LDLR的表达与HBsAg的表达均呈正相关(见图 3A、B、C),即HMGCR、SREBP-2和LDLR的表达水平随HBsAg的表达比例的增高而上升。图 4显示了3组代表不同表达水平的HBsAg及其对应的脂代谢相关基因表达免疫荧光染色。结果提示,HBsAg可能参与了正向调控脂质代谢基因的表达。
|
| A~C.分别为HMGCR、SREBP-2、LDLR;*代表P<0.05,* *代表P<0.01;+代表相应蛋白染色阳性。 图 2 通过免疫荧光法检测HBV感染对肝癌组织中脂质代谢相关基因表达的影响 Fig. 2 The effect of HBV infection on the expression of lipid metabolism-related genes in hepatocellular carcinoma detected by immunofluorescence assay |
|
| A~C.分别为HMGCR、SREBP-2和LDLR;+代表相应蛋白染色阳性。 图 3 脂质代谢相关基因和HBsAg表达的相关性分析 Fig. 3 Correlation analysis of lipid metabolism-related genes and HBsAg expression |
|
| A.高表达HBsAg的样本,其HMGCR、SREBP-2、LDLR同步高表达;B.低表达HBsAg的样本,HMGCR、SREBP-2、LDLR表达水平也相对较低;C.不表达HBsAg的样本,HMGCR不表达,SREBP-2和LDLR微弱表达。 图 4 HBV阳性及阴性肝癌患者HMGCR、SREBP-2、LDLR、HBsAg免疫荧光染色 Fig. 4 Immunofluorescence staining of HMGCR, SREBP-2, LDLR, HBsAg in HBV-positive and HBV-negative liver cancer patients |
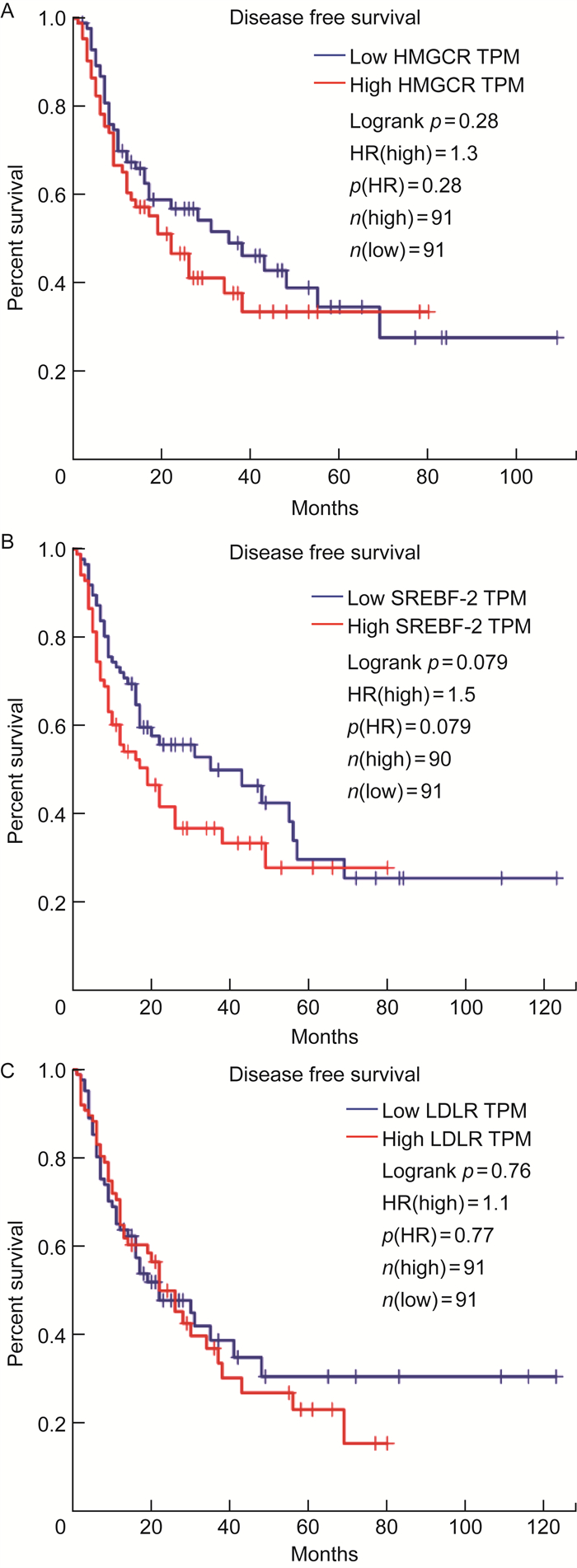
为关联分析脂代谢基因表达对肝癌病人生存期的影响,本文基于TCGA (The Cancer Genome Atlas) 数据库肝癌患者的病理资料,使用基因表达谱数据动态分析(gene expression profiling interactive analysis, GEPIA)数据库分析HMGCR、SREBP-2、LDLR在人类肝癌组织中的表达与预后的相关性。通过将患者按照相应脂代谢基因表达水平高于75%及低于25%的风险评分作为截断值分为高表达组和不表达/低表达组,绘制Kaplan-Meier(K-M)生存曲线,同时采用Logrank检验计算显著性p(value)值,以期得到与预后显著相关的基因与临床表型。患者资料如表 3所示,共有365例患者(包括HBV阳性和阴性肝癌患者)被纳入统计,其中男女比例为1∶2.07,共分为10个病理分期,i期患者占47%,截至统计时间,共130例患者死亡。生存曲线如图 5A所示,高表达与不表达/低表达HMGCR相比,无病生存期(disease-free-survival, DFS)的风险比(hazards ratio, HR)为1.3,表明其对肝癌的发生有促进作用,无病生存率Logrank p值为0.28,差异无统计学意义,但有预后较差的趋势。与高表达HMGCR的预后曲线类似,高表达与不表达/低表达SREBP-2的HR为1.5,Logrank p值为0.079(见图 5B);高表达与不表达/低表达LDLR的HR为1.1,Logrank p值为0.76(见图 5C)。K-M生存分析结果显示,SREBP-2、LDLR同样均为肝癌发生的风险基因,虽然高表达与不表达/低表达相比,无病生存期均没有显著性差异,但二者的高表达有预后变差的趋势。上述365例患者中,共153例为HBV阳性患者,本文进一步利用Kaplan-Meier Plotter数据库分析了上述脂质代谢基因分别与HBV阳性肝癌患者的预后相关性。结果如图 6所示,与对照组相比,高表达HMGCR在HBV阳性肝癌患者中虽没有显著性差异,但无进展生存期(progression-free-survival, PFS)有相对较差的趋势(Logrank p=0.15)(见图 6A),高表达队列中位生存期为17.9月,低表达组中位生存期为36.1月,可见HMGCR高表达对肝癌的发生有促进作用(HR=1.46);SREBP-2的高表达呈现了类似的结果(HR=1.3, Logrank p=0.28)(见图 6B),高表达中位生存期为25.13月,低表达组为30.1月;而LDLR高表达组的PFS和无复发生存期(recurrence-free survival, RFS)Logrank p值分别为0.003 9和0.004 5,高表达中位生存期分别为16.73、19.73月,低表达组分别为50.3、54.33月,提示在HBV阳性肝癌患者中,LDLR高表达预后较差,且对肝癌的发生有促进作用(PFS: HR=2.01, RFS: HR=2.09)(见图 6C、D)。
| 指标 | 类别 | 数量 |
| 性别 | 女 | 119 |
| 男 | 246 | |
| 病理分期 | i | 170 |
| ii | 84 | |
| iii | 3 | |
| iiia | 63 | |
| iiib | 8 | |
| iiic | 9 | |
| iv | 1 | |
| iva | 1 | |
| ivb | 2 | |
| n/a | 24 | |
| 存活状态 | 存活 | 235 |
| 死亡 | 130 | |
| 年龄(岁) | ≥60 | 197 |
| < 60 | 168 |
|
| 图 5 HMGCR(A)、SREBP-2(B)、LDLR(C)表达与肝癌患者预后的相关性 Fig. 5 Correlation between the expressions of HMGCR (A), SREBP-2 (B), LDLR (C) and prognosis of patients with liver cancer |

|
| A.HMGCR;B.SREBP-2;C.LDLR (PFS);D.LDLR (RFS). 图 6 脂代谢相关基因表达与HBV阳性肝癌患者预后的相关性 Fig. 6 Correlation between lipid metabolism-related gene expressions and prognosis of HBV-positive liver cancer patients |
相较于糖代谢与谷氨酰胺的代谢重编程,脂代谢重编程的研究较少,但近年来其在癌症中的作用也逐渐受到重视。在我国高发肝癌的急、慢性乙肝病毒感染过程中,常伴有代谢调节失常。很多代谢相关的酶就是癌基因与抑癌基因,这些基因的异常活化以及抑癌基因的抑制失活会造成细胞代谢水平以及代谢方式的改变,导致脂代谢重编程。脂代谢重编程涵盖脂质合成、脂质运输、降解等一系列步骤,为肿瘤的生长、分裂和生存提供了所需的ATP和大分子[16]。
胆固醇是细胞膜的结构成分,胆固醇的快速合成是癌细胞得以快速增殖的必要条件,其动态平衡受到以SREBPs为中心的复杂蛋白质网络的严格调控,SREBP-2在肝脏和脂肪组织中表达,优先激活胆固醇的合成和摄取,上调LDLR和PSCK9的表达[17]。HMGCR的活性大小直接影响着胆固醇的合成速度,这种酶通常被LDLR介导的低密度脂蛋白的内化以及氧化的胆固醇抑制[18]。已有研究表明,HMGCR的过表达促进了癌细胞的生长和迁移,而HMGCR敲低则抑制了肿瘤发生。HMGCR表达在胃癌、胶质母细胞瘤和前列腺癌中上调。HMGCR抑制剂已经靶向用于治疗具有耐药性的实体癌和血癌[19]。PSCK9通过降解LDLR,升高了血清LDL-C水平,导致高胆固醇血症[15]。LDLR是血浆源LDL胆固醇结合和内化最重要的受体,且有研究表明,LDLR敲除抑制了HBV病毒的复制,促进了病毒的清除。本研究的实验结果显示,在稳定表达HBV的HepG2.2.15细胞中,脂代谢相关基因HMGCR、SREBP-2以及PSCK9的mRNA表达量显著上调,且在肝细胞癌患者的临床病理结果中相应蛋白表达水平也同步升高,提示HBV感染导致了相应代谢基因的高表达,而这些基因主要参与胆固醇的生物合成与降解,推测HBV的感染造成了脂质代谢的动态紊乱;而LDLR在HepG2.2.15细胞中高表达mRNA,但在HBV阳性肝癌患者组织与对照组中的蛋白表达并无明显差异,推测可能与样本量大小,以及在肝癌的发生过程中,其他因素对LDLR的表达产生了影响,为进一步评估HBV感染与LDLR的关系,本文统计了HBsAg与LDLR的相关关系,结果显示,LDLR的表达与HBsAg的表达呈正相关,提示HBV感染在一定程度上造成了LDLR的紊乱。另外,本研究结果显示,稳定表达HBsAg的Hep3B细胞以及过表达HBsAg的HepG2细胞也导致了类似的实验结果,提示HBsAg是调控脂质代谢酶基因的关键蛋白。
为关联分析脂代谢基因表达对肝癌病人的生存期影响,本研究使用GEPIA数据库分析了365例大样本肝癌患者HMGCR、SREBP-2、LDLR的表达与预后的相关性。研究结果提示,虽然脂代谢相关基因在肝癌组织中的高表达组与不表达/低表达组相比,没有显著性差异,但是有预后变差的趋势,提示脂质代谢的紊乱可能是影响肝癌患者总生存期的危险因素。为进一步探究HBV感染与患者预后的关系,本研究进一步利用Kaplan-Meier Plotter数据库分析了HBV阳性肝癌患者中HMGCR、SREBP-2、LDLR与无进展生存期(PFS)的相关性,以及LDLR与无复发生存期(RFS)的相关性,高表达HMGCR和SREBP-2在HBV阳性肝癌患者中PFS有相对较差的趋势,且二者的高表达对肝癌的发生有促进作用;而LDLR高表达组的PFS和RFS在HBV阳性肝癌患者中预后均较差,且对肝癌的发生有促进作用,提示HBV感染引起的脂质代谢紊乱与肝癌患者的生存期密切相关。
脂质代谢在肝癌的发生过程中占有重要地位,改变脂代谢会影响许多细胞进程,如增殖、迁移和肿瘤的发生。在本研究中,HBV感染介导的脂代谢重编程主要体现在由HBsAg参与调控的脂代谢相关酶数量与活性的升高,使肿瘤细胞的脂代谢异常,从而影响其生长和增殖。部分脂代谢相关基因生存曲线虽然差异不显著,但是其高表达有预后较差的趋势,本文推测可能与样本量有关。在未来的研究中,有必要进一步增加数据集扩大样本量验证其相关性是否有统计学意义。作为近年来新兴的研究热点,肝癌脂代谢重编程的研究逐渐深入,临床上出现了众多靶向脂代谢重编程的治疗方法和药物,如脂代谢相关的各种酶的抑制剂等[20-21]。然而,其影响肿瘤细胞发生、发展的机制仍不清晰,且目前对于胆管癌与混合细胞型肝癌的脂代谢重编程的机制及其影响仍有待进一步探索。肝癌是一种代谢性的疾病,是研究肿瘤脂代谢重编程的绝佳模型。针对肝癌脂代谢水平的分子标记和信号传导的探索,将为靶向药物的开发及其在联合免疫治疗中作用的研究奠定基础,提供靶向药物与常规抗癌药协同作用的可能,从而为肝癌的分子靶向治疗提供新方向。
| [1] |
Wang Y, Wu T, Hu D, Weng X, Wang X, Chen PJ, Luo X, Wang H, Ning Q. Intracellular hepatitis B virus increases hepatic cholesterol deposition in alcoholic fatty liver via hepatitis B core protein[J]. J Lipid Res, 2018, 59(1): 58-68.
[DOI]
|
| [2] |
Wang G, Li J, Bojmar L, Chen H, Li Z, Tobias GC, Hu M, Homan EA, Lucotti S, Zhao F, Posada V, Oxley PR, Cioffi M, Kim HS, Wang H, Lauritzen P, Boudreau N, Shi Z, Burd CE, Zippin JH, Lo JC, Pitt GS, Hernandez J, Zambirinis CP, Hollingsworth MA, Grandgenett PM, Jain M, Batra SK, DiMaio DJ, Grem JL, Klute KA, Trippett TM, Egeblad M, Paul D, Bromberg J, Kelsen D, Rajasekhar VK, Healey JH, Matei IR, Jarnagin WR, Schwartz RE, Zhang H, Lyden D. Tumour extracellular vesicles and particles induce liver metabolic dysfunction[J]. Nature, 2023, 618(7964): 374-382.
[DOI]
|
| [3] |
Yang F, Hilakivi-Clarke L, Shaha A, Wang Y, Wang X, Deng Y, Lai J, Kang N. Metabolic reprogramming and its clinical implication for liver cancer[J]. Hepatology, 2023, 78(5): 1602-1624.
[DOI]
|
| [4] |
Mullen PJ, Yu R, Longo J, Archer MC, Penn LZ. The interplay between cell signalling and the mevalonate pathway in cancer[J]. Nat Rev Cancer, 2016, 16(11): 718-731.
[DOI]
|
| [5] |
Guerra B, Recio C, Aranda-Tavío H, Guerra-Rodríguez M, García-Castellano JM, Fernández-Pérez L. The mevalonate pathway, a metabolic target in cancer therapy[J]. Front Oncol, 2021, 11: 626971.
[DOI]
|
| [6] |
Mollinedo F, Gajate C. Lipid rafts as signaling hubs in cancer cell survival/death and invasion: implications in tumor progression and therapy: thematic review series: biology of lipid rafts[J]. J Lipid Res, 2020, 61(5): 611-635.
[DOI]
|
| [7] |
Halimi H, Farjadian S. Cholesterol: an important actor on the cancer immune scene[J]. Front Immunol, 2022, 13: 1057546.
[DOI]
|
| [8] |
Ding X, Zhang W, Li S, Yang H. The role of cholesterol metabolism in cancer[J]. Am J Cancer Res, 2019, 9(2): 219-227.
[PubMed]
|
| [9] |
Bhardwaj A, Singh H, Trinidad CM, Albarracin CT, Hunt KK, Bedrosian I. The isomiR-140-3p-regulated mevalonic acid pathway as a potential target for prevention of triple negative breast cancer[J]. Breast Cancer Res, 2018, 20(1): 150.
[DOI]
|
| [10] |
Amemiya-Kudo M, Shimano H, Hasty AH, Yahagi N, Yoshikawa T, Matsuzaka T, Okazaki H, Tamura Y, Iizuka Y, Ohashi K, Osuga J, Harada K, Gotoda T, Sato R, Kimura S, Ishibashi S, Yamada N. Transcriptional activities of nuclear SREBP-1a, -1c, and-2 to different target promoters of lipogenic and cholesterogenic genes[J]. J Lipid Res, 2002, 43(8): 1220-1235.
[DOI]
|
| [11] |
Sharpe L J, Brown A J. Controlling cholesterol synthesis beyond 3-hydroxy-3-methylglutaryl-CoA reductase (HMGCR)[J]. J Biol Chem, 2013, 288(26): 18707-18715.
[DOI]
|
| [12] |
Clendening JW, Pandyra A, Li Z, Boutros PC, Martirosyan A, Lehner R, Jurisica I, Trudel S, Penn LZ. Exploiting the mevalonate pathway to distinguish statin-sensitive multiple myeloma[J]. Blood, 2010, 115(23): 4787-4797.
[DOI]
|
| [13] |
Duncan RE, El-Sohemy A, Archer MC. Mevalonate promotes the growth of tumors derived from human cancer cells in vivo and stimulates proliferation in vitro with enhanced cyclin-dependent kinase-2 activity[J]. J Biol Chem, 2004, 279(32): 33079-33084.
[DOI]
|
| [14] |
Calvier L, Herz J, Hansmann G. Interplay of low-density lipoprotein receptors, LRPs, and lipoproteins in pulmonary hypertension[J]. JACC Basic Transl Sci, 2022, 7(2): 164-180.
[PubMed]
|
| [15] |
Wong CC, Wu JL, Ji F, Kang W, Bian X, Chen H, Chan LS, Luk STY, Tong S, Xu J, Zhou Q, Liu D, Su H, Gou H, Cheung AH, To KF, Cai Z, Shay JW, Yu J. The cholesterol uptake regulator PCSK9 promotes and is a therapeutic target in APC/KRAS-mutant colorectal cancer[J]. Nat Commun, 2022, 13(1): 3971.
[DOI]
|
| [16] |
Nomura M, Liu J, Rovira II, Gonzalez-Hurtado E, Lee J, Wolfgang MJ, Finkel T. Fatty acid oxidation in macrophage polarization[J]. Nat Immunol, 2016, 17(3): 216-217.
[DOI]
|
| [17] |
Naito T, Yang H, Koh DHZ, Mahajan D, Lu L, Saheki Y. Regulation of cellular cholesterol distribution via non-vesicular lipid transport at ER-Golgi contact sites[J]. Nat Commun, 2023, 14(1): 5867.
[DOI]
|
| [18] |
Medina MW, Gao F, Ruan W, Rotter JI, Krauss RM. Alternative splicing of 3-hydroxy-3-methylglutaryl coenzyme A reductase is associated with plasma low-density lipoprotein cholesterol response to simvastatin[J]. Circulation, 2008, 118(4): 355-362.
[DOI]
|
| [19] |
Lee JS, Roberts A, Juarez D, Vo TT, Bhatt S, Herzog LO, Mallya S, Bellin RJ, Agarwal SK, Salem AH, Xu T, Jia J, Li L, Hanna JR, Davids MS, Fleischman AG, O'Brien S, Lam LT, Leverson JD, Letai A, Schatz JH, Fruman DA. Statins enhance efficacy of venetoclax in blood cancers[J]. Sci Transl Med, 2018, 10(445): eaaq1240.
[DOI]
|
| [20] |
Liu X, Hartman CL, Li L, Albert CJ, Si F, Gao A, Huang L, Zhao Y, Lin W, Hsueh EC, Shen L, Shao Q, Hoft DF, Ford DA, Peng G. Reprogramming lipid metabolism prevents effector T cell senescence and enhances tumor immunotherapy[J]. Sci Transl Med, 2021, 13(587): eaaz6314.
[DOI]
|
| [21] |
Yang K, Wang X, Song C, He Z, Wang R, Xu Y, Jiang G, Wan Y, Mei J, Mao W. The role of lipid metabolic reprogramming in tumor microenvironment[J]. Theranostics, 2023, 13(6): 1774-1808.
[DOI]
|
 2023, Vol. 18
2023, Vol. 18


