2. 复旦大学附属华山医院宝山院区, 上海 201907
2. Huashan Hospital, Baoshan Campus, Fudan University, Shanghai 201907, China
2019年11月份以来,新型冠状病毒(简称“新冠病毒”)感染在全球的大流行已导致大量患者死亡,严重威胁人类健康,干扰正常的生产生活秩序。随着新冠病毒变异株的不断出现,病毒传播力、疾病的严重程度、现有疫苗的保护效果都在发生变化。自2021年底开始,传播性更强的奥密克戎变异株在全球流行,逐步成为优势变异株,其基本再生数R0值高达8.2,是德尔塔变异株的2.5倍[1]。由于刺突蛋白的变异,奥密克戎变异株可逃避多种新冠疫苗的免疫保护作用,造成疫苗突破性感染[2]。国外的研究显示,虽然接种新冠疫苗对预防奥密克戎变异株感染效果欠佳,但相较于未接种疫苗患者,接种疫苗对预防重症和死亡仍有保护效果[3]。与此同时,相较于阿尔法株和德尔塔株,奥密克戎变异株感染患者需要呼吸支持的强度更低,住院时间更短,疾病严重程度更低。从阿尔法株流行进展到奥密克戎株流行,疫苗接种比例也从11.1%增加到52.1%[4],疾病严重程度的下降与疫苗接种比例的上升不无关系。
2022年3月,上海暴发流行奥密克戎变异株,其中60岁及以上老年患者作为重型/危重型新冠肺炎的高危人群受到了广泛关注。文献报道老年新冠肺炎患者发生吸氧、气管插管和院内死亡的风险高于非老年患者[5]。由于既往的新冠疫苗接种策略未将老年人列为优先人群,此次疫情中老年感染者完成疫苗接种的比例较低,而发生吸氧、气管插管和院内死亡等临床转归也多见于老年患者,提示新冠疫苗接种也可能对中国老年奥密克戎变异株感染者的临床转归和预后造成一定的影响。
复旦大学附属华山医院宝山院区是此次上海新冠疫情暴发的市级定点收治医院之一,重点收治新冠肺炎普通型、重型和合并较重基础疾病的新冠患者,老年人占较大比例。基于本院收治的60岁以上老年新冠肺炎患者队列,本研究分析疫苗接种对60岁及以上老年新冠感染者疾病严重程度、临床结局和预后的影响,旨在为我国未来修订疫苗接种策略、确定疫苗接种的重点人群提供参考。
1 材料与方法 1.1 病例来源样本来源为2022年3月20日—2022年5月6日复旦大学附属华山医院宝山院区收治的奥密克戎变异株感染的60岁以上患者,共1 029例。本研究已取得患者的知情同意并通过复旦大学附属华山医院伦理委员会审批,方案号为KY2022-675。
1.2 纳入与排除标准纳入标准如下。①符合国家卫生健康委发布的《新型冠状病毒肺炎诊疗方案(试行第九版)》[6]中新型冠状病毒肺炎的诊断标准,临床分型为危重型、重型、普通型、轻型患者或无症状感染者。轻症:临床症状轻微,影像学未见肺炎表现。普通型:具有发热和(或)呼吸道症状等新型冠状病毒肺炎相关临床表现,影像学可见肺炎表现。成人重型病例符合下列任一条:出现气促,呼吸率(respiration rate,RR)≥30次/分;静息状态下,吸空气时指氧饱和度≤93%;动脉血氧分压(PaO2)/吸氧浓度(FiO2)≤300 mmHg;临床症状进行性加重,肺部影像学显示24~48 h内病灶明显进展>50%者。危重型病例符合下列任一条:出现呼吸衰竭,且需要机械通气;出现休克;合并其他器官功能衰竭需ICU监护治疗。无症状感染者是具备病原学诊断证据但无主观症状或可临床识别的新型冠状病毒肺炎相关症状和体征的病例。②年龄为60岁及以上。排除标准:新型冠状病毒肺炎疫苗接种史资料缺失的病例。
1.3 研究方法收集60岁及以上新型冠状病毒肺炎确诊病例的临床资料,内容具体如下。①人口学信息:性别、年龄、身高、体重、基础疾病、新冠疫苗接种史;②新型冠状病毒肺炎相关临床症状;③入院后首次实验室检验和辅助检查:血常规、肝功能、肾功能、凝血功能、炎症指标、新冠病毒核酸检测、胸部CT等;④呼吸支持方式(包括鼻导管或面罩吸氧、高流量氧疗或无创通气、有创通气);⑤临床结局:治愈出院或死亡、是否需要呼吸支持、是否出现影像学肺炎表现、核酸转阴时间。核酸转阴的标准定义为连续2次新型冠状病毒核酸检测阴性[采用荧光定量聚合酶链反应(polymerase chain reaction, PCR)方法,Ct界限值低于35,采样时间至少间隔24 h][6]。
根据新冠疫苗接种状态将患者分为未接种疫苗和接种疫苗2组,比较2组间人口学特征、临床症状、实验室指标、临床结局的差异,通过多因素回归分析控制混杂因素,探究疫苗接种状态对老年新冠肺炎患者临床结局的影响。本研究中的临床结局包括核酸转阴时间、经影像学证实的肺炎表现、因病情需要接受任何形式的呼吸支持(包括鼻导管或面罩吸氧、高流量氧疗或无创通气、有创通气)、死亡。分析疫苗保护作用时将接受有创通气或在观察终点死亡的病例合并为一类结局,因为此类患者预后较差且需投入更多医疗救治资源。
为进一步探索新冠疫苗接种对重型/危重型新冠肺炎高危人群临床转归的保护作用,对60~74岁老年人、75岁及以上老年人、合并高血压、糖尿病、心血管疾病、慢性肾脏病等基础疾病的患者进行亚组分析。通过多因素回归分析,了解接种疫苗对亚组人群发生呼吸支持、有创通气或死亡结局的影响。合并慢性肺部疾病、慢性肝脏疾病、肿瘤及免疫功能缺陷等基础疾病的病例数较少,未纳入亚组分析。
1.4 统计学分析计数资料以构成比(%)描述,采用卡方检验或Fisher’s精确概率法进行组间比较。计量资料以均数±标准差(mean±SD)或中位数(4分位间距)[median(IQR=P75-P25)]描述,正态性检验采用Kolmogorov-Smirnov检验。符合正态分布且方差齐性的计量资料采用独立样本T检验进行比较。不符合正态分布的计量资料采用Mann-Whitney U检验。组间核酸转阴时间采用Kaplan-Meier法和Log-rank法进行分析。将具有统计学差异(P<0.05)的新型冠状病毒肺炎患者临床结局影响因素纳入多因素回归分析。
采用多因素logistic回归模型分析疫苗接种状态与临床结局(肺炎、呼吸支持、有创通气或死亡)的相关性,主要自变量为是否接种新冠疫苗,协变量包括年龄(60~74岁和75岁及以上)、性别、高血压、糖尿病、心血管疾病、慢性肾脏病、肿瘤、慢性肺病、合并基础疾病数量(0、1种、2种及以上)、淋巴细胞绝对值、C反应蛋白、D-二聚体。采用Cox回归模型分析疫苗接种状态与核酸转阴时间的相关性,主要自变量为是否接种新冠疫苗,协变量为年龄(60~74岁和75岁及以上)、性别、吸烟史、合并基础疾病数量(0、1种、2种及以上)、高血压、糖尿病、心血管疾病、慢性肾脏病、淋巴细胞绝对值、C反应蛋白、D-二聚体。
数据统计和分析使用SPSS 20.0软件,图表使用GraphPad Prism 9.0软件和Microsoft Excel 2020绘制。P<0.05代表差异具有统计学意义。
2 结果分析 2.1 老年新冠肺炎患者的基本特征纳入1 029例60岁及以上的新型冠状病毒肺炎病例中,未接种疫苗的患者643例(占62.49%),接种疫苗的患者386例(占37.51%)。未接种疫苗的病例中,年龄在75岁及以上的有272例(42.3%),显著高于接种疫苗组(65例,16.8%),组间年龄分层差异具有统计学意义(P<0.001)。未接种疫苗病例的BMI中位数为22.49,接种疫苗组BMI中位数为23.44,差异具有统计学意义(P=0.001)。两组病例在性别构成(P=0.881)和吸烟史(P=0.367)方面无统计学差异。未接种疫苗组病例中合并至少一种基础疾病的为483例(75.1%),在接种疫苗组中为216例(55.9%)。基础疾病包括高血压、糖尿病、心血管疾病、慢性肾脏病、血液透析、慢性肝病、慢性肺病、免疫抑制状态及肿瘤。其中,未接种疫苗组病例合并糖尿病、心血管疾病和慢性肾脏病(包括血液透析)的比例显著高于接种疫苗的患者(P<0.001)。两组病例的基本特征比较如表 1所示。
| 项目 | n(%) | P值 | ||
| 未接种疫苗(n=643) | 接种疫苗(n=386) | |||
| 年龄(岁) | 60~74 | 371(57.7) | 321(83.2) | < 0.001 |
| ≥75 | 272(42.3) | 65(16.8) | ||
| 性别 | 男性 | 323(50.2) | 188(48.7) | 0.881 |
| 女性 | 320(49.8) | 198(51.3) | ||
| BMI [M, (IQR)] | 22.49(4.77) | 23.44(4.34) | 0.001 | |
| 吸烟史 | 34(5.3) | 24(6.2) | 0.531 | |
| 基础疾病 | 高血压 | 349(54.3) | 167(43.3) | 0.531 |
| 糖尿病 | 175(27.2) | 54(14.0) | < 0.001 | |
| 心血管疾病 | 167(26.0) | 42(10.9) | < 0.001 | |
| 慢性肾脏病 | 94(14.6) | 7(1.8) | < 0.001 | |
| 慢性肝病 | 18(2.8) | 7(1.8) | 0.320 | |
| 慢性肺病 | 40(6.2) | 0(0.0) | 0.294 | |
| 免疫抑制状态 | 4(0.6) | 7(1.8) | 0.656 | |
| 肿瘤 | 44(6.8) | 18(4.7) | 0.221 | |
| 合并基础疾病数量(种) | 0 | 160(24.9) | 170(44.0) | < 0.001 |
| 1 | 199(31.0) | 134(34.7) | ||
| ≥2 | 284(44.1) | 82(21.2) | ||
| 注:M,中位数;IQR,四分位距。 | ||||
入院后首次血常规提示,未接种疫苗的患者外周血淋巴细胞绝对值降低幅度较接种疫苗的患者更为显著(P<0.001);未接种疫苗患者入院后C反应蛋白、D-二聚体显著高于接种疫苗的患者(P<0.001)。此外,未接种疫苗患者的谷丙转氨酶、肌酐、肌钙蛋白、脑钠肽前体等指标显著高于接种疫苗的患者(P<0.001),提示未接种疫苗组中合并基础心肺、肝肾疾病的患者比例较高。入院后的首次病毒核酸检测中,未接种疫苗组和接种疫苗组病例的N基因检测Ct值分别为21.59±4.65、21.67±4.92,ORFlab基因Ct值分别为24.60±4.53、25.11±4.55,两组间新冠病毒核酸Ct值无统计学差异(P>0.05)。入院后胸部影像学检查提示,未接种疫苗的患者中51.6%(332例)有病毒性肺炎表现,该比例高于接种疫苗组(101例,26.2%),组间比较具有显著的统计学差异(P<0.001)。两组病例入院后首次实验室检验指标和病毒核酸检测比较结果如表 2所示。
| 项目 | 未接种疫苗 | 接种疫苗 | P值 |
| 白细胞计数(×109/L) | 5.97±4.61 | 5.89±2.96 | 0.091 |
| 淋巴细胞计数(×109/L) | 1.21±0.59 | 1.60±0.67 | < 0.001 |
| C反应蛋白(mg/L) | 31.71±46.81 | 17.42±27.72 | < 0.001 |
| 降钙素原(μg/L) | 1.67±8.72 | 0.13±0.58 | < 0.001 |
| D二聚体(mg/L) | 1.85±4.74 | 1.02±1.86 | < 0.001 |
| 谷丙转氨酶(U/L) | 25.1±56.0 | 24.14±42.61 | 0.002 |
| 谷草转氨酶(U/L) | 27.6±36.5 | 24.11±42.49 | 0.286 |
| 总胆红素(μmol/L) | 10.3±17.2 | 10.14±6.06 | 0.085 |
| 肌酐(μmol/L) | 232.0±375.8 | 79.20±59.30 | < 0.001 |
| eGFR | 61.2±31.7 | 81.63±16.56 | < 0.001 |
| 肌钙蛋白(ng/mL) | 0.071±0.462 | 0.012±0.013 | < 0.001 |
| 脑钠肽前体(pg/mL) | 3 607.4±8681.9 | 281.43±1 270.26 | < 0.001 |
| 乳酸脱氢酶(U/L) | 224.1±95.2 | 213.25±148.49 | 0.149 |
| N基因Ct值 | 21.59±4.65 | 21.67±4.92 | 0.854 |
| ORFlab基因Ct值 | 24.60±4.53 | 25.11±4.55 | 0.169 |
| 病毒性肺炎表现n(%) | 332(51.6) | 101(26.2) | < 0.001 |
| 注:eGFR为估算肾小球滤过率;连续型变量以均数±标准差(mean±SD)表示,计数资料以构成比(%)表示。 | |||
在1 029例老年新型冠状病毒肺炎病例中,无主观症状的患者有624例(60.6%),其中409例(63.6%)为未接种疫苗者,215例(55.7%)为接种疫苗患者(P=0.012)。常见的首发症状包括咳嗽(302例,29.3%)、咳痰(211例,20.5%)、发热(130例,12.6%)、乏力(132例,12.8%),其次为肌肉酸痛(84例,8.2%)、头晕头痛(12例,1.2%)、胸闷气喘(13例,1.3%)、味觉异常(11例,1.1%),而咽痛(5例,0.5%)、鼻塞流涕(3例,0.3%)、嗅觉异常(5例,0.5%)、腹泻(2例,0.2%)、恶心呕吐(5例,0.5%)、纳差(2例,0.2%)、寒战(1例,0.1%)等症状出现比例较低。在接种疫苗的患者中,以发热、咳嗽、咽痛为首发症状的比例高于未接种疫苗者(P<0.05)。其余首发症状在两组间无显著统计学差异(P>0.05)。两组病例首发症状比较如表 3所示。
| 临床表现 | n(%) | P值 | ||
| 总计(n=1 029) | 未接种疫苗(n=643) | 接种疫苗(n=386) | ||
| 无症状 | 624(60.6) | 409(63.6) | 215(55.7) | 0.012 |
| 发热 | 130(12.6) | 70(10.9) | 60(15.5) | 0.029 |
| 乏力 | 132(12.8) | 87(13.5) | 45(11.7) | 0.385 |
| 咳嗽 | 302(29.3) | 172(26.7) | 130(33.7) | 0.018 |
| 咳痰 | 211(20.5) | 126(19.6) | 85(22.0) | 0.351 |
| 咽痛 | 5(0.5) | 0(0.0) | 5(1.3) | 0.007a |
| 鼻塞流涕 | 3(0.3) | 1(0.2) | 2(0.2) | 0.560a |
| 肌肉酸痛 | 84(8.2) | 48(7.5) | 36(9.3) | 0.291 |
| 恶心呕吐 | 5(0.5) | 3(0.5) | 2(0.5) | 1.000a |
| 头晕头痛 | 12(1.2) | 6(0.9) | 6(1.6) | 0.382a |
| 胸闷气喘 | 13(1.3) | 6(0.9) | 7(1.8) | 0.254a |
| 味觉异常 | 11(1.1) | 8(1.2) | 3(0.8) | 0.550a |
| 嗅觉异常 | 5(0.5) | 4(0.6) | 1(0.3) | 0.656a |
| 腹泻 | 2(0.2) | 2(0.3) | 0(0.0) | 0.531a |
| 纳差 | 2(0.2) | 1(0.2) | 1(0.3) | 1.000a |
| 寒战 | 1(0.1) | 0(0.0) | 1(0.3) | 0.375a |
| 注:a采用Fisher’s精确概率检验。 | ||||
1 029例60岁及以上的新型冠状病毒肺炎病例中,核酸转阴时间中位数为15天,309例(30.03%)接受鼻导管或面罩吸氧,29例(2.82%)接受高流量氧疗或无创通气,33例(3.21%)接受有创通气,24例(2.33%)死亡,须接受任一形式的呼吸支持共314例(30.52%),43例(4.2%)在病程中接受有创通气或最终死亡。
未接种疫苗的老年患者核酸转阴时间中位数为18天,接种疫苗者核酸转阴时间中位数为12天。未接种疫苗病例的核酸转阴时间长于接种疫苗的病例,且差异具有统计学意义(P<0.001)。上述结果提示,未接种疫苗的老年患者更可能出现新冠病毒核酸转阴时间的延长。两组病例核酸转阴时间比较如图 1所示。
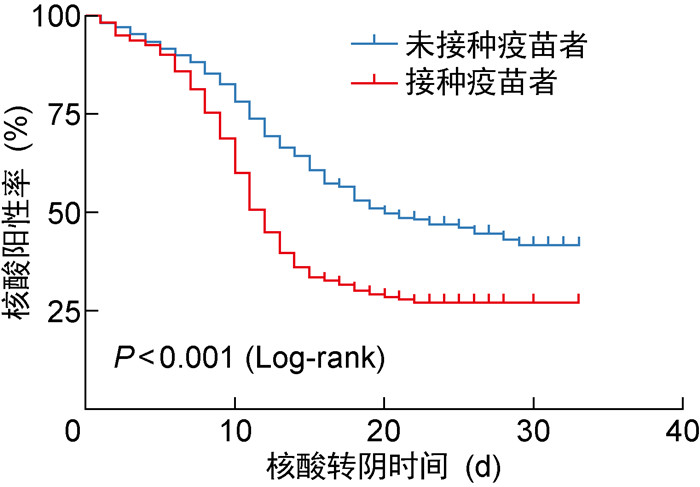
|
| 注:观察时间截至2022年5月10日,截至该日核酸未转阴者为删失病例。 图 1 不同疫苗接种状态的老年新冠肺炎病例核酸转阴时间 Fig. 1 Viral shedding time in elderly patients with COVID-19 stratified by vaccination status |
在未接种疫苗的老年患者中,257例(40.0%)在病程中须接受鼻导管或面罩吸氧治疗,而接种疫苗患者中有52例(13.5%),差异具有统计学意义(P<0.001)。4.2%的未接种疫苗患者(27例)接受高流量氧疗或无创通气支持,该比例显著高于接种疫苗组(P=0.001)。未接种疫苗患者中接受有创通气支持的有31例(4.8%),接种疫苗患者中有2例(0.5%)。24例死亡病例中,23例为未接种疫苗患者,1例为接种疫苗患者(P=0.001)。两组患者发生有创通气或死亡临床结局的差异具有统计学意义(P<0.05)。上述结果提示,在老年患者中,疫苗接种状态与新型冠状病毒肺炎病程中呼吸支持结局、有创通气或死亡结局的发生相关。两组病例的临床结局比较如表 4所示。
| 临床结局 | n(%) | P值 | ||
| 总计(n=1 029) | 未接种疫苗(n=643) | 接种疫苗(n=386) | ||
| 核酸转阴时间[M(IQR)] | 15.0(6.0) | 18.0(7.0) | 12.0(5.0) | < 0.001 |
| 鼻导管或面罩吸氧 | 309(30.03) | 257(40.0) | 52(13.5) | < 0.001 |
| 高流量氧疗或无创通气 | 29(2.82) | 27(4.2) | 2(0.5) | 0.001 |
| 有创通气 | 33(3.21) | 31(4.8) | 2(0.5) | < 0.001 |
| 呼吸支持 | 314(30.52) | 262(40.7) | 52(13.5) | < 0.001 |
| 死亡 | 24(2.33) | 23(3.6) | 1(0.3) | 0.001 |
| 有创通气或死亡 | 43(4.2) | 40(6.2) | 3(0.7) | < 0.001 |
| 注:M,中位数;IQR,4分位距;呼吸支持包括鼻导管吸氧或面罩吸氧、高流量氧疗、无创通气、有创通气。 | ||||
为探究新冠疫苗接种状态是否为老年新型冠状病毒肺炎临床结局的影响因素,将性别、年龄、合并基础疾病数量等混杂因素纳入多因素回归分析。校正可能的混杂因素后,接种新冠疫苗是60岁及以上的新型冠状病毒肺炎患者发生核酸转阴、影像学证实的病毒性肺炎表现、呼吸支持、有创通气或死亡结局的独立保护因素(P<0.05)。
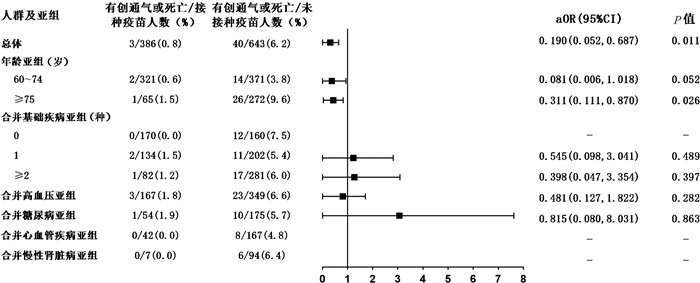
多因素回归分析提示,接种新冠疫苗与老年新型冠状病毒肺炎患者核酸转阴相关[aHR=1.594,95%CI (1.259, 2.017),P<0.001](见图 2)。接种新冠疫苗的老年患者出现影像学肺炎表现的风险是未接种者的0.501倍[aOR=0.501,95%CI (0.370, 0.678),P<0.001](见图 3)。对呼吸支持、有创通气或死亡结局进行多因素分析,接种新冠疫苗的老年患者在病程中需要呼吸支持的风险显著低于未接种疫苗患者[aOR=0.336,95%CI(0.232, 0.487),P<0.001](见图 4),接种疫苗者发生有创通气或死亡结局的风险亦较未接种者明显降低[aOR: 0.190,95%CI(0.052, 0.687),P=0.011](见图 5)。上述结果提示,接种新冠疫苗对老年新型冠状病毒肺炎患者的预后具有保护作用。
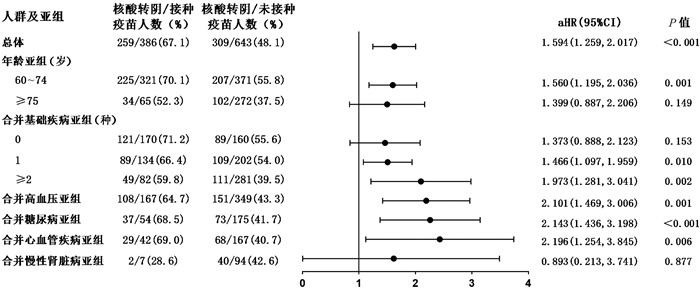
|
| 注:aHR,校正后的风险比;95%CI为95%置信区间。 图 2 接种疫苗对老年患者核酸转阴的保护作用 Fig. 2 Protection of vaccination against prolonged viral shedding in elderly patients with COVID-19 and in risk-group |
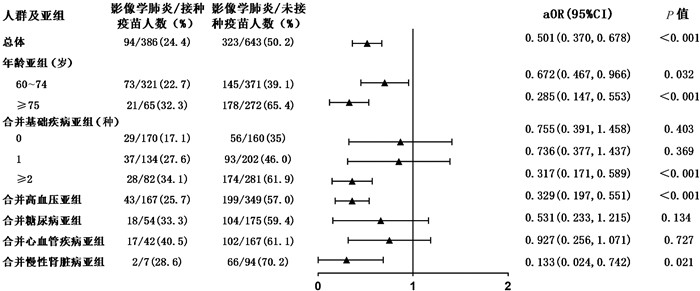
|
| 注:aOR,校正后的优势比;95%CI为95%置信区间。 图 3 接种疫苗对老年患者发生影像学肺炎结局的保护作用 Fig. 3 Protection of vaccination against progression to pneumonia in elderly patients with COVID-19 and in risk-group |
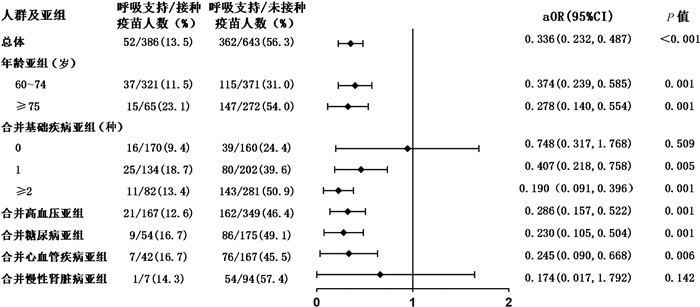
|
| 注:aOR,校正后的优势比;95%CI为95%置信区间;呼吸支持包括鼻导管或面罩吸氧、高流量氧疗或无创通气、有创通气。 图 4 接种疫苗对老年患者接受呼吸支持的保护作用 Fig. 4 Protection of vaccination against progression to respiratory support in elderly patients with COVID-19 and in risk-group |
|
| 注:aOR,校正后的优势比;95%CI为95%置信区间。 图 5 接种疫苗对老年患者接受有创通气或死亡结局的保护作用 Fig. 5 Protection of vaccination against progression to invasive mechanical ventilation or death in elderly patients with COVID-19 and in risk-group |
60岁以上、合并高血压、糖尿病、心血管疾病、慢性肾脏病等基础疾病是重型/危重型新型冠状病毒肺炎的高危因素,对合并上述危险因素的患者进行亚组分析。多因素回归分析结果提示,在60~74岁患者[aHR: 1.560,95%CI (1.195, 2.036),P=0.001]、合并基础疾病[合并1种基础疾病aHR: 1.466,95%CI (1.097, 1.959),P=0.010;合并2种及以上基础疾病aHR: 1.973,95%CI (1.281, 3.041),P=0.002]、高血压[aHR: 2.101,95%CI(1.469, 3.006),P=0.001]、糖尿病[aHR: 2.143,95%CI(1.436, 3.198),P<0.001]、心血管疾病[aHR: 2.196,95%CI (1.254, 3.845),P=0.006]的亚组中,接种疫苗仍是核酸转阴的保护因素。
对影像学肺炎结局进行多因素分析,结果提示疫苗接种对60~74岁亚组[aOR: 0.672,95%CI (0.467, 0.966),P=0.032]、75岁以上亚组[aOR: 0.285,95%CI (0.147, 0.553),P<0.001]、合并2种及以上基础疾病的亚组[aOR: 0.317,95%CI (0.171, 0.589),P<0.001]以及合并高血压[aOR: 0.329,95%CI (0.197, 0.551),P<0.001]或慢性肾脏病[aOR: 0.133,95%CI (0.024, 0.742),P=0.021]的亚组人群中影像学肺炎结局的发生仍有明显的保护作用。
对发生呼吸支持的患者进行亚组分析,接种疫苗降低了60~74岁[aOR: 0.374,95%CI (0.239, 0.585),P=0.001]、75岁及以上[aOR: 0.278,95%CI (0.140, 0.554),P=0.001]、合并基础疾病[合并1种基础疾病aOR: 0.407,95%CI (0.218, 0.758),P=0.005;合并2种及以上aOR: 0.190,95%CI (0.091, 0.396),P=0.001]、合并高血压[aOR: 0.286,95%CI (0.157, 0.522),P=0.001]、合并糖尿病[aOR: 0.230,95%CI (0.105, 0.504),P=0.001]、合并心血管疾病[aOR: 0.245,95%CI (0.090, 0.668),P=0.006]的亚组人群发生呼吸支持结局的风险。在发生有创通气或死亡结局的患者中,接种疫苗对75岁及以上的亚组人群具有保护作用[aOR: 0.311,95%CI (0.111, 0.870),P=0.026]。
3 讨论接种新冠疫苗能有效降低重型新冠肺炎的发生率和死亡率[7],然而老年患者尚未成为我国目前新冠疫苗接种计划的主要优先人群。因此,本研究对老年奥密克戎变异株感染者的临床结局、预后进行观察,以探究新冠疫苗接种对该群体的保护作用,为未来的老年患者疫苗接种策略提供证据支持。研究结果显示,在复旦大学附属华山医院宝山院区收治的1 029例60岁及以上新冠肺炎患者中,未接种疫苗的比例高达62.49%,其中多为年龄75岁及以上、合并至少1种慢性基础疾病的患者。合并基础疾病是新冠肺炎进展至重型或死亡的危险因素之一[8]。此外,实验室指标提示未接种疫苗患者的淋巴细胞绝对值明显低于接种疫苗者,且未接种疫苗患者的D-二聚体、C反应蛋白明显升高。研究表明淋巴细胞下降、C反应蛋白升高和D-二聚体升高是新冠肺炎重型化和死亡的早期预警指标[9-11]。以上结果均提示,未接种疫苗的老年患者存在基础疾病多、炎症指标高等进展到重型的多个危险因素,与不良预后相关,是新冠奥密克戎变异株感染后的脆弱人群。
为了控制混杂因素的影响,本研究采用多因素回归方法分析接种疫苗对老年新冠肺炎患者的保护作用。研究结果表明,接种新冠疫苗能降低60岁及以上患者发生肺炎(影像学证实)、呼吸支持、有创通气或死亡的风险,提示接种疫苗有助于延缓老年奥密克戎变异株感染者的病情进展,预防重症和死亡的发生。这与国内外对疫苗保护力的研究结论一致。既往研究已表明,接种疫苗对阿尔法、德尔塔及奥密克戎变异株感染引起的重症和死亡均有保护作用[3]。国内研究者亦发现,全程接种和接种加强针均可降低60岁以上德尔塔或奥密克戎变异株感染者发生重型新冠肺炎的风险[12]。此外,Ma等[13]发现我国使用的灭活疫苗和腺病毒载体疫苗对重型患者的保护力无明显差异。但由于条件所限,本研究未对不同疫苗类型进行分析比较。
因老年患者常合并1种或多种基础疾病,为进一步探索疫苗接种对合并基础疾病老年患者的保护作用,在尽可能排除不同基础疾病情况对预后的影响的情况下,本研究分析疫苗对预后影响时,对合并疾病数量及合并高血压、糖尿病、心血管疾病和慢性肾脏病的老年患者进行亚组分析。研究表明,在合并多种基础疾病的患者中,接种疫苗能够降低新冠病毒感染导致入院和重症的风险[14]。亚组分析提示,接种新冠疫苗在合并高血压或慢性肾脏病、合并2种及以上基础疾病的亚组患者中仍有保护作用。对呼吸支持结局的亚组分析结果表明,新冠疫苗对老年患者的保护作用在合并高血压、糖尿病和心血管疾病的亚组人群中仍然显著,且合并基础疾病的数量越多,疫苗保护作用更明显。此外,尽管研究表明慢性肾脏病是引起重症和死亡的高危因素[15],本研究中疫苗对合并慢性肾脏病的老年患者发生呼吸支持结局的保护作用并不显著。这可能是由于慢性肾脏病患者接种新冠疫苗的例数较少,仅有7例。此外,对于有创通气或死亡结局的亚组分析显示,疫苗在75岁及以上人群中仍有保护力,在其他亚组人群中未见显著的保护作用。不排除因本研究中发生有创通气或死亡结局的患者数量较少,暂不足以证明具有统计学意义的差异。
对奥密克戎感染者核酸转阴时间的多因素分析结果表明,接种新冠疫苗能够促进60岁及以上患者病毒核酸转阴,且在合并高血压、糖尿病、心血管疾病的亚组和合并1种及以上基础疾病的亚组群体中仍有保护作用。研究表明,疫苗诱导产生的中和抗体可通过激活补体、吞噬细胞和自然杀伤细胞促进机体清除病毒[16]。但中和性抗体的保护力随时间逐渐减退。Kowk等[17]报道接种两剂新冠灭活疫苗后,健康受试者血液中和性抗体在4月后降至临界值以下。接种灭活疫苗加强针可提高对新冠病毒及其变异株(包括阿尔法、贝尔塔、德尔塔和奥密克戎)的中和抗体滴度,增强机体的免疫反应[18]。本研究结果初步提示了接种疫苗可能促进老年患者核酸转阴和病毒清除,然囿于研究条件,本研究未追溯患者完成全程接种及加强针接种的时间,因此灭活疫苗对病毒核酸转阴的作用仍须进一步探索和证实。
本研究为基于单中心的回顾性队列,有一定的局限性。本研究的纳入对象为市级定点医院收治的新冠患者,存在选择偏倚。其次,本研究将纳入对象根据疫苗接种状态分为接种与未接种2组,由于接种疫苗的例数相对较少,未区分是否接种加强针,暂未追溯患者接种新冠疫苗的具体类型及接种时间。未来仍须扩大样本量,进行前瞻性研究,以进一步探索疫苗接种及疫苗类型、接种剂次、接种时间对高危人群的保护作用。
本研究结果显示,未接种疫苗的患者多为75岁及以上的高龄患者,合并慢性基础疾病的比例较高,该群体并非当前我国新冠疫苗的重点接种人群。尽管已有研究报道奥密克戎变异株引起重症和死亡的风险低于其他已知变异株[19-20],但是老年患者仍然是进展至重症的脆弱人群[21]。在此次上海奥密克戎变异株流行中,接种疫苗能有效降低老年患者发生呼吸支持或死亡的风险,促进核酸转阴,提示应重视新冠疫苗在60岁及以上的老年人群中的接种,尤其是合并慢性基础疾病的老年患者。因此,完善新冠疫苗的接种策略,在高危人群中推广疫苗的接种, 尤其是60岁以上的老年人群,对延缓疾病进展和降低新冠感染人群的重症率、病死率有积极意义。
| [1] |
Liu Y, Rocklöv J. The effective reproductive number of the Omicron variant of SARS-CoV-2 is several times relative to Delta[J]. J Travel Med, 2022, 29(3): taac037.
[DOI]
|
| [2] |
Dejnirattisai W, Huo J, Zhou D, Zahradník J, Supasa P, Liu C, Duyvesteyn HME, Ginn HM, Mentzer AJ, Tuekprakhon A, Nutalai R, Wang B, Dijokaite A, Khan S, Avinoam O, Bahar M, Skelly D, Adele S, Johnson SA, Amini A, Ritter TG, Mason C, Dold C, Pan D, Assadi S, Bellass A, Omo-Dare N, Koeckerling D, Flaxman A, Jenkin D, Aley PK, Voysey M, Costa Clemens SA, Naveca FG, Nascimento V, Nascimento F, Fernandes da Costa C, Resende PC, Pauvolid-Correa A, Siqueira MM, Baillie V, Serafin N, Kwatra G, Da Silva K, Madhi SA, Nunes MC, Malik T, Openshaw PJM, Baillie JK, Semple MG, Townsend AR, Huang KA, Tan TK, Carroll MW, Klenerman P, Barnes E, Dunachie SJ, Constantinides B, Webster H, Crook D, Pollard AJ, Lambe T, OPTIC Consortium; ISARIC4C Consortium, Paterson NG, Williams MA, Hall DR, Fry EE, Mongkolsapaya J, Ren J, Schreiber G, Stuart DI, Screaton GR. SARS-CoV-2 Omicron-B.1.1.529 leads to widespread escape from neutralizing antibody responses[J]. Cell, 2022, 185(3): 467-484..
[PubMed]
|
| [3] |
Lauring AS, Tenforde MW, Chappell JD, Gaglani M, Ginde AA, McNeal T, Ghamande S, Douin DJ, Talbot HK, Casey JD, Mohr NM, Zepeski A, Shapiro NI, Gibbs KW, Files DC, Hager DN, Shehu A, Prekker ME, Erickson HL, Exline MC, Gong MN, Mohamed A, Johnson NJ, Srinivasan V, Steingrub JS, Peltan ID, Brown SM, Martin ET, Monto AS, Khan A, Hough CL, Busse LW, Ten Lohuis CC, Duggal A, Wilson JG, Gordon AJ, Qadir N, Chang SY, Mallow C, Rivas C, Babcock HM, Kwon JH, Halasa N, Grijalva CG, Rice TW, Stubblefield WB, Baughman A, Womack KN, Rhoads JP, Lindsell CJ, Hart KW, Zhu Y, Adams K, Schrag SJ, Olson SM, Kobayashi M, Verani JR, Patel MM, Self WH, Influenza and Other Viruses in the Acutely Ill (IVY) Network. Clinical severity of, and effectiveness of mRNA vaccines against, covid-19 from omicron, delta, and alpha SARS-CoV-2 variants in the United States: prospective observational study[J]. BMJ, 2022, 376: e069761.
[DOI]
|
| [4] |
Christensen PA, Olsen RJ, Long SW, Snehal R, Davis JJ, Ojeda Saavedra M, Reppond K, Shyer MN, Cambric J, Gadd R, Thakur RM, Batajoo A, Mangham R, Pena S, Trinh T, Kinskey JC, Williams G, Olson R, Gollihar J, Musser JM. Signals of significantly increased vaccine breakthrough, decreased hospitalization rates, and less severe disease in patients with coronavirus disease 2019 caused by the Omicron Variant of severe acute respiratory syndrome coronavirus 2 in Houston, Texas[J]. Am J Pathol, 2022, 192(4): 642-652.
[DOI]
|
| [5] |
Palaiodimos L, Kokkinidis DG, Li W, Karamanis D, Ognibene J, Arora S, Southern WN, Mantzoros CS. Severe obesity, increasing age and male sex are independently associated with worse in-hospital outcomes, and higher in-hospital mortality, in a cohort of patients with COVID-19 in the Bronx, New York[J]. Metabolism, 2020, 108: 154262.
[DOI]
|
| [6] |
国家中医药管理局办公室, 国家卫生健康委员会办公厅. 新型冠状病毒肺炎诊疗方案(试行第九版)[EB/OL]. (2020-03-14)[2022-05-20]. http://www.nhc.gov.cn/yzygj/s7653p/202203/b74ade1ba4494583805a3d2e40093d88/files/ef09aa4070244620b010951b088b8a27.pdf.
|
| [7] |
Lopez Bernal J, Andrews N, Gower C, Robertson C, Stowe J, Tessier E, Simmons R, Cottrell S, Roberts R, O'Doherty M, Brown K, Cameron C, Stockton D, McMenamin J, Ramsay M. Effectiveness of the Pfizer-BioNTech and Oxford-AstraZeneca vaccines on covid-19 related symptoms, hospital admissions, and mortality in older adults in England: test negative case-control study[J]. BMJ, 2021, 373.
[DOI]
|
| [8] |
Gude-Sampedro F, Fernández-Merino C, Ferreiro L, Lado-Baleato Ó, Espasandín-Domínguez J, Hervada X, Cadarso CM, Valdés L. Development and validation of a prognostic model based on comorbidities to predict COVID-19 severity: a population-based study[J]. Int J Epidemiol, 2021, 50(1): 64-74.
[DOI]
|
| [9] |
Liu Y, Du X, Chen J, Jin Y, Peng L, Wang HHX, Luo M, Chen L, Zhao Y. Neutrophil-to-lymphocyte ratio as an independent risk factor for mortality in hospitalized patients with COVID-19[J]. Int J Epidemiol, 2021, 50(1): 64-74.
[DOI]
|
| [10] |
Smilowitz NR, Kunichoff D, Garshick M, Shah B, Pillinger M, Hochman JS, Berger JS. C-reactive protein and clinical outcomes in patients with COVID-19[J]. Eur Heart J, 2021, 42(23): 2270-2279.
[DOI]
|
| [11] |
Zhang L, Yan X, Fan Q, Liu H, Liu X, Liu Z, Zhang Z. D-dimer levels on admission to predict in-hospital mortality in patients with Covid-19[J]. J Thromb Haemost, 2020, 18(6): 1324-1329.
[DOI]
|
| [12] |
Li M, Liu Q, Wu D, Tang L, Wang X, Yan T, An Z, Yin Z, Gao GF, Wang F, Zheng H. Association of COVID-19 vaccination and clinical severity of patients infected with Delta or Omicron variants-China, May 21, 2021-February 28, 2022[J]. China CDC Wkly, 2022, 4(14): 293-297.
[DOI]
|
| [13] |
Ma C, Sun W, Tang T, Jia M, Liu Y, Wan Y, Han J, Rodewald L, Li J, Song Y, Wang Y, Wu D, Wang F, Zheng H, Tang L, Gao GF, Yin Z, An Z. Effectiveness of adenovirus type 5 vectored and inactivated COVID-19 vaccines against symptomatic COVID-19, COVID-19 pneumonia, and severe COVID-19 caused by the B.1.617.2 (Delta) variant: evidence from an outbreak in Yunnan, China, 2021[J]. Vaccine, 2022, 40(20): 2869-2874.
[DOI]
|
| [14] |
Barda N, Dagan N, Cohen C, Hernán MA, Lipsitch M, Kohane IS, Reis BY, Balicer RD. Effectiveness of a third dose of the BNT162b2 mRNA COVID-19 vaccine for preventing severe outcomes in Israel: an observational study[J]. Lancet, 2021, 398(10316): 2093-2100.
[DOI]
|
| [15] |
ERA-EDTA Council, ERACODA Working Group. Chronic kidney disease is a key risk factor for severe COVID-19: a call to action by the ERA-EDTA[J]. Nephrol Dial Transplant, 2021, 36(1): 87-94.
[PubMed]
|
| [16] |
Barrett JR, Belij-Rammerstorfer S, Dold C, Ewer KJ, Folegatti PM, Gilbride C, Halkerston R, Hill J, Jenkin D, Stockdale L, Verheul MK, Aley PK, Angus B, Bellamy D, Berrie E, Bibi S, Bittaye M, Carroll MW, Cavell B, Clutterbuck EA, Edwards N, Flaxman A, Fuskova M, Gorringe A, Hallis B, Kerridge S, Lawrie AM, Linder A, Liu X, Madhavan M, Makinson R, Mellors J, Minassian A, Moore M, Mujadidi Y, Plested E, Poulton I, Ramasamy MN, Robinson H, Rollier CS, Song R, Snape MD, Tarrant R, Taylor S, Thomas KM, Voysey M, Watson MEE, Wright D, Douglas AD, Green CM, Hill AVS, Lambe T, Gilbert S, Pollard AJ, Oxford COVID Vaccine Trial Group. Phase 1/2 trial of SARS-CoV-2 vaccine ChAdOx1 nCoV-19 with a booster dose induces multifunctional antibody responses[J]. Nat Med, 2021, 27(2): 279-288.
[PubMed]
|
| [17] |
Kwok SL, Cheng SM, Leung JN, Leung K, Lee CK, Peiris JM, Wu JT. Waning antibody levels after COVID-19 vaccination with mRNA Comirnaty and inactivated CoronaVac vaccines in blood donors, Hong Kong, April 2020 to October 2021[J]. Euro Surveill, 2022, 27(2): 2101197.
[DOI]
|
| [18] |
Deshpande GR, Yadav PD, Abraham P, Nyayanit DA, Sapkal GN, Shete AM, Gupta N, Vadrevu KM, Ella R, Panda S, Bhargava B. Booster dose of the inactivated COVID-19 vaccine BBV152 (Covaxin) enhances the neutralizing antibody response against Alpha, Beta, Delta and Omicron variants of concern[J]. J Travel Med, 2022, 29(3): taac039.
[DOI]
|
| [19] |
Ulloa AC, Buchan SA, Daneman N, Brown KA. Estimates of SARS-CoV-2 Omicron variant severity in Ontario, Canada[J]. JAMA, 2022, 327(13): 1286-1288.
|
| [20] |
Wrenn JO, Pakala SB, Vestal G, Shilts MH, Brown HM, Bowen SM, Strickland BA, Williams T, Mallal SA, Jones ID, Schmitz JE, Self WH, Das SR. COVID-19 severity from Omicron and Delta SARS-CoV-2 variants[J]. Influenza Other Respir Viruses, 2022, 10.
[DOI]
|
| [21] |
Kahn F, Bonander C, Moghaddassi M, Rasmussen M, Malmqvist U, Inghammar M, Björk J. Risk of severe COVID-19 from the Delta and Omicron variants in relation to vaccination status, sex, age and comorbidities-surveillance results from southern Sweden, July 2021 to January 2022[J]. Euro Surveill, 2022, 27(9): 2200121.
[DOI]
|
 2022, Vol. 17
2022, Vol. 17


