2. 军事科学院军事医学研究院微生物流行病研究所病原微生物生物安全国家重点实验室, 北京 100071
2. State Key Laboratory of Pathogens and Biosecurity, Institute of Microbiology and Epidemiology, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100071, China
鼠疫是由鼠疫耶尔森菌(Yersinia pestis)引起的自然疫源性烈性传染病,在《中华人民共和国传染病防治法》中被列为甲类传染病。国家卫生健康委员会《人间传染的病原微生物名录》根据其危害程度,将鼠疫耶尔森菌列为第二类高致病性微生物。鼠疫耶尔森菌主要在啮齿类动物中引起原发性感染,经鼠蚤或直接接触及吸入气溶胶传播给人,引起的疾病主要包括腺鼠疫、肺鼠疫和败血型鼠疫3种类型,其中肺鼠疫病死率较高[1]。人类历史上曾发生过3次鼠疫大流行,造成上亿人死亡。时至今日,很多地区如非洲、亚洲、美洲仍将鼠疫视为可能会死灰复燃的烈性传染性疾病之一[2-4]。
根据现行的《鼠疫诊断标准(WS279-2008)》规定,鼠疫耶尔森菌F1抗体检测是鼠疫诊断过程中的重要实验室检查项目。目前有多种鼠疫耶尔森菌抗体检测方法均很有效,如间接血凝法、胶体金法、酶联免疫法、上转发光免疫层析法等[5-7],但我国尚无鼠疫耶尔森菌F1抗体检测试剂评价用国家参考品。为此,本团队研制了一套鼠疫耶尔森菌F1抗体检测试剂评价用国家参考品,这对鼠疫耶尔森菌F1抗体检测试剂的注册管理及指导我国该类试剂的健康有序发展具有重要意义。
1 材料与方法 1.1 材料 1.1.1 菌种鼠疫耶尔森菌EV株(CMCC~52006)、鼠疫耶尔森菌0614F株、鼠疫耶尔森菌Tjiusidej(R)株(CMCC52010)、鼠疫耶尔森菌田鼠型201株、假结核耶尔森菌(CMCC53521)、小肠结肠炎耶尔森菌(CMCC52203)、土拉热弗朗西丝菌LVS株、布鲁菌104M株(CMCC55010)、炭疽芽孢杆菌(CMCC63001)、伤寒沙门菌(CMCC50071)均由中国医学细菌菌种保藏管理中心(National Center for Medical Culture Collections,CMCC)提供。
1.1.2 动物新西兰大耳白家兔,体重2.5~3.0 kg,无特定病原体(specific pathogen free,SPF)级,雄性。
1.1.3 样本鼠疫疫苗人免血清、正常人血浆及兔抗鼠疫耶尔森菌F1抗原血清由兰州生物制品研究所有限责任公司提供。
1.1.4 主要试剂鼠疫耶尔森菌抗体检测试剂盒(上转发光法)(批号:20211001)由北京热景生物技术股份有限公司生产;鼠疫耶尔森菌抗体检测试剂盒(上转发光法)(批号:20210907)由军事科学院军事医学研究院微生物流行病研究所生产;鼠疫耶尔森菌抗体检测试剂(胶体金法)(批号:20210202401)由北京金豪制药股份有限公司生产;鼠疫耶尔森菌F1抗体检测试剂(胶体金法)(批号:20210801)、鼠疫耶尔森菌F1抗体检测试剂盒(酶联免疫法)(批号:20210201)、鼠疫耶尔森菌F1抗体诊断试剂盒(间接血凝法)(批号:20210201)均由兰州生物制品研究所有限责任公司生产。
1.1.5 仪器设备生物安全柜购自美国NuAire公司;MIR-153型恒温培养箱购自日本三洋公司。
1.2 方法 1.2.1 兔免血清的制备首先制备兔抗鼠疫耶尔森菌血清。将鼠疫耶尔森菌EV株(CMCC52006)、鼠疫耶尔森菌0614F株、鼠疫耶尔森菌Tjiusidej(R)株(CMCC52010)、鼠疫耶尔森菌田鼠型201株(其中除EV株外均为灭活菌体)分别免疫家兔,共免疫2次,间隔2周,背部皮下接种,每次免疫1.0 mL[含5×108个菌及1.0 mg氢氧化铝佐剂(活疫苗除外)]。于第2次免疫后2周采血并分离血清。
再制备兔抗阴性菌血清,将假结核耶尔森菌、小肠结肠炎耶尔森菌、布鲁菌、炭疽芽孢杆菌、伤寒沙门菌、土拉热弗朗西丝菌(均为灭活菌体)分别免疫家兔,共免疫4次,间隔2周,背部皮下接种,每次免疫1.0 mL(含5×108个菌及1.0 mg氢氧化铝佐剂)。于第4次免疫后2周采血并分离血清。
1.2.2 去纤维血浆的制备每100 mL正常人血浆中加入脱纤维试剂(氯化钙终浓度为0.012 5 mol/L,凝血酶终浓度为3.5 IU/mL),加入后立即混匀,于37 ℃水浴轻微转动处理30 min至纤维蛋白原凝集,12 000 g离心10 min,收集上清液,即为去纤维血浆。
1.2.3 参考品的组成首先,制备阳性参考品,将4株鼠疫耶尔森菌免疫家兔,制备4份兔免血清。另用正常人去纤维血浆10倍稀释鼠疫耶尔森菌EV株兔免血清,制备1份弱阳性参考品。考虑到本套参考品将用于评价人用鼠疫耶尔森菌F1抗体检测试剂,将1份鼠疫疫苗人免血清作为阳性参考品。
阴性参考品包括2份正常人脱纤维血浆、6份微生物学分类接近或高致病性微生物的兔免血清。由于高致病性微生物感染者的血清难以获得,因此使用兔免血清作为相应阴性参考品。
采用纯化的鼠疫耶尔森菌F1抗原免疫家兔,制备血清,用作最低检出限参考品与重复性参考品。
1.2.4 参考品的分装将6份阳性参考品及8份阴性参考品以每支0.15 mL分装于冻存管中。将F1抗原兔免血清用冻干保护剂稀释后定量分装于安瓿中,每支0.5 mL,冻干后封口,作为最低检出限参考品与重复性参考品。分装精确度不高于1%,水分低于3%。分装后参考品样品均于-80 ℃冰箱保存备用。
1.2.5 分装后验证随机抽取一套参考品,用鼠疫耶尔森菌抗体检测试剂进行F1抗体检测。
1.2.6 均匀性检验随机抽取最低检出限参考品10支,分别加入0.5 mL样本稀释液复溶;取复溶样本0.1 mL,加入0.3 mL样本稀释液(4倍稀释),混匀;用鼠疫耶尔森菌抗体检测试剂检测抗体水平。每支样本重复测定3次。
1.2.7 稳定性研究分为以下3类。①冻融稳定性试验。从冰箱中取出阳性参考品及最低检出限参考品,于室温放置约4 h,再放回冰箱,如此重复1次及3次,用鼠疫耶尔森菌抗体检测试剂进行F1抗体检测。②加速稳定性试验。从-80 ℃冰箱中取出阳性参考品及最低检出限参考品,分别于-20 ℃、4 ℃、37 ℃各放置2套。阳性参考品放置3 d和5 d,最低检出限参考品放置14 d和28 d,分别用鼠疫耶尔森菌抗体检测试剂盒(上转发光法)及鼠疫耶尔森菌F1抗体检测试剂盒(酶联免疫法)进行F1抗体检测。③长期稳定性试验。对弱阳性参考品及最低检出限参考品进行长期稳定性观察,用鼠疫耶尔森菌抗体检测试剂进行F1抗体检测。
1.2.8 协作标定按照国家药品标准物质协作标定技术的要求设计方案,制定生物制品标准物质协作标定作业指导,并邀请北京热景生物技术股份有限公司、军事科学院军事医学研究院微生物流行病研究所、北京金豪制药股份有限公司、兰州生物制品研究所有限责任公司共4家实验室,使用各自生产的鼠疫耶尔森菌抗体检测试剂进行参考品协作标定工作[8]。采用上转发光法、胶体金法、酶联免疫法、间接血凝法的鼠疫耶尔森菌抗体检测试剂分别有2、2、1、1个,编号为1~6。
1.3 统计学方法采用IBM SPSS Statistics 21.0统计软件进行统计学分析,其中上转发光法测定结果以T/C值进行统计分析,酶联免疫法以样品吸光度值与临界值(cut off)的比值(S/CO值)进行统计分析。均匀性和稳定性试验数据分别采用单因子方差分析和配对t检验进行分析,P<0.05代表差异有统计学意义。
2 结果 2.1 参考品的组成共6份阳性参考品,编号为P1~P6;8份阴性参考品,编号为N1~N8;1份最低检出限参考品,编号为L;1份重复性参考品,编号为R。
2.2 分装后验证结果使用鼠疫耶尔森菌抗体检测试剂检测分装后的参考品,阳性参考品检测结果均为阳性,阴性参考品检测结果均为阴性,检测结果与预期一致。
2.3 均匀性检验结果均匀性检验结果如表 1所示,F临界值为F0.05(9,20)=2.42,计算的F值为0.571,该值小于F临界值,P=0.805,表明在显著性水平为0.05时,样品中的抗体含量是均匀的。
| Sample number | Testing number | ||
| 1 | 2 | 3 | |
| 1 | 1.087 | 1.380 | 1.038 |
| 2 | 1.159 | 1.008 | 1.065 |
| 3 | 1.219 | 1.107 | 0.921 |
| 4 | 1.292 | 1.307 | 0.940 |
| 5 | 1.201 | 1.410 | 1.334 |
| 6 | 1.500 | 1.134 | 1.162 |
| 7 | 1.449 | 0.888 | 1.135 |
| 8 | 1.343 | 0.982 | 0.911 |
| 9 | 1.384 | 1.579 | 0.961 |
| 10 | 1.009 | 1.394 | 0.917 |
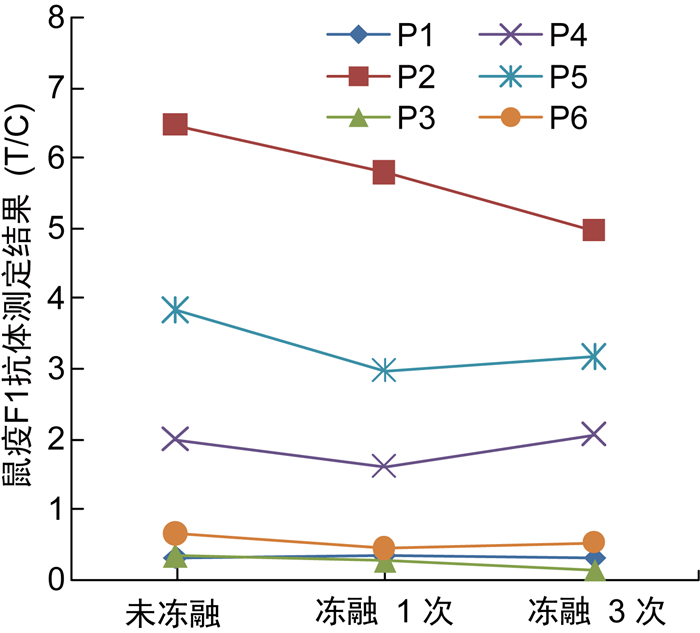
冻融1次及3次后,6份阳性参考品的F1抗体检测结果均仍为阳性,且F1抗体水平与未冻融对照相比无显著性差异(均P>0.05)(见图 1);最低检出限参考品冻融3次后的最低检出水平与未冻融对照一致。
|
| 图 1 阳性参考品冻融稳定性试验结果 Fig. 1 Results of freeze-thaw stability test of positive references |
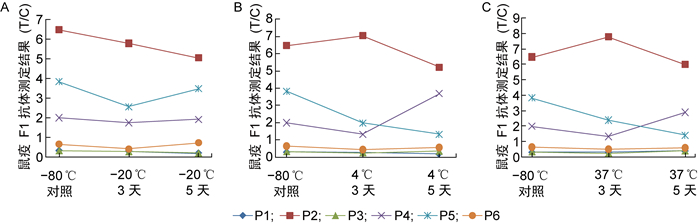
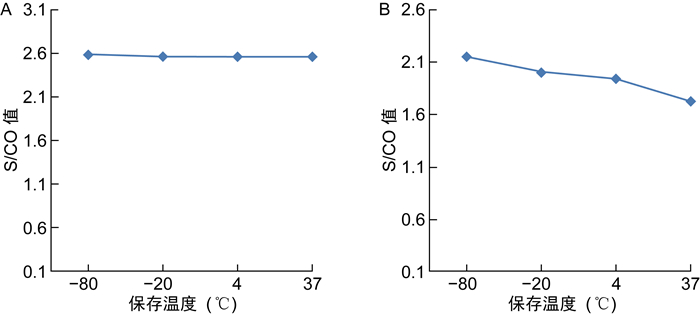
6份阳性参考品在不同温度下加速3 d和5 d后,F1抗体检测结果均仍为阳性,各样本的F1抗体水平与对照样品相比无显著性差异(均P>0.05)(见图 2)。最低检出限参考品在不同温度下加速14 d后,F1抗体水平未见明显变化;在不同温度下加速28 d后,随着加速温度的升高,F1抗体水平出现降低趋势(见图 3)。
|
| A: The results of accelerated stability test at-20 ℃. B: The results of accelerated stability test at 4 ℃. C: The results of accelerated stability test at 37 ℃. 图 2 阳性参考品加速稳定性试验结果 Fig. 2 Results of accelerated stability test of positive references |
|
| A: The results of accelerated stability test for 14 d. B: The results of accelerated stability test for 28 d. 图 3 最低检出限参考品加速稳定性试验结果 Fig. 3 Results of accelerated stability test of minimum detection limit reference |
最低检出限参考品及弱阳性参考品的长期稳定性试验结果分别如表 2和表 3所示,观察期内F1抗体水平均未见明显变化。
| Dilution multiple | 1 month | 12 months |
| 1: 2 | + | + |
| 1: 4 | + | + |
| 1: 8 | + | + |
| 1: 16 | + | + |
| 1: 32 | + | + |
| 1: 64 | - | - |
| Dilution multiple | 1 month | 3 months | 6 months | 12 months |
| 10 | + | + | + | + |
| 100 | + | + | + | + |
| 1 000 | - | - | - | - |
采用6种鼠疫耶尔森菌抗体检测试剂盒来检测本参考品。对于阳性参考品,所有检测试剂的阳性符合率均为100%;对于阴性参考品,所有检测试剂的阴性符合率均为100%。最低检出限参考品方面,1种检测试剂的最低检出限为原倍血清,3种检测试剂的最低检出限为10倍稀释血清,2种检测试剂的最低检出限为100倍稀释血清。重复性参考品分别检测10次,人工判读的检测试剂(胶体金法、间接血凝法)实验结果一致,仪器判读的检测试剂(上转发光法、酶联免疫法)实验结果的变异系数均小于15%。具体结果详如表 4所示。
| Reference | Serial number | Sample | Reagent number | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |||
| Negative reference | N1 | Healthy human plasma | - | - | - | - | - | - |
| N2 | Healthy human plasma | - | - | - | - | - | - | |
| N3 | Rabbit anti-Yersinia pseudotuberculosis serum | - | - | - | - | - | - | |
| N4 | Rabbit anti-Yersinia enterocolitica serum | - | - | - | - | - | - | |
| N5 | Rabbit anti-Brucella serum | - | - | - | - | - | - | |
| N6 | Rabbit anti-Bacillus anthracis serum | - | - | - | - | - | - | |
| N7 | Rabbit anti-Salmonella typhi serum | - | - | - | - | - | - | |
| N8 | Rabbit anti-Francisella tularensis serum | - | - | - | - | - | - | |
| Positive reference | P1 | Human anti-plague vaccine serum | + | + | + | + | + | + |
| P2 | Rabbit anti-Yersinia pestis EV strain serum | + | + | + | + | + | + | |
| P3 | Rabbit anti-Yersinia pestis EV strain serum | + | + | + | + | + | + | |
| P4 | Rabbit anti-Yersinia pestis 0614F strain serum | + | + | + | + | + | + | |
| P5 | Rabbit anti-Yersinia pestis Tjiusidej(R) strain serum | + | + | + | + | + | + | |
| P6 | Rabbit anti-Yersinia pestis 201 strain serum | + | + | + | + | + | + | |
| Minimum detection limit reference | L | Rabbit anti-Yersinia pestis F1 antigen serum | 10× | 1× | 100× | 10× | 100× | 10× |
| Repetitive reference | R | Rabbit anti-Yersinia pestis F1 antigen serum | Q | Q | Q | Q | Q | Q |
| Note: Q means qualified. | ||||||||
我国鼠疫发病率低,近10年来每年发病人数均为个位数,因此在研制鼠疫耶尔森菌抗体检测试剂参考品时难以获得鼠疫患者的血清[9]。现用鼠疫耶尔森菌抗体检测试剂中的间接血凝法和双抗原夹心法对待检血清的来源没有严格的种属限制[10-11],且常见的鼠疫抗体检测试剂主要针对的是鼠疫耶尔森菌F1抗体[12]。因此,本套参考品在制备阳性参考品时,采用表达鼠疫耶尔森菌F1抗原的4株鼠疫耶尔森菌免疫家兔,制备兔免血清,并用正常人血浆10倍稀释其中的EV株兔免血清制备了1份弱阳性参考品。同时考虑到本套参考品将用于人用鼠疫耶尔森菌F1抗体检测试剂的评价,所以选取了1份鼠疫疫苗人免血清作为阳性参考品。采用上转发光法和胶体金法鼠疫耶尔森菌抗体检测试剂对候选的阳性参考品分别进行F1抗体验证,检测结果均为阳性。采用酶联免疫法对6份阳性参考品进行F1抗体效价测定,结果在1∶250~1∶4 000。
阴性参考品包括正常人血浆、微生物学分类接近或高致病性微生物的兔免血清。鉴于难以获得高致病性微生物感染者的血清,本研究使用兔免血清作为相应的阴性参考品。在制备阴性参考品兔免血清时,免疫次数比阳性参考品多2次。血清中针对免疫用菌体抗原的抗体检测结果均为阳性。分别用酶联免疫法、上转发光法和胶体金法鼠疫耶尔森菌抗体检测试剂进行F1抗体验证,检测结果均为阴性。
本套参考品具有较好的均匀性和稳定性,12个月的稳定性检测结果表明参考品的质量未见明显变化。协作标定结果表明,本套参考品可用于对多种鼠疫耶尔森菌F1抗体检测试剂的质量评价。
综上所述,本研究所建立的鼠疫耶尔森菌F1抗体检测试剂评价用参考品可用于鼠疫耶尔森菌F1抗体检测试剂的质量评价,对提高该类产品质量具有重要意义。
| [1] |
Mead P. Epidemics of plague past, present, and future[J]. Lancet Infect Dis, 2019, 19(5): 459-460.
[DOI]
|
| [2] |
Andrianaivoarimanana V, Wagner DM, Birdsell DN, Nikolay B, Rakotoarimanana F, Randriantseheno LN, Vogler AJ, Sahl JW, Hall CM, Somprasong N, Cauchemez S, Schweizer HP, Razafimandimby H, Rogier C, Rajerison M. Transmission of antimicrobial resistant Yersinia pestis during a pneumonic plague outbreak[J]. Clin Infect Dis, 2022, 74(4): 695-702.
[DOI]
|
| [3] |
He Z, Wei B, Zhang Y, Liu J, Xi J, Ciren D, Qi T, Liang J, Duan R, Qin S, Lv D, Chen Y, Xiao M, Fan R, Song Z, Jing H, Wang X. Distribution and characteristics of human plague cases and Yersinia pestis isolates from 4 Marmota plague foci, China, 1950-2019[J]. Emerg Infect Dis, 2021, 27(10): 2544-2553.
[DOI]
|
| [4] |
杨清銮, 翁涛平, 李杨. 鼠疫的流行病学概述[J]. 微生物与感染, 2019, 14(6): 333-337. [DOI]
|
| [5] |
杜春红, 王鹏, 常娅莉, 王秉翔, 宋志忠. 鼠疫菌F1抗体/抗原酶联免疫诊断试剂盒的应用评价[J]. 微生物学免疫学进展, 2014, 42(4): 21-25. [CNKI]
|
| [6] |
冯建萍, 郭文涛, 王梅, 吴海生, 李玲雯, 张晓璐, 祁芝珍. 3种鼠疫菌诊断制剂的应用及质控措施[J]. 医学动物防制, 2022, 38(1): 56-59. [CNKI]
|
| [7] |
王蒴, 王信惠, 黎唯. 鼠疫免疫学检测技术的应用和研究进展[J]. 中国媒介生物学及控制杂志, 2019, 30(2): 228-231. [CNKI]
|
| [8] |
曹丽梅, 辛晓芳, 周诚, 张春涛, 马双成. 传染病体外诊断试剂标准物质研制技术要求的介绍[J]. 药物分析杂志, 2011, 31(11): 2196-2197. [CNKI]
|
| [9] |
向锁玉, 孙希, 吴忠道. 中国鼠疫的疫情及防治进展[J]. 中国热带医学, 2020, 20(5): 486-490. [CNKI]
|
| [10] |
洪梅, 亚红祥, 段彪, 陈福美, 杨聪静, 和映天, 和琼光, 吴鹤松. 玉龙县鼠疫疫源地高危人群鼠疫菌F1抗体水平调查[J]. 医学动物防制, 2021, 37(7): 709-711. [CNKI]
|
| [11] |
杜国义, 杨顺林, 史献明, 周松, 杨建民, 白雪薇, 王海峰, 杨晓燕, 刘合智, 胡乐乐, 牛艳芬. 河北省鼠疫自然疫源地蒙系绵羊血清鼠疫F1抗体调查[J]. 中国地方病防治杂志, 2013, 28(5): 351-352. [CNKI]
|
| [12] |
冯建萍, 游培松, 郭文涛, 杨建国, 辛文媛, 金星, 祁芝珍. 鼠疫F1抗原在鼠疫诊断中的应用及质控措施[J]. 医学动物防制, 2022, 38(2): 150-152. [CNKI]
|
 2023, Vol. 18
2023, Vol. 18


