惠普尔养障体(Tropheryma whipple)是一种杆状革兰氏阳性菌,可引起罕见的慢性全身性感染性疾病——惠普尔病(Whipple disease),该病于1907年由George Hoyt Whipple命名[1]。随着人们对这种细菌的了解不断加深,研究人员发现惠普尔养障体可在健康个体中定植[2],还可引起急性感染,如急性肺炎等[3],但由于其感染缺乏特异性,常常被临床医师漏诊[4]。随着诊断技术的快速发展,特别是宏基因组二代测序(metagenomic next-generation sequencing,mNGS)技术在实验室诊断领域的应用,惠普尔养障体引起的肺部感染逐渐引起临床医师的关注。现将柳州市人民医院(以下简称“该院”)收治的2例通过mNGS明确诊断的惠普尔养障体感染引起重症肺炎患儿的临床资料报道如下,并对相关国内外文献进行复习,以提醒临床医师对惠普尔养障体引起的婴幼儿重症肺炎提高警觉。
1 临床资料以2020—2021年该院儿童重症监护室收治的2例重症肺炎患儿为研究对象,2例患儿诊断均符合《儿科学》第9版儿童重症肺炎的诊断标准[5]。
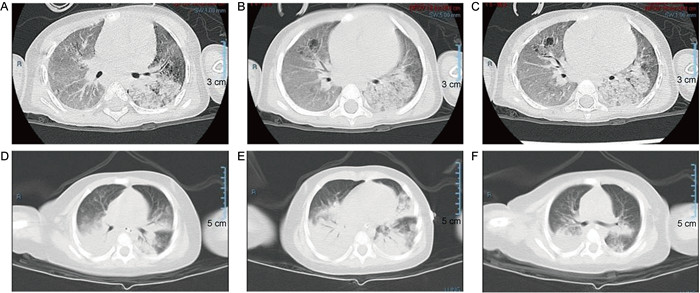
1.1 病例1资料患儿女,3岁5个月,因“咳嗽、发热1周,气促、发绀12 h”急诊入院。患儿2岁时在外院诊断为重度营养不良,无激素、抗生素等长期用药史。入院体格检查:体温39.3 ℃,呼吸197次/min,心率75次/min,血压8.93/4.67 kPa,体质量10 kg,身长89 cm。神清而靡,鼻翼扇动,胸腹式呼吸,见吸气性三凹征,动脉血氧饱和度(oxygen saturation in arterial blood,SaO2)58%,双肺闻及湿啰音及哮鸣音。心音有力,律齐,无杂音。腹软,腹壁脂肪消失,肝脾肋下未触及,肠鸣音正常。神经系统检查无异常。辅助检查具体如表 1及图 1A~C所示。
| 检测项目 | 病例1 | 病例2 |
| WBC(×109/L)A | 15.51/29.98 | 1.54/8.16 |
| NE(%)A | 75.7/70.2 | 57.2/63.1 |
| CRP(mg/L)A | 12.64/41.06 | 267.72/119 |
| PCT(ng/mL)A | 6.47/15.97 | 60.56/>100 |
| 肺炎支原体抗体IGM | 阴性 | 阴性 |
| 病毒核酸B | 阴性 | 阴性 |
| 结核分枝杆菌特异性T细胞检测 | 阴性 | 阴性 |
| 真菌D-葡聚糖 | 阴性 | 阴性 |
| 曲霉半乳甘露聚糖 | 阴性 | 阴性 |
| 肺泡灌洗液涂片 | 阴性 | 阴性 |
| 淋巴细胞亚群分析 | 辅助性T淋巴细胞:44.4%,抑制性T淋巴细胞:18.4% 总T淋巴细胞:62.8%,自然杀伤淋巴细胞:2.8%↓ |
辅助性T淋巴细胞24.3%,抑制性T淋巴细胞25.8%,总T淋巴细胞50.7%,自然杀伤淋巴细胞8.5% B淋巴细胞40.0% |
| B淋巴细胞百分率33.5%↑ | 辅助性T淋巴细胞/抑制性T淋巴细胞比值0.94 | |
| 辅助性T淋巴细胞/抑制性T淋巴细胞比值2.42 CD4绝对计数1 203/μL,CD8绝对计数498/μL CD3绝对计数1 703/μL,CD16CD56绝对计数83/μL↓,CD19绝对计数978/μL↑,CD45绝对计数2 712/μL |
CD4绝对计数1 422/μL,CD8绝对计数1 512/μL,CD3绝对计数2 971/μL,CD16CD56绝对计数545/μL CD19绝对计数2 558/μL,CD45绝对计数5 859/μL |
|
| 免疫球蛋白定量(IGG、IGA、IGM) | IgG 8.320 g/L, IgA 0.100 g/L, IgM 0.380 g/L | IgG 13.090 g/L, IgA 1.460 g/L, IgM 1.460 g/L |
| 细菌培养(痰/血) | 阴性 | 阴性 |
| mNGS | 金黄色葡萄球菌(检出序列数202 869) 惠普尔养障体(检出序列数98 984) |
惠普尔养障体(检出序列数30 020) 鲍曼不动杆菌(检出序列数15 020) |
| A: 入院第1天/入院第3天的检测结果; B: 包括呼吸道合胞病毒、甲型流感病毒、乙型流感病毒、副流感病毒1/2/3型。 |
||
|
|
A~C: 病例1肺部CT征象,两肺可见斑片状、片状密度增高模糊影,以左肺下叶为主(A),可见支气管充气征(B),可见囊状薄壁透亮影(C)。 D~F: 病例2肺部CT征象,两肺可见斑片状、片状密度增高模糊影,以双肺下叶为主(D),可见支气管充气征(E),右侧胸腔见弧形液性密度影(F)。 图 1 惠普尔养障体感染患儿肺部CT征象 Fig. 1 The pulmonary CT findings in children with Whipple disease and associated infections |
入院诊断:重症肺炎,急性呼吸衰竭,重度营养不良。入院后立即予气管插管接呼吸机辅助通气治疗,予头孢哌酮钠舒巴坦钠抗感染等对症支持治疗。由于患儿持续高热,后出现少尿、双下肢水肿,怀疑发生脓毒症相关急性肾损伤,于入院后第3天予连续性血液净化治疗,经验性更换美洛培南及万古霉素加强抗感染治疗,同时进行纤维支气管镜检查,并使用mNGS检测肺泡灌洗液以完善病原学检查,检出金黄色葡萄球菌(序列数202 869)及惠普尔养障体(序列数98 984)。入院第5天,根据病原学检查结果将抗菌药物调整为美洛培南及复方磺胺甲噁唑联合治疗3周,入院2周后撤呼吸机,入院28天后患儿好转出院。出院后医嘱继续口服复方磺胺甲噁唑片1年,儿童呼吸专科定期随访。2021年11月13日患儿因重症肺炎再次住院治疗,采用mNGS技术检测肺泡灌洗液,结果提示惠普尔养障体序列数43,链球菌属序列数16。2022年1月31日复查肺部计算机体层扫描(computed tomography, CT)提示闭塞性细支气管炎改变。
1.2 病例2资料患儿男,5月龄,因“发热、声音嘶哑27 h,气促11 h”急诊入院。体格检查:体温39.6 ℃,呼吸200次/min,心率60次/min,血压10.67/4.93 kPa,体质量8 kg,SaO2 90%(未吸氧)。患儿神清,前囟平软,咽部充血,呼吸急促,见轻度吸气三凹征,双肺闻及喉喘鸣,心律齐,心音有力,未闻及杂音。腹部检查无异常,神经系统检查未见异常。辅助检查具体结果如表 1及图 1所示。
入院诊断为重症肺炎。患儿入院后立即予头孢他啶抗感染治疗,但其呼吸困难逐步加重,于入院12 h后予气管插管接呼吸机辅助通气治疗。之后患儿仍有高热,出现尿量减少,发生脓毒症相关急性肾损伤,于入院后第3天予连续性血液净化,经验性改美洛培南抗感染治疗,并进行纤维支气管镜检查,使用mNGS检测肺泡灌洗液完善病原学检查,检出惠普尔养障体(序列数30 020)和鲍曼不动杆菌(序列数15 020)。入院第5天依据病原学检查结果将抗菌药物调整为美洛培南及复方磺胺甲噁唑联合治疗3周,呼吸机于治疗8天后撤机,患儿住院25天好转出院。医嘱出院后继续口服复方磺胺甲噁唑片(SMZCO),因患儿家长担心药物副作用,1周后自行停药,之后定期至儿童呼吸专科随访至2023年9月,其间因轻症肺炎住院一次,但未进行mNGS复检肺泡灌洗液。2023年9月20日门诊复查CT显示肺部感染病灶吸收消失。
2 讨论惠普尔养障体是惠普尔病的病原菌,在一项针对儿童囊性纤维化患者的宏基因组研究中,研究者在研究对象的支气管肺泡灌洗液中首次检测到惠普尔养障体[6]。对重症监护病房中的肺炎患者进行的一项研究发现[2],惠普尔养障体在支气管肺泡灌洗液中的检出率为3%,研究者认为惠普尔养障体是急性呼吸道感染的致病菌之一。在近期报告的成人病例中[7-8],研究者进一步证实了惠普尔养障体是肺炎的病原菌之一,且可引起成人重症肺炎。在本文的病例报告中,2名重症肺炎患儿的肺泡灌洗液中均检出了惠普尔养障体合并其他细菌的混合感染,提示前者可以导致婴幼儿重症肺炎而没有肺外表现,应引起临床医师的重视。本文报道的2例惠普尔养障体混合其他细菌感染引起的婴幼儿急性重症肺炎的患儿症状及体征无特异性,主要表现为发热、咳嗽和气促等呼吸道症状,没有胃肠道症状、免疫缺陷疾病或使用免疫抑制剂的用药史。胸部影像学表现为斑片影、磨玻璃样影,这些影像学表现均缺乏特异性,不易与其他病原体感染导致的肺炎相鉴别[9]。另外,临床微生物学实验室应用常规检测方法不易检出惠普尔养障体[10],缺乏对该病原菌的了解,容易导致惠普尔病被误诊或漏诊。
临床上婴幼儿重症肺炎的诊断和治疗往往具有挑战性,尤其是当肺炎由罕见或未知病原体感染引起。几乎所有感染性病原体都包含DNA或RNA基因组,这使得mNGS技术在病原体检测中颇具吸引力[11],目前其已用于检测临床样本和对微生物进行分类[12]。此外,研究表明当患者存在混合感染时,mNGS技术具有明显优势,目前该技术已全面应用于罕见细菌感染的诊断[13]。本报道收治的2例患儿因发热、咳嗽、气促等症状入住儿童重症监护室,最初诊断为重症肺炎。患儿外周血炎症指标明显升高,考虑为细菌性肺炎。除进行常规病原体检测外,本研究对患儿进行了纤维支气管镜检查,获取了支气管肺泡灌洗液并用于mNGS检测,仅用2天时间就确认了这2个重症肺炎病例是由惠普尔养障体合并其他细菌感染引起的。就本文报道的病例而言,使用mNGS技术检测患者的肺泡灌洗液的优势在于可同时识别惠普尔养障体和其他病原体的混合感染。但解释支气管肺泡灌洗液mNGS结果必须结合患者的临床表现、既往治疗过程、采样方法以及靶向抗感染治疗的效果等临床情况,以鉴别是否存在机体定植菌或污染可能[14]。本文中针对惠普尔养障体的特殊治疗效果良好,支持了惠普尔肺炎这一诊断。
目前,惠普尔病的发病机制尚不清楚,现有的研究表明其与性别、共感染和遗传易感性等宿主因素有关。有报道提示,感染人类免疫缺陷病毒的患者更容易发生惠普尔养障体感染[15],且惠普尔养障体引起的肺部感染易发生于本身具有免疫缺陷或接受免疫抑制剂治疗的患者[16]。但一项针对176份支气管肺泡灌洗样本的研究表明[3],与对照组相比,惠普尔养障体组中有更多的患者接受了肿瘤坏死因子α抑制剂的治疗,但总体而言,2组患者的免疫功能低下状态没有差异。本文报道的病例提示,患儿的T细胞亚群和免疫球蛋白有不同程度的异常,但其发生重症肺炎是否与免疫功能异常有关尚不明确。宿主免疫系统在惠普尔养障体引起感染过程中的作用在很大程度上仍未得到阐明。但有研究认为,免疫抑制疗法(如皮质类固醇或肿瘤坏死因子拮抗剂的治疗),可能会加重惠普尔病,因此在治疗过程中没有常规使用糖皮质激素[1, 16]。
针对惠普尔养障体的抗感染方案和疗程目前尚无统一标准及共识,针对其导致肺部感染的诊疗经验则更加不足。目前对于惠普尔养障体感染引起的重症肺炎的治疗方案和持续时间,均有赖于前期经验和专家意见。既往文献提出了多种针对成人的抗菌方案[1],包括青霉素、四环素、甲氧苄啶/磺胺甲噁唑、甲氧苄啶/磺胺甲噁唑加头孢曲松或美洛培南,多西环素加羟氯喹,结果显示大多数患者对抗菌治疗表现出快速而良好的临床反应[17]。由于惠普尔病的复发率和死亡率均较高,患者须接受长期治疗。目前推荐的治疗方法基于一项随机对照试验[1],建议使用头孢曲松或美洛培南14天,然后口服复方新诺明12个月。而一些研究者认为,羟氯喹联合多西环素是一种更合理的替代方案[16]。而对于惠普尔养障体引起的重症感染,目前尚无治疗持续时间的证据。因为考虑合并有金黄色葡萄球菌/鲍曼不动杆菌感染,本文对报道的病例采用了复方磺胺甲噁唑联合美洛培南抗感染的治疗方案,疗程延长至3周,同时给予其他对症支持治疗,患儿好转出院,出院后医嘱继续口服复方磺胺甲噁唑治疗。研究表明,临床医师对惠普尔养障体肺炎临床表现的认识在不断提高,能及时使用抗菌药物对患者进行长期治疗,故该病的复发率大幅下降[18]。另一方面,惠普尔养障体感染也可能因潜在的威胁生命的肿瘤性和引起血栓栓塞性疾病而变得复杂,因此对患者进行终身多学科随访是很有必要的。
总之,惠普尔养障体感染引起的婴幼儿重症肺炎较为少见,临床以发热、咳嗽、气促为主要表现,可合并其他病原菌感染,肺部CT表现为斑片影。临床上惠普尔养障体引起的肺部感染通常与其他细菌感染无法区分,常规病原检测方法难以明确诊断,而病原微生物mNGS检测对于惠普尔养障体感染的诊断和鉴别诊断尤其有价值。因此,应及时行肺泡灌洗液病原微生物mNGS检测,尽早明确诊断并及时给予针对性抗感染治疗。本文的病例预后提示,复方磺胺甲噁唑联合美洛培南抗感染可有效治疗婴幼儿肺部惠普尔养障体重症感染,但有复发可能,应注意对该类患儿进行长期随访。
| [1] |
Dolmans RA, Boel CH, Lacle MM, Kusters JG. Clinical manifestations, treatment, and diagnosis of tropheryma whipplei infections[J]. Clin Microbiol Rev, 2017, 30(2): 529-555.
[DOI]
|
| [2] |
Lagier JC, Fenollar F, Raoult D. Acute infections caused by Tropheryma whipplei[J]. Future Microbiol, 2017, 12: 247-254.
[DOI]
|
| [3] |
Lagier JC, Papazian L, Fenollar F, Edouard S, Melenotte C, Laroumagne S, Michel G, Martin C, Gainnier M, Lions C, Carrieri P, Stein A, Brouqui P, Raoult D. Tropheryma whipplei DNA in bronchoalveolar lavage samples: a case control study[J]. Clin Microbiol Infect, 2016, 22(10): 875-879.
[DOI]
|
| [4] |
Duss FR, Jaton K, Vollenweider P, Troillet N, Greub G. Whipple disease: a 15-year retrospective study on 36 patients with positive polymerase chain reaction for Tropheryma whipplei[J]. Clin Microbiol Infect, 2021, 27(6): 910.e9-910.e13.
[DOI]
|
| [5] |
王卫平, 孙锟, 常立文. 儿科学[M]. 第9版. 北京: 人民卫生出版社, 2018: 252.
|
| [6] |
Fenollar F, Ponge T, La Scola B, Lagier JC, Lefebvre M, Raoult D. First isolation of Tropheryma whipplei from bronchoalveolar fluid and clinical implications[J]. J Infect, 2012, 65(3): 275-278.
[DOI]
|
| [7] |
Li W, Zhang Q, Xu Y, Zhang X, Huang Q, Su Z. Severe pneumonia in adults caused by Tropheryma whipplei and Candida spinfection: a 2019 case series[J]. BMC Pulm Med. 2021 Jan 15; 21(1): 29. doi: 10.1186/s12890020-01384-4. [URI]
|
| [8] |
Li W, Zhang Q, Xu Y, Zhang X, Huang Q, Su Z. Severe pneumonia in adults caused by Tropheryma whipplei and Candida sp. infection: a 2019 case series[J]. BMC Pulm Med, 2021, 21(1): 29.
[DOI]
|
| [9] |
程燕, 宁永忠. 惠普尔养障体导致急性肺炎的探讨[J]. 中华检验医学杂志, 2021, 44(11): 1090-1093. [DOI]
|
| [10] |
Zhu B, Tang J, Fang R, Fei X, Wang Q, Wang W, Wu X, Liu C, Wang Q. Pulmonary coinfection of Mycobacterium tuberculosis and Tropheryma whipplei: a case report[J]. J Med Case Rep, 2021, 15(1): 359.
[DOI]
|
| [11] |
谭文文, 李建民, 潘婵苑, 唐朝, 刘慧. 重症肺炎细菌感染老年患者二代测序阳性情况及影响因素分析[J]. 湖南师范大学学报(医学版), 2022, 19(2): 23-27. [DOI]
|
| [12] |
Gu W, Miller S, Chiu CY. Clinical metagenomic next-generation sequencing for pathogen detection[J]. Annu Rev Pathol, 2019, 14: 319-338.
[DOI]
|
| [13] |
Fang X, Mei Q, Fan X, Zhu C, Yang T, Zhang L, Geng S, Pan A. Diagnostic value of metagenomic next-generation sequencing for the detection of pathogens in bronchoalveolar lavage fluid in ventilator-associated pneumonia patients[J]. Front Microbiol, 2020, 11: 599756.
[DOI]
|
| [14] |
中华医学会检验医学分会临床微生物学组, 中华医学会微生物学与免疫学分会临床微生物学组, 中国医疗保健国际交流促进会临床微生物与感染分会. 宏基因组高通量测序技术应用于感染性疾病病原检查中国专家共识[J]. 中华检验医学杂志, 2021, 44(2): 107-117. |
| [15] |
Yan J, Zhang B, Zhang Z, Shi J, Liu S, Qi J, Wang M. Case report: Tropheryma whipplei hide in an AIDS patient with pneumocystis pneumonia[J]. Front Public Health, 2021, 9: 663093.
[DOI]
|
| [16] |
Zhang WM, Xu L. Pulmonary parenchymal involvement caused by Tropheryma whipplei[J]. Open Med (Wars), 2021, 16(1): 843-846.
[DOI]
|
| [17] |
Marth T. Whipple's disease[J]. Acta Clin Belg, 2016, 71(6): 373-378.
[DOI]
|
| [18] |
Schiepatti A, Nicolardi ML, Marone P, Biagi F. Long-term morbidity and mortality in Whipple's disease: a single-center experience over 20 years[J]. Future Microbiol, 2020, 15: 847-854.
[DOI]
|
 2024, Vol. 19
2024, Vol. 19


