肺炎克雷伯菌(Klebsiella pneumoniae,KPN)是引发医院感染最主要的机会致病菌和医源性感染细菌之一,既有研究表明其检出率位居院内常见革兰氏阴性菌的第2位。肺炎克雷伯菌可以侵袭人类呼吸道、泌尿生殖道、腹膜、血液,导致患者出现呼吸系统、泌尿系统甚至血液系统的感染[1]。作为最为常见的多重耐药菌之一,因为产超广谱β-内酰胺酶(extended-spectrum β-lactamases,ESBLs)菌株的产生,肺炎克雷伯菌对一些常用的一、二线抗菌药物及β-内酰胺类抗生素表现出高水平的耐药性[2]。一直以来,碳青霉烯类抗生素因其有抗菌谱广、抗菌活性强、对ESBLs稳定等优点,常被用于治疗产ESBLs菌株所引起的严重感染,被临床视为治疗肺炎克雷伯菌的最后一道防线。但近年来产ESBLs菌株的感染比例逐年升高,使得肺炎克雷伯菌对碳青霉烯类抗生素的耐药性逐年增强,给肺炎克雷伯菌引起的感染治疗带来了巨大的挑战[3-4]。这类对碳青霉烯类抗生素耐药的肺炎克雷伯菌被称为耐碳青霉烯肺炎克雷伯菌(carbapenem-resistant klebsiella pneumoniae, CRKP),其耐药机制包括碳青霉烯酶的产生、由孔蛋白丢失或数量减少导致的渗透性改变、主动外排泵系统活跃、高产AmpC酶或ESBLs[5]、碳青霉烯类药物高亲和性结合位点PBP2缺失、数量下降或者亲和性下降等。其中,产生碳青霉烯酶是最主要的耐药机制,可导致细菌对碳青霉烯类、头孢菌素类、青霉素类等多类抗生素耐药。耐药的肺炎克雷伯菌在医疗环境中传播速度快且传播范围广,非常容易在社区中形成隐匿性传播,成为反复感染病人的感染源,且感染后致死率高,是临床治疗中的一个极大挑战。因此,医疗机构应加强对耐碳青霉烯肺炎克雷伯菌感染的关注。
头孢他啶/阿维巴坦(ceftazidime-avibactam,CZA)为半合成的第3代头孢菌素与新型非β-内酰胺类β-内酰胺酶抑制剂形成的复合制剂[6],其抑酶谱广,可以抑制A类、C类和某些D类β-内酰胺酶。CZA为治疗包括耐碳青霉烯肺炎克雷伯菌在内的耐药革兰氏阴性菌引起的感染带来了新的突破。目前临床使用的头孢他啶/阿维巴坦药敏试验方法为微量肉汤稀释法,该方法成本较高且操作较为复杂。本文收集了从同济大学附属东方医院不同科室患者送检的临床标本中分离出非重复的82株肺炎克雷伯菌,并分析其耐药情况,比较微量肉汤稀释法和纸片扩散法检测肺炎克雷伯菌对头孢他啶/阿维巴坦的药敏检测结果,探讨纸片扩散法替代微量肉汤稀释法的可行性,旨在为临床检测方法的合理选择提供实验室依据,帮助临床尽早选择可用药物,改善患者预后。
1 材料与方法 1.1 菌株来源与鉴定选择从上海市同济大学附属东方医院2022年10月—12月的临床患者标本中分离的非重复KPN菌株,共82株。全部菌株使用法国生物梅里埃公司Vitek-2 compact全自动微生物分析系统进行鉴定,并经16S rRNA基因测序来确认菌株鉴定结果。
1.2 质控菌株铜绿假单胞菌ATCC27853、大肠埃希菌ATCC25922、金黄色葡萄球菌ATCC29213、大肠埃希菌ATCC35218均来自上海市临床检验中心。
1.3 仪器与试剂哥伦比亚血平板、MH平板购自赛默飞世尔生物化学制品有限公司。细菌鉴定仪(Vitek-2 compact)及配套试剂购自法国梅里埃公司。头孢他啶/阿维巴坦微量肉汤稀释法试剂购自温州康泰生物技术有限公司。两种头孢他啶/阿维巴坦药敏纸片药敏纸片(30 μg/20 μg)分别购自温州康泰生物技术有限公司和英国MAST公司。校准合格的游标卡尺。Xpert Carba-R试剂盒和Gene Xpert仪器购自美国赛沛公司。
1.4 方法 1.4.1 样品制备① 菌株复苏:所有入组菌株转种于哥伦比亚血平板复苏,放置于细菌培养箱35 ℃ 5%CO2培养16~24 h。②菌种鉴定:从培养平板上挑取一个独立的菌落。使用含0.45% NaCl无菌水(即每100 mL无菌水中含0.45 g NaCl)来制备菌液,将菌液浓度调整至1.5×108 CFU/mL。使用Vitek-2细菌鉴定卡片GN进行菌种鉴定。再使用16S rRNA基因测序对鉴定菌株进行验证。
1.4.2 ESBLs确证实验① 菌株复苏。②制备药敏平板:用一次性接种环挑选琼脂平板上纯培养或形态相同的菌落,混匀于3 mL 0.45% NaCl无菌水中,将待检菌株制备成0.5麦氏浊度的均匀菌悬液,确保无颗粒或块状物,在MH琼脂平板上均匀涂布。③待琼脂完全吸收菌悬液后,添加头孢他啶和头孢他啶/克拉维酸及头孢噻肟和头孢噻肟/克拉维酸药敏纸片。将平板置于细菌培养箱35 ℃中孵育18~24 h,并采用游标卡尺测量抑菌圈的直径。1组添加头孢他啶或头孢噻肟,2组添加头孢他啶/克拉维酸或头孢噻肟/克拉维酸,这两组中任何一个药物,加与不加克拉维酸抑菌圈直径相比增加≥5 mm时,则判定为产ESBL。
1.4.3 酶抑制剂增强试验检测肺炎克雷伯菌产碳青霉烯酶表型① 复苏菌株。②制备药敏平板。③待琼脂完全吸收菌悬液后贴4张亚胺培南纸片,一张纸片不加任何液体,一张纸片添加10 μL磷酸铵缓冲液(ammonium phosphate buffer,APB)溶液,一张纸片滴加10 μL乙二胺四乙酸(ethylenediaminetetra-acetic acid,EDTA)溶液,最后一张同时滴加10 μL APB溶液和10 μL EDTA溶液。将平板置于细菌培养箱35 ℃培养16~20 h,用游标卡尺量取纸片抑菌圈直径。添加APB溶液的亚胺培南纸片抑菌圈直径与单药纸片相差≥5 mm,即可判断该受试菌株产A类碳青霉烯酶;添加EDTA溶液的亚胺培南纸片抑菌圈直径与单药纸片相差≥5 mm,即可判断该受试菌株产生B类碳青霉烯酶;如含酶抑制剂的亚胺培南纸片抑菌圈直径与单药相差均<5 mm,则可判断该菌不产A类或B类碳青霉烯酶。
1.4.4 实时荧光PCR法检测耐药基因① 菌株复苏。②将复苏后的菌株配置成浓度为0.5麦氏浓度的菌悬液,在一次性试管中加入3 mL稀释液,吸取10 μL菌悬液到试管中漩涡振荡,吸取1.7 mL振荡后的混合液加到GeneXpert试剂盒中,盖上试剂盒盖子,在赛沛GeneXpert机器上进行检测。③检测的目的基因及其对应的酶型:该方法主要检测5种目的基因,分别为KPC、NDM、IMP-1、VIM、OXA-48。KPC基因型产生碳青霉烯酶;NDM基因型产生新德里金属β-内酰胺酶;IMP-1基因型产生亚胺培南金属酶;VIM基因型产生产维罗纳整合子型金属β-内酰胺酶;OXA-48基因型产生苯唑西林酶48。
1.4.5 微量肉汤稀释法检测头孢他啶/阿维巴坦最低抑菌浓度① 菌株复苏。②取出冷冻保存的药敏板,恢复至室温。用接种环挑取经18~24 h培养的新鲜菌落3~5个,碾磨于0.45% NaCl无菌水中,调制成0.5麦氏浊度的均匀菌悬液(15 min内使用)。吸取调好的菌液,加到液体药敏试验培养基中,菌液和培养基的比例为1: 200,充分混匀再按每孔100 μL加到药敏板内的各个凹孔中。③细菌于培养箱35 ℃孵育16~20 h,通过浊度判断各孔内细菌的生长情况,由低浓度向高浓度,能抑制细菌生长的最低药物浓度即为该药的最低抑菌浓度(minimal inhibitory concentration, MIC)。
1.4.6 纸片扩散法检测头孢他啶/阿维巴坦抑菌圈直径① 菌株复苏。②在MH琼脂平板上均匀涂布制备好的菌悬液。待琼脂完全吸收菌悬液后再贴上头孢他啶/阿维巴坦(30 μg/20 μg)药敏纸片。将贴上纸片的平板置于35 ℃孵箱培养18~24 h,用游标卡尺测量抑菌圈的直径。③质控菌株按同样方法进行检测,确保结果符合控制标准。
1.4.7 药敏结果分析① 纸片扩散法:抑菌圈直径≥21 mm时为敏感,抑菌圈直径≤20 mm时为耐药;②微量肉汤稀释法:MIC≤ 8/4 mg/L时为敏感,MIC≥ 16/4 mg/L时为耐药。以微量肉汤稀释法的检测结果作为CZA药敏结果的参考,将纸片扩散法检测结果与其进行比较。
1.4.8 统计学处理采用卡方检验比较两种药敏纸片(扩散法)与微量肉汤稀释法(参考方法)的结果差异,P<0.05代表差异具有统计学意义。
通过以下指标评估扩散法与参考方法间的一致性:分类一致性(category agreement,CA)、假敏感[极重大错误(very major error,VME)]以及假耐药[重大错误(major error,ME)]等,以综合判读其可靠性。可接受的标准是:需要同时满足CA≥90%、VME≤3%以及ME≤3%[7]。
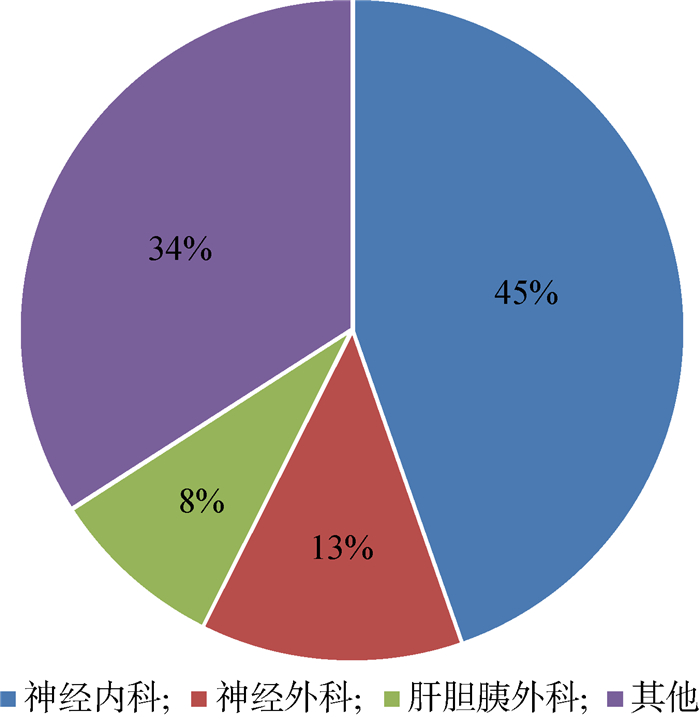
2 结果 2.1 肺炎克雷伯菌分布情况及耐药表型和耐药基因在82株肺炎克雷伯菌中,ESBLs确证实验检测出产ESBLs菌株6株;酶抑制剂增强试验检测出耐碳青霉烯肺炎克雷伯菌菌株47株,不耐药菌株29株。82株肺炎克雷伯菌具体科室分布情况如图 1所示。
|
| 图 1 82株肺炎克雷伯菌的临床分布情况 Fig. 1 Clinical distribution profile of 82 Klebsiella pneumoniae strains |
在47株耐碳青霉烯肺炎克雷伯菌菌株中,40株为产A组碳青霉烯酶,7株为产B组碳青霉烯酶(见表 1)。耐碳青霉烯肺炎克雷伯菌检出率最高的科室为神经内科(44.7%,21/47),其次为神经外科(12.8%,6/47)和肝胆胰外科(8.5%,4/47)。通过实时荧光PCR法检测耐药基因,得出其中40株为blaKPC型,7株为blaNDM型。
| 菌株种类 | 检出数量(个) | 检出率(%) |
| 产ESBLs肺炎克雷伯菌 | 6 | 7.3 |
| 产KPC肺炎克雷伯菌 | 40 | 48.8 |
| 产NDM肺炎克雷伯菌 | 7 | 8.5 |
耐药基因型(PCR法)与表型(酶抑制剂增强试验)检测结果比对显示,82株肺炎克雷伯菌中碳青霉烯酶基因检出率与表型阳性率完全一致(符合率为100%)(见表 2)。
| PCR法 | 酶抑制剂增强试验 | 合计 | |
| 产A组碳青霉烯酶(株) | 产B组碳青霉烯酶(株) | ||
| blaKPC | 40 | 0 | 40 |
| blaNDM | 0 | 7 | 7 |
| 合计 | 40 | 7 | 47 |
以微量肉汤稀释法作为参考方法,使用温州康泰和英国MAST纸片头孢他啶/阿维巴坦(30 μg/20 μg)进行药敏试验。微量肉汤稀释法、温州康泰纸片及MAST纸片检测出82株肺炎克雷伯菌对CZA的敏感率分别为90.2%、91.5%、92.7%。卡方检验结果P值均大于0.05,表明2种纸片扩散法的药敏结果和微量肉汤稀释法的结果没有显著差异(见表 3)。
| 药敏结果 | 微量肉汤稀释法 | 纸片扩散法 | P1 | P2 | |
| 温州康泰 | MAST | ||||
| 敏感 | 74(90.2) | 75(91.5) | 76(92.7) | 0.412 | 0.415 |
| 耐药 | 8(9.8) | 7(8.5) | 6(7.3) | / | / |
| 注:P1、P2分别代表使用温州康泰公司头孢他啶/阿维巴坦(30 μg/20 μg)纸片、英国MAST公司头孢他啶/阿维巴坦(30 μg/20 μg)纸片两种纸片扩散法和微量肉汤稀释法之间敏感率的比较,“/”代表此表格中数据不做比较。 | |||||
按照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)的判读标准[8],以微量肉汤稀释法结果作为参考方法,温州康泰纸片扩散法和MAST纸片扩散法的CA率分别为98.3%、99.7%,VME率分别为12.5%、25%,ME率均为0。参照CLSI规定,头孢他啶/阿维巴坦(30 μg/20 μg)抑菌圈直径为20~22 mm的菌株,需要用MIC试验确认,以避免报告假敏感或假耐药结果。82株肺炎克雷伯菌药敏结果中,有2株使用温州康泰药敏纸片扩散法抑菌圈直径为20 mm,被判为耐药,微量肉汤稀释法的MIC结果亦为耐药,两者结果一致。有5株肺炎克雷伯菌使用MAST纸片扩散法抑菌圈直径为22 mm,被判断为敏感,微量肉汤稀释法结果亦为敏感,两者结果一致。
| 菌株号 | 菌名 | 微量肉汤稀释法 | 温州康泰纸片扩散法 | MAST纸片扩散法 | |||||
| 结果 (μg/mL) |
质控范围 (μg/mL) |
结果 (mm) |
质控范围 (mm) |
结果 (mm) |
质控范围 (mm) |
||||
| ATCC27853 | 铜绿假单胞菌 | 0.5/4 | 0.5/4~4/4 | 29 | 25~31 | 28 | 25~31 | ||
| ATCC25922 | 大肠埃希菌 | 0.125/4 | 0.06/4~0.5/4 | 32 | 28~35 | 32 | 28~35 | ||
| ATCC29213 | 金黄色葡萄球菌 | 8/4 | 4/4~16/4 | 21 | 16~22 | 22 | 16~22 | ||
| ATCC35218 | 大肠埃希菌 | 0.125/4 | 0.03/4~0.12/4 | 32 | 28~35 | 30 | 28~35 | ||
细菌耐药性问题日益严峻,已成为重症医学科等临床科室的重要挑战。在各种耐药菌中,以革兰氏阴性杆菌最为常见,特别是碳青霉烯耐药的革兰氏阴性杆菌,所以,耐碳青霉烯革兰氏阴性杆菌引起的感染治疗目前已成为感染病学领域亟待解决的难题。近几年,耐碳青霉烯肺炎克雷伯菌流行态势尤为突出[9-10]。研究表明,耐碳青霉烯肺炎克雷伯菌的耐药机制有2个,其中最主要的是产生碳青霉烯酶,以KPC为主[11],这也与本文的研究结果相符合。近年来,产NDM型金属酶的耐碳青霉烯肺炎克雷伯菌的菌株也逐渐增多[12]。
耐碳青霉烯肺炎克雷伯菌感染的危险因素包括:多次或长期住院史、ICU入住、侵入性检查或治疗史、最近手术史、免疫力低下(如血液肿瘤患者)、严重基础疾病、多种抗菌药物使用史以及存在耐碳青霉烯肺炎克雷伯菌的定植情况。在临床上,耐碳青霉烯肺炎克雷伯菌感染治疗困难且病死率高,且抗菌药物单药的疗效往往不理想,大部分情况下需要联合用药方案。头孢他啶/阿维巴坦为新型非β-内酰胺类β -内酰胺酶抑制剂复合制剂[13],通过广谱抑酶活性(尤其对KPC型碳青霉烯酶),为治疗包括耐碳青霉烯肺炎克雷伯菌在内的耐药革兰氏阴性菌引起的感染带来了新的突破。所以,及时准确地为临床提供肺炎克雷伯菌对头孢他啶/阿维巴坦的药敏结果十分重要。
纸片扩散法作为传统方法,其优点是操作较为简单,成本比微量肉汤稀释法低廉。本研究采用微量肉汤稀释法(参考方法)和纸片扩散法(温州康泰和英国MAST公司产品)检测82株肺炎克雷伯菌对头孢他啶/阿维巴坦(CZA)的敏感性,两种方法的药物敏感性结果基本一致,表明临床使用纸片扩散法检测肺炎克雷伯菌对头孢他啶/阿维巴坦是否耐药有较高的可靠性。且与微量肉汤稀释法相比,使用温州康泰和英国MAST公司两种纸片的纸片扩散法CA>90%,ME为0。CLSI中要求可接受的误差范围为:CA≥90%,ME≤3%[8],表明本文的替代方法具有一定的可行性。在8株对头孢他啶/阿维巴坦耐药的耐碳青霉烯肺炎克雷伯菌中,有1株使用温州康泰药敏纸片判定为敏感,有2株使用英国MAST药敏纸片判定为敏感,所得VME分别为12.5%和25%,超出了CLSI的标准。分析该结果是因为本实验样本量过小(耐药菌株仅8株),纸片扩散法具有一定的局限性。头孢他啶/阿维巴坦作为新药,目前在临床上治疗耐碳青霉烯肺炎克雷伯菌引起的感染耐药率较低,后续应加大实验样本量,观察纸片扩散法的VME是否符合CLSI的标准。此外,对于头孢他啶/阿维巴坦(30 μg/20 μg)抑菌圈直径为20~22 mm的菌株,须用微量肉汤稀释法进行确认,以避免报告假敏感或假耐药结果。本试验中,抑菌圈直径为20~22 mm的菌株均符合微量肉汤稀释法的复核结果。综上所述,本文认为纸片扩散法可以作为替代方法为临床快速提供头孢他啶/阿维巴坦的药敏结果,但仍须采用微量肉汤稀释法进行敏感性确认。
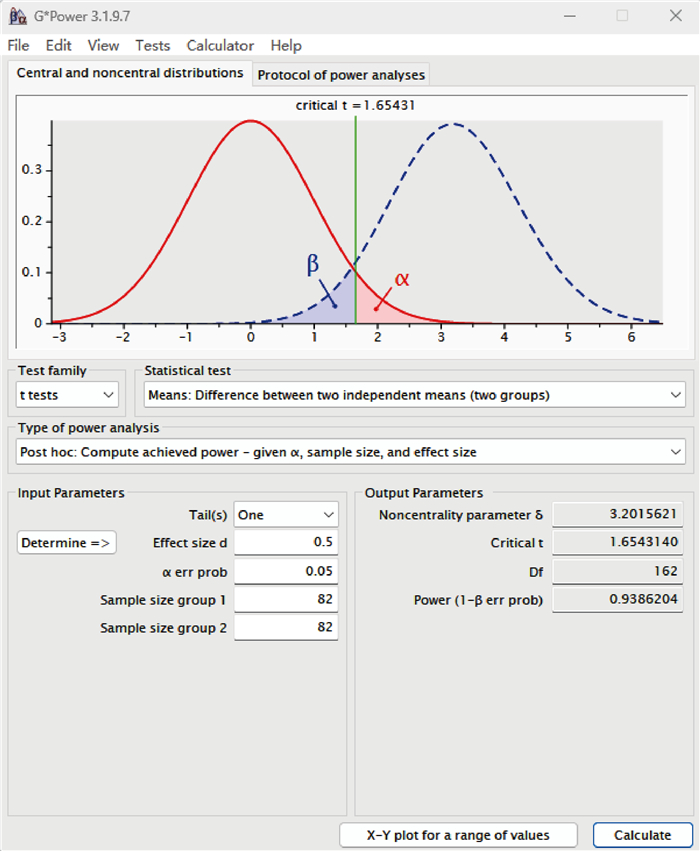
本研究存在以下局限:首先,本文使用G*power软件进行Post-hoc分析表明,当前样本量(n=82)对检测d=0.5的效应量功效为93.86%,符合常规标准(见图 2)。尽管通过功效分析证实样本量已满足基本需求[7-8],但因为耐药菌株仅8例,在亚组分析中的统计效能可能降低,这提示未来需要多中心合作研究。因本研究收集标本的时间较短,且采样医院的目标人群总量有限,导致样本量较少,属于初步探索。但本研究严格纳入排除标准,并使用了高精度检测设备,旨在为后续大样本研究提供方向性证据。
|
| 图 2 G * power软件post-hoc功效分析结果 Fig. 2 Analysis results of post-hoc efficacy of G * power software |
纸片扩散法检测头孢他啶/阿维巴坦的药敏结果和微量肉汤稀释法的结果基本一致,且抑菌圈直径在20~22 mm的菌株经微量肉汤稀释法验证的结果一致,证明纸片扩散法可以在临床检测KPN对头孢他啶/阿维巴坦的药敏试验中替代微量肉汤稀释法,但仍须采用微量肉汤稀释法进行确认,避免出现假敏感结果。
| [1] |
Tängdén T, Giske CG. Global dissemination of extensively drugresistant carbapenemase producing Enterobacteriaceae: clinical perspectives on detection, treatment and infection control[J]. J Intern Med, 2015, 277(5): 501-512.
[DOI]
|
| [2] |
Molton JS, Tambyah PA, Ang BS, Ling ML, Fisher DA. The blobal spread of healthcare ass-ociated multidmg resistant bacteria: a perspective from Asia[J]. Clin Infect Dis, 2013, 5(9): 1310-1318.
|
| [3] |
Patel G, Bonomo RA. Status report on carbapenemases: challenges and prospects[J]. Expert Rev Anti Infect Ther, 2011, 9(5): 555-570.
|
| [4] |
World Health Organization. Antimicrobial resistance: global report on surveillance[R]. Geneva: World Health Organization, 2014.
|
| [5] |
Chen L, Mathema B, Chavda KD, DeLeo FR, Bonomo RA, Kreiswirth BN. Carbapenemase producing Klebsiella pneumoniae: molecular and genetic decoding[J]. Trends Microbiol, 2014, 22(12): 686-696.
[PubMed]
|
| [6] |
MacVane SH, Crandon JL, Nichols WW, Nicolau DP. In vivo efficacy of humanized exposures of ceftazidime-avibactam in comparison with ceftazidime against contemporary enter obacteriaceae isolates[J]. Antimicrob Agents Chemother, 2014, 58(11): 6913-6919.
[PubMed]
|
| [7] |
中华人民共和国国家卫生健康委员会. 抗菌药物敏感性试验的技术要求: WS/T639-2018[S]. 北京: 中国标准出版社, 2018.
|
| [8] |
Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing[S]. 33rd ed., CLSI supplement M100. Wayne, PA: Clinical and Laboratory Standards Institute, 2023.
|
| [9] |
Logan LK, Weinstein RA. The epidemiology of carbapenem resistant Enterobacteriaceae: the impact and evolution of a global menace[J]. J Infect Dis, 2017, 215(suppl1): S28-S36.
[DOI]
|
| [10] |
Marsh JW, Krauland MG, Nelson JS, Schlackman JL, Brooks AM, Pasculle AW, Shutt KA, Doi Y, Querry AM, Muto CA, Harrison LH. Genomic epidemiology of anendoscope-associated out break of Klebsiella pneumoniae. Carbapenemase (KPC)-producing K. pneumoniae[J]. PLoS One, 2015, 10(12): e0144310.
[DOI]
|
| [11] |
Yigit H, Queenan AM, Rasheed JK, Biddle JW, Domenech-Sanchez A, Alberti S, Bush K, Tenover FC. Carbapenemresistant strain of Klebsiella oxytoca harboring carbapenem-hydrolyzing Beta-lactamase KPC-2[J]. Antimicrob Agents Chemother, 2003, 47(12): 3881-9.
[DOI]
|
| [12] |
Zhang R, Liu L, Zhou H, Chan EW, Li J, Fang Y, Li Y, Liao K, Chen S. Nationwide surveillance of clinical carbapenem-resistant Enterobacteriaceae (CRE) strains in China[J]. EBioMedicine, 2017, 19: 98-106.
[PubMed]
|
| [13] |
Vena A, Castaldo N, Bassetti M. The role of new β-lactamase inhibitors in gram-negative infections[J]. Curr Opin Infect Dis, 2019, 32(6): 638-646.
[PubMed]
|
| [14] |
Liang Q, Huang M, Xu Z. Early use of polymyxin B reduces the mortality of carbapenem-resistant Klebsiella pneumoniae bloodstream infection[J]. Braz J Infect Dis, 2019, 23(1): 1-6.
[PubMed]
|
 2025, Vol. 20
2025, Vol. 20


