近几十年来,人类免疫缺陷病毒、埃博拉病毒、寨卡病毒、严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)等严重传染性疾病的病原体的广泛流行,对全球公共安全和人类健康构成了严重威胁。接种疫苗仍然是控制传染病全球大流行的最有效手段。传统疫苗(如灭活疫苗、减毒疫苗等)的研发和生产须进行完整的病原体培养,面对新发传染病和病毒的快速变异,显现出研发时间长、生产能力有限的短板。因此,亟须开发能够实现快速构建和大规模生产疫苗的新技术。核酸疫苗具有易于设计、制备工艺简单、生产成本低、研发周期短、对不断变化的病原体的快速适应性强等优点,近年来已经在全球疫苗研发中占据重要地位[1-2]。然而,核酸疫苗在应用过程中仍面临着诸多问题,如易被体内核酸酶降解、生物稳定性不佳、带负电荷的核酸难以跨越细胞膜屏障、内体逃逸困难等,导致核酸疫苗转染效率低下、难以达到预期的免疫保护效果[3-4]。递送载体能够包裹核酸使其免受降解,增强疫苗的免疫效力[5]。因此,开发安全、高效的核酸递送载体,提高核酸疫苗递送效率成为核酸疫苗领域的研究热点。
核酸疫苗载体可分为病毒载体和非病毒载体2类。相较于病毒载体,非病毒载体具有递送容量高、安全性好、生产成本低和易大规模生产等优势[6-7]。其中,聚(β-氨基酯)[poly(β-amino ester),PBAE]是一类有前景的核酸递送载体,它具有可生物降解的酯键结构,可以通过简单的Michael加成反应将胺单体与二丙烯酸酯聚合而成[8]。阳离子聚合物PBAE能够通过静电相互作用包封带负电荷的核酸,形成PBAE纳米颗粒(PBAE nanoparticles,PBAE-NPs),通过细胞内吞途径实现核酸的胞内运输[9-11]。当PBAE-NPs进入内体后,PBAE上的氨基引发质子海绵效应,使细胞中的内体破裂,释放核酸到细胞质中,进而发挥其生物活性[12]。然而,由于PBAE自身具有在丰富的正电荷和生理条件下易发生水解反应的酯键,其血清稳定性不佳,限制了其核酸递送效率[13]。
纳米颗粒载体可通过配体分子(抗体、多肽、甘露糖等)实现进一步功能化修饰[14-17]。许多研究已经表明,表面修饰是提高PBAE递送载体稳定性的有效策略[18-19]。对PBAE-NPs进行表面修饰,可以有效减少其与血液成分的相互作用,增强其在生理条件下的稳定性,延长循环时间,从而提高PBAE-NPs作为核酸递送载体的稳定性和核酸转染效率[20]。聚谷氨酸(poly(glutamic acid),PGA)是一种水溶性、安全无毒的天然阴离子聚合物,是较为理想的阴离子生物材料。通过静电相互作用,将带负电荷的PGA修饰在纳米颗粒表面,可以降低纳米颗粒的正电性,增强其生物相容性,有利于提高纳米颗粒的细胞转染效率[21]。
本研究提出一种新型核酸递送策略,通过核酸与阳离子聚合物PBAE自组装形成PBAE-NPs,并在其表面包覆PGA,制备得到核-壳式PGA修饰的PBAE纳米颗粒(PGA modified PBAE nanoparticles,PPs)。本文通过结构表征和生物学评价探究了PPs作为核酸递送载体的性能。研究结果显示,相较于PBAE-NPs,PPs展现出强大的溶酶体逃逸能力、高效的核酸转染效率和良好的生物相容性,为核酸疫苗载体的设计提供了新的思路。
1 材料与方法 1.1 实验材料 1.1.1 细胞DC2.4细胞、RAW 264.7细胞购自中国科学院细胞库。
1.1.2 质粒真核表达质粒pEGFP-N1、pCAGGS-RBD均由本实验室保存。
1.1.3 试剂5-氨基-1-戊醇、1,4丁二醇二丙烯酸酯、1-(3-氨丙基)-4-甲基哌嗪、聚L-谷氨酸钠盐、二甲基亚砜购自美国Sigma-Aldrich公司,DMEM培养基购自上海源培生物科技股份有限公司,胎牛血清(fetal bovine serum,FBS)购自新西兰NEWZERUM公司,CCK8试剂盒购自上海翌圣生物科技股份有限公司,Label ITⓇ TrackerTM试剂盒购自上海达科为生物技术股份有限公司。
1.2 实验方法 1.2.1 PBAE的合成和表征通过Michael加成反应合成阳离子聚合物PBAE。具体而言,按照酯单体和胺单体为1.2∶1的摩尔比,精准称量1, 4-丁二醇二丙烯酸酯与5-氨基-1-戊醇,以酯单体、胺单体的顺序依次加入烧瓶中,使用磁力搅拌器进行充分搅拌混匀,在避光条件下,95 ℃油浴24 h。
取得2.3 g反应产物,即酯单体封端聚合物PBAE45,溶解于2 mL四氢呋喃中。在13 mL四氢呋喃中溶解786 mg的1-(3-氨丙基)-4-甲基哌嗪,加入聚合物PBAE45/四氢呋喃,在室温下搅拌反应12 h,获得哌嗪封端的聚合物PBAE457[22]。用10倍体积的乙醚沉淀得到的聚合物PBAE457,去除未反应的小分子。收集聚合物,再次用2倍体积的乙醚进行2次重复洗涤,去除上清液。收集聚合物,室温真空干燥48 h,将获得的聚合物保存于-20 ℃冰箱备用,或用二甲基亚砜配置终浓度为100 mg/mL的PBAE溶液用于后续实验。
聚合物PBAE的纯度通过1H-NMR图谱表征,样品溶于氘代二甲基亚砜中。PBAE的分子量使用凝胶渗透色谱(gel permeation chromatography,GPC)测定,流动相为四氢呋喃。
1.2.2 纳米颗粒的制备与表征按照PBAE与核酸为30∶1质量比(w/w)制备纳米颗粒。具体操作如下:将pCAGGS-RBD质粒或RBD-mRNA溶解于pH值为5.2的25 mmol/L乙酸钠溶液中,终浓度为40 μg/mL。用25 mmol/L乙酸钠溶液将100 mg/mL聚合物PBAE稀释至终浓度为1.2 mg/mL。将上述稀释好的核酸溶液和PBAE溶液等体积混匀,室温下静置10 min,获得DNA-NPs或mRNA-NPs。按照PGA与核酸为2.5∶1的质量比,加入适量体积的100 μg/mL PGA溶液,混匀后室温静置5 min,获得DNA-PPs或mRNA-PPs用于后续实验。
采用透射电子显微镜观察纳米颗粒形貌:分别取10 μL新鲜制备的PBAE-NPs和PPs样品滴在碳支持膜上,静置5 min后,用滤纸吸弃多余液体,在红外灯下烘干,使用透射电子显微镜(JEOL JEM-1400)观察PBAE-NPs和PPs纳米颗粒的形态。
粒径和Zeta电位测定:采用动态光散射粒度仪(Nano ZS-ZEN3600)检测颗粒的粒径和表面电位。对新鲜制备的PBAE-NPs和PPs,每组设置3个平行样本进行粒径和Zeta电位检测。
1.2.3 琼脂糖凝胶电泳将0.7 g琼脂糖溶于70 mL TAE电泳缓冲液中,加热溶解,加入7 μL YeaRed核酸染料,配置质量分数为1%的琼脂糖凝胶。分别按照PBAE和核酸不同的质量比(0∶1,5∶1,15∶1,30∶1,45∶1,60∶1,75∶1,90∶1和120∶1)制备获得PBAE-NPs。取制备的PBAE-NPs样品,加入5×上样缓冲液,充分混匀,进行1%琼脂糖凝胶电泳。设定电压为130 V,电泳40 min后,停止电泳。于凝胶成像系统上观察、拍照。
抗DNaseⅠ酶切作用:取新鲜制备的PBAE-NPs和PPs,与80 U/mL DNaseⅠ共孵育,37 ℃水浴孵育15 min。取反应后的样品,加入5×上样缓冲液,充分混匀,进行1%琼脂糖凝胶电泳,电泳条件同上。
抗血清解离作用:取新鲜制备的PBAE-NPs和PPs,与体积分数10% 的FBS共孵育,37 ℃水浴孵育30 min。取反应后的样品,加入5×上样缓冲液,充分混匀,进行1%琼脂糖凝胶电泳,电泳条件同上。
1.2.4 细胞毒性检测采用CCK-8法检测不同浓度PBAE对DC 2.4细胞和RAW 264.7细胞的细胞毒性。使用培养基分别将RAW 264.7细胞密度调整至1×105/mL或将DC 2.4细胞密度调整至5×104/mL,将细胞均匀地接种到96孔板中,每孔中的细胞培养体积为100 μL,在37 ℃,5% CO2培养箱内培养至细胞密度达90%。用无血清培养基将100 mg/mL的PBAE原液稀释成一系列浓度(5 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL、300 μg/mL和400 μg/mL),分别加入培养板中(每孔100 μL),继续孵育6 h或24 h。吸弃原有培养基,向每孔加入90 μL新鲜培养基和10 μL CCK-8溶液,将培养板在培养箱内孵育2 h,终止培养。用酶标仪在450 nm处测定每孔的吸光度并计算细胞活力。
采用CCK-8法检测不同PGA含量的PPs对DC 2.4细胞的细胞毒性。首先,按照PBAE与DNA的质量比为30∶1制备获得PBAE-NPs。其次,按照PGA∶PBAE∶DNA不同的质量比(0.5∶30∶1,1∶30∶1,2.5∶30∶1,5∶30∶1,10∶30∶1和20∶30∶1)制备获得不同PGA含量的PPs,向96孔板中每孔加入含有0.2 μg DNA的PPs,继续孵育24 h。吸弃原有培养基,向每孔加入90 μL新鲜培养基和10 μL CCK-8溶液,将培养板在培养箱内孵育2 h,终止培养。用酶标仪在450 nm处测定每孔的吸光度并计算细胞活力。
1.2.5 纳米颗粒溶酶体逃逸性能研究使用培养基调整RAW 264.7细胞密度至1×105/mL,取1.5 mL细胞悬液均匀地接种到共聚焦培养皿中,在培养箱内孵育24 h。使用Label ITⓇ TrackerTM试剂盒制备标记有Cy5的pCAGGS-RBD质粒。按照PBAE与Cy5标记pCAGGS-RBD的质量比为30∶1制备获得含有Cy5标记DNA的PBAE-NPs和PPs。向每个共聚焦培养皿中分别加入含有1 μg Cy5标记DNA的PBAE-NPs或PPs,在培养箱中孵育2 h或6 h,吸弃培养基,加入浓度为50 nmol/L的Lyso Tracker Green DND-26溶酶体绿色荧光探针,在37 ℃培养箱中孵育30 min。使用磷酸缓冲盐溶液(phosphate buffered saline, PBS)洗涤2次后,加入10 μg/mL的Hoechst工作液,室温孵育10 min,PBS洗涤2次后,使用激光共聚焦显微镜观察纳米颗粒进入细胞后的溶酶体逃逸情况。采用Image J数据软件plot profile功能计算纳米颗粒(红色)和溶酶体(绿色)的重叠程度。
1.2.6 纳米颗粒体外转染效率研究使用培养基调整RAW 264.7细胞密度至5×105/mL或DC 2.4细胞密度至1×105/mL,将细胞均匀地接种到12孔板中,每孔细胞培养体积为1 mL,在培养箱内培养。当细胞密度达到80%~90%时,开始进行转染操作。
不同质量比的PBAE-NPs转染效率检测:将PBAE与pEGFP-N1质粒按照不同的质量比(5∶1,15∶1,30∶1,45∶1,60∶1)制备获得PBAE-NPs,向12孔板中每孔加入含有1 μg DNA的PBAE-NPs,孵育4 h后将培养基更换为新鲜完全培养基。同时设置空白对照和PEI对照组,PEI转染用量和实验操作参考试剂说明书。
PBAE-NPs和PPs转染效率检测:按照PBAE与DNA的质量比为30∶1制备获得PBAE-NPs和PPs,向12孔板中每孔加入含有1 μg DNA的PBAE-NPs,孵育4 h后将培养基更换为新鲜完全培养基。同时,设置空白对照和PEI对照组,PEI转染用量和实验操作参考试剂说明书。
转染48 h后,使用荧光显微镜对绿色荧光蛋白(green fluorescent protein,GFP)报告基因pEGFP-N1的体外转染效率进行定性观察,同时使用流式细胞术对pEGFP-N1体外转染效率进行定量评价。
1.3 统计学分析采用GraphPad Prism 8进行图形绘制,曲线或柱状图的数据用重复值±标准差表示。采用one-way ANOVA分析进行组间比较,P<0.05表示差异具有统计学意义。
2 结果 2.1 PBAE的合成与表征如图 1A所示,通过两步法合成哌嗪封端的阳离子聚合物PBAE457。通过1H-NMR对中间产物PBAE45和最终产物PBAE457进行结构表征。如图 1B所示,PBAE45中关键的特征峰归属如下:1H-NMR (600 MHz) δ5.93(dd,J=10.2,1.6 Hz,2H,—CH2CH2COOCH=CH2),6.16(dd,J=17.3,10.3 Hz,2H,—CH2CH2COOCH=CH2),6.33(dd,J=17.3,1.6 Hz,2H,—CH2CH2COOCH=CH2)。上述结果显示,在1H-NMR化学位移5.9~6.4范围内,丙烯酸酯的烯双键上的氢特征峰在经过1-(3-氨丙基)-4-甲基哌嗪封端后消失,表明聚合物PBAE457成功实现了哌嗪的完全封端。通过GPC检测PBAE457的分子量。根据GPC结果可知,PBAE457的数均分子量为4 925 Da,重均分子量为8 352 Da,多分散系数为1.696(见图 1C)。上述结果表明,本研究成功合成了聚合物PBAE457,可进一步用于后续实验。
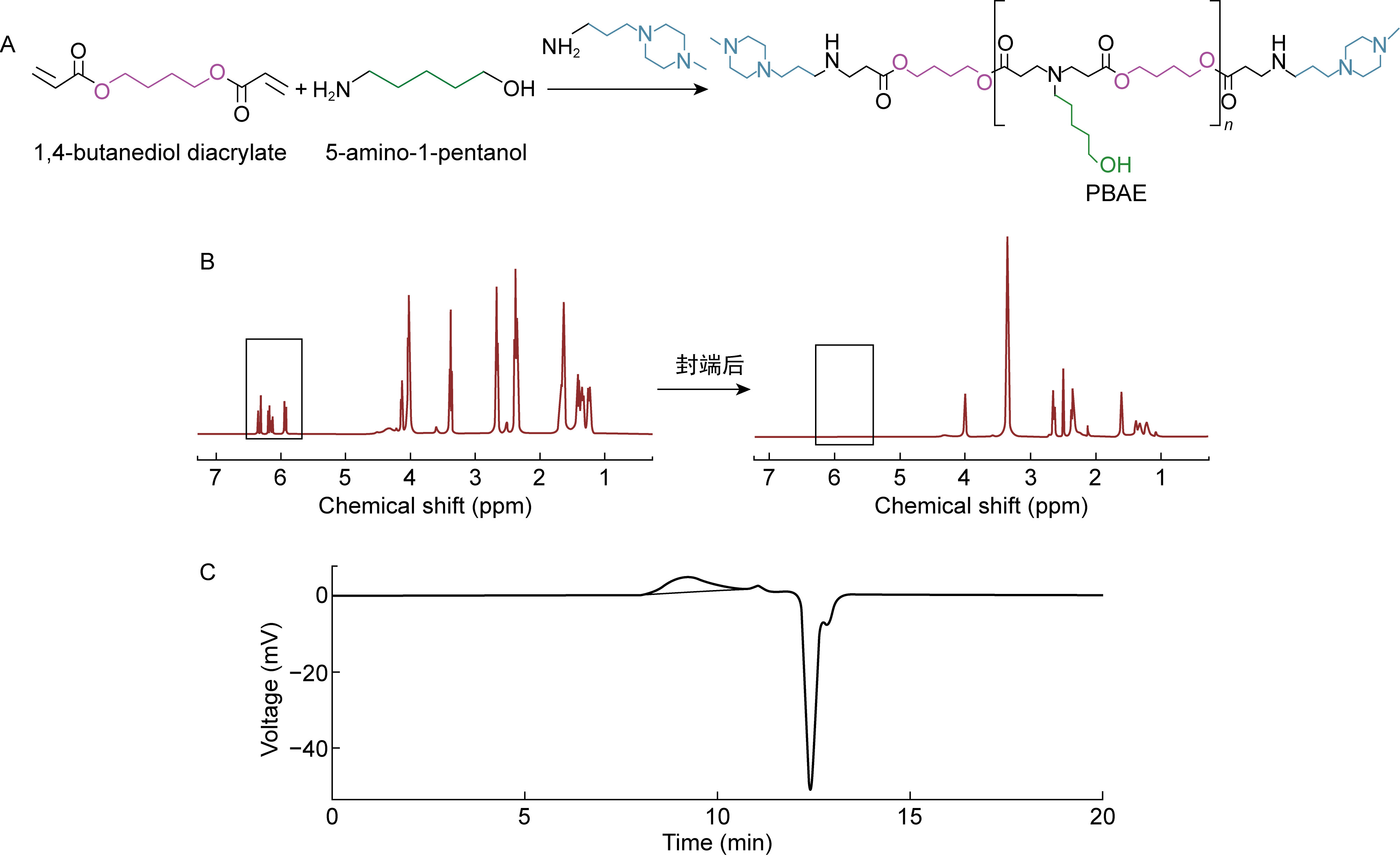
|
| A: The synthetic schemes of PBAE. B: The 1H-NMR spectrum of PBAE45 and PBAE457. C: GPC traces of PBAE457. 图 1 PBAE的制备与表征 Fig. 1 Synthesis and characterization of poly (β-amino esters) |
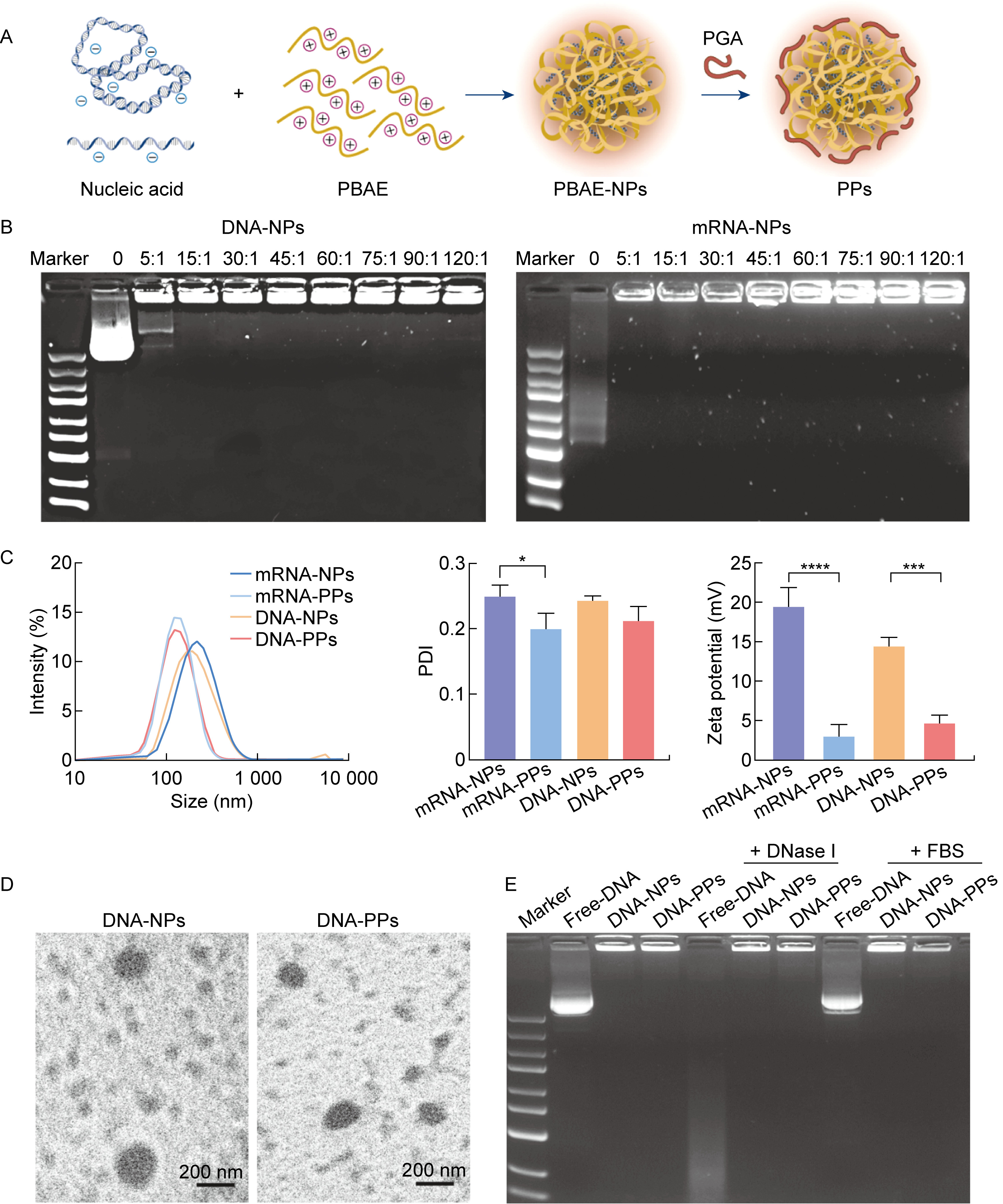
阳离子聚合物PBAE通过分子内带正电荷的氨基与带负电荷的核酸之间的静电相互作用,有效地压缩核酸,形成PBAE-NPs。本研究进一步利用带负电荷的PGA对PBAE-NPs进行修饰,构建了核-壳式核酸递送载体PPs(见图 2A)。
|
|
A: Schematic diagram of nanoparticles synthesis. B: Agarose gel retardation electrophoresis assay (left: DNA-NPs, right: mRNA-NPs). C: The particle sizes, zeta potential and polymer dispersity index (PDI) of different nanoparticles. D: Images of DNA-NPs and DNA-PPs under transmission electron microscopy. E: The protection of nanoparticles against DNaseⅠ and FBS.
*: P < 0.05, ***: P < 0.001, ****: P < 0.000 1. 图 2 纳米颗粒的制备与表征 Fig. 2 Synthesis and characterization of nanoparticles |
使用琼脂糖凝胶电泳实验评估聚合物PBAE对核酸的包封能力(见图 2B)。结果显示,当PBAE与DNA的质量比为5∶1时,可以观察到部分未被封装的DNA条带,提示PBAE在5∶1的质量比条件下可以通过静电作用压缩大部分DNA,但无法完全包封全部DNA。当PBAE和核酸的质量比达到15∶1时,在电泳槽内未观察到游离DNA对应的条带,表明此时PBAE能够完全压缩核酸,并将其阻滞在加样孔中。mRNA-NPs的琼脂糖凝胶电泳结果与DNA-NPs相似。值得注意的是,mRNA十分容易降解,在电泳过程中,未被包封的mRNA容易降解形成拖尾条带,而PBAE能够有效保护mRNA免受降解。
合适的粒径大小有助于纳米颗粒被细胞摄取。使用动态光散射技术检测纳米颗粒的粒径分布和Zeta电位。实验结果显示,mRNA-NPs的粒径为175.2±4.2 nm,mRNA-PPs的粒径为111.4±5.3 nm,DNA-NPs的粒径为175.3±0.4 nm,DNA-PPs的粒径为118.2±8.5 nm(见图 2C)。上述结果表明,PBAE能够有效压缩DNA和mRNA,而PGA修饰能进一步压缩核酸分子,使纳米颗粒的粒径进一步减小。同时,mRNA-PPs的多分散系数相比于mRNA-NPs有所降低(见图 2C)。纳米颗粒易发生颗粒聚集导致粒径分布不均,经过带负电荷的PGA修饰后,可以形成粒径更为均一的颗粒。此外,mRNA-NPs的Zeta电位为19.4±2.5 mV,mRNA-PPs的Zeta电位为2.95±1.5 mV,DNA-NPs的Zeta电位为14.5±1.3 mV,DNA-PPs的Zeta电位为4.6±1.0 mV。上述电位结果表明,相较于PBAE-NPs,经过PGA修饰后的PPs电荷显著下降,表现出更接近于中性的电荷。若PGA的比例过高,易使纳米颗粒反转为负电荷,不利于与带负电荷的细胞膜相互作用,可能降低细胞转染效率,因此选择PGA与核酸的质量比为2.5∶1作为PPs的配方。使用透射电镜观察DNA-NPs和DNA-PPs的形貌。结果显示,PBAE能够有效压缩DNA,呈现均一的球形纳米颗粒(见图 2D)。
纳米颗粒的稳定性是转染成功的关键因素。PBAE在压缩核酸分子的同时也保护核酸免受降解。通过琼脂糖凝胶电泳实验评估DNA-NPs和DNA-PPs在一定浓度DNaseⅠ和FBS中的稳定性。结果显示,与DNaseⅠ共孵育后,游离DNA泳道未观察到明显条带,提示游离DNA已经被DNaseⅠ完全降解。而DNA-NPs和DNA-PPs在加样孔内显示明亮的条带,表明PBAE能够保护DNA免受DNaseⅠ的酶解作用。此外,DNA-NPs和DNA-PPs能够在10% FBS的浓度下保持稳定,说明PBAE具有一定程度的血清稳定性(见图 2E)。
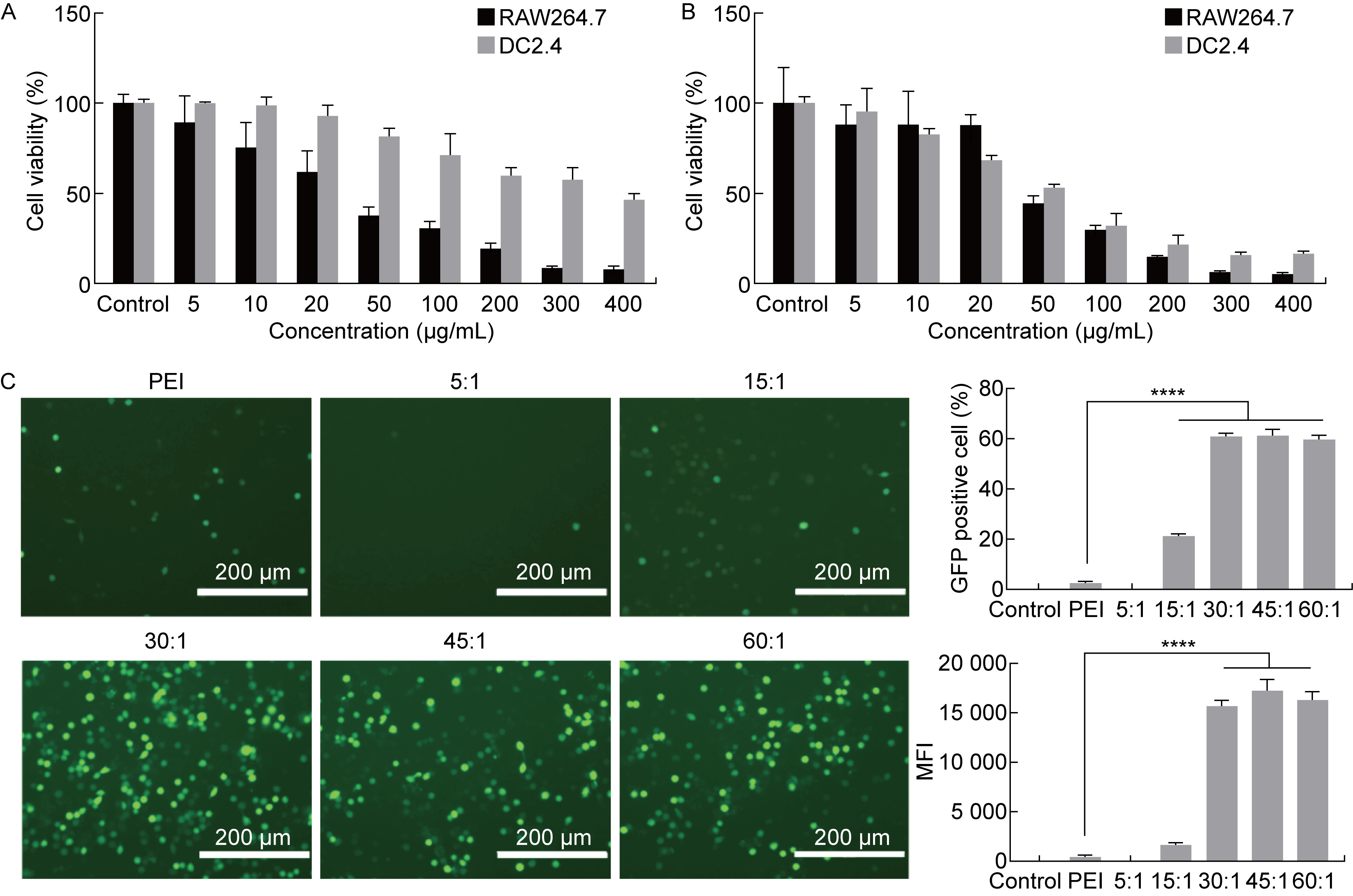
2.3 PBAE-NPs细胞转染能力检测巨噬细胞和树突状细胞是2种常见的抗原呈递细胞。为了筛选出阳离子聚合物PBAE合适的工作浓度,使用CCK-8法考察不同浓度的PBAE对DC 2.4细胞和RAW 264.7细胞的细胞毒性(见图 3A、B)。结果显示,随着聚合物PBAE浓度的提高,其细胞毒性逐渐增加。当PBAE浓度低于50μg/mL时,细胞存活率较高。此外,PBAE与细胞共孵育时间越久,产生的细胞毒性越大。因此,本研究选择在细胞转染4 h后更换新鲜培养基以降低细胞毒性。
|
| A, B: Cytotoxicity of various concentration of PBAE on DC 2.4 and RAW 264.7 cells for 6 h (A) and 24 h (B). C: Transfection efficiency of PBAE-NPs at various weight ratios. ****: P < 0.000 1. 图 3 不同质量比下PBAE-NPs的核酸递送效率 Fig. 3 Nucleic acid delivery efficiency of PBAE-NPs at various weight ratios |
PBAE和DNA的质量比是影响PBAE-NPs核酸递送效率的重要因素,使用pEGFP-N1质粒转染RAW 264.7细胞,考察在不同PBAE和DNA的质量比下PBAE-NPs的转染效率差异。荧光显微镜结果显示,在质量比为5∶1和15∶1时,只有少量GFP表达,而当质量比达到30∶1时,转染效率显著提高。随着质量比的增加,PBAE-NPs转染效率趋于稳定。当质量比达到15∶1及以上时,PBAE-NPs对RAW 264.7细胞的转染效率都显著高于阳性对照PEI组(见图 3C)。采用流式细胞术定量检测GFP阳性细胞数量,结果与荧光显微镜下定性结果基本一致。当PBAE和DNA的质量比达到30∶1及以上时,GFP阳性细胞数量和平均荧光强度都显著高于PEI组。根据上述结果,本研究选择PBAE和DNA的质量比为30∶1作为PBAE-NPs的后续配方。
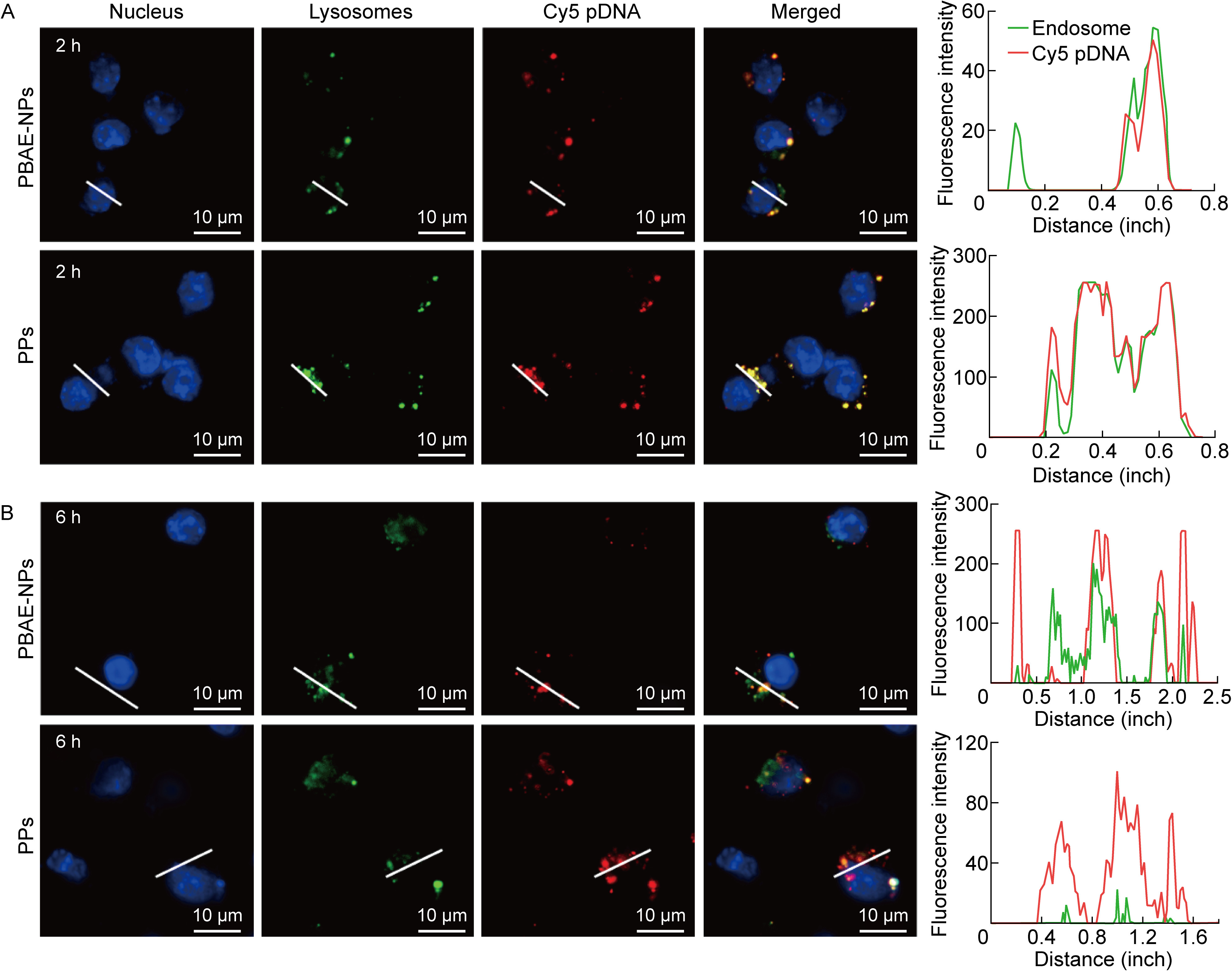
2.4 PGA修饰的纳米颗粒提高溶酶体逃逸能力当核酸疫苗通过网格蛋白介导途径或细胞吞噬途径进入细胞时,核酸会被转运到细胞的溶酶体内。如果核酸疫苗不能及时逃逸出溶酶体,就会在溶酶体中被分解,最终导致转染效率低下。因此,理想的核酸疫苗递送载体应具有出色的溶酶体逃逸能力。共聚焦显微镜结果显示,转染2 h后,负载Cy5标记pCAGGS-RBD质粒的PBAE-NPs和PPs均被RAW 264.7细胞摄取。图 4A展示了Cy5-DNA(红色)和溶酶体(绿色)在细胞内的分布情况,红色信号与绿色信号重叠产生黄色信号,提示溶酶体捕获PBAE-NPs和PPs。转染6 h后,红色信号与绿色信号分离,说明纳米颗粒被细胞吞噬6 h后已经成功逃逸溶酶体(见图 4B)。值得注意的是,PPs比PBAE-NPs表现出更加明显的红绿信号分离,这表明PGA修饰可以促进纳米颗粒的溶酶体逃逸,有助于提高转染效率。
|
| A: Confocal fluorescence images of RAW 264.7 cells incubated with PBAE-NPs and PPs for 2 h. B: Confocal fluorescence images of RAW 264.7 cells incubated with PBAE-NPs and PPs for 6 h. Blue: cell nuclei; Green: lysosomes; Red: Cy5-DNA. 图 4 PBAE-NPs和PPs的溶酶体逃逸能力 Fig. 4 Lysosomal escape ability of PBAE-NPs和PPs |
DC 2.4细胞作为抗原呈递细胞,在免疫反应中发挥重要作用。对DC 2.4细胞进行高效的核酸转染有助于提高核酸疫苗的免疫效果。为了评估PGA修饰对纳米颗粒核酸递送效率的影响,使用pEGFP-N1质粒转染DC 2.4细胞,并以PEI为阳性对照。荧光显微镜成像结果显示,PBAE-NPs和PPs均展现出较高的GFP转染效率,明显高于市售转染试剂PEI,并且PPs表现出最佳的转染效率(见图 5A)。此外,采用流式细胞术定量检测转染后DC 2.4细胞中GFP阳性细胞数量(见图 5B)。流式结果显示,PPs对DC 2.4细胞转染pEGFP-N1质粒的转染效率约是PBAE-NPs组的2.5倍,平均荧光强度约是PBAE-NPs组的3倍,提示PGA修饰能够显著提高核酸的转染效率(见图 5C)。此外,本研究采用CCK-8法考察了不同PGA含量的PPs的安全性。如图 5D所示,PPs相较于PBAE-NPs表现出更高的细胞存活率。本研究选择PGA∶PBAE∶DNA质量比为2.5∶30∶1为PPs的配方。此外,PPs和PBAE-NPs的细胞存活率均高于商品化转染试剂PEI。上述结果表明,PPs是一种安全、高效的核酸递送载体。
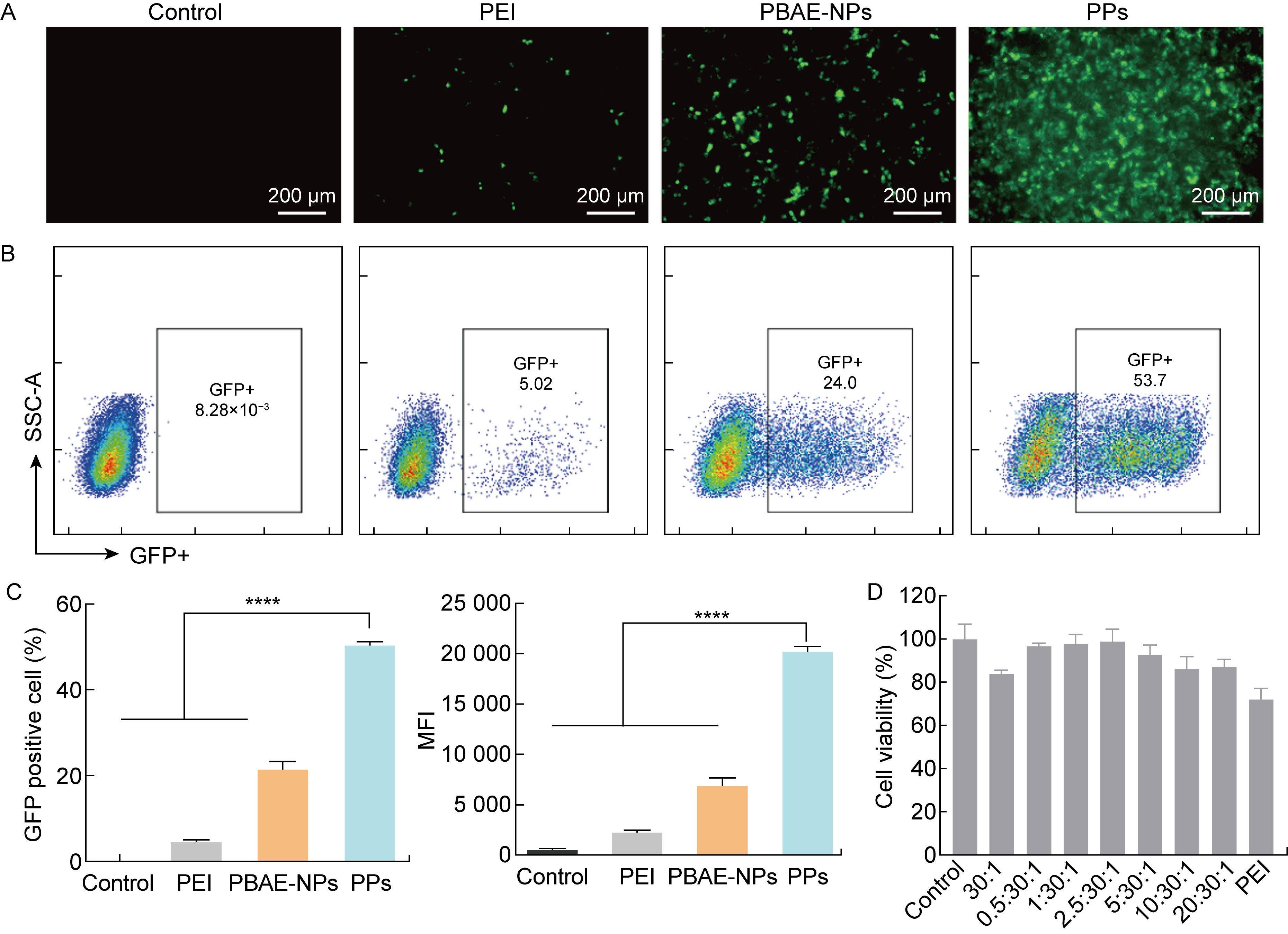
|
| A: Fluorescence imaging of DC 2.4 cells transfected by pEGFP-N1 plasmid loaded PBAE-NPs and PPs. B: Quantitative transfection efficiency by flow cytometry. C: The percentages of GFP positive cells and mean fluorescence intensities (MFI) from DC 2.4 cells transfected by PBAE-NPs and PPs. D: Cytotoxicity of various nanoparticles on DC 2.4 cells. Cells were incubated with PBAE-NPs (weight ratio 30:1) and PPs (weight ratio 0.5∶30∶1, 1∶30∶1, 2.5∶30∶1, 5∶30∶1, 10∶30∶1, 20∶30∶1, respectively) for 24 h. ****: P < 0.000 1. 图 5 PPs具有安全、高效的核酸转染性能 Fig. 5 PPs show high gene delivery in vitro |
近几十年来,不断出现新的传染病大流行,尤其是SARS-CoV-2的全球性传播,对国际卫生安全和全球经济稳定造成了严重威胁[23]。核酸疫苗展现出了预防大流行性疾病传播的巨大潜力[3-24]。为核酸疫苗开发合适的递送载体已经成为全球研究热点[25]。然而,核酸疫苗仍然面临着稳定性不佳、转染效率低下等问题[26]。因此,迫切需要开发安全、高效的核酸递送载体,以提高核酸疫苗的免疫保护性能。
可生物降解的阳离子聚合物PBAE在多种细胞类型中都具有良好的核酸转染效果[27-29]。因此,将聚合物PBAE作为核酸递送载体,有望解决核酸转染效率低下的瓶颈。本研究提出一种新型核酸递送策略,即将阳离子聚合物PBAE与核酸自组装形成PBAE-NPs,进一步通过静电相互作用在其外层修饰阴离子聚合物PGA,形成核-壳式纳米颗粒PPs。表征结果显示,PPs表现出接近中性的电荷,小且均匀的粒径分布,说明PGA的修饰能够进一步压缩核酸,减少纳米颗粒聚集,增加颗粒稳定性,有利于细胞内吞作用。溶酶体降解是核酸递送过程中必须克服的一个重要屏障。核酸递送载体需要在细胞内化之后成功实现溶酶体逃逸,保护核酸免受溶酶体内多种消化酶的降解,从而实现核酸在胞内的有效释放。因此,高效的溶酶体逃逸能力对提高核酸载体的转染效率尤为重要。结果显示,PPs在转染6 h后展现出比PBAE-NPs更强的溶酶体逃逸能力,有助于实现更高效的核酸递送效率。值得注意的是,在同等的核酸转染剂量下,PPs展现出更高的转染效率,明显优于商业化转染试剂PEI的转染效率。细胞毒性通常是纳米颗粒实际应用的一大限制因素。CCK-8实验结果显示,经过PGA修饰后,PPs在高效的转染浓度下未见明显的细胞毒性,表明PGA修饰具有改善PBAE-NPs生物相容性的优势。
本研究也存在一定的局限性,后续将进行深入研究。首先,本研究中细胞实验主要围绕着包封DNA的PBAE-NPs和PPs开展,对于mRNA-NPs和mRNA-PPs的研究仅停留在前期粒径、Zeta电位和1%琼脂糖凝胶电泳等表征层面,后续有待进一步评估PPs在细胞水平递送mRNA的效率,并比较PPs递送DNA和mRNA的异同之处。其次,结果显示载有pEGFP-N1质粒的PPs展现出比PBAE-NPs更高的细胞转染效率,初步验证了PPs提高核酸转染效率的有效性,后续将进一步在细胞层面研究载有pCAGGS-RBD质粒的PPs表达SARS-CoV-2 RBD蛋白的水平,以评估PPs作为核酸疫苗的可行性。第三,本研究使用DC 2.4细胞和RAW 264.7细胞作为体外评价的细胞系,后续研究将提取小鼠骨髓来源树突状细胞和小鼠骨髓来源巨噬细胞,体外评估包封pCAGGS-RBD质粒的PPs的免疫原性。相较于细胞系,小鼠骨髓来源原代细胞的性能更加贴近小鼠体内的树突状细胞和巨噬细胞。此外,后续将进行小鼠免疫实验,评估载有pCAGGS-RBD质粒的PPs激活小鼠细胞免疫和体液免疫的性能。
综上所述,PGA修饰的PBAE/核酸纳米颗粒作为一种有前景的非病毒递送载体,实现了高效、安全的核酸转染效果,为核酸疫苗递送载体的设计提供了新的思路。
| [1] |
Chen G, Zhao B, Ruiz EF, Zhang F. Advances in the polymeric delivery of nucleic acid vaccines[J]. Theranostics, 2022, 12(9): 4081-4109.
[DOI]
|
| [2] |
Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, Perez JL, Pérez Marc G, Moreira ED, Zerbini C, Bailey R, Swanson KA, Roychoudhury S, Koury K, Li P, Kalina WV, Cooper D, Frenck RW, J r. , Hammitt LL, Türeci Ö, Nell H, Schaefer A, Vnal S, Tresnan DB, Mather S, Dormitzer PR, Ũahin U, Jansen KU, Gruber WC. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine[J]. N Engl J Med, 2020, 383(27): 2603-2615.
[DOI]
|
| [3] |
Barbier AJ, Jiang AY, Zhang P, Wooster R, Anderson DG. The clinical progress of mRNA vaccines and immunotherapies[J]. Nat Biotechnol, 2022, 40(6): 840-854.
[DOI]
|
| [4] |
Zhang Y, Luo J, Gui X, Zheng Y, Schaar E, Liu G, Shi J. Bioengineered nanotechnology for nucleic acid delivery[J]. J Control Release, 2023, 364: 124-141.
[DOI]
|
| [5] |
Zhang YQ, Guo RR, Chen YH, Li TC, Du WZ, Xiang RW, Guan JB, Li YP, Huang YY, Yu ZQ, Cai Y, Zhang P, Ling GX. Ionizable drug delivery systems for efficient and selective gene therapy[J]. Mil Med Res, 2023, 10(1): 9.
[DOI]
|
| [6] |
Ishaqat A, Herrmann A. Polymers strive for accuracy: from sequence-defined polymers to mRNA vaccines against COVID-19 and Polymers in nucleic acid therapeutics[J]. J Am Chem Soc, 2021, 143(49): 20529-20545.
[DOI]
|
| [7] |
Yin H, Kanasty RL, Eltoukhy AA, Vegas AJ, Dorkin JR, Anderson DG. Non-viral vectors for gene-based therapy[J]. Nat Rev Genet, 2014, 15(8): 541-555.
[DOI]
|
| [8] |
Gregory TZ, Weidan P, Andreas Z, Siddharth J, Yu-Hung H, Robert L, Janet AS, Daniel GA. Rapid optimization of gene delivery by parallel end-modification of poly(β-amino ester)s[J]. Mol Ther, 2007, 15(7): 1306-1312.
[DOI]
|
| [9] |
Kaczmarek JC, Patel AK, Rhym LH, Palmiero UC, Bhat B, Heartlein MW, Derosa F, Anderson DG. Systemic delivery of mRNA and DNA to the lung using polymer-lipid nanoparticles[J]. Biomaterials, 2021, 275: 120966.
[DOI]
|
| [10] |
Liu Y, Li Y, Keskin D, Shi L. Poly(β-amino esters): synthesis, formulations, and their biomedical applications[J]. Adv Healthc Mater, 2019, 8(2): e1801359.
[DOI]
|
| [11] |
Cordeiro RA, Serra A, Coelho JFJ, Faneca H. Poly(β-amino ester)-based gene delivery systems: from discovery to therapeutic applications[J]. J Control Release, 2019, 310: 155-187.
[DOI]
|
| [12] |
Lynn DM, Anderson DG, Putnam D, Langer R. Accelerated discovery of synthetic transfection vectors: parallel synthesis and screening of a degradable polymer library[J]. J Am Chem Soc, 2001, 123(33): 8155-8156.
[DOI]
|
| [13] |
Zhang C, An T, Wang D, Wan G, Zhang M, Wang H, Zhang S, Li R, Yang X, Wang Y. Stepwise pH-responsive nanoparticles containing charge-reversible pullulan-based shells and poly(β-amino ester)/poly(lactic-co-glycolic acid) cores as carriers of anticancer drugs for combination therapy on hepatocellular carcinoma[J]. J Control Release, 2016, 226: 193-204.
[DOI]
|
| [14] |
Pere D, Nathaly S, Anna C, Victor R, Salvador B. Surface charge tunability as a powerful strategy to control electrostatic interaction for high efficiency silencing, using tailored oligopeptide-modified poly(beta-amino ester)s (PBAEs)[J]. Acta Biomaterialia, 2015, 20: 82-93.
[DOI]
|
| [15] |
Brugada-Vilà P, Cascante A, Lázaro M, Castells-Sala C, Fornaguera C, Rovira-Rigau M, Albertazzi L, Borros S, Fillat C. Oligopeptide-modified poly(beta-amino ester)s-coated AdNuPARmE1A: boosting the efficacy of intravenously administered therapeutic adenoviruses[J]. Theranostics, 2020, 10(6): 2744-2758.
[DOI]
|
| [16] |
Puigmal N, Ramos V, Artzi N, Borrós S. Poly(β-amino ester)s-based delivery systems for targeted transdermal vaccination[J]. Pharmaceutics, 2023, 15(4): 1262.
[DOI]
|
| [17] |
Dosta P, Cryer AM, Dion MZ, Shiraishi T, Langston SP, Lok D, Wang J, Harrison S, Hatten T, Ganno ML, Appleman VA, Taboada GM, Puigmal N, Ferber S, Kalash S, Prado M, Rodríguez AL, Kamoun WS, Abu-Yousif AO, Artzi N. Investigation of the enhanced antitumour potency of STING agonist after conjugation to polymer nanoparticles[J]. Nat Nanotechnol, 2023, 18(11): 1351-1363.
[DOI]
|
| [18] |
Rachel JF, Christopher JC, Elias Q, Caroline W, Nina K, Nha D, Christopher H, Marie EE, Saltzman WM. Surface modified poly(β amino ester)-containing nanoparticles for plasmid DNA delivery[J]. J Control Release, 2012, 164(1): 41-48.
[DOI]
|
| [19] |
Liu Y, Wang Y, Zhang C, Zhou P, Liu Y, An T, Sun D, Zhang N, Wang Y. Core-shell nanoparticles based on pullulan and poly(β-amino) ester for hepatoma-targeted codelivery of gene and chemotherapy agent[J]. ACS Appl Mater Interfaces, 2014, 6(21): 18712-18720.
[DOI]
|
| [20] |
Trubetskoy VS, Wong SC, Subbotin V, Budker VG, Loomis A, Hagstrom JE, Wolff JA. Recharging cationic DNA complexes with highly charged polyanions for in vitro and in vivo gene delivery[J]. Gene Therapy, 2003, 10(3): 261-271.
[DOI]
|
| [21] |
Kurosaki T, Kitahara T, Kawakami S, Higuchi Y, Yamaguchi A, Nakagawa H, Kodama Y, Hamamoto T, Hashida M, Sasaki H. Gamma-polyglutamic acid-coated vectors for effective and safe gene therapy[J]. J Control Release, 2010, 142(3): 404-410.
[DOI]
|
| [22] |
Mangraviti A, Tzeng SY, Kozielski KL, Wang Y, Jin Y, Gullotti D, Pedone M, Buaron N, Liu A, Wilson DR, Hansen SK, Rodriguez FJ, Gao GD, Dimeco F, Brem H, Olivi A, Tyler B, Green JJ. Polymeric nanoparticles for nonviral gene therapy extend brain tumor survival in vivo[J]. ACS Nano, 2015, 9(2): 1236-1249.
[DOI]
|
| [23] |
瞿涤. 迎接新发与再现传染病挑战, 我们一直在路上[J]. 微生物与感染, 2023, 18(1): 1. [URI]
|
| [24] |
Chaudhary N, Weissman D, Whitehead KA. mRNA vaccines for infectious diseases: principles, delivery and clinical translation[J]. Nat Rev Drug Discov, 2021, 20(11): 817-838.
[DOI]
|
| [25] |
Kulkarni JA, Witzigmann D, Thomson SB, Chen S, Leavitt BR, Cullis PR, van der Meel R. The current landscape of nucleic acid therapeutics[J]. Nat Nanotechnol, 2021, 16(6): 630-643.
[DOI]
|
| [26] |
Piotrowski-Daspit AS, Kauffman AC, Bracaglia LG, Saltzman WM. Polymeric vehicles for nucleic acid delivery[J]. Adv Drug Deliv Rev, 2020, 156: 119-132.
[DOI]
|
| [27] |
Bishop CJ, Ketola TM, Tzeng SY, Sunshine JC, Urtti A, Lemmetyinen H, Vuorimaa-Laukkanen E, Yliperttula M, Green JJ. The effect and role of carbon atoms in poly(β-amino ester)s for DNA binding and gene delivery[J]. J Am Chem Soc, 2013, 135(18): 6951-6957.
[DOI]
|
| [28] |
Tzeng SY, Guerrero-Cázares H, Martinez EE, Sunshine JC, Quiñones-Hinojosa A, Green JJ. Non-viral gene delivery nanoparticles based on poly(β-amino esters) for treatment of glioblastoma[J]. Biomaterials, 2011, 32(23): 5402-5410.
[DOI]
|
| [29] |
Sunshine J, Green JJ, Mahon KP, Yang F, Eltoukhy AA, Nguyen DN, Langer R, Anderson DG. Small-molecule end-groups of linear polymer determine cell-type gene-delivery efficacy[J]. Adv Mater, 2009, 21(48): 4947-4951.
[DOI]
|
 2024, Vol. 19
2024, Vol. 19


