2. 复旦大学上海医学院基础医学院教育部/卫健委/医科院医学分子病毒学重点实验室, 上海 200032
2. Department of Medical Microbiology and Parasitology, Key Laboratory of Medical Molecular Virology (MOE/NHC/CAMS), School of Basic Medical Science, Fudan University, Shanghai 200032, China
黄病毒科病毒属于包膜正义单链RNA病毒,由蚊子、蜱等节肢动物传播,常见的包括登革热病毒、寨卡病毒、西尼罗河病毒、黄热病病毒等,对人类健康构成了重大威胁[1]。蜱传脑炎病毒(tick-borne encephalitis virus, TBEV)也是黄病毒中的一种。其病毒颗粒为直径约50 nm的球形粒子,病毒粒子包含1个核衣壳(nucleocapsid,NC),周围环绕着宿主来源的脂质膜,病毒包膜糖蛋白(E)和膜蛋白(M)[2]。TBEV的基因组长约11 kb,编码单个多聚蛋白,该多聚蛋白在翻译后被宿主和病毒蛋白酶切割,产生3种结构蛋白(C、PrM和E)和7种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)[3]。
蜱传脑炎病毒常见于欧洲及亚洲[4],每年约有1万例感染病例[5]。人类大多通过被含有病毒的蜱叮咬感染蜱传脑炎病毒,也可以通过食用受污染的乳制品感染[6],潜伏期通常为7~14天。蜱传脑炎病毒是一种嗜神经性病毒,当它感染神经系统时,可导致广泛的神经系统功能障碍,临床上可能表现为发热、脑膜炎、脑炎、脊髓炎或神经根炎[7],大量患者严重至需要入住重症监护病房(intensive care unit,ICU),甚至出现死亡[8-10]。幸存的患者可能会出现很长时间的神经系统后遗症,包括癫痫、颅神经或脊髓麻痹[11-13]。
蜱传脑炎病毒给人类带来了严重的健康危害,尽管近年来黄病毒研究取得了一定的进步,但蜱传脑炎病毒的许多方面仍然有待解答。病毒感染性克隆可在DNA水平上调控病毒,是了解病毒进化、传播、发病机制和免疫反应的有力工具[14]。本研究构建了蜱传脑炎病毒全长感染性cDNA克隆,旨在为深入研究病毒的基因功能以及开发疫苗和抗病毒药物奠定基础。
反向遗传学技术是一种分子生物学技术,被广泛应用于病毒基因组结构与功能研究、抗病毒药物筛选、疫苗开发等方面。反向遗传学技术通过操纵病毒基因组来研究病毒的生物学特性和开发抗病毒策略,对理解病毒生命周期、致病机制、病毒与宿主互相作用、开发新型疫苗以及抗病毒药物具有重要意义。尽管这一技术具有巨大潜力,但在实际操作过程中面临着病毒基因组的不稳定、与克隆载体或宿主细胞不兼容等多个难点。为了解决这些问题,本研究采用了低拷贝质粒载体,并优化了病毒基因组序列以提高其在宿主细胞中的稳定性和兼容性。低拷贝质粒载体通过限制病毒基因组的拷贝数,抑制了在宿主细胞中的过度表达,从而减弱可能的细胞毒性或免疫反应,并减轻宿主细胞压力,同时减少复制错误,提高克隆的稳定性。而消除病毒基因组的细菌启动子活性,有利于病毒cDNA克隆在细菌中稳定扩增[14]。因此,本研究预测所选序列的细菌启动子并进行同义突变消除其活性,通过聚合酶链反应(polymerase chain reaction,PCR)及同源重组技术将其克隆至低拷贝质粒pFK载体上,获得了在细菌中稳定表达的TBEV全长感染性cDNA克隆,旨在为深入研究这一亚型的病毒特性提供新的工具。
1 材料和方法 1.1 材料 1.1.1 细胞与感受态BHK-21细胞、VERO E6细胞均取自实验室自行保存的细胞系,Top10感受态由实验室自行制作。
1.1.2 质粒pFK载体模板取自实验室已有质粒pFK-Zl1。pFK-TBEV由本研究自行构建。
1.1.3 主要试剂限制性内切酶(美国NEB),DNA聚合酶试剂2X Phanta Max Master Mix (南京Vazyme, P515-02),无缝克隆试剂ClonExpress Ultra One Step Cloning Kit V2(南京Vazyme,C116-02),菌落PCR试剂(北京TIANGEN, KT201),质粒小提试剂盒(北京TIANGEN, DP103-03),mMESSAGE mMACHINE T7转录试剂盒(美国Invitrogen,AM1344),DMEM培养基(美国Gibco,C11965500BT),胎牛血清FBS(美国Gibco,A5669701),非必需氨基酸溶液(美国Gibco,11140050),青霉素-链霉素双抗溶液(美国Gibco,15140122),TRNzol Universal总RNA提取试剂(北京TIANGEN,DP424),逆转录预混液HiScript Ⅲ RT SuperMix(南京Vazyme,R323-01),qPCR试剂ChamQ Blue Universal SYBR qPCR Master Mix(南京Vazyme,Q312-02),ExpressCast PAGE彩色凝胶快速试剂盒(苏州新赛美,P2012),4G2抗体(美国Merck,MAB10216),X73抗体(海军军医大学赵平教授惠赠),Goat Anti-Rabbit IgG (H+L) HRP(上海圣尔生物,SB-AB0101),ECL化学发光超敏显色试剂盒(上海Yeasen,36208ES76)。
1.1.4 主要仪器移液枪(美国Gilson),涡旋混合器(上海琪特),PCR仪(美国Bio-rad),水浴锅(常州苏瑞),细菌培养箱(上海精宏),细菌摇床(上海新苗),电泳仪(上海Tanon),Nanodrop核酸定量仪(美国Thermo Scientific),4 ℃冰箱(青岛海尔),-20 ℃冰箱(青岛海信),-80 ℃冰箱(美国Thermo Scientific),电子天平(北京兰杰柯),高速离心机(美国Thermo Scientific),高速冷冻离心机(美国Thermo Scientific),超净台(苏州安泰),细胞培养箱(美国Thermo Scientific),倒置显微镜(南京江南永新),生物安全柜(青岛海尔),脱色摇床(南通其林贝尔)
1.2 方法 1.2.1 全长感染性克隆质粒构建在https://www.fruitfly.org/seq_tools/promoter.html网站预测原核启动子,进行同义突变消除细菌启动子活性后,交由上海捷瑞公司合成TBEV cDNA序列1(来自ON228408.1的1~6 459 bp)和序列2(来自ON228408.1的6 460~11 238 bp),利用同源重组技术,通过SbfⅠ、MluⅠ酶切位点克隆至载体pFK,获得全长的TBEV感染性cDNA克隆,命名为pFK-TBEV。
1.2.2 质粒线性化及回收使用限制性内切酶(NEB),以质粒10 μ g、rCutSmart 10 μ L、MluⅠ 3 μ L、ddH2O补至100 μ L的体系,在37 ℃下孵育2 h。以体积比25∶24∶1的混合苯酚、氯仿、异戊醇,向待回收的酶切产物中加入等体积的混合液,然后在旋转混匀仪中混合10 min,13 300 r/min离心5 min,尽可能地吸取上层液体至新离心管中,加入等体积的氯仿异戊醇(氯仿∶异戊醇=24∶1),旋转混匀仪混合10 min,13 300 r/min离心5 min,尽可能吸取顶层液体至新离心管,加入3 mol/L的醋酸钠使液体中醋酸钠浓度为0.3 mol/L,然后加入当前溶液2倍体积的无水乙醇,混合后于-20 ℃保存30 min以上。之后在4 ℃、12 000 r/min下离心20 min,去除上清液,加入40 μ L 70%乙醇洗涤,12 000 r/min离心2 min。吸除乙醇,开盖晾干5 min,加入10 μ L RNase-free water,最后测回收产物的浓度,凝胶电泳验证。
1.2.3 体外转录使用T7转录试剂盒(Invitrogen,AM1344)进行体外转录。在冰上操作,依次在EP管中加入10 μ L NTP/CAP(2×)、2 μ L Buffer(10×)、1 μ L GTP(30 μ M)、Linear template(1 μ g)、2 μ L Enzyme Mix,补充RNase-free-water至20 μ L,37 ℃孵育2 h,加入DNase 1 μ L,37 ℃孵育15 min。加入30 μ L氯化锂溶液,混匀,-20 ℃静置至少30 min,在4 ℃下以12 000 r/min离心20 min,可观察到白色沉淀。使用预冷的70%乙醇洗涤一次后弃上清,静置挥发乙醇。加入50 μ L RNase-free-water,冰上放置20 min,使其充分溶解后吹打混匀。使用微量分光光度计测浓度,并采用琼脂糖凝胶电泳观察RNA的完整性,后保存至-80 ℃备用。
1.2.4 RNA电转配制电转液,384 μ L cytomix、8 μ L ATP、8 μ L L-Glu混匀。取BHK-21细胞5×106个,离心后用PBS缓冲液洗涤,再离心重悬至电转液中。将重悬的细胞与5 μ g RNA混匀,放入电转杯,270 V、975 μ F、4 mm电击一次,取出细胞加入培养基,铺到孔板中以进行下一步实验。
1.2.5 细胞培养DMEM培养基中补充胎牛血清(fetal bovine serum,FBS,终浓度体积分数为10%)、非必需氨基酸(终浓度体积分数为1%) 及青霉素-链霉素双抗溶液(终浓度体积分数为1%),置于37 ℃培养箱,培养BHK-21细胞与VERO E6细胞。
1.2.6 病毒感染取5×106个细胞铺于10 cm培养皿,培养基为含10% FBS的DMEM培养基。一天后吸除孔板中的培养基,加入PBS洗涤细胞。加入不含FBS的DMEM与感染复数(multiplicity of infection,MOI)为0.01的病毒液。轻轻摇晃后放入37 ℃培养箱中,每15 min拿出摇晃混匀一次。1 h后吸除病毒液,PBS洗涤后加入3%FBS培养基。
1.2.7 RNA提取收24孔板细胞样品,每孔加入500 μ L TRNzol Universal试剂,混匀,室温放置5 min。加入100 μ L氯仿,用涡旋仪剧烈振荡15 s,室温放置3 min。12 000 r/min、4 ℃离心15 min。将离心后的样品转移至冰上,吸取上层水相200 μ L到新离心管中,加入等体积异丙醇,充分混匀,室温放置10 min。12 000 r/min、4 ℃离心10 min,吸除上清液,加入600 μ L 75%乙醇,12 000 r/min、4 ℃离心5 min。吸净液体,开盖冰上放置3 min晾干沉淀。加入20 μ L RNase-free ddH2O,溶解沉淀,混匀。
1.2.8 反转录使用HiScriptⓇ Ⅲ SuperMix for qPCR(+gDNA wiper)试剂盒(Vazyme公司)进行反转录。首先去除基因组DNA,在RNase-free离心管中配制混合液,加入4×gDNA wiper Mix 4 μ L、模板RNA 1 pg-1 μ g,加RNase-free ddH2O将体系补至16 μ L,吹打混匀,42 ℃、2 min处理。继续加入4 μ L 5×HiScript Ⅲ qRT superMix配制逆转录反应体系,反应条件为37 ℃、15 min,85 ℃、5 s。
1.2.9 RT-qPCRqPCR试剂使用ChamQ Blue Universal SYBR qPCR Master Mix(Vazyme公司,Q312-02)。使用96孔板,每个孔中加入10 μ L 2×ChamQ Blue Universal SYBR qPCR Master Mix、0.4 μ L上游引物(10 μ mol/L)、0.4 μ L下游引物(10 μ mol/L)、2 μ L cDNA模板、7.2 μ L RNase-free ddH2O。反应程序为95 ℃、30 s,40循环(95 ℃、10 s,60 ℃、30 s),熔解曲线。
1.2.10 蛋白免疫印迹使用ExpressCast PAGE彩色凝胶快速试剂盒配制10%分离胶与浓缩胶,凝固后转移至电泳槽,加入TGS buffer,样品每孔加入10 μ L,蛋白Marker每孔加入5 μ L。电压80 V待样品通过浓缩胶后改换120 V电压。裁剪合适尺寸的PVDF膜,将PVDF浸泡入甲醇溶液。切下蛋白胶,按照黑板子、三层滤纸、蛋白胶、PVDF膜、三层滤纸、红板子的顺序组装转膜装置放入转膜槽,倒入转膜液并放入冰袋,将转膜槽放到冰里,同色电极连接同色板子,90 V电压转膜70 min。用TBST配制5%脱脂牛奶,转膜后拿出蛋白膜放到摇床上在牛奶中封闭1 h,然后一抗4 ℃封闭过夜。TBST洗一抗3遍,每遍10 min。二抗摇床上孵育1 h。TBST洗二抗3遍,每遍10 min。将显色液A液、B液按1∶1的比例避光混合,蛋白膜浸泡后曝光。
1.2.11 半数组织培养感染量(50% tissue culture infectious dose,TCID50)病毒滴度测定将BHK-21细胞铺到96孔板,每孔1×104个细胞。24 h后,将待测病毒液分别用不含FBS的DMEM培养基稀释为10-4、10-5、10-6、10-7,每个梯度依次感染1列8孔,3次重复。放置于37 ℃培养箱,4 h后使用PBS洗涤且更换含3% 体积分数FBA的DMEM培养基,4天后观察计数细胞病变的孔数并计算滴度。
1.2.12 空斑实验铺VERO E6细胞于24孔板中,每孔2×105个,培养基为含10% FBS的DMEM。一天后取病毒液稀释,选取的稀释梯度分别为10-2、10-3、10-3.7、10-4。吸除孔板中的培养基,加入PBS洗涤细胞,然后每个稀释梯度取200 μ L病毒液加入孔中,每个病毒梯度设置3次重复。轻轻摇晃后放入37 ℃培养箱中,每15 min拿出摇晃混匀一次。1 h后吸除病毒液,采用PBS洗涤一次后每孔加入500 μ L含1% CMC和1.5% FBS的覆盖层(用2% CMC和3% FBS培养基等体积配制而成)。放入培养箱中静置4天,然后吸除覆盖层,每孔加入200 μ L 4% 多聚甲醛(paraformaldehyde,PFA),室温固定20 min。吸除PFA,加入PBS洗涤,室温静置5 min。吸除PBS,加入1%结晶紫溶液染色1 h后,去除结晶紫溶液,用PBS洗涤,而后可观察空斑并统计,计算滴度。
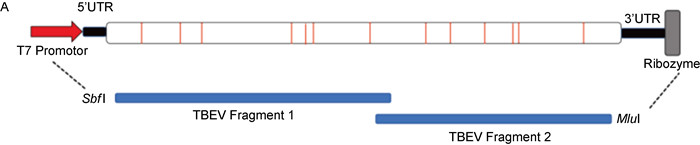
2 结果 2.1 蜱传脑炎病毒基因组内细菌启动子的预测及同义突变选取一株临床上分离出来的TBEV-Eu亚型蜱传脑炎病毒的序列[15],黄病毒基因组含有原核启动子序列,这些序列在细菌中可能导致非特异性表达,从而影响基因组cDNA的稳定性;为提高其稳定性,在启动子预测网站(http://www.fruitfly.org/seq_tools/promoter.html)上预测TBEV-Eu亚型蜱传脑炎病毒序列中的原核启动子,根据预测网站提供的得分系统,预测出13个启动子序列(similarity score > 0.9)(见图 1A),进行同义突变(见表 1)消除细菌毒性,随后基于对序列复杂性和克隆效率的考虑,将TBEV cDNA序列分为2段进行合成(见图 1A),中间保留独一内切酶位点BsiWⅠ,以便尝试其他克隆策略,如酶切连接。
|
| A: Synonymous mutations were introduced into the prokaryotic promoters of the TBEV sequence (marked in red) to eliminate bacterial toxicity, and then the sequence was divided into two segments for synthesis. 图 1 蜱传脑炎病毒基因组内细菌启动子的预测及同义突变 Fig. 1 Prediction and silent mutation of bacterial promoter sequences of the TBEV genome |
| Virus and E.coli promoter | Start | Virus sequence (5′-3′) | End | Score |
| 1WT | 1 146 | TACTGTTTACACGCCAAGTTGTCGGACACTAAGG~TTGCAGCCAGATGCCC | 1 191 | 0.94 |
| Mutant | TACTGTCTACACGCCAAGTTGTCGGACACTAAGG~TTGCAGCCAGATGCCC | ND | ||
| 2WT | 2 364 | GCTTGGTTGGGCCTGAACATGAGAAACCCTACAA~TGTCCATGAGCTTCCT | 2 409 | 0.95 |
| Mutant | GCATGGCTGGGCCTGAACATGAGAAACCCTACAA~TGTCCATGAGCTTCCT | ND | ||
| 3WT | 2 515 | TAGTCGTGTGGAGAGAGGTCTCAGAATGGTATGA~CAACTATGCCTACTAC | 2 560 | 0.93 |
| Mutant | TAGTCGTATGGAGAGAGGTCTCAGAATGGTATGA~CAACTATGCCTACTAC | ND | ||
| 4WT | 4 101 | AAGGGATTGACCTGGATTGTCCCCCTGGCTAGAT~TGCTTGGGGGAGAGGG | 4 146 | 0.95 |
| Mutant | AAGGGATTAACCTGGATTGTCCCCCTGGCTAGAT~TGCTTGGGGGAGAGGG | ND | ||
| 5WT | 4 314 | CTCTTGTTGATGCTGGTGCTGGGGACAAGAAAGA~TGCAGCTGGTTGCCGA | 4 359 | 0.92 |
| Mutant | CTCTTATTGATGCTGGTGCTGGGGACAAGAAAGA~TGCAGCTGGTTGCCGA | ND | ||
| 6WT | 4 452 | TTTCACTTGACTGAGCTCGAGAAAGAAGAGAGAA~TGATGGCTTTTTGGCT | 4 497 | 0.95 |
| Mutant | TTTCACTTAACTGAGCTCGAGAAAGAAGAGAGAA~TGATGGCTTTTTGGCT | ND | ||
| 7WT | 5 746 | TCTGTTTGAACAGCAAAACCTTTGAAAAGGACTA~TTCCAGAGTGAGGGAT | 5 809 | 0.94 |
| Mutant | TCTGTTTAAACAGCAAAACCTTTGAAAAGGACTA~TTCCAGAGTGAGGGAT | ND | ||
| 8WT | 6 738 | CTCTTGTGGGCAGGTGGCGTCGGCTATGGGAATA~TGGCCGGAGTGGCTCT | 6 783 | 0.97 |
| Mutant | CTCTTATGGGCAGGTGGCGTCGGCTATGGGAATA~TGGCCGGAGTGGCTCT | ND | ||
| 9WT | 7 295 | GGCTGAATTAACACAGAGAGCTCACAAGGTCTTT~TTCTCTGCAATGGTGC | 7 340 | 0.90 |
| Mutant | GGCAGAATTAACACAGAGAGCTCACAAGGTCTTT~TTCTCTGCAATGGTGC | ND | ||
| 10WT | 7 572 | GCTTGTGGCATGAGTGGCGTGGTCAGGGGTAGCC~TGTGGGGGTTTCTGCC | 7 617 | 0.97 |
| Mutant | GCTTGCGGCATGAGTGGCGTGGTCAGGGGTAGCC~TGTGGGGGTTTCTGCC | ND | ||
| 11WT | 7 900 | ATCTTGGATGTGGAAGGGGCGGCTGGTCCTATTA~TGCGGCATCCCGACCG | 7 945 | 0.92 |
| Mutant | ATCTAGGATGTGGAAGGGGCGGCTGGTCCTATTA~TGCGGCATCCCGACCG | ND | ||
| 12WT | 7 977 | ATTGGTGGAAGAGGGCACGAGGCTCCAAAGATG~ATAACAAGCCTGGGTTG | 8 022 | 0.97 |
| Mutant | ATTGGCGGAAGAGGGCACGAGGCTCCAAAGATG~ATAACAAGCCTGGGTTG | ND | ||
| 13WT | 9 673 | CCTTGGATGACAGATTTGGCAAAGCACTTTACTT~TCTGAATGACATGGCC | 9 718 | 0.98 |
| Mutant | CCCTGGATGACAGATTTGGCAAAGCACTTTACTT~TCTGAATGACATGGCC | ND |
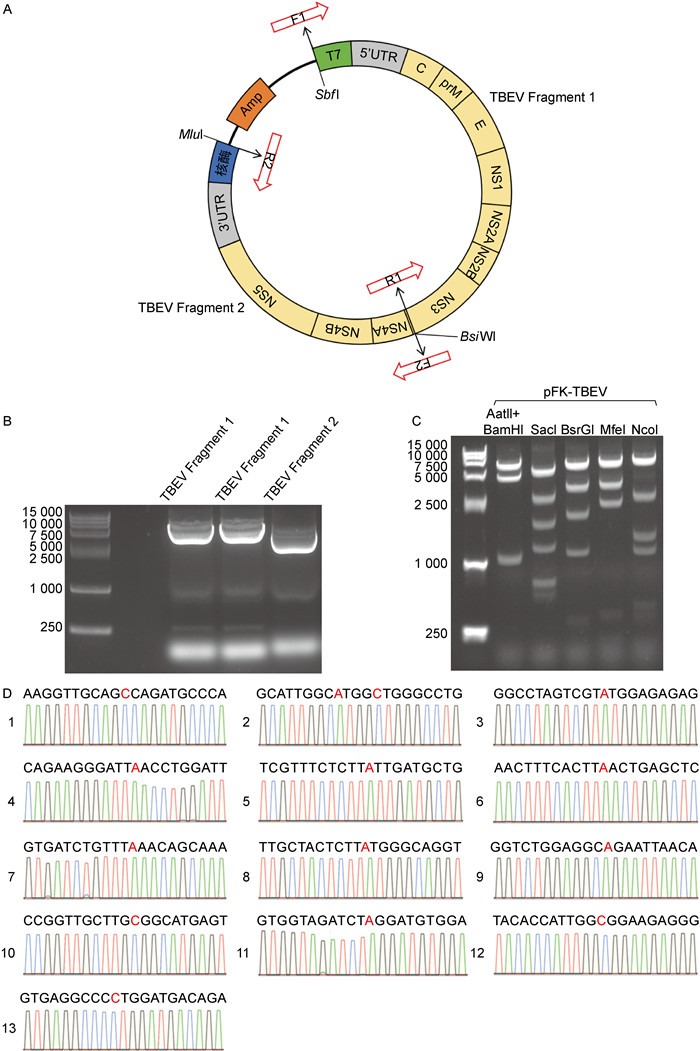
设计克隆策略将TBEV的两段序列克隆至pFK载体上(见图 2A)。使用SbfⅠ和MluⅠ酶切载体,并在酶切后通过琼脂糖凝胶电泳验证酶切产物,以确保回收正确的pFK载体。以合成的cDNA为模板,在2个片段的两端分别设计引物进行PCR扩增(见图 2B)。载体和TBEV片段1之间的同源重组重叠区域序列为TTCTGCC~AAGCTA~AGCTGCC;TBEV片段1和片段2之间连接的重叠区域为:GACATC~AAAGAG~TTCGTG~GCGTA~CGCTTC~TGGGC~GTCGCA~GCTT;载体与TBEV片段2的重叠区域为:TACTAG~TCCCTTT~AGTGA~GG。通过凝胶电泳验证PCR产物后,回收DNA产物,片端1回收得338 ng,片段2回收得166 ng。使用同源重组的方法将TBEV的序列克隆至pFK载体上(见图 2B)。从阳性菌落中提取质粒DNA,并通过多种限制性内切酶鉴定(见图 2C)来验证克隆的正确性,对酶切鉴定结果与预期一致的克隆进行测序(委托上海擎科生物公司)以确认序列的准确性。为评估TBEV全长感染性克隆在细菌增殖过程中的稳定性,本研究开展了连续5轮“转化-质粒提取-再转化”循环实验。通过测序证实第5代质粒序列与初始序列完全一致,其中13个启动子修改的区域如图 2D所示。该多代次验证实验表明,所构建的感染性克隆在长期细菌复制过程中具有优异的结构稳定性。
|
|
A: Digest the pFK vector with restriction enzymes, amplify the two segments of the TBEV viral sequence by PCR, recover the respective fragments from the gel, and clone them into the pFK vector using a three-fragment homologous recombination method. B: Amplification of TBEV Segment 1 and Segment 2 was carried out separately using PCR technology, followed by recovery of the DNA products. C: After picking the positive bacteria, extract the DNA for enzymatic digestion identification. D: After five consecutive rounds of transformation-plasmid extraction-retransformation, 13 promoter-modified regions in the fifth-generation plasmid sequence were obtained by sequencing. 图 2 构建蜱传脑炎病毒全长感染性克隆 Fig. 2 Construction of the full-length infectious clone of tick-borne encephalitis virus |
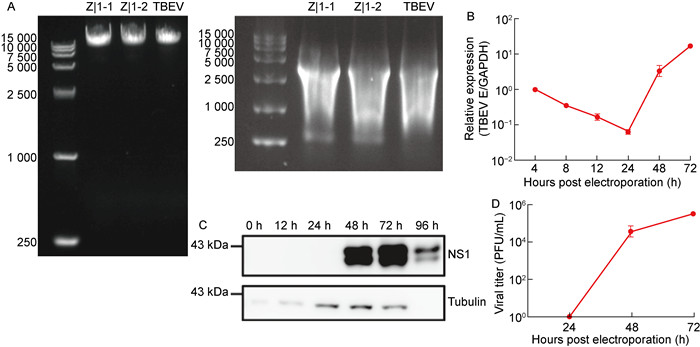
使用MluⅠ限制性内切酶将TBEV全长感染性cDNA克隆线性化,并通过1%琼脂糖凝胶验证以确保DNA条带的完整性和纯度。使用T7 RNA聚合酶试剂盒在37 ℃下进行体外转录获得RNA,并以实验室先前的ZL1克隆[14]为阳性对照(见图 3A)。将TBEV全长感染性克隆的RNA电转至BHK-21细胞,包装生产病毒。取不同时间点的电转后细胞样本提取RNA进行RT-qPCR检测,根据CT值计算相对定量数据结果,发现病毒RNA丰度在24 h内下降;电转后48 h和72 h后细胞内病毒RNA复制显著增加(见图 3B)。取不同时间点的细胞样本Western blot检测病毒NS1蛋白表达量,发现病毒NS1蛋白在电转后48~72 h显著表达,96 h出现细胞毒性作用(见图 3C)。取不同时间点的上清病毒液进行TCID50检测,计算病毒滴度,发现电转后48 h病毒滴度接近105 PFU/mL,到电转后72 h病毒滴度增至约106 PFU/mL(见图 3D)。以上结果均表明,TBEV-Eu亚型蜱传脑炎病毒被成功拯救。
|
|
A: Plasmid linearization and in vitro transcription, using two Zl1 samples as positive controls. B: After electroporation, collect cells at different time points, extract RNA, and perform qPCR using mGAPDH as an endogenous control to detect the RNA expression levels of the viral E protein. Each sample is repeated three times. C: After electroporation, collect cells at different time points and perform Western blot to detect the expression levels of the viral NS1 protein. The antibody used for the viral NS1 protein is the X73 antibody. D: After electroporation, collect supernatant viral fluid at different time points, use BHK-21 cells to conduct TCID50 cytotoxicity assays, and calculate the viral titer. Perform the experiment in triplicate for each sample. 图 3 拯救蜱传脑炎病毒 Fig. 3 Rescue of tick-borne encephalitis virus |
收取电转后的上清病毒液感染Vero E6细胞进行空斑实验,设置4个稀释倍数,96 h后观察并计数空斑,发现随着稀释度的减小,空斑更加密集(见图 4A)。以MOI=0.01的病毒液感染BHK-21细胞,收取不同时间点的细胞样本并提取RNA进行RT-qPCR检测,发现病毒的相对表达量随着感染时间延长而显著增加(见图 4B),采用Western blot检测病毒E蛋白及NS1蛋白,结果表明随着感染时间的增加,病毒蛋白的表达量增加(见图 4C)。这表明获得的二代病毒上清液具有感染性及在细胞内高效复制的能力。为评估拯救的TBEV病毒在传代过程中的遗传稳定性,本研究从感染第2代病毒的BHK-21细胞中提取总RNA,反转录合成cDNA。针对病毒基因组中人工引入的3个紧密分布的同义突变位点4~6(见表 1),设计特异性引物,通过高保真PCR扩增目标片段。经测序验证,扩增片段与原始克隆序列完全一致,未检测到变异(见图 4D)。上述结果表明,工程化修饰的启动子区域在病毒传代过程中保持高度稳定,未出现可能增强复制或改变感染性的自发突变,支持了拯救病毒的遗传可靠性。
|
|
A: Electroporate the TBEV RNA into BHK cells, harvest the viral fluid, filter it through a 0.22 μ m membrane, and then perform a plaque assay to count the plaques. B: After the viral fluid infects the cells (MOI=0.01), collect the cells at different time points, extract RNA, and perform qPCR using mGAPDH as an endogenous control to detect the RNA expression levels of the viral E protein. Each sample is repeated three times. C: Following the infection of cells with the viral fluid (MOI=0.01), collect the cells at various time points and examine the expression levels of the viral E protein and NS1 protein by Western blot. The antibody for the E protein is the 4G2 antibody, and the antibody for the NS1 protein is the X73 antibody. D: The genetic stability of the recombinant virus was detected by sequence identification of three closely distributed synonymous mutation sites 4—6 in the recombinant virus after passage. 图 4 二代病毒的感染性 Fig. 4 Infectivity of the second-generation virus |
蜱传脑炎病毒分为3个主要亚型——欧洲亚型(TBEV-Eu)、西伯利亚亚型(TBEV-Sib)和远东亚型(TBEV-FE)[16]。TBEV-Eu亚型主要由蓖麻硬蜱(Ixodes ricinus)传播,这种蜱在欧洲广泛分布,而TBEV-Sib和TBEV-FE主要由全沟硬蜱(Ixodes persulcatus)传播,在亚洲更为常见,而在波罗的海国家、西伯利亚、乌克兰和俄罗斯的欧洲部分等地区2种蜱共同存在[17]。目前,已在27个欧洲国家检测到蜱传脑炎,其中捷克共和国、波罗的海国家和斯洛文尼亚的年发病率最高[18],蜱传脑炎在不同的欧洲国家被低估,存在监测、诊断不足和病例漏报的情况[19-20]。大约74%~85%的TBEV-Eu亚型病例是双相病程[6],第一相通常在感染后的3~7天内出现发热和一般症状,如头痛、身体疼痛等不适,随后在数日至数周内发展为中枢神经系统炎症症状。病程结束后仍可能经历持续数月的后遗症,如上下肢麻痹、颅神经麻痹和小脑综合征[21]。
尽管已有研究成功构建了TBEV-FE亚型克隆[22-23],但针对在欧洲国家影响广泛的TBEV-Eu亚型的感染性克隆构建尚未见报道,因此,本研究选取了来自斯洛文尼亚卢布尔雅那大学医学中心传染病科的TBEV-Eu亚型临床样本测序而来的基因组序列[15],针对此亚型构建病毒感染性克隆以进行TBEV-Eu亚型的病毒学研究。既有蜱传脑炎病毒感染性克隆的研究,为提高病毒基因组在细菌中的稳定性,在非结构蛋白1(nonstructural protein 1,NS1)基因的编码区插入了β -珠蛋白内含子,在哺乳动物细胞中,插入的内含子被精确切除和剪接,因此不会产生插入突变体[23]。本研究采取同义突变原核启动子的新方法,通过精确设计和验证同义突变,有效消除了细菌中的非特异性启动子活性,从而提高了蜱传脑炎病毒的稳定性,这为病毒学研究提供了新路径。
本文在构建过程中采用了同源重组技术,利用设计好的同源臂将病毒序列克隆至pFK载体上。通过体外转录和RNA电转等技术,将病毒基因组有效送入细胞生产病毒,利用RT-qPCR和Western blot技术成功检测到病毒RNA的复制和病毒蛋白的表达。TCID50检测显示,病毒滴度在48 h后显著上升,证实了病毒得到成功拯救。空斑实验进一步在BHK-21细胞中验证了96 h后二代病毒的感染性,表明病毒液具有感染细胞且在细胞内复制的能力。
本研究通过构建蜱传脑炎病毒的感染性克隆,提供了一种新的工具与策略,有助于更好地理解蜱传脑炎病毒的生物学特性及其发病机制。此外,感染性克隆技术能够实现对病毒基因组的精确操纵,这对于理解病毒的关键抗原表位和药物靶点至关重要,从而为开发有效的疫苗和抗病毒药物提供了基础。未来的研究可基于这些感染性克隆,通过精确删除或修饰特定病毒基因,深入探究其在免疫逃逸中的作用,从而为新型疫苗和治疗策略的开发提供重要线索。
| [1] |
van Leur SW, Heunis T, Munnur D, Sanyal S. Pathogenesis and virulence of flavivirus infections[J]. Virulence, 2021, 12(1): 2814-2838.
[DOI]
|
| [2] |
Chiffi G, Grandgirard D, Leib SL, Chrdle A, Růžek D. Tick-borne encephalitis: a comprehensive review of the epidemiology, virology, and clinical picture[J]. Rev Med Virol, 2023, 33(5): e2470.
[DOI]
|
| [3] |
Pulkkinen LIA, Butcher SJ, Anastasina M. Tick-borne encephalitis virus: a structural view[J]. Viruses, 2018, 10(7): 350.
[DOI]
|
| [4] |
Mansfield KL, Johnson N, Phipps LP, Stephenson JR, Fooks AR, Solomon T. Tick-borne encephalitis virus-a review of an emerging zoonosis[J]. J Gen Virol, 2009, 90(Pt 8): 1781-1794.
[DOI]
|
| [5] |
Yoshii K. Epidemiology and pathological mechanisms of tick-borne encephalitis[J]. J Vet Med Sci, 2019, 81(3): 343-347.
[DOI]
|
| [6] |
Halsby K, Gildea L, Madhava H, Angulo FJ, Pilz A, Erber W, Moisi J, Schley K, Colosia A, Sellner J. Clinical manifestations and outcomes of tick-borne encephalitis: a systematic literature review[J]. Ticks Tick Borne Dis, 2024, 15(6): 102407.
[DOI]
|
| [7] |
Kaiser R. The clinical and epidemiological profile of tick-borne encephalitis in southern Germany 1994-98: a prospective study of 656 patients[J]. Brain, 1999, 122(Pt 11): 2067-2078.
[DOI]
|
| [8] |
Radzišauskienė D, Urbonienė J, Kaubrys G, Andruškevičius S, Jatužis D, Matulytė E, Žvirblytė-Skrebutienė K. The epidemiology, clinical presentation, and predictors of severe tick-borne encephalitis in Lithuania, a highly endemic country: a retrospective study of 1040 patients[J]. PLoS One, 2020, 15(11): e0241587.
[DOI]
|
| [9] |
Lenhard T, Ott D, Jakob NJ, Pham M, Bäumer P, Martinez-Torres F, Meyding-Lamadé U. Predictors, neuroimaging characteristics and long-term outcome of severe European tick-borne encephalitis: a prospective cohort study[J]. PLoS One, 2016, 11(4): e0154143.
[DOI]
|
| [10] |
Kohlmaier B, Schweintzger NA, Sagmeister MG, Švendová V, Kohlfürst DS, Sonnleitner A, Leitner M, Berghold A, Schmiedberger E, Fazekas F, Pichler A, Rejc-Marko J, Růžek D, Dufková L, AČG ejková D, Husa P, Pýchová M, Krbková L, Chmelík V, Štruncová V, Zavadska D, Karelis G, Mickiene A, Zajkowska J, Bogovič P, Strle F, Zenz W, The Eu-Tick-Bo Study G. Clinical characteristics of patients with tick-borne encephalitis (TBE): a European multicentre study from 2010 to 2017[J]. Microorganisms, 2021, 9(7): 1420.
[DOI]
|
| [11] |
Czupryna P, Grygorczuk S, Krawczuk K, Pancewicz S, Zajkowska J, Dunaj J, Matosek A, Kondrusik M, Moniuszko-Malinowska A. Sequelae of tick-borne encephalitis in retrospective analysis of 1072 patients[J]. Epidemiol Infect, 2018, 146(13): 1663-1670.
[DOI]
|
| [12] |
Veje M, Nolskog P, Petzold M, Bergström T, Lindén T, Peker Y, Studahl M. Tick-borne encephalitis sequelae at long-term follow-up: a self-reported case-control study[J]. Acta Neurol Scand, 2016, 134(6): 434-441.
[DOI]
|
| [13] |
Engman ML, Lindström K, Sallamba M, Hertz C, Sundberg B, Hansson ME, Lindquist L, Orvell C, Lidefelt KJ, Sundin M. One-year follow-up of tick-borne central nervous system infections in childhood[J]. Pediatr Infect Dis J, 2012, 31(6): 570-574.
[DOI]
|
| [14] |
Zhao F, Xu Y, Lavillette D, Zhong J, Zou G, Long G. Negligible contribution of M2634V substitution to ZIKV pathogenesis in AG6 mice revealed by a bacterial promoter activity reduced infectious clone[J]. Sci Rep, 2018, 8(1): 10491.
[DOI]
|
| [15] |
Zakotnik S, Knap N, Bogovič P, Zorec TM, Poljak M, Strle F, Avšič-Županc T, Korva M. Complete genome sequencing of tick-borne encephalitis virus directly from clinical samples: comparison of shotgun metagenomic and targeted amplicon-based sequencing[J]. Viruses, 2022, 14(6): 1267.
[DOI]
|
| [16] |
Ruzek D, Avšič Županc T, Borde J, Chrdle A, Eyer L, Karganova G, Kholodilov I, Knap N, Kozlovskaya L, Matveev A, Miller AD, Osolodkin DI, Överby AK, Tikunova N, Tkachev S, Zajkowska J. Tick-borne encephalitis in Europe and Russia: review of pathogenesis, clinical features, therapy, and vaccines[J]. Antiviral Res, 2019, 164: 23-51.
[DOI]
|
| [17] |
Lindquist L, Vapalahti O. Tick-borne encephalitis[J]. Lancet, 2008, 371(9627): 1861-1871.
[DOI]
|
| [18] |
Hansson KE, Rosdahl A, Insulander M, Vene S, Lindquist L, Gredmark-Russ S, Askling HH. Tick-borne encephalitis vaccine failures: a 10-year retrospective study supporting the rationale for adding an extra priming dose in individuals starting at age 50 years[J]. Clin Infect Dis, 2020, 70(2): 245-251.
[DOI]
|
| [19] |
Schley K, Friedrich J, Pilz A, Huang L, Balkaran BL, Maculaitis MC, Malerczyk C. Evaluation of under-testing and under-diagnosis of tick-borne encephalitis in Germany[J]. BMC Infect Dis, 2023, 23(1): 139.
[DOI]
|
| [20] |
Cocchio S, Bertoncello C, Napoletano G, Claus M, Furlan P, Fonzo M, Gagliani A, Saia M, Russo F, Baldovin T, Baldo V. Do we know the true burden of tick-borne encephalitis? A cross-sectional study[J]. Neuroepidemiology, 2020, 54(3): 227-234.
[DOI]
|
| [21] |
Krawczuk K, Czupryna P, Pancewicz S, Ołdak E, Moniuszko-Malinowska A. Comparison of tick-borne encephalitis between children and adults-analysis of 669 patients[J]. J Neurovirol, 2020, 26(4): 565-571.
[DOI]
|
| [22] |
Takano A, Yoshii K, Omori-Urabe Y, Yokozawa K, Kariwa H, Takashima I. Construction of a replicon and an infectious cDNA clone of the Sofjin strain of the Far-Eastern subtype of tick-borne encephalitis virus[J]. Arch Virol, 2011, 156(11): 1931-1941.
[DOI]
|
| [23] |
Li P, Yao C, Wang T, Wu T, Yi W, Zheng Y, Miao Y, Sun J, Tan Z, Liu Y, Zhang X, Wang H, Zheng Z. Recovery of a far-eastern strain of tick-borne encephalitis virus with a full-length infectious cDNA clone[J]. Virol Sin, 2021, 36(6): 1375-1386.
[DOI]
|
 2024, Vol. 19
2024, Vol. 19


