2. 太仓市第一人民医院(苏州大学附属太仓医院)感染科,江苏 苏州 215400;
3. 无锡市第五人民医院感染科,江苏 无锡 320200
2. Department of Infectious Diseases, the First People's Hospital of Taicang City (Taicang Hospital, Suzhou University), Suzhou 215400, Jiangsu Province, China;
3. Department of Infectious Diseases, The Fifth People's Hospital of Wuxi City, Wuxi 320200, Jiangsu Province, China
结核病是由结核分枝杆菌感染引起的慢性疾病,是威胁全世界人类健康的重大传染病之一。世界卫生组织估计2022年全球新发结核病例数约为750万,约130万人死于结核病[1]。活动性结核(active tuberculosis,ATB)是指患者体内结核分枝杆菌繁殖活跃,通常在开放病灶处排出。机体对结核分枝杆菌的免疫机制复杂多样,以T细胞介导的细胞免疫为主要手段。CD4+ T细胞主要通过分泌γ-干扰素等细胞因子活化巨噬细胞,增强其吞噬杀灭结核杆菌的能力;CD8+ T细胞则主要通过穿孔素-颗粒酶途径等直接裂解被结核杆菌感染的细胞,使其暴露于巨噬细胞等杀伤细胞,从而有效清除胞内寄生的结核杆菌[2]。在清除结核分枝杆菌的免疫过程中,T细胞表面活化分子的表达水平会随着细胞的功能状态发生变化。记忆T细胞在结核慢性感染过程中发挥的免疫调控作用同样不容忽视,根据细胞表面CD45RA和CCR7的表达情况,将其分为初始T细胞(naïve T cell)、中枢记忆T细胞(central memory T cell,TCM)、效应记忆T细胞(effector memory T cell,TEM)、终末分化效应记忆T细胞(terminal effector memory T cell,TEMRA)亚群[3]。记忆T细胞各亚群既能迅速在结核杆菌抗原的刺激下增殖分化为效应T细胞来执行免疫清除功能,又能长期分泌γ-干扰素等细胞因子来调控免疫功能。然而,长期的抗原暴露会使记忆T细胞的表型与功能发生异常,从耗竭前体T细胞(progenitor exhausted T cell,TPEX)逐渐分化为终末耗竭T细胞(terminal exhausted T cell,TTEX),不仅失去清除结核的能力,还进一步抑制其他免疫细胞的免疫效应[4]。本研究通过评估ATB患者T细胞亚群以及功能状态的改变,以初步揭示T细胞分化在结核感染中的异质性。
1 材料和方法 1.1 材料本研究纳入2020年12月—2021年5月太仓市第一人民医院收治的ATB患者21例,同时纳入同期来自复旦大学附属华山医院的10例健康体检者。纳入者年龄均≥18周岁,排除肿瘤以及自身免疫疾病。所有纳入者均签署知情同意书。本研究通过了复旦大学附属华山医院伦理委员会审核批准(KY2021-542)和太仓市第一人民医院医学伦理委员会审核批准(2020-KY-238)。
ATB组纳入标准[5],须符合以下条件之一:(1)病原学诊断标准:组织病理学检查提示结核病,或痰/肺泡灌洗液抗酸杆菌涂片和(或)分枝杆菌培养阳性和(或)GeneXpert.TB阳性;(2)临床诊断标准:①胸部计算机断层扫描(computed tomography,CT)检查显示ATB的特征;②有结核中毒症状或呼吸道症状,如午后低热、盗汗、乏力、咳嗽、咯血、胸痛或胸闷等;③抗结核治疗有效。纳入患者入组时均为初治患者,尚未接受抗结核治疗或抗结核治疗不超过2周。
健康对照(healthy controls,HC)组纳入标准,须同时符合以下条件:①外周血QuantiFERON-TB GOLD-IN-TUBE检测阴性;②无任何ATB感染的临床证据。
1.2 方法 1.2.1 流式抗体配色LIVE/DEAD Blue、人类白细胞抗原-DR(human leukocyte antigen-DR, HLA-DR)-eFluor 450、CD8-Qdot 800、脱中胚蛋白(eomesodermin, EOMES)-PerCP-eFluor 710、胸腺细胞选择相关性高迁移率族蛋白(thymocyte selection-associated high mobility group box protein, TOX)-PE来自美国Thermo Fisher Scientific。CD45RA-BUV563、CCR7-BUV661、CD25-BUV737)、程序性细胞死亡蛋白1(programmed cell death protein 1, PD1)-BV421、CD39-BV480、CD3-BV510)、CXCR5-BV750、CD62L-BB515、CD19-PE-Cy5.5、CD69-APC-Cy7来自美国BD Bioscience。CD4-BV570、CD56-BV605、CD127-BV650、淋巴细胞激活基因3(lymphocyte activation gene 3, LAG3)-BV711、杀伤细胞凝集素样受体G1(killer cell lectin-like receptor G1, KLRG1)-BV785、CD45-FITC、含Ig和ITIM结构域的T细胞免疫受体(T cell immunoreceptor with Ig and ITIM domains, TIGIT)-PE-Dazzle 594、T盒转录因子(T-box expressed in T cells, T-bet)-PE-Cy7、T细胞免疫球蛋白黏蛋白分子3(T-cell immunoglobulin and mucin domain 3,TIM-3)-APC、T细胞因子1 (T cell factor 1,TCF1)-Alexa Fluor 647、CD14-Alexa Fluor 700来自美国BioLegend。
1.2.2 标本采集以EDTA抗凝采血管采集受试者外周静脉血,于4~6 h之内处理。
1.2.3 全血流式细胞表面染色染色设置空白管和荧光减一对照管。取流式管若干,每管加入100 μ L全血,加入相应表面染色的抗体,震荡混匀,室温避光孵育15 min;每100 μ L全血对应加入2 mL红细胞裂解液(美国BD Bioscience),震荡混匀,室温避光孵育10 min;400×g离心5 min,弃去上清液;分别加入2 mL及1 mL 1×PBS(0.01 mol/L)各洗涤1次(400×g离心5 min),将细胞沉淀震荡混匀;细胞破膜,每管分别加入1 mL破膜工作液,置于4 ℃冰箱避光孵育45 min;每管分别加入1 mL 1×破膜洗剂(含0.1%皂苷和0.09%叠氮化钠)(美国BD Bioscience)洗涤2次(500×g离心5 min),弃上清液,留细胞沉淀,将细胞沉淀震荡混匀;加入细胞内染色的抗体,震荡混匀,置于4 ℃冰箱避光孵育45 min;每管分别加入1 mL 1×破膜洗剂(含0.1%皂苷和0.09%叠氮化钠)洗涤2次(500×g离心5 min),弃上清液,细胞沉淀震荡混匀;每管加入200 μ L 2%多聚甲醛(合肥白鲨生物)固定细胞,加盖,4 ℃避光保存待流式检测;使用Cytek光谱流式细胞仪(美国Cytek Biosciences)上机检测,并应用Flowjo软件(美国Treestar)进行数据分析。
1.2.4 统计学分析应用GraphPad Prism 9.5软件进行统计学分析。呈偏态分布的计量资料以均值[4分位数的间距(interquartile range,IQR)] 表示,即M(Q1,Q3)。两组间连续变量比较采用非参数Mann-Whitney U检验。计数资料以例数表示,比较采用Fisher确切概率法。P < 0.05代表差异有统计学意义。
2 结果 2.1 一般资料及外周血免疫细胞亚群占比差异21例ATB患者中,分别有12例男性和9例女性,中位年龄为43(29~70)岁,与HC组在性别、年龄上均无统计学差异(P=0.40)(见图 1、表 1及表 2)。ATB组的外周血单个核细胞(peripheral blood monocytic cells, PBMCs)中T细胞[41.10% (32.30%, 52.60%) vs 44.05% (34.83%, 48.83%)]、B细胞[4.62% (2.89%, 5.78%) vs 5.34% (3.07%, 8.53%)]、NK细胞[12.80% (8.68%, 17.00%) vs 13.40% (9.54%, 15.35%)]、单核细胞[12.00% (6.25%, 22.30%) vs 10.65% (6.02%, 13.35%)]的占比均无统计学差异(P>0.05)。T细胞中CD4+ T细胞[51.30% (38.85%, 58.20%) vs 55.25% (46.95%, 59.95%)]与CD8+ T细胞[35.10% (26.75%, 39.70%) vs 33.10% (30.28%, 41.85%)]的占比无统计学差异(P>0.05)(具体数据见表 2及图 2)。
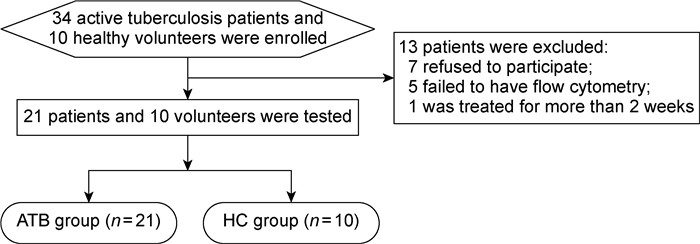
|
| 图 1 ATB组与HC组入组流程 Fig. 1 Participant flow diagram of ATB group and HC group |
| Subject | ATB group (n=21) | Subject | ATB group (n=21) | |
| Sex [count(%)] | Bloodroutine [M (Q1, Q3)]a | |||
| Male | 12(57.1) | WBC count(×109/L) | 6.25(5.00,7.18) | |
| Female | 9(42.9) | Neutrophil proportion(%) | 68.60(63.03,73.83) | |
| Age [count(%)] | Lymphocyte proportion(%) | 21.20(16.68,28.00) | ||
| ≥60 | 6(28.6) | Hemoglobin(g/L) | 123.5(109.3,137.8) | |
| < 60 | 15(71.4) | Platelet count(×109/L) | 266.5(195.8,368.3) | |
| Symptom [count(%)] | Etiological examination [count(%)] | |||
| Fever | 5(23.8) | All negative | 10(47.6) | |
| Night sweat | 3(14.3) | Sputum smear positive | 4(19.0) | |
| Weight loss | 4(19.0) | Sputum culture positive | 4(19.0) | |
| Cough | 10(47.6) | GeneXpert MTB positive | 6(28.6) | |
| Expectoration | 6(28.6) | CT scan [count(%)] | ||
| Hemoptysis | 5(23.8) | Infiltration | 16(76.2) | |
| Dyspnea | 4(19.0) | Nodule | 6(28.6) | |
| Chest pain | 3(14.3) | Cavityb | 3(14.3) | |
| Comorbidity [count(%)] | Pleural effusion | 3(14.3) | ||
| Chronic hepatopathy | 2(9.52) | Involving lobesc [count(%)] | ||
| (hepatitis, cirrhosis, etc) | 1 lobe | 6(28.6) | ||
| Diabetes | 1(4.76) | 2 lobes | 8(38.1) | |
| Chronic Kidney Disease | 1(4.76) | 3 lobes | 4(19.0) | |
| BCG vaccination [count(%)] | 4 lobes | 1(4.76) | ||
| Yes | 10(47.6) | 5 lobes | 2(9.52) | |
| No | 11(52.4) | |||
| a 5 patients didn’t measure blood routine. b These 3 patients have 1, 2 and 5 cavities in their lungs respectively, the largest of which covers 31 mm×24 mm, 7.6 mm×8.2 mm and 10 mm×14 mm correspondingly. c The result originates from CT scan. |
||||
| Subject[M(Q1, Q3)] | ATB group(n=21) | HC group(n=10) | U | P |
| Male [count(%)] | 12(57.1) | 4(40) | / | 0.458 |
| Age (years) | 43(29, 70) | 42(30, 43) | 84.50 | 0.400 |
| T cell (%) | 41.10(32.30, 52.60) | 44.05(34.83, 48.83) | 100.00 | 0.874 |
| CD4+ T cell (%) | 51.30(38.85, 58.20) | 55.25(46.95, 59.95) | 80.00 | 0.519 |
| CD8+ T cell (%) | 35.10(26.75, 39.70) | 33.10(30.28, 41.85) | 102.00 | 0.910 |
| B cell (%) | 4.62(2.89, 5.78) | 5.34(3.07, 8.53) | 84.00 | 0.393 |
| NK cell (%) | 12.80(8.68, 17.00) | 13.40(9.54, 15.35) | 90.50 | 0.874 |
| Monocyte (%) | 12.00(6.25, 22.30) | 10.65(6.02, 13.35) | 88.50 | 0.874 |
|
|
A: The gate strategy of all subsets from PBMC and T cells in ATB group. B: The gate strategy of all subsets from PBMC and T cells in HC group. 图 2 ATB组与HC组流式细胞术圈门示意图 Fig. 2 The gate strategy of flow cytometry between ATB group and HC group |
与HC组相比,ATB组CD4+ T细胞中naïve T、TCM、TEM、TEMRA细胞占比均无显著差异(P>0.05),耗竭前体TPEX及终末耗竭TTEX细胞占比无显著差异(P>0.05),仅Tfh占比低于HC组[11.90% (8.78%, 13.95%) vs 16.15% (13.00%, 22.30%)](P=0.007)。CD8+ T细胞中naïve T细胞[10.50% (3.47%, 19.15%) vs 26.45% (14.68%, 48.90%)]比例低于HC组(P=0.020);TPEX细胞比例[2.28% (1.52%, 4.63%) vs 20.55% (9.13%, 31.13%)]低于HC组(P < 0.001),而终末耗竭TTEX细胞[12.70% (7.14%, 19.45%) vs 5.43% (4.03%, 9.76%)]高于HC组(P=0.044),TCM、TEM、TEMRA间无显著差异(P>0.05),具体数据如表 3及图 2所示。
| Cell type | Subtype[M(Q1, Q3)] | ATB group(n=21) | HC group(n=10) | U | P |
| CD4+ T | CD45RA+CCR7+naïve T | 18.90(15.00, 42.85) | 34.00(28.35, 39.88) | 70.00 | 0.373 |
| cell (%) | CD45RA-CCR7+central memory T | 22.60(17.45, 34.20) | 25.80(22.35, 34.88) | 83.00 | 0.596 |
| CD45RA-CCR7-effector memory T | 47.10(32.25, 55.00) | 32.45(27.58, 43.75) | 52.00 | 0.095 | |
| CD45RA+CCR7-terminal effector memory T | 1.88(0.65, 3.19) | 1.78(0.98, 3.22) | 98.00 | 0.780 | |
| PD1- TCF1+ exhausted T precursor | 3.31(1.26, 7.54) | 6.32(4.07, 9.38) | 69.00 | 0.252 | |
| PD1+ TCF1-terminal exhausted T | 10.40(7.20, 20.65) | 12.50(7.88, 17.20) | 102.0 | 0.910 | |
| CD127-CD25+ regulatory T | 4.81(3.73, 6.02) | 5.45(4.65, 6.65) | 82.00 | 0.348 | |
| CXCR5+ follicular helper T | 11.90(8.78, 13.95) | 16.15(13.00, 22.30) | 38.00 | 0.007 | |
| CD8+ T | CD45RA+CCR7+naïve T | 10.50(3.47, 19.15) | 26.45(14.68, 48.90) | 40.50 | 0.020 |
| cell (%) | CD45RA+CCR7-central memory T | 0.98(0.49, 1.87) | 1.79(0.92, 2.47) | 74.00 | 0.490 |
| CD45RA-CCR7+ effector memory T | 59.20(29.70, 77.55) | 42.50(35.88, 53.50) | 90.00 | 0.603 | |
| CD45RA-CCR7- terminal effector memory T | 19.20(10.72, 55.90) | 16.95(7.06, 34.95) | 83.00 | 0.603 | |
| PD1-TCF1+ exhausted T precursor | 2.28(1.52, 4.63) | 20.55(9.13, 31.13) | 17.00 | < 0.001 | |
| PD1+ TCF1- terminal exhausted T | 12.70(7.14, 19.45) | 5.43(4.03, 9.76) | 57.50 | 0.044 |
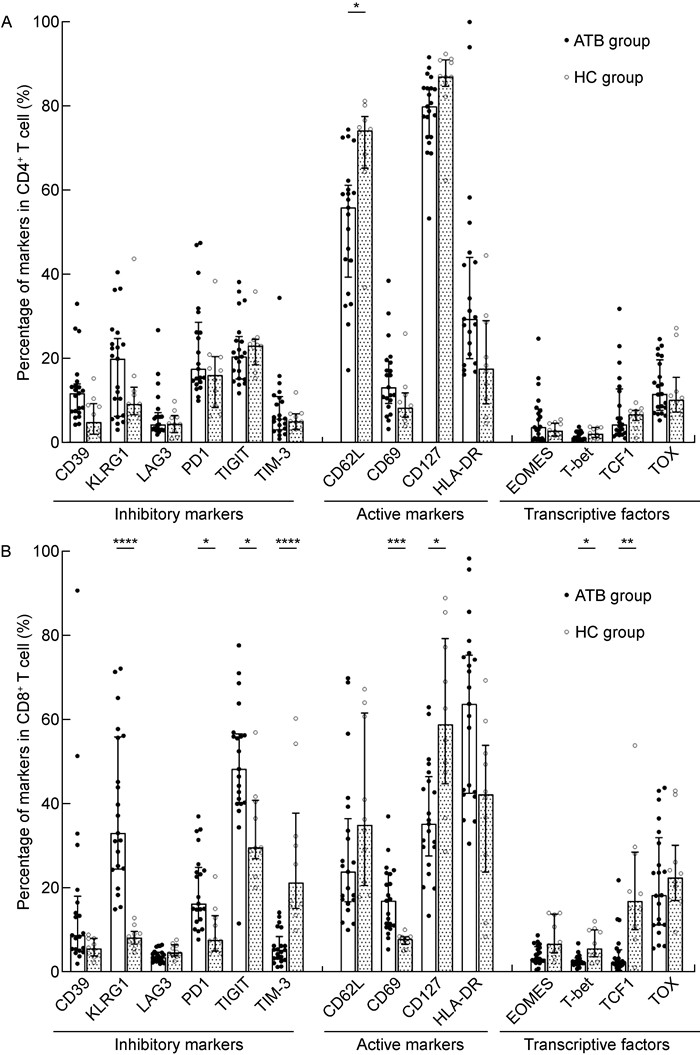
ATB组CD4+ T细胞表面抑制性标志分子表达量CD39、KLRG1、LAG3、PD 1、TIGIT、TIM-3之间均无显著差异(P>0.05);活化性标志分子仅CD62L[55.80% (39.25%, 61.15%) vs 74.15% (65.20%, 77.50%)] 低于HC组(U=29, P=0.010),CD69、CD127、HLA-DR之间无显著差异(P>0.05);转录因子EOMES、T-bet、TCF1、TOX水平也没有统计学差异(P>0.05)。在CD8+ T细胞上,ATB组TIM-3[5.19% (3.01%, 8.40%) vs 21.25% (15.08%, 37.80%)]以及CD127[35.20% (27.60%, 46.45%) vs 58.90% (44.78%, 79.38%)]显著降低(P < 0.05),而抑制性标志分子KLRG1[33.00% (24.45%, 55.95%) vs 8.15% (6.60%, 9.63%)]、PD1[16.20% (12.20%, 24.85%) vs 7.56% (4.97%, 13.35%)]、TIGIT[48.30% (40.15%, 56.65%) vs 29.55% (26.95%, 40.80%)]表达显著升高(P < 0.05)。除此之外,活化性标志分子CD69[16.90% (10.80%, 23.40%) vs 7.79% (6.51%, 8.36%)]在ATB组的CD8+ T淋巴细胞中的表达也显著升高(P < 0.001),转录因子中T-bet[2.32% (1.83%, 3.28%) vs 5.52% (3.58%, 10.01%), P=0.013]和TCF1[2.22% (1.43%, 5.24%) vs 14.05% (8.15%, 23.63%), P=0.006]表达均显著降低(见图 3)。
|
|
A: The percentage of markers in CD4+ T cell in ATB group and HC group. B: The percentage of markers in CD8+ T cell in ATB group and HC group. *: P≤0.05; * *: P≤0.01; * * *: P≤0.001; * * * *: P < 0.000 1. 图 3 ATB组与HC组抑制分子、活化分子与转录因子表达水平比较 Fig. 3 The comparison of inhibitory markers, active markers and transcriptive factors on CD4+ and CD8+ T cells between ATB group and HC group |
机体对抗结核分枝杆菌感染的机制十分复杂,菌体定植局灶乃至全身都有相应的免疫反应,本研究主要探索结核分枝杆菌对循环中T细胞的影响。长期以来,CD4+ T细胞被认为是抗结核保护性免疫的关键细胞,人类免疫缺陷病毒感染引起的CD4+ T细胞大量减少可导致患者新发结核或潜伏结核再活动的概率上升[6]。近期研究还表明,除了通过分泌γ-干扰素(interferon-γ,IFN γ)增强单核-巨噬细胞吞噬杀灭结核分枝杆菌能力的1型T辅助细胞(helper T cell 1,Th1)亚群,CD4+ T细胞的其他亚群也会在结核分枝杆菌诱发的机体免疫过程中发挥多种作用,Th2可以通过分泌IL-4、IL-5等细胞因子促进IgA等抗体的产生,来阻止结核分枝杆菌的播散,也可促进巨噬细胞向M2型的极化,从而促进肉芽肿的形成,并参与结核变态反应[7]。Th17则可以分泌IL-17、IL-23等细胞因子募集单核-巨噬细胞、中性粒细胞至感染局部,以遏制结核分枝杆菌的早期播散[8]。调节性T细胞(regulatory T cell,Treg)可以抑制过度的炎症反应,但也会导致结核的播散[9]。慢性结核感染可使CD4+ T细胞转向耗竭状态,表现为表型和功能的转变,如IFN γ等正向调控细胞因子分泌的减少、PD1等免疫抑制分子表达增加等[10]。本研究发现,ATB组的Tfh显著低于HC组,提示在结核感染过程淋巴结淋巴滤泡形成增加,从而募集更多Tfh,使循环中Tfh的比例降低。Swanson等[11]发现,结核特异性抗原可以诱导特定B细胞表型,该表型可以趋化Tfh进入淋巴滤泡发挥作用,佐证了本研究发现循环Tfh减少的结果。
CD8+ T细胞在结核免疫中的作用尚未明确,但越来越多的文献表明其在结核免疫中的作用应予以重视。CD8+ T细胞识别结核分枝杆菌寄生的细胞表面MHC-I类分子呈递的抗原成分,并释放穿孔素与颗粒酶或通过FasL直接接触,使被寄生的细胞裂解释放结核杆菌,从而解除结核杆菌的免疫逃避[12]。CD8+ T细胞释放穿孔素的某些亚型还具备直接裂解结核杆菌的能力[13]。然而,由于长期接受抗原的刺激,CD8+ T较CD4+ T细胞更容易转变为耗竭表型。本研究发现,CD8+ T细胞的耗竭表现为耗竭T细胞亚群的比例变化,ATB患者相较于HC组其PD1-TCF1+ TPEX细胞显著减少,而PD1+ TCF1- TTEX细胞显著增加。Beltra等[14]发现,耗竭前体T细胞仍有逆转耗竭状态重新转为活化状态的能力,而终末耗竭T细胞则发生不可逆的耗竭表型转换。本研究中ATB患者与HC组耗竭前体T细胞转向终末耗竭T细胞的比例可在一定程度上反映结核感染可促进T细胞的耗竭。以上表现在CD4+ T细胞中并未观察到,并且ATB患者T细胞中CD8+ T细胞占比显著低于HC组,说明慢性结核感染过程中CD8+ T细胞耗竭程度加剧,且比CD4+ T细胞更严重。
PDL1/PD1轴是T细胞免疫检查点的常见信号通路之一,该通路可以通过多种途径抑制T细胞功能(包括抑制T细胞活化、降低T细胞分泌IFN-γ等细胞因子的水平、诱导T细胞耗竭等),从而避免过度炎症反应,以维持免疫稳态[15]。然而,在恶性肿瘤及感染性疾病中,PD1的上调并不利于肿瘤细胞与病原体的清除,反而加剧了疾病进展,因此阻断PDL1/PD1通路,恢复T细胞功能成为治疗上述疾病的一种新型方案。本研究发现,ATB组CD8+ T细胞的PD1水平显著高于HC组,与Pan等[16]的研究结果一致,佐证了结核杆菌能够诱导PD1表达逃避免疫杀伤的能力。同时也有研究表明,恶性肿瘤患者使用PD1阻断剂后会诱导潜伏感染结核转为活动性结核,并加重结核造成的组织损伤[17],这揭示了PDL1/PD1轴在结核感染中的复杂作用。
TIGIT也是常见的免疫检查点分子,其于T细胞、NK细胞表面限制表达,CD155/TIGIT轴在恶性肿瘤与慢性病毒感染中抑制CD8+ T细胞的功能,加重了肿瘤或病原体的播散[18]。但在结核感染中TIGIT的具体作用尚未明确,目前有文献认为TIGIT可能主要通过抑制NK细胞杀伤功能,加剧结核杆菌播散以及组织局部炎症反应,从而加重了结核病情[19]。
KLRG1主要于高度分化的效应T细胞中表达,KLRG1+ T细胞的增殖能力较弱,凋亡率增加,并且具有抑制其他效应T细胞活化的能力,标志着T细胞进入衰老阶段[20]。同时,KLRG1+ T细胞也是记忆T细胞前体的重要标志,外周KLRG1+效应T细胞可通过减少KLRG1表达来重新获得潜在增殖能力,转化为记忆T细胞,在下一次相同病原体的侵袭下产生迅速强效的免疫反应[21]。本研究发现,ATB组CD8+ T细胞的KLRG1表达水平高于HC组,表明在慢性结核感染的过程中,结核抗原的长期刺激不仅可以降低效应T细胞的活力,而且能阻止效应T细胞转化为记忆T细胞,以防止机体产生针对结核杆菌杀伤力极强的特异性免疫反应。
CD127是IL-7的受体α链,而IL-7由胸腺基质细胞分泌,在胸腺中具有促进T细胞分化成熟的功能,在外周血则可以抑制T细胞凋亡并激活静息的记忆T细胞,对维持T细胞的免疫功能具有重要作用。Acheampong等[22]发现,ATB患者外周血T细胞表面CD127水平下降,可能与记忆T细胞形成障碍相关;Li等[23]则通过结核感染小鼠模型证实,长期持续结核抗原刺激可以抑制骨髓造血细胞增殖导致的外周血淋巴细胞数量下降,而补充IL-7可以恢复淋巴细胞的数量与功能。本研究发现,ATB患者外周血CD8+ T细胞CD127分子水平均显著低于HC组,提示结核分枝杆菌可以降低T细胞对IL-7的反应,从而抑制淋巴细胞在外周组织的更新,导致大量功能受损的衰老耗竭淋巴细胞滞留在病灶局部,形成免疫抑制微环境以维持生存。
T-bet最早由Szabo等[24]于2000年发现,是T-box家族的转录因子之一,为TBX21基因所编码,参与调控初始T细胞向Th1型辅助T细胞分化的过程,并具有调节T细胞表面CXCR3表达的功能。T-bet在CD8+ T细胞中具有促进IFN-γ生成的功能,后者在细胞免疫过程中激活巨噬细胞的吞噬功能等,对于清除结核杆菌至关重要,同时在多种病原体(例如HIV、LCMV)的慢性感染中CD8+ T细胞T-bet水平的下调提示T细胞促炎能力的下降,这与不良预后结局密切相关[25]。本研究发现的ATB患者CD8+ T细胞T-bet表达水平下降也进一步佐证了以上观点。
Wetering等[26]在1991年于人T细胞中发现了一个T细胞特异性表达的转录因子,并将其命名为T细胞因子1(T cell-specific transcription factor,TCF1),TCF1由Tcf7基因编码,可以通过Wnt/β-catenin通路调控CD3 ε的表达。TCF1是T细胞保持自我更新能力的重要标志之一,通过调控Bcl2、Bcl6等抗凋亡蛋白来维持T细胞存活及其增殖能力,在CD8+ T细胞耗竭的过程中TCF1的表达水平随着耗竭程度的加深、杀伤能力的下降而下调[27]。本研究结果表明,与健康人群相比,ATB患者CD8+ T细胞的TCF1表达水平降低,这反映了慢性结核感染对T细胞活化功能的损伤,这一结果与Fan等[28]在严重的空洞性肺结核患者中观察到的Wnt/β -catenin通路相关蛋白表达下调的结果一致。
BCG(Bacillus Calmette-Guérin),中文名称卡介苗,是由法国科学家卡尔梅特(Calmette)和介朗(Guérin)通过将牛结核分枝杆菌传代230次获得的减毒活菌株,目前广泛应用于学龄前儿童的结核病预防。BCG能有效降低婴幼儿感染结核的风险,然而对于成年人的保护作用一直不太理想。Dintwe等[29]通过临床试验表明,成年人再次皮下接种BCG可以显著提升外周血效应记忆CD4+ Th1细胞亚群的比例,但并未观察到CD8+ T细胞的差异,提示BCG主要通过CD4+ T细胞发挥保护作用,但对CD8+ T细胞的功能状态影响有限。Audran等[30]通过随机对照试验发现,吸入式接种BCG不仅增强了受试者全身针对结核杆菌的细胞免疫反应,而且有效增加了支气管肺泡灌洗液中IFN γ/IL17+CD4+ T细胞的比例,显示出更强的黏膜免疫能力。这表明,相较于皮下接种,经呼吸道局部接种BCG能更有效诱导针对结核分枝杆菌的免疫保护。本研究主要探究结核分枝杆菌突破免疫屏障引起活动性结核对T细胞表型的影响,但未考虑到BCG的预防性作用。此外,健康对照组均为BCG接种者,无法形成有效对照,故未就接种BCG对T细胞表型的影响进行对比分析。
本研究有如下不足之处:①入选样本数量不足;②选择比较的表面分子主要与T细胞功能相关,对于其他细胞的特征分子(例如B细胞与CD19、CD79a,单核细胞与CD14、TLR4,NK细胞与CD56、CD16等)与活动性结核感染的关系关注较少;③本研究仅挑选具有代表性的数种免疫细胞,并未考虑其他免疫细胞(如中性粒细胞、树突状细胞等)的功能变化;④本研究为横断面研究,未能阐述ATB患者随病程进展而发生的免疫状态变化以及不同免疫状态对于患者预后的影响。后续将扩大样本量,进行深入研究。
综上所述,ATB患者体内T细胞表型变化与健康人群差异较大,其中PD1、KLRG1、TIGIT的上升、CD127的下降,反映活动性结核感染使T细胞表现出独特的表型特征:促炎能力下降而抗炎能力增强,同时CD8+ T细胞向耗竭表型分化加剧。
| [1] |
World Health Organization. Global tuberculosis report 2023[EB/OL]. (2023-10-01)[2024-08-15]. https://www.who.int/teams/global-tuberculosis-programme/tb-reports/global-tuberculosis-report-2023.
|
| [2] |
Sia JK, Rengarajan J. Immunology of mycobacterium tuberculosis infections[J]. Microbiol Spectr, 2019, 7(4).
[DOI]
|
| [3] |
Benichou G, Gonzalez B, Marino J, Ayasoufi K, Valujskikh A. Role of memory T Cells in allograft rejection and tolerance[J]. Front Immunol, 2017, 8: 170.
[DOI]
|
| [4] |
Counoupas C, Triccas JA. The generation of T-cell memory to protect against tuberculosis[J]. Immunol Cell Biol, 2019, 97(7): 656-663.
[DOI]
|
| [5] |
张炜, 龚银花, 刘倩倩, 杨清銮, 许毓贞, 刘袁媛, 邵凌云, 欧勤芳, 浦永兰, 张文宏. 人类免疫缺陷病毒感染、结核分枝杆菌感染和共感染患者的CD8+ T细胞耗竭状态[J]. 中华传染病杂志, 2022, 40(7): 392-399. [DOI]
|
| [6] |
Bell LCK, Noursadeghi M. Pathogenesis of HIV-1 and Mycobacterium tuberculosis co-infection[J]. Nat Rev Microbiol, 2018, 16(2): 80-90.
[DOI]
|
| [7] |
Abebe F. Synergy between Th1 and Th2 responses during Mycobacterium tuberculosis infection: a review of current understanding[J]. Int Rev Immunol, 2019, 38(4): 172-179.
[DOI]
|
| [8] |
Lovey A, Verma S, Kaipilyawar V, Ribeiro-Rodrigues R, Husain S, Palaci M, Dietze R, Ma S, Morrison RD, Sherman DR, Ellner JJ, Salgame P. Early alveolar macrophage response and IL-1R-dependent T cell priming determine transmissibility of Mycobacterium tuberculosis strains[J]. Nat Commun, 2022, 13(1): 884.
[DOI]
|
| [9] |
Cardona P, Cardona PJ. Regulatory T Cells in Mycobacterium tuberculosis infection[J]. Front Immunol, 2019, 10: 2139.
[DOI]
|
| [10] |
Lombardi A, Villa S, Castelli V, Bandera A, Gori A. T-cell exhaustion in Mycobacterium tuberculosis and nontuberculous Mycobacteria infection: pathophysiology and therapeutic perspectives[J]. Microorganisms, 2021, 9(12): 2460.
[DOI]
|
| [11] |
Swanson RV, Gupta A, Foreman TW, Lu L, Choreno-Parra JA, Mbandi SK, Rosa BA, Akter S, Das S, Ahmed M, Garcia-Hernandez ML, Singh DK, Esaulova E, Artyomov MN, Gommerman J, Mehra S, Zuniga J, Mitreva M, Scriba TJ, Rangel-Moreno J, Kaushal D, Khader SA. Antigen-specific B cells direct T follicular-like helper cells into lymphoid follicles to mediate Mycobacterium tuberculosis control[J]. Nat Immunol, 2023, 24(5): 855-868.
[DOI]
|
| [12] |
Witt KD. Role of MHC class I pathways in Mycobacterium tuberculosis antigen presentation[J]. Front Cell Infect Microbiol, 2023, 13: 1107884.
[DOI]
|
| [13] |
Noschka R, Wondany F, Kizilsavas G, Weil T, Weidinger G, Walther P, Michaelis J, Stenger S. Gran1: a granulysin-derived peptide with potent activity against intracellular Mycobacterium tuberculosis[J]. Int J Mol Sci, 2021, 22(16): 8392.
[DOI]
|
| [14] |
Beltra JC, Manne S, Abdel-Hakeem MS, Kurachi M, Giles JR, Chen Z, Casella V, Ngiow SF, Khan O, Huang YJ, Yan P, Nzingha K, Xu W, Amaravadi RK, Xu X, Karakousis GC, Mitchell TC, Schuchter LM, Huang AC, Wherry EJ. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms[J]. Immunity, 2020, 52(5): 825-41.e8.
[DOI]
|
| [15] |
Chamoto K, Yaguchi T, Tajima M, Honjo T. Insights from a 30-year journey: function, regulation and therapeutic modulation of PD1[J]. Nat Rev Immunol, 2023, 23(10): 682-695.
[DOI]
|
| [16] |
Pan SW, Shu CC, Huang JR, Lee CC, Tseng YH, Hung JJ, Hsu PK, Chen NJ, Su WJ, Feng JY, Chen YM. PD-L1 expression in monocytes correlates with bacterial burden and treatment outcomes in active pulmonary tuberculosis[J]. Int J Mol Sci, 2022, 23(3): 1619.
[DOI]
|
| [17] |
Barber DL, Sakai S, Kudchadkar RR, Fling SP, Day TA, Vergara JA, Ashkin D, Cheng JH, Lundgren LM, Raabe VN, Kraft CS, Nieva JJ, Cheever MA, Nghiem PT, Sharon E. Tuberculosis following PD-1 blockade for cancer immunotherapy[J]. Sci Transl Med, 2019, 11(475): eaat2702.
[DOI]
|
| [18] |
Freed-Pastor WA, Lambert LJ, Ely ZA, Pattada NB, Bhutkar A, Eng G, Mercer KL, Garcia AP, Lin L, Rideout WM 3rd, Hwang WL, Schenkel JM, Jaeger AM, Bronson RT, Westcott PMK, Hether TD, Divakar P, Reeves JW, Deshpande V, Delorey T, Phillips D, Yilmaz OH, Regev A, Jacks T. The CD155/TIGIT axis promotes and maintains immune evasion in neoantigen-expressing pancreatic cancer[J]. Cancer Cell, 2021, 39(10): 1342-60.e14.
[DOI]
|
| [19] |
Rao Y, Cao W, Qu J, Zhang X, Wang J, Wang J, Li G, Li D, Pei Y, Xu W, Gai X, Sun Y. More severe lung lesions in smoker patients with active pulmonary tuberculosis are associated with peripheral NK cell subsets[J]. Tuberculosis (Edinb), 2023, 138: 102293.
[DOI]
|
| [20] |
Zhang Y, Chen S, Tang X, Peng Y, Jiang T, Zhang X, Li J, Liu Y, Yang Z. The role of KLRG1: a novel biomarker and new therapeutic target[J]. Cell Commun Signal, 2024.
[DOI]
|
| [21] |
Herndler-Brandstetter D, Ishigame H, Shinnakasu R, Plajer V, Stecher C, Zhao J, Lietzenmayer M, Kroehling L, Takumi A, Kometani K, Inoue T, Kluger Y, Kaech SM, Kurosaki T, Okada T, Flavell RA. KLRG1(+) effector CD8(+) T cells lose KLRG1, differentiate into all memory T cell lineages, and convey enhanced protective immunity[J]. Immunity, 2018, 48(4): 716-29.e8.
[DOI]
|
| [22] |
Acheampong I, Minadzi D, Adankwah E, Aniagyei W, Vivekanandan MM, Yeboah A, Arthur JF, Lamptey M, Abass MK, Kumbel F, Osei-Yeboah F, Gawusu A, Laing EF, Batsa Debrah L, Owusu DO, Debrah A, Mayatepek E, Seyfarth J, Phillips RO, Jacobsen M. Diminished interleukin-7 receptor expression on T-cell subsets in tuberculosis patients[J]. Hum Immunol, 2023, 84(10): 543-550.
[DOI]
|
| [23] |
Li F, Ma Y, Li X, Zhang D, Han J, Tan D, Mi Y, Yang X, Wang J, Zhu B. Severe persistent mycobacteria antigen stimulation causes lymphopenia through impairing hematopoiesis[J]. Front Cell Infect Microbiol, 2023, 13: 1079774.
[DOI]
|
| [24] |
Szabo SJ, Kim ST, Costa GL, Zhang X, Fathman CG, Glimcher LH. A novel transcription factor, T-bet, directs Th1 lineage commitment[J]. Cell, 2000, 100(6): 655-669.
[DOI]
|
| [25] |
Pritchard GH, Kedl RM, Hunter CA. The evolving role of T-bet in resistance to infection[J]. Nat Rev Immunol, 2019, 19(6): 398-410.
[DOI]
|
| [26] |
van de Wetering M, Oosterwegel M, Dooijes D, Clevers H. Identification and cloning of TCF-1, a T lymphocyte-specific transcription factor containing a sequence-specific HMG box[J]. EMBO J, 1991, 10(1): 123-132.
[DOI]
|
| [27] |
Escobar G, Mangani D, Anderson AC. T cell factor 1: a master regulator of the T cell response in disease[J]. Sci Immunol, 2020, 5(53): eabb9726.
[DOI]
|
| [28] |
Fan L, Shen H, Huang H, Yang R, Yao L. Impairment of Wnt/ β -catenin signaling in blood cells of patients with severe cavitary pulmonary tuberculosis[J]. PLoS One, 2017, 12(3): e0172549.
[DOI]
|
| [29] |
Dintwe OB, Ballweber Fleming L, Voillet V, McNevin J, Seese A, Naidoo A, Omarjee S, Bekker LG, Kublin JG, De Rosa SC, Newell EW, Fiore-Gartland A, Andersen-Nissen E, McElrath MJ. Adolescent BCG revaccination induces a phenotypic shift in CD4(+) T cell responses to Mycobacterium tuberculosis[J]. Nat Commun, 2024, 15(1): 5191.
[DOI]
|
| [30] |
Audran R, Karoui O, Donnet L, Soumas V, Fares F, Lovis A, Noirez L, Cavassini M, Fayet-Mello A, Satti I, McShane H, Spertini F. Randomised, double-blind, controlled phase 1 trial of the candidate tuberculosis vaccine ChAdOx1-85A delivered by aerosol versus intramuscular route[J]. J Infect, 2024, 89(2): 106205.
[DOI]
|
 2024, Vol. 19
2024, Vol. 19


