乙型肝炎病毒(hepatitis B virus, HBV)慢性感染是造成肝硬化及肝癌的主要原因之一[1]。患者外周血中乙肝表面抗原(hepatitis B surface antigen, HBsAg)持续阳性超过6个月即为乙肝病毒慢性感染。慢性乙型肝炎患者外周血中的HBsAg可高达300 μ g/mL。大量的HBsAg可吸附乙肝中和抗体,并抑制或耗竭机体针对乙肝病毒的特异性免疫反应,在慢性乙肝的致病过程中起重要作用。因此,清除慢性乙肝患者外周血中的乙肝表面抗原(hepatitis B surface antigen, HBsAg)是慢性乙肝功能性治愈的一项关键指标[2]。
HBV是直径约为42 nm的球形颗粒,由核衣壳及镶嵌有病毒大包膜蛋白(large envelope protein, L)、中包膜蛋白(middle envelope protein, M)、小包膜蛋白(small envelope protein, S)的脂质外膜构成。在病毒包膜蛋白中,S蛋白含量最高[3]。HBV包膜蛋白都能和乙肝表面抗体反应,因此统称为乙肝表面抗原。HBV复制的源头是共价闭合环状DNA(covalently closed circular DNA,cccDNA)。以其为模板利用肝细胞RNA聚合酶II可转录出长度为3.5 kb、2.4 kb、2.1 kb以及0.7 kb的病毒RNA[4]。这些HBV RNA的转录起始位点各不相同,但转录终止位置相同。其中2.4 kb RNA(也称为preS1 mRNA)编码L蛋白;2.1 kb RNA(也称为preS2/S mRNA)编码M和S蛋白。S蛋白由S结构域构成;M蛋白由preS2和S结构域组成;L蛋白由preS1、preS2和S结构域组成。在2.4 kb和2.1 kb RNA中S结构域的终止密码和多聚腺苷酸尾(polyadenylation tail, polyA tail)之间的序列,被称为3’-非翻译区(3’-untranslated region, 3’-UTR)。3’-UTR包含能够影响病毒RNA稳定性和调控病毒RNA核质转运的序列元件。
细胞内蛋白质降解途径主要为自噬-溶酶体途径(autophagy-lysosome pathway)和泛素-蛋白酶体途径(ubiquitin-proteasome pathway, UPP)。此外,半胱氨酸-天冬氨酸蛋白水解酶(caspase)途径、Ca2+依赖钙蛋白酶系统、选择性自噬(selective autophagy)和midnolin-蛋白酶体途径等降解方式也在蛋白质降解过程中发挥着重要的生物学功能[5]。除了以上5种主要的蛋白质降解途径之外,还有细胞器特有的蛋白水解酶,例如线粒体的La蛋白酶、高尔基体内的Kex2水解酶及细胞膜表面的水解酶等,也具有分解蛋白质的作用[6]。既有研究表明,HBV包膜蛋白可能通过多种途径降解,但降解机制仍不明确。NDP52蛋白可与HBV包膜蛋白preS2区作用,可能与L和M包膜蛋白通过溶酶体途径降解相关[7],但是否与S包膜蛋白降解相关尚未明确;自噬受体CALCOCO2通过Rab9依赖的溶酶体降解途径将包膜蛋白靶向到溶酶体进行降解,进而抑制病毒的复制[8];钠钾ATP酶β 3亚基可与L和M包膜蛋白作用,通过泛素-蛋白酶体途径促进L和M蛋白降解,下调细胞外HBsAg的表达[9];20S蛋白酶体能够在体外降解免疫亲合纯化的S蛋白,但细胞内L和M蛋白是否影响这一过程目前仍不清楚。此外,由于HBV的3种包膜蛋白结构可能不同,细胞内的降解方式也可能不同[10]。
本研究在前期工作中发现,靶向HBV包膜蛋白的嵌合抗原受体(chimeric antigen receptor, CAR)G12-CAR高效抑制HBsAg的分泌,并促进其在胞内降解。为研究相关机制,本研究采用多种表达载体转染Huh-7人肝癌细胞表达S蛋白,再用巴佛洛霉素A1(bafilomycin A1)和硼替佐米(bortezomib)分别抑制细胞内的溶酶体自噬和蛋白酶体降解途径,并通过蛋白免疫印迹和酶联免疫吸附试验检测细胞内和细胞外的S蛋白,以研究影响胞内S蛋白降解的病毒学因素。
1 材料和方法 1.1 材料人肝癌细胞Huh-7由本实验室保存,质粒pAAV-S、0.7 mer-L/M/S、pCH-9/3091、0.7 mer-L/S、0.7 mer-M/S、pBluescript SK (-)-CMV-S-UTR-SV40pA、pcDNA3.1-CMV-L、pcDNA3.1-CMV-M、pcDNA6-G12-scFv(G12-CAR)、pcDNA6-VRCol-scFv(VRC-CAR)由本实验室保存[11-12]。本研究所用试剂包括FastPure Plasmid Mini Kit(南京诺唯赞,DC201-01)、乙型肝炎病毒表面抗原诊断试剂盒(HBsAg)(上海科华生物KHB)、NeofectTM DNA transfection reagent(北京零客创智生物,TF201201)、溶酶体抑制剂巴佛洛霉素A1(上海生工生物,A417398)、蛋白酶体抑制剂硼替佐米(上海生工生物,A424151)、二甲基亚砜(dimethyl sulfoxide,DMSO)(美国Santa)、Anti-HBsAg兔多克隆抗体(美国Novus)、HRP标记山羊抗小鼠IgG(H+L)(美国Jackson ImmunoResearch)、HRP标记山羊抗兔IgG(H+L)(美国Jackson Immuno~Research)[13]。Anti-preS1 (7H11)鼠多克隆抗体和Anti-preS2(3E6)鼠多克隆抗体由厦门大学袁权老师惠赠。
1.2 方法 1.2.1 细胞培养人肝癌细胞Huh7在含有体积分数为10%的胎牛血清(美国GIBCO)、100 U/mL青霉素-链霉素(美国GIBCO)的Dulbecco’s Modified Eagle’s Medium(DMEM)(美国GIBCO)培养基中于体积分数为5%的CO2、37 ℃条件下传代培养,至对数生长期时接种于12孔板。
1.2.2 细胞转染将对数生长期的Huh7细胞接种于12孔板中,于5% CO2、37 ℃条件下孵育12 h~18 h,观察细胞的状态及密度;使用Neofect试剂对12孔板中的细胞进行瞬时转染:将质粒与转染试剂轻轻混匀,室温放置15~20 min,缓慢滴加至含有Huh7细胞和培养液的单孔中;培养箱孵育48 h后加入抑制剂处理细胞。实验组采用溶酶体自噬抑制剂巴佛洛霉素A1(溶于DMSO,工作浓度400 nmol/L)和蛋白酶体抑制剂硼替佐米(溶于DMSO,工作浓度500 nmol/L)分别处理细胞,对照组采用等量DMSO处理细胞[14]。
1.2.3 酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)检测HBsAg分别收集上述加药处理48 h的细胞上清液为待测样本,调整稀释比例后,在孔板中依次加入待测样本和阴性对照、阳性对照,轻轻振荡后用封板膜覆盖反应板,于37 ℃孵育1 h。然后分别加入酶结合物,手动振荡混匀,用封板膜覆盖反应板,置于37 ℃孵育30 min。采用手工洗板法彻底洗涤反应板5次,充分拍干孔内残余液体。洗涤结束后加入显色剂A、显色剂B,充分混匀后用封板膜覆盖反应板,于37 ℃孵育,之后加入终止液,振荡混匀,用酶标仪在450 nm波长下测定吸光度(OD值)。
1.2.4 蛋白免疫印迹检测吸去Huh-7细胞培养液,收集12孔板细胞,加入适量的上样缓冲液混合,100 ℃处理10 min,高速离心后吸取上清液上样。将制备的蛋白样品经12.5%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离,采用电转移法转印至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,经5%脱脂牛奶封闭1 h,加入适当稀释的一抗,于4 ℃孵育过夜。次日,经TBS/T(tris buffered saline/Tween 20)漂洗后,加入相应二抗,室温孵育1 h,再经TBS/T漂洗,采用eBlot Touch ImagerTM电子压片成像仪进行检测。
采用归一化过程进行蛋白免疫印迹半定量分析,以显示胞内包膜蛋白丰度的相对变化。以转染VCR-CAR载体并经DMSO处理的细胞中的目标蛋白的表达水平为基准进行归一化,并将该基准值设定为100%,将其他泳道校正后的信号除以基准信号值得到比率,该比率反映经不同实验处理后其他通道目标蛋白的表达差异。
1.2.5 统计学处理采用GraphPad Prism 8进行图形绘制和统计学分析,以上实验均重复3次以上,柱状图数据以3孔均值±标准差表示;使用t检验比较两组之间的差异,P<0.05代表差异有统计学意义。
2 结果 2.1 一些乙型肝炎病毒的因素影响了S蛋白降解与本研究前期报道的工作一致[14],采用单独表达S蛋白的pAAV-S载体和表达G12-CAR的载体共转染Huh-7细胞,G12-CAR能够有效阻断HBsAg的分泌(P<0.001,见图 1A)。胞内蛋白的免疫印迹结果显示,与DMSO处理组比较,巴佛洛霉素A1和硼替佐米都显著提高了细胞内的S蛋白的水平(见图 1B),表明S蛋白可通过溶酶体和蛋白酶体2种途径降解。由于HBV表达L/M/S 3种包膜蛋白,所以本研究还将可表达这3种蛋白的0.7倍体质粒和表达G12-CAR的载体共转染至Huh-7细胞,结果显示G12-CAR仍然能有效阻断HBsAg的分泌(P<0.001,见图 1C);但是,与DMSO处理组比较,巴佛洛霉素A1和硼替佐米并不能提高细胞内的S蛋白的水平(见图 1D)。本研究使用pCH-9/3091质粒表达完整的HBV(见图 1E和1F),经过相同处理后检测胞内蛋白的表达情况,发现与DMSO处理组比较,巴佛洛霉素A1和硼替佐米同样不能提高细胞内S蛋白的水平,与仅表达L/M/S 3种包膜蛋白的情况类似。因此,这些结果提示L蛋白或M蛋白或其他病毒学因素可能影响了S蛋白通过溶酶体和蛋白酶体途径降解。
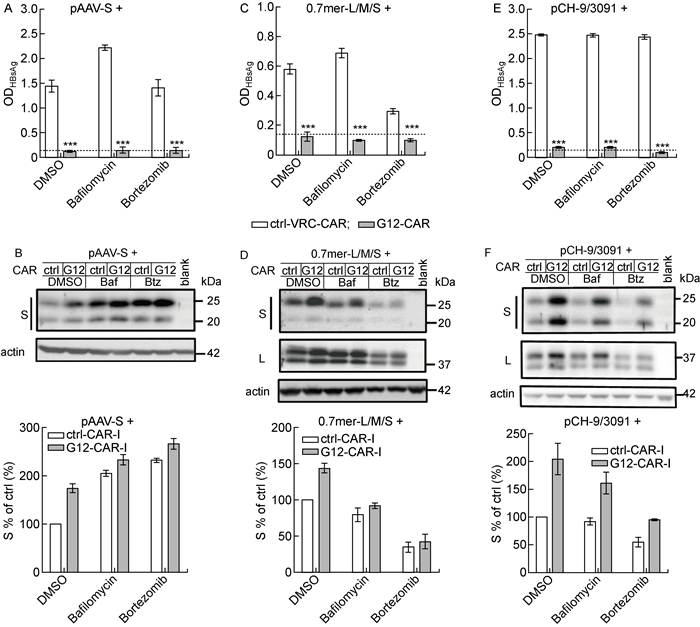
|
|
Huh-7 cells were co-transfected by pAAV-S or 0.7 mer or pCH-9/3091 plasmids and control or G12-CAR-I expressing plasmids. Two days later, cells were separately treated for 48 h with DMSO, bafilomycin A1, or bortezomib. A, C, E: Extracellular HBsAg from three independent experiments was detected by ELISA. The dotted line shows the cut-off value of ELISA. ***P < 0.001, compared with the control group. B, D, F: Cells were harvested for the analysis of intracellular S by Western blotting. Intracellular S was semi-quantitated by normalizing to the one which was from DMSO treated cells expressing control CAR-I and set at 100%. 图 1 一些乙型肝炎病毒的因素对S蛋白降解的影响 Fig. 1 Influence of other components of the HBV on the degradation of S protein |
为研究0.7倍体表达的L蛋白或M蛋白是否影响S蛋白降解,本研究使用了构建0.7 mer-M/S和0.7 mer-L/S质粒的这2种质粒分别将0.7倍体质粒中L蛋白和M蛋白的起始密码突变为“ACG”,分别表达M、S蛋白和L、S蛋白[11](见图 2A),然后将这些质粒分别和G12-CAR质粒共转染Huh-7细胞。用DMSO、巴佛洛霉素A1和硼替佐米分别处理细胞48 h,通过Western blot和ELISA分别检测胞内外的S蛋白的水平。与预期一致,G12-CAR完全抑制了S蛋白的分泌(P<0.001,见图 2B和2D)。与野生型0.7倍体质粒转染结果类似,巴佛洛霉素A1和硼替佐米处理未能使0.7 mer-L/S质粒转染产生的S蛋白水平升高(见图 2C);但巴佛洛霉素A1却能使0.7 mer-M/S质粒转染产生的S蛋白水平升高(见图 2E)。因此,以上结果提示0.7倍体质粒表达的L蛋白影响了细胞内S蛋白通过溶酶体降解。
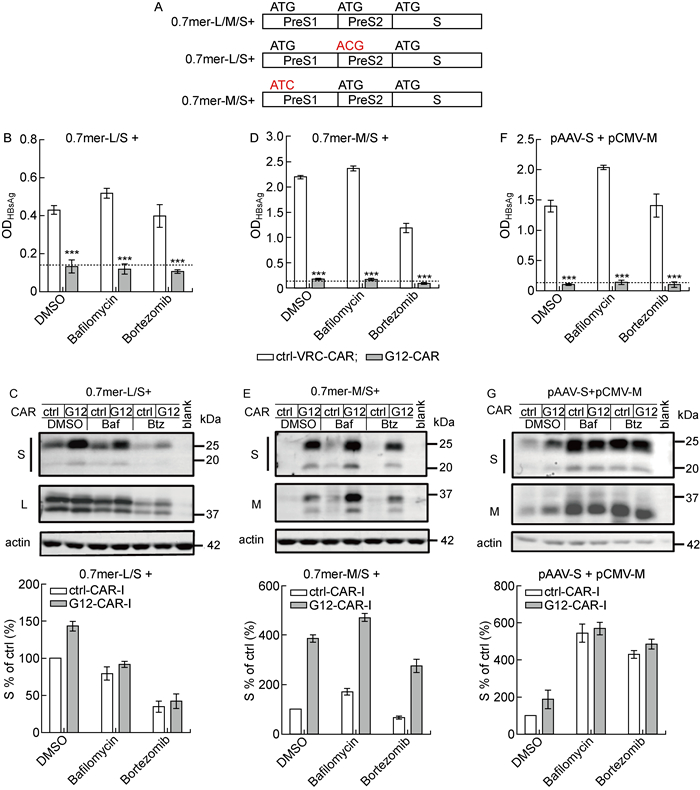
|
|
A: The structure of 0.7 mer plasmids encoding L/M/S, M/S or L/S. Huh-7 cells were co-transfected by 0.7 mer plasmids encoding M/S or L/S and control or G12-CAR-I expressing plasmids. Two days later, cells were separately treated for 48 h with DMSO, bafilomycin A1, or bortezomib. B, D, F: Extracellular HBsAg from three independent experiments was detected by ELISA. The dotted line shows the cut-off value of ELISA. ***P < 0.001, compared with the control group. C, E, G: Cells were harvested for the analysis of intracellular S by Western blotting. Intracellular S was semi-quantitated by normalizing to the one which was from DMSO treated cells expressing control CAR-I and set at 100%. 图 2 L蛋白对S蛋白细胞内降解的影响 Fig. 2 Influence of L proteins on the intracellular degradation of S proteins |
此外,为排除M蛋白对S蛋白降解的潜在作用,本研究将单独表达M蛋白的质粒与G12-CAR质粒共转染Huh-7细胞,通过Western blot和ELISA分别检测胞内外S蛋白的表达。与预期一致,G12-CAR完全抑制了S蛋白的分泌(P<0.001,见图 2F),经过抑制剂处理后细胞内S蛋白有明显堆积(见图 2G),与0.7-M/S质粒转染产生的S蛋白水平结果类似。因此,以上结果提示M蛋白对细胞内S蛋白降解的影响并不显著。
2.3 HBV基因组中包膜蛋白mRNA 3’-UTR序列影响胞内S蛋白的降解与HBV感染转录的RNA类似,0.7倍体表达质粒转录的病毒RNA包含3’-UTR序列,该序列可影响RNA的出核转运、稳定性及翻译等过程[15-16]。本研究使用包含UTR序列的S包膜蛋白表达质粒转染Huh-7细胞,再检测细胞内外包膜蛋白的水平。与上述结果一致,G12-CAR仍能够完全抑制S蛋白的分泌(P<0.001,见图 3A和3C)。免疫印迹结果显示,在表达包含UTR序列的S包膜蛋白表达质粒的Huh-7细胞中,与DMSO处理组比较,巴佛洛霉素A1处理可使胞内S蛋白水平升高,但硼替佐米并不能使胞内S蛋白水平升高(见图 3B)。这一结果提示3’-UTR干扰了S蛋白通过蛋白酶体通路的降解。而当与L蛋白表达质粒共转染时(见图 3D),与DMSO处理组比较,巴佛洛霉素A1和硼替佐米处理都不能使胞内S蛋白水平升高。这一结果进一步证明L蛋白对S蛋白通过溶酶体通路降解具有一定的影响。
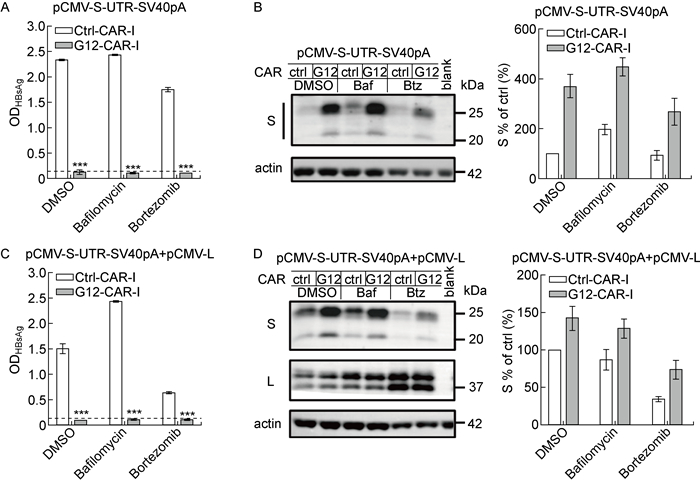
|
|
Huh-7 cells were co-transfected by pCMV-S-UTR-SV40pA encoding S only and control or G12-CAR-I expressing plasmids. Two days later, cells were separately treated for 48 h with DMSO, bafilomycin A1, or bortezomib. A: Extracellular HBsAg from three independent experiments was detected by ELISA. The dotted line shows the cut-off value. ***P < 0.001 compared with the control group. B: Cells were harvested for the analysis of intracellular S by Western blotting. Huh-7 cells were co-transfected by pCMV-S-UTR-SV40pA encoding S only, pCMV-L plasmids and control or G12-CAR-I expressing plasmids. C: Extracellular HBsAg from three independent experiments was detected by ELISA. D: Cells were harvested for the analysis of intracellular S by Western blotting. 图 3 HBV基因组中包膜蛋白mRNA 3′-UTR序列对胞内S蛋白降解的影响 Fig. 3 Influence of envelope protein mRNA 3′-UTR sequence in the HBV genome on the degradation of intracellular S protein |
HBsAg是诱导HBV免疫耐受和造成持续性感染的重要因素。S蛋白是HBsAg的主要成分。它由226个氨基酸组成,在内质网翻译后插入内质网膜,并可自组装成亚病毒颗粒分泌形成HBsAg。目前,S蛋白细胞内降解的机制仍不明确。有研究显示,S蛋白可不经过泛素化修饰而被20S蛋白酶体的内质网相关降解(endoplasmic reticulum-associated degradation, ERAD)途径降解[17];但另一项研究则发现,E3泛素连接酶β-TrCP(β-transducin repeats-containing proteins, β-TrCP)可与S蛋白互作使其泛素化,从而通过蛋白酶体途径降解[18]。本研究通过巴佛洛霉素A1和硼替佐米分别特异性抑制溶酶体降解和泛素-蛋白酶体降解途径,发现细胞内S蛋白含量显著升高。因此,本研究的结果表明,细胞内S蛋白可以通过溶酶体和泛素-蛋白酶体2种途径降解。已有研究报道显示,L蛋白与S蛋白存在相互作用,并且L蛋白对S蛋白的抑制作用具有剂量依赖性[13, 15, 19]。因此,可以推测L蛋白可能直接调控溶酶体和泛素-蛋白酶体途径;或者通过与S蛋白互作间接影响这2种细胞内降解途径。本研究的结果显示,L蛋白影响了细胞内S蛋白通过溶酶体降解,与这一推测一致。本研究发现,L蛋白可影响S蛋白在细胞内的降解,但L蛋白与S蛋白之间的相互作用机制仍不明确;L蛋白如何影响溶酶体的降解途径仍有待进一步研究。
在编码包膜蛋白的2.4 kb和2.1 kb RNA中,都存在3’-UTR序列。已有诸多报道表明,3’-UTR可影响病毒RNA的稳定性和核质转运。3’-UTR也很可能影响蛋白翻译和蛋白定位,从而影响包膜蛋白的降解途径。本研究发现,3’-UTR干扰了S蛋白通过蛋白酶体通路降解,因此支持这一推测。但是,3’-UTR如何影响S蛋白的降解仍有待深入研究。3’-UTR调节S蛋白降解的关键区域以及参与这一过程的关键宿主因子等问题,都值得深入探讨,未来仍须探究UTR序列对包膜蛋白产生影响的具体作用机制。
综上所述,本研究结果显示:S蛋白可通过溶酶体自噬和蛋白酶体途径降解;L蛋白可干扰S蛋白的溶酶体降解途径;编码S蛋白的mRNA的3’-UTR序列对S蛋白通过蛋白酶体通路降解也具有一定的影响。本研究探索了HBsAg在细胞内的降解途径及影响因素,旨在为研制以蛋白降解相关分子为靶点的抗乙肝病毒药物提供依据,对降低外周血中HBsAg的水平进而改善宿主的抗HBV免疫反应有所启发。
| [1] |
Tu T, Budzinska MA, Shackel NA, Urban S. HBV DNA integration: molecular mechanisms and clinical implications[J]. Viruses, 2017, 9(4): 75.
[DOI]
|
| [2] |
Pollicino T, Caminiti G. HBV-integration studies in the clinic: role in the natural history of infection[J]. Viruses, 2021, 13(3): 368.
[DOI]
|
| [3] |
Vaillant A. HBsAg, subviral particles, and their clearance in establishing a functional cure of chronic hepatitis B virus infection[J]. ACS Infect Dis, 2021, 7(6): 1351-1368.
[PubMed]
|
| [4] |
Wang J, Huang H, Liu Y, Chen R, Yan Y, Shi S, Xi J, Zou J, Yu G, Feng X, Lu F. HBV genome and life cycle[J]. Adv Exp Med Biol, 2020, 1179: 17-37.
[PubMed]
|
| [5] |
Chen X, Htet ZM, López AE, Martin A, Walters KJ. Proteasome interaction with ubiquitinated substrates: from mechanisms to therapies[J]. FEBS J, 2021, 288(18): 5231-5251.
[PubMed]
|
| [6] |
Martelli A, Omrani M, Zarghooni M, Citi V, Brogi S, Calderone V, Sureda A, Lorzadehm S, Rosa SC, Grabarek BO, Staszkiewicz R, Nabavi ML, Nabavi SM, Mehrbod P, Klionsky DJ, Ghavami S. New visions on natural products and cancer therapy: autophagy and related regulatory pathways[J]. Cancers (Basel), 2022, 14(23): 5839.
[DOI]
|
| [7] |
Cui S, Xia T, Zhao J, Ren X, Wu T, Kameni M, Guo X, He L, Guo J, Duperray A, Levillayer F, Collard JM, Zhong J, Pan L, Tangy F, Vidalain PO, Zhou D, Jiu Y, Faure M, Wei Y. NDP52 mediates an antiviral response to hepatitis B virus infection through Rab9-dependent lysosomal degradation pathway[J]. Nat Commun, 2023, 14(1): 8440.
[DOI]
|
| [8] |
Cui S, Faure M, Wei Y. CALCOCO2/NDP52 associates with RAB9 to initiate an antiviral response to hepatitis B virus infection through a lysosomal degradation pathway[J]. Autophagy, 2024, 20(9): 2109-2111.
[PubMed]
|
| [9] |
Zhang J, Zheng T, Zhou X, Wang H, Li Z, Huan C, Zheng B, Zhang W. ATP1B3 restricts hepatitis B virus replication via reducing the expression of the envelope proteins[J]. Virol Sin, 2021, 36(4): 678-691.
[PubMed]
|
| [10] |
Liu Y, Zhou T, Simsek E, Simsek E, Block T, Mehta A. The degradation pathway for the HBV envelope proteins involves proteolysis prior to degradation via the cytosolic proteasome[J]. Virology, 2007, 369(1): 69-77.
[PubMed]
|
| [11] |
Zhang F, Tang X, Garcia T, Lok AS, Wang Y, Jia H, Qin Y, Chen C, Wen Y, Li J, Tong S. Characterization of contrasting features between hepatitis B virus genotype A and genotype D in small envelope protein expression and surface antigen secretion[J]. Virology, 2017, 503: 52-61.
[PubMed]
|
| [12] |
Wang Q, Qin Y, Zhang J, Jia L, Fu S, Wang Y, Li J, Tong S. Tracing the evolutionary history of hepadnaviruses in terms of e antigen and middle envelope protein expression or processing[J]. Virus Res, 2020, 276: 197825.
[DOI]
|
| [13] |
Zhang J, Wang Y, Fu S, Yuan Q, Wang Q, Xia N, Wen Y, Li J, Tong S. Role of small envelope protein in sustaining the intracellular and extracellular levels of hepatitis B virus large and middle envelope proteins[J]. Viruses, 2021, 13(4): 613.
[DOI]
|
| [14] |
Wang Y, Li Q, Li C, Wang C, Wang S, Yuan W, Yu D, Zhang K, Shi B, Chen X, Liu T, Yuan Z, Tong S, Nassal M, Wen Y, Wang Y. Chimeric antigen receptors of HBV envelope proteins inhibit hepatitis B surface antigen secretion[J]. Gut, 2024, 73(4): 668-681.
[PubMed]
|
| [15] |
Zhang J, Yuan Q, Wang Y, Wang Y, Yuan W, Xia N, Wen Y, Li J, Tong S. 5' preS1 mutations to prevent large envelope protein expression from hepatitis B virus genotype A or genotype D markedly increase polymerase-envelope fusion protein[J]. J Virol, 2022, 96(5): e0172321.
[DOI]
|
| [16] |
Mouzannar K, Schauer A, Liang TJ. The post-transcriptional regulatory element of hepatitis B virus: from discovery to therapy[J]. Viruses, 2024, 16(4): 528.
[DOI]
|
| [17] |
Yang S, Shen Z, Kang Y, Sun L, Viswanathan U, Guo H, Zhou T, Dai X, Chang J, Zhang J, Guo J. A putative amphipathic alpha helix in hepatitis B virus small envelope protein plays a critical role in the morphogenesis of subviral particles[J]. J Virol, 2021, 95(8): e02399-20.
[DOI]
|
| [18] |
Tu W, Liu J, Qian F, Zhu L, Li M, Zheng H, Zhu C. Ubiquitin E3 ligase β-TrCP negatively regulates surface protein of hepatitis B virus[J]. J Med Virol, 2023, 95(3): e28620.
[DOI]
|
| [19] |
Zhang J, Wang Q, Yuan W, Li J, Yuan Q, Zhang J, Xia N, Wang Y, Li J, Tong S. Both middle and large envelope proteins can mediate neutralization of hepatitis B virus infectivity by anti-preS2 antibodies: escape by naturally occurring preS2 deletions[J]. J Virol, 2024, 98(8): e0192923.
[DOI]
|
 2025, Vol. 20
2025, Vol. 20


