真菌是一类广泛存在于人类生存环境中的真核生物,大多数属于机会性致病菌。即当宿主免疫功能出现异常时,机体无法有效清除真菌,导致皮肤、黏膜、皮下及系统性真菌感染。近年来,随着真菌感染性疾病特别是侵袭性深部真菌病的发病率日益增多,有关真菌感染发生机制及宿主抗真菌免疫机制的研究成为热点。胱天蛋白酶募集域蛋白9(caspase recruitment domain-containing protein 9,CARD9)属于CARD家族中的一员,是Bertin等[1]研究CARD时发现的一个重要衔接蛋白,高度表达于髓细胞,尤其是树突细胞和巨噬细胞中。自2009年首次报道慢性皮肤黏膜念珠菌病患者中存在CARD9突变以来[2],陆续有报道表明CARD9突变可导致多种真菌易感性明显增加[3-8]。本文就近年来CARD9基因突变在真菌感染性疾病中的研究进展进行综述。
1 真菌感染性疾病概述真菌属于异养真核腐生生物,具有真正的细胞器和细胞核,广泛存在于自然界中。尽管已知真菌种属超过100万种,但仅极少数种属的真菌被证实具有致病性,可导致免疫正常个体致病。多数种属的真菌属于机会性致病菌,仅在机体免疫状态改变、物理屏障破坏或正常菌群平衡被破坏时才致病。近年来,随着医疗介入性操作、机体微生物组分发生紊乱(如长期使用广谱抗生素等)、造血干细胞移植和实体器官移植、化学治疗、长程及大剂量接受免疫抑制剂治疗及人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染等危险因素增多,真菌感染特别是侵袭性真菌感染成为目前人类疾病谱中高发病率和高病死率的重要病种,特别是在免疫受损个体,严重威胁高危人群的生命安全[9-10]。
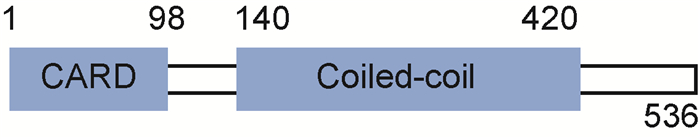
2 CARD9概述CARD9定位于染色体9q34.3,包含2 108 bp的cDNA,可编码536个氨基酸残基、相对分子质量为62 300的蛋白。CARD9具有两个重要功能区域(图 1):N端区域和C端区域。前者具有胱天蛋白酶募集功能,有7~98个氨基酸残基;后者具有寡聚化作用,由7肽重复特征的卷曲螺旋域组成,至少有3个,分别为第140~230位、第243~277位、第332~419位的卷曲螺旋域,这些卷曲螺旋域行使蛋白质寡聚化功能[1]。CARD9存在于人体多种组织中,如脾、肝、胎盘、肺、脑等,并高度表达于髓细胞尤其是骨髓源巨噬细胞和骨髓源树突细胞中[11-12]。
CARD9能高效整合多种天然免疫受体的识别信号,在机体抗真菌免疫中发挥重要作用。CARD9可通过其寡聚化结构域与天然免疫蛋白Bcl-10、黏膜相关淋巴组织淋巴瘤转运蛋白1(mucosa-associated lymphoid tissue lymphoma translocation protein 1,MALT-1)结合并形成CARD9-Bcl-10-MALT-1(CBM)复合体,作为C型凝集素受体(C-type lectin receptor,CLR)等受体通路的重要媒介,激活核因子κB(nuclear factor κB,NF-κB)等炎症信号通路,进而激活下游信号分子,促进炎症因子产生[12-14]。
3 CARD9基因突变与真菌感染性疾病CARD9存在于人类免疫细胞胞质中,作为Dectin-1、Dectin-2、Dectin-3和巨噬细胞诱导型C型凝集素(macrophage-inducible C-type lectin,Mincle)等CLR细胞表面模式识别受体的下游关键连接蛋白[15],接收识别受体的转导信号,并通过其寡聚化结构域与多种分子形成复合物,从而介导下游抗真菌免疫应答产生[15-16]。其介导的信号通路被认为是连接宿主抗真菌天然免疫与适应性免疫的桥梁[3]。迄今为止,全世界已报道14个国家共计56例患者发生18种CARD9基因改变。这些患者均表现为选择性地对某种真菌易感,引起多种真菌感染性疾病,包括念珠菌病(22例)、皮肤癣菌病(22例)、暗色真菌感染(10例)、肺外曲霉病(2例)。
3.1 CARD9基因突变与念珠菌感染迄今为止,共有来自7个国家的22例CARD9基因突变患者感染念珠菌[2, 3, 5, 8, 17-21],其中8例发生无义突变,涉及的突变位点有p.Q295X[2, 8, 17-18]和p.Q289X[18],均为纯合突变;10例发生错义突变,涉及的突变位点有p.R373P[3]、p.G72S[3]、p.Y91H[5, 19]、p.R70W[18, 21]、p.R35Q[18]、p.R57H[20],杂合突变与纯合突变均存在;其余4例突变类型未被提及。9例患者CARD9蛋白C端结构发生改变,9例CARD9蛋白N端结构发生改变。CARD9基因突变引起念珠菌感染患者多发生慢性皮肤黏膜念珠菌病及念珠菌中枢神经系统感染(念珠菌性脑膜炎),少数累及鼻窦、结肠和脊髓。感染的念珠菌类型几乎都是白念珠菌,仅1例为光滑念珠菌。此类患者多在幼年发病,之后出现相应部位念珠菌感染症状迁延不愈,甚至威胁生命。22例患者中,14例患者的父母为近亲结婚,符合CARD9基因为常染色体隐性遗传的特点。
由于CARD9基因突变,患者的抗真菌免疫功能发生障碍,外周血中性粒细胞存在吞噬能力缺陷,有些念珠菌中枢神经感染患者出现中枢神经系统中性粒细胞数量减少的现象,同时大部分患者外周血促炎因子如肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素6(interleukin 6,IL-6)、IL-1β、IL-8、IL12p70、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)等分泌减少,有些患者外周血Th17细胞数量减少。
针对患者体内抗真菌免疫细胞因子分泌减少,Gavino等[5]对4例复发性白念珠菌性脑膜炎进行GM-CSF辅助治疗,患者于6 d内有所改善,脑脊液细胞、蛋白及糖类水平逐渐恢复正常。患者共接受GM-CSF治疗18个月,症状缓解。Celmeli等[17]对1例念珠菌性脑膜炎患者皮下注射粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)后,患者症状有所缓解,脑脊液相关指标逐渐恢复,体内IL-17分泌水平趋于正常(表 1)。
| 家系或散发病例 | 国家 | 发病年龄 | 现状 | 感染部位 | 是否近亲结婚 | 菌种 | 突变氨基酸 | 细胞因子分泌缺陷 | 外周血Th17细胞 | 治疗 | 参考文献 |
| 家系1-1 | 伊朗 | 童年 | 死亡 | 中枢神经系统 | 是 | 白念珠菌 | NR | NR | NR | NR | [2] |
| 家系1-2 | 伊朗 | 童年 | 死亡 | 皮肤,中枢神经系统 | 是 | 白念珠菌 | NR | NR | NR | 手术治疗 | |
| 家系1-3 | 伊朗 | 婴儿期 | 死亡 | 黏膜,中枢神经系统 | 是 | 白念珠菌 | NR | NR | NR | NR | |
| 家系1-4 | 伊朗 | 3岁 | 存活 | 黏膜 | 是 | 白念珠菌 | p.Q295X(纯合) | TNF-α | 低 | 酮康唑 | |
| 家系1-5 | 伊朗 | 童年 | 存活 | 皮肤 | NR | 白念珠菌 | p.Q295X(纯合) | TNF-α | 低 | NR | |
| 家系1-6 | 伊朗 | 童年 | 存活 | 口腔,阴道,皮肤 | NR | 白念珠菌 | p.Q295X(纯合) | TNF-α | 低 | NR | |
| 家系1-7 | 伊朗 | 42岁 | 存活 | 阴道,皮肤 | NR | 白念珠菌,皮肤癣菌 | p.Q295X(纯合) | TNF-α | 低 | NR | |
| 散发2-1 | 亚洲 | 7岁 | 存活 | 中枢神经系统 | NR | 都柏林念珠菌 | p.R373P(复合杂合p.G72S) | IL-6,IL-1β,IL-8,IL-17 | 低 | 两性霉素B,氟康唑 | [3] |
| 散发3-1 | 加拿大法裔 | 30岁 | 存活 | 中枢神经系统 | NR | 白念珠菌 | p.Y91H(纯合) | GM-CSF | 正常 | GM-CSF,伏立康唑 | [5] |
| 散发4-1 | 土耳其 | 3岁 | 存活 | 中枢神经系统 | 是 | 白念珠菌 | p.Q295X(纯合) | IL-6,TNF-α, IL-1β | 正常 | NR | [8] |
| 散发5-1 | 土耳其 | NR | 存活 | 中枢神经系统 | 是 | 白念珠菌 | p.Q295X(纯合) | NR | 低 | 氟康唑,两性霉素B,伏立康唑,卡泊芬净,G-CSF | [17] |
| 家系6-1 | 土耳其 | 39岁 | 存活 | 中枢神经系统 | 是 | 白念珠菌 | p.R70W(纯合) | IL-6,TNF-α | 正常 | 两性霉素B,5-氟胞嘧啶,氟康唑 | [18] |
| 家系6-2 | 土耳其 | 7岁 | 存活 | 中枢神经系统 | 是 | 白念珠菌 | p.R70W(纯合) | IL-6,TNF-α | 正常 | 两性霉素B,氟康唑 | |
| 家系7-1 | 伊朗 | 17岁 | 存活 | 中枢神经系统,鼻窦,消化系统 | 是 | 光滑念珠菌 | p.R35Q(纯合) | IL-6,TNF-α | NR | 氟康唑,伊曲康唑 | |
| 家系8-1 | 摩洛哥 | 37岁 | 存活 | 中枢神经系统 | 是 | 白念珠菌 | p.Q289X(纯合) | NR | NR | 两性霉素B,5-氟胞嘧啶,氟康唑 | |
| 家系9-1 | 巴基斯坦 | 26岁 | 存活 | 消化系统 | 是 | 白念珠菌 | p.Q295X(纯合) | IL-6,TNF-α | 正常 | 两性霉素B,氟康唑,伊曲康唑,泊沙康唑 | |
| 家系10-1 | 加拿大法裔 | 38岁 | 存活 | 中枢神经系统 | 否 | 白念珠菌 | p.Y91H(杂合) | GM-CSF | NR | 氟康唑,GM-CSF | [19] |
| 家系11-1 | 加拿大法裔 | 39岁 | 存活 | 中枢神经系统,脊柱 | 否 | 白念珠菌 | p.Y91H(杂合) | GM-CSF | NR | 氟康唑,GM-CSF | |
| 家系11-2 | 加拿大法裔 | NR | 存活 | 皮肤黏膜,中枢神经系统 | 否 | NR | p.Y91H (杂合) | GM-CSF | NR | NR | |
| 散发12-1 | 美国 | 8岁 | 存活 | 中枢神经系统,骨骼 | 是 | 白念珠菌 | p.R57H(纯合) | TNF-α,IL-6,IFN-γ,IL-1β,IL12p70 | 正常 | 氟康唑 | [20] |
| 家系13-1 | 土耳其 | 8岁 | 存活 | 皮肤黏膜 | 是 | 白念珠菌 | p.R70W (纯合) | GM-CSF,IL-6,IL-22,IL-17A | NR | NR | [21] |
| 家系13-2 | 土耳其 | 5岁 | 存活 | 皮肤黏膜,中枢神经系统 | 是 | 白念珠菌 | NR | NR | NR | 两性霉素B,氟康唑,氟胞嘧啶 | |
| NR: not reported. | |||||||||||
CARD9基因突变者还有可能发生严重的皮肤癣菌感染。截至目前,共报道6个国家的22例CARD9基因突变导致的皮肤癣菌感染[4, 7, 21-24]。其中14例发生无义突变,突变位点均为p.Q289X[4, 22, 24],均为纯合突变;4例发生错义突变,涉及的突变位点有p.R101C[4]、p.R101L[7]、p.R70W[21],均为纯合突变;其余4例突变类型未提及。CARD9基因突变引起的皮肤癣菌感染不仅累及浅表皮肤、甲、头皮等,还可累及淋巴结、中枢神经系统等部位发生深部皮肤癣菌病或引起全身泛发的皮肤癣菌病。与念珠菌感染患者相似,此类患者也具有发病早、病程迁延不愈,甚至威胁生命的特点。感染的皮肤癣菌类型主要有红色毛癣菌、紫色毛癣菌、须癣毛癣菌及疣状毛癣菌。22例患者中,17例患者的父母为近亲结婚,高于念珠菌感染患者中的比例。
由于CARD9基因缺陷,患者外周血促炎因子IL-6等分泌减少,Th17细胞数量不足,导致患者在天然免疫和适应性免疫两个层面均出现抗真菌能力不足,最终表现为顽固的难治性真菌感染(表 2)。
| 家系或散发病例 | 国家 | 发病年龄 | 现状 | 感染部位 | 是否近亲结婚 | 菌种 | 突变氨基酸 | 细胞因子分泌缺陷 | 外周血Th17细胞 | 治疗 | 参考文献 |
| 家系1-1 | 阿尔及利亚 | 6岁 | 存活 | 皮肤, 头皮, 甲, 淋巴结 | 是 | 紫色毛癣菌 | p.Q289X(纯合) | lL-6 | 低 | NR | [4] |
| 家系1-2 | 阿尔及利亚 | 2岁 | 死亡 | 皮肤, 头皮, 甲, 淋巴结,脑 | 是 | 紫色毛癣菌 | NR | NR | NR | NR | |
| 家系2-1 | 阿尔及利亚 | 9岁 | 存活 | 皮肤, 头皮, 甲, 淋巴结 | 是 | 红色毛癣菌 | p.Q289X(纯合) | lL-6 | 低 | NR | |
| 家系3-1 | 阿尔及利亚 | 8岁 | 存活 | 皮肤,头皮,甲 | 是 | 紫色毛癣菌 | p.Q289X(纯合) | lL-6 | 低 | NR | |
| 家系3-2 | 阿尔及利亚 | 8岁 | 死亡 | 皮肤, 头皮, 甲, 淋巴结 | 是 | 紫色毛癣菌 | NR | NR | NR | NR | |
| 家系3-3 | 阿尔及利亚 | 8岁 | 存活 | 甲 | 是 | 紫色毛癣菌 | p.Q289X(纯合) | lL-6 | 低 | NR | |
| 家系4-1 | 阿尔及利亚 | 19岁 | 存活 | 皮肤, 头皮, 甲, 淋巴结 | 是 | NR | p.Q289X(纯合) | lL-6 | 低 | NR | |
| 家系4-2 | 阿尔及利亚 | 21岁 | 存活 | 皮肤,会阴,头皮,淋巴结 | 是 | NR | p.Q289X(纯合) | lL-6 | 低 | NR | |
| 家系4-3 | 阿尔及利亚 | NR | 死亡 | 皮肤,头皮 | 是 | NR | NR | NR | NR | NR | |
| 家系5-1 | 阿尔及利亚 | NR | 死亡 | 皮肤,头皮,淋巴结 | 是 | 紫色毛癣菌 | p.Q289X(纯合) | lL-6 | 低 | NR | |
| 家系5-2 | 阿尔及利亚 | NR | 存活 | 甲 | 是 | 皮肤癣菌 | p.Q289X(纯合) | lL-6 | 低 | NR | |
| 家系6-1 | 摩洛哥 | NR | 存活 | 皮肤,甲,骨,淋巴结 | 是 | 红色毛癣菌 | p.R101C(纯合) | lL-6 | 低 | NR | |
| 家系6-2 | 摩洛哥 | NR | 存活 | 头皮,甲 | 是 | 皮肤癣菌 | p.R101C(纯合) | lL-6 | 低 | NR | |
| 家系7-1 | 突尼斯 | 6岁 | 死亡 | 皮肤,头皮,甲 | 是 | 皮肤癣菌 | p.Q289X(纯合) | lL-6 | 低 | NR | |
| 家系7-2 | 突尼斯 | 12岁 | 存活 | 头皮,甲 | 是 | 红色毛癣菌 | p.Q289X(纯合) | lL-6 | 低 | NR | |
| 家系7-3 | 突尼斯 | 5岁 | 存活 | 皮肤, 头皮, 甲, 淋巴结 | 是 | 红色毛癣菌,紫色毛癣菌 | p.Q289X(纯合) | lL-6 | 低 | NR | |
| 家系8-1 | 突尼斯 | 6岁 | 存活 | 皮肤, 头皮, 甲, 淋巴结 | 否 | 红色毛癣菌,紫色毛癣菌 | p.Q289X(纯合) | lL-6 | 低 | NR | |
| 散发9-1 | 埃及 | 13岁 | 存活 | 皮肤,甲 | 否 | 红色毛癣菌 | p.Q289X(纯合) | NR | NR | 泊沙康唑 | [22] |
| 散发10-1 | 巴西 | 11岁(系统) | 存活 | 皮肤 | 否 | 须癣毛癣菌 | p.R101L(纯合) | NR | NR | 伊曲康唑,酮康唑,特比萘芬,泊沙康唑,两性霉素B | [7] |
| 散发11-1 | 阿尔及利亚 | 47岁(脑脓肿) | 存活 | 皮肤,甲,头皮,脑,淋巴结 | NR | 红色毛癣菌 | p.Q289X(纯合) | NR | NR | 伊曲康唑 | [24] |
| 家系12-1 | 土耳其 | 8岁 | 存活 | 皮肤,甲,口腔,淋巴结 | 是 | 红色毛癣菌,紫色毛癣菌,疣状毛癣菌,马拉色菌 | p.R70W(纯合) | lL-6 | 低 | 伊曲康唑,酮康唑,特比萘芬,氟康唑 | [21] |
| 家系12-2 | 土耳其 | NR | 死亡 | NR | NR | NR | NR | NR | NR | NR | |
| NR:not reported. | |||||||||||
暗色真菌也称为“黑酵母”,包含一大类以细胞壁存在黑色素颗粒为特征的病原性真菌,呈世界性分布,主要发现于土壤中。暗色真菌可导致免疫正常和免疫异常个体出现众多慢性皮肤、皮下组织的系统或播散性真菌性感染性疾病,包括暗色丝孢霉病、着色芽生菌病和足菌肿[25-27]。截至目前,共报道10例CARD9基因突变相关暗色真菌感染病例,其中8例由我国报道[6, 28-29]。
Wang等[6]报道4例疣状瓶霉感染导致的顽固性难治皮下型暗色丝孢霉病,患者均存在CARD9基因突变及Th17数量和功能缺陷。其中1例患者CARD9基因突变类型为杂合突变p.L64fsX59和p.Q158X,另外3例患者为纯合移码突变p.D274fsX60。4例患者CARD9基因在mRNA水平均正常表达,而在蛋白水平表达缺失。患者的树突细胞和巨噬细胞均存在促炎因子(IL-6、TNF-α、IL-1β、IL-23p19)分泌障碍,同时外周血Th17细胞数量减少、IL-17和IL-22分泌减少。该研究首次确定了CARD9基因突变与暗色丝孢霉病的关系,并对患者免疫功能进行了初步探讨,有利于进一步研究CARD9基因突变与真菌感染性疾病之间的关系。
Lanternier等[30]报道2例散发的CARD9基因突变所致外瓶霉感染。1例来自安哥拉的患者5岁时出现肝脏和中枢神经系统的皮炎外瓶霉感染,其CARD9基因突变类型为纯合错义突变p.R18W,CARD9蛋白表达完整但功能缺失,导致外周血促炎因子分泌减少,NF-κB转录水平降低,而IL-17产生能力正常。另1例来自伊朗的患者18岁时出现皮下、骨骼及肺部棘状外瓶霉感染,其CARD9基因突变类型为p.E232del。
张瑞珺等[28]报道了1例疣状瓶霉感染所致暗色丝孢霉病,由皮肤及皮下组织暗色丝孢霉病逐渐进展为播散性暗色丝孢霉病(图 2)。患者CARD9基因存在新的复合杂合错义突变(p.R35Q和p.E81K),CARD9蛋白表达正常,外周血淋巴细胞(peripheral blood lymphocyte,PBL)和Th1/Th17细胞比例均降低,外周血单个核细胞(peripheral blood mononuclear cell,PBMC)抗疣状瓶霉感染存在天然及适应性免疫缺陷,导致无法清除病原性真菌,病程迁延进展达10年余(表 3)。

|
| A: In 2006, the lesions were located in the left ear. B: In 2009, the lesions extended to the face, ear and back. C: In 2011, the infectious lesions could be found in the face, back, left upper limb and chest. D: In 2015, septate hyphae were visible in the oral cavity and maxillary secretions of the patient (direct microscopic examination, ×400). 图 2 CARD9基因突变患者皮肤及皮下组织暗色丝孢霉病的临床进展照片及真菌直接镜检结果[28] Fig. 2 Clinical manifestations of the skin and subcutaneous phaeohyphomycosis over the past ten years and direct microscopic examination results of fungi[28] |
| 家系或散发病例 | 国家 | 发病年龄 | 现状 | 感染部位 | 是否近亲结婚 | 菌种 | 突变氨基酸 | 细胞因子分泌缺陷 | 外周血Th17细胞 | 治疗 | 参考文献 |
| 散发1-1 | 中国 | 13岁 | NR | 皮肤 | 否 | 疣状瓶霉 | p.L64fsX59(复合杂合p.Q158X) | IL-6, TNF-α, IL-1β, IL-23p19 | 低 | 伊曲康唑,两性霉素B | [6] |
| 散发2-1 | 中国 | 6岁 | NR | 皮肤 | 否 | 疣状瓶霉 | p.D274fsX60(纯合) | IL-6, TNF-α, IL-1β, IL-23p19 | 低 | 伊曲康唑,两性霉素B | |
| 散发3-1 | 中国 | 20岁 | NR | 皮肤 | 否 | 疣状瓶霉 | p.D274fsX60(纯合) | IL-6, TNF-α, IL-1β, IL-23p19 | 低 | 外科治疗,伊曲康唑 | |
| 散发4-1 | 中国 | 48岁 | NR | 皮肤 | 否 | 疣状瓶霉 | p.D274fsX60(纯合) | IL-6, TNF-α, IL-1β, IL-23p19 | 低 | 特比萘芬,伊曲康唑 | |
| 散发5-1 | 安哥拉 | 5岁 | NR | 肝脏,中枢神经系统 | 否 | 皮炎外瓶霉 | p.R18W(纯合) | IL-6, TNF-α | 低 | 伏立康唑两性霉素B | [30] |
| 散发6-1 | 伊朗 | 18岁 | NR | 皮下组织,骨骼,肺 | 是 | 棘状外瓶霉 | p.E232del(纯合) | NR | NR | NR | |
| 散发7-1 | 中国 | 16岁 | NR | 皮肤,黏膜,鼻窦,中枢神经系统 | NR | 疣状瓶霉 | p. R35Q (复合杂合突变p. E81K) | IL-6, TNF-α, IL-1β,IFN-γ,IL-17, IL-22, GM-CSF | 低 | IFN,GM-CSF,胸腺五肽,特比萘芬,伊曲康唑,两性霉素B | [28] |
| 散发8-1 | 中国 | 13岁 | NR | 皮肤 | NR | 棘状外瓶霉 | 复合杂合突变,p.S23X和p.D274fsX60 | TNF-α,IL-1β,IL-6,IL-17A,IL-22,GM-CSF | Th17细胞和Th22细胞低,Th1比例未见明显缺乏 | GM-CSF,特比萘芬,伊曲康唑,两性霉素B | [29] |
| 散发9-1 | 中国 | 45岁 | NR | 皮肤 | NR | 马萨埃指霉 | 纯合插入移码突变p.D274fsX60 | TNF-α,IL-1β,IL-6,IL-17A,IL-22,GM-CSF | Th17细胞和Th22细胞低,Th1比例未见明显缺乏 | 特比萘芬,伊曲康唑,两性霉素B | |
| 散发10-1 | 中国 | 35岁 | NR | 皮肤,黏膜 | NR | 多主棒孢霉 | 复合杂合突变,p.L64fsX59和p.D274fsX60 | TNF-α,IL-1β,IL-6,IL-17A,IL-22,GM-CSF | Th17细胞和Th22细胞低,Th1比例未见明显缺乏 | 伏立康唑,特比萘芬,伊曲康唑,两性霉素B | |
| NR:not reported. | |||||||||||
Liang等[31-32]研究CARD9基因缺陷患者,体外细胞实验显示CARD9参与中性粒细胞抗疣状瓶霉过程中细胞因子TNF-α、IL-8、IL-6的表达。研究发现,疣状瓶霉感染的CARD9基因缺陷患者外周血中性粒细胞功能存在部分缺陷,包括针对疣状瓶霉孢子的杀伤功能减弱,促炎因子分泌减少,而这种抵抗疣状瓶霉感染的免疫功能缺陷可被血清调理作用进行补偿。
最近,Wang等[29]又报道了3例皮下组织暗色丝孢霉病,分别由棘状外瓶霉、马萨埃指霉及多主棒孢霉感染引起。3例患者均存在CARD9基因突变,其中p. S23X为新发突变,p.D274fsX60和p.L64fsX59为已发突变,导致野生型CARD9蛋白表达缺乏。患者外周血免疫细胞经相应暗色真菌刺激后,促炎因子、趋化因子、NF-κB活性及Th17和Th22相关免疫反应受损,但吞噬能力和活性氧生成能力均未见缺乏。
Wu等[33]利用CARD9基因敲除小鼠建立疣状瓶霉感染的暗色丝孢霉病模型,模拟CARD9缺陷患者的疣状瓶霉感染。结果发现,CARD9基因敲除小鼠疣状瓶霉易感性明显增加,感染后期还可发生脑、肺、肝、脾、肾、淋巴结等全身多系统播散,死亡率为100%。
3.4 CARD9基因突变与曲霉感染Rieber等[34]报道2例侵袭性肺外曲霉感染患者,分别在8岁和18岁时出现肺外曲霉感染症状。其中1例患者于12岁出现腹腔内曲霉感染而死亡,存在CARD9基因纯合突变M1I/M1I;另外1例患者从9岁开始陆续出现腹腔内念珠菌病及中枢神经系统和腹腔内曲霉感染,存在CARD9基因纯合突变Q295X。2例患者均存在CARD9蛋白表达缺失。患者外周血中单核细胞、中性粒细胞和Th17细胞数量正常,中性粒细胞的吞噬杀伤能力未见异常,但单核细胞在真菌刺激后表现为促炎因子分泌减少,同时感染部位的中性粒细胞数量减少,可能与CARD9基因突变导致的肺外组织趋化因子生成减少有关。
4 结语CARD9基因突变会引起不同真菌感染,主要机制涉及以下几点。①中性粒细胞参与组成宿主抗真菌感染的第一道防线,CARD9缺陷影响中性粒细胞募集和相应趋化因子分泌,患者出现中性粒细胞数量减少及效应减弱,从而导致真菌清除困难。②CARD9缺陷患者抗真菌感染天然免疫相关促炎因子分泌严重缺乏(如IL-6、IL-1β、TNF-α等),影响下游适应性免疫中效应细胞Th1和Th17分化。③适应性免疫尤其是Th1和Th17细胞免疫在真菌免疫中发挥重要作用,Th1细胞效应因子γ干扰素(interferon γ,IFN-γ)可增强巨噬细胞对真菌的吞噬杀伤作用,Th17细胞效应因子IL-17可诱导集落刺激因子及趋化因子产生,调节中性粒细胞募集,增加抗微生物多肽分泌,从而增强宿主免疫防御。然而,大部分CARD9缺陷患者外周血中Th1/Th17细胞比例降低,效应因子分泌缺乏,导致患者出现真菌感染。
目前报道的CARD9基因突变所致真菌感染患者多有发病较早、父母近亲结婚、病程迁延不愈、抗真菌免疫功能障碍等共同特点,感染的病原体类型涉及念珠菌、皮肤癣菌、暗色真菌及曲霉等。高度提示,如果在临床工作中发现患者具有以上特点,应积极筛查其遗传免疫缺陷,从而为后续病因诊断和治疗提供重要指导。
随着CARD9缺陷患者真菌感染的报道逐渐增多,发现他们往往具有仅感染某一类或几类真菌的特点,是否不同真菌表面成分的不同对CARD9信号通路的作用有差异,有待进一步研究。未来可通过对不同真菌成分及毒力的研究,对宿主抗真菌免疫的深入认识,以及遗传学的不断探索,这些问题可能会一一得到解决。
| [1] |
Bertin J, Guo Y, Wang L, Srinivasula SM, Jacobson MD, Poyet JL, Merriam S, Du MQ, Dyer MJ, Robison KE, DiStefano PS, Alnemri ES. CARD9 is a novel caspase recruitment domain-containing protein that interacts with BCL10/CLAP and activates NF-kappa B[J]. J Biol Chem, 2000, 275(52): 41082-41086.
[DOI]
|
| [2] |
Glocker EO, Hennigs A, Nabavi M, Schäffer AA, Woellner C, Salzer U, Pfeifer D, Veelken H, Warnatz K, Tahami F, Jamal S, Manguiat A, Rezaei N, Amirzargar AA, Plebani A, Hannesschläger N, Gross O, Ruland J, Grimbacher B. A homozygous CARD9 mutation in a family with susceptibility to fungal infections[J]. N Engl J Med, 2009, 361(18): 1727-1735.
[DOI]
|
| [3] |
Drewniak A, Gazendam RP, Tool AT, van Houdt M, Jansen MH, van Hamme JL, van Leeuwen EM, Roos D, Scalais E, de Beaufort C, Janssen H, van den Berg TK, Kuijpers TW. Invasive fungal infection and impaired neutrophil killing in human CARD9 deficiency[J]. Blood, 2013, 121(13): 2385-2392.
[DOI]
|
| [4] |
Lanternier F, Pathan S, Vincent QB, Liu L, Cypowyj S, Prando C, Migaud M, Taibi L, Ammar-Khodja A, Stambouli OB, Guellil B, Jacobs F, Goffard JC, Schepers K, Del Marmol V, Boussofara L, Denguezli M, Larif M, Bachelez H, Michel L, Lefranc G, Hay R, Jouvion G, Chretien F, Fraitag S, Bougnoux ME, Boudia M, Abel L, Lortholary O, Casanova JL, Picard C, Grimbacher B, Puel A. Deep dermatophytosis and inherited CARD9 deficiency[J]. N Engl J Med, 2013, 369(18): 1704-1714.
[DOI]
|
| [5] |
Gavino C, Cotter A, Lichtenstein D, Lejtenyi D, Fortin C, Legault C, Alirezaie N, Majewski J, Sheppard DC, Behr MA, Foulkes WD, Vinh DC. CARD9 deficiency and spontaneous central nervous system candidiasis:complete clinical remission with GM-CSF therapy[J]. Clin Infect Dis, 2014, 59(1): 81-84.
[DOI]
|
| [6] |
Wang X, Wang W, Lin Z, Wang X, Li T, Yu J, Liu W, Tong Z, Xu Y, Zhang J, Guan L, Dai L, Yang Y, Han W, Li R. CARD9 mutations linked to subcutaneous phaeohyphomycosis and TH17 cell deficiencies[J]. J Allergy Clin Immunol, 2014, 133(3): 905-908.
[DOI]
|
| [7] |
Grumach AS, de Queiroz-Telles F, Migaud M, Lanternier F, Filho NR, Palma SM, Constantino-Silva RN, Casanova JL, Puel A. A homozygous CARD9 mutation in a Brazilian patient with deep dermatophytosis[J]. J Clin Immunol, 2015, 35(5): 486-490.
[DOI]
|
| [8] |
Herbst M, Gazendam R, Reimnitz D, Sawalle-Belohradsky J, Groll A, Schlegel PG, Belohradsky B, Renner E, Klepper J, Grimbacher B, Kuijpers T, Liese J. Chronic Candida albicans meningitis in a 4-year-old girl with a homozygous mutation in the CARD9 gene (Q295X)[J]. Pediatr Infect Dis J, 2015, 34(9): 999-1002.
[DOI]
|
| [9] |
Liu M, Spellberg B, Phan QT, Fu Y, Fu Y, Lee AS, Edwards JE Jr, Filler SG, Ibrahim AS. The endothelial cell receptor GRP78 is required for mucormycosis pathogenesis in diabetic mice[J]. J Clin Invest, 2010, 120(6): 1914-1924.
[DOI]
|
| [10] |
LeibundGut-Landmann S, Wuthrich M, Hohl TM. Immunity to fungi[J]. Curr Opin Immunol, 2012, 24(4): 449-458.
[DOI]
|
| [11] |
Colonna M. All roads lead to CARD9[J]. Nat Immunol, 2007, 8(6): 554-555.
[DOI]
|
| [12] |
Hsu YM, Zhang Y, You Y, Wang D, Li H, Duramad O, Qin XF, Dong C, Lin X. The adaptor protein CARD9 is required for innate immune responses to intracellular pathogens[J]. Nat Immunol, 2007, 8(2): 198-205.
[DOI]
|
| [13] |
Gross O, Gewies A, Finger K, Schafer M, Sparwasser T, Peschel C, Förster I, Ruland J. Card9 controls a non-TLR signalling pathway for innate anti-fungal immunity[J]. Nature, 2006, 442(7103): 651-656.
[DOI]
|
| [14] |
Drummond RA, Saijo S, Iwakura Y, Brown GD. The role of Syk/CARD9 coupled C-type lectins in antifungal immunity[J]. Eur J Immunol, 2011, 41(2): 276-281.
[DOI]
|
| [15] |
Roth S, Ruland J. Caspase recruitment domain-containing protein 9 signaling in innate immunity and inflammation[J]. Trends Immunol, 2013, 34(6): 243-250.
[DOI]
|
| [16] |
Jia XM, Tang B, Zhu LL, Liu YH, Zhao XQ, Gorjestani S, Hsu YM, Yang L, Guan JH, Xu GT, Lin X. CARD9 mediates dectin-1-induced ERK activation by linking Ras-GRF1 to H-Ras for antifungal immunity[J]. J Exp Med, 2014, 211(11): 2307-2321.
[DOI]
|
| [17] |
Celmeli F, Oztoprak N, Turkkahraman D, Seyman D, Mutlu E, Frede N, Köksoy S, Grimbacher B. Successful granulocyte colony-stimulating factor treatment of relapsing Candida albicans meningoencephalitis caused by CARD9 deficiency[J]. Pediatr Infect Dis J, 2016, 35(4): 428-431.
[DOI]
|
| [18] |
Lanternier F, Mahdaviani SA, Barbati E, Chaussade H, Koumar Y, Levy R, Denis B, Brunel AS, Martin S, Loop M, Peeters J, de Selys A, Vanclaire J, Vermylen C, Nassogne MC, Chatzis O, Liu L, Migaud M, Pedergnana V, Desoubeaux G, Jouvion G, Chretien F, Darazam IA, Schaffer AA, Netea MG, De Bruycker JJ, Bernard L, Reynes J, Amazrine N, Abel L, Van der Linden D, Harrison T, Picard C, Lortholary O, Mansouri D, Casanova JL, Puel A. Inherited CARD9 deficiency in otherwise healthy children and adults with Candida species-induced meningoencephalitis, colitis, or both[J]. J Allergy Clin Immunol, 2015, 135(6): 1558-1568.
[DOI]
|
| [19] |
Gavino C, Hamel N, Zeng JB, Legault C, Guiot MC, Chankowsky J, Lejtenyi D, Lemire M, Alarie I, Dufresne S, Boursiquot JN, McIntosh F, Langelier M, Behr MA, Sheppard DC, Foulkes WD, Vinh DC. Impaired RASGRF1/ERK-mediated GM-CSF response characterizes CARD9 deficiency in French-Canadians[J]. J Allergy Clin Immunol, 2016, 137(4): 1178-1188.
[DOI]
|
| [20] |
Drummond RA, Collar AL, Swamydas M, Rodriguez CA, Lim JK, Mendez LM, Fink DL, Hsu AP, Zhai B, Karauzum H, Mikelis CM, Rose SR, Ferre EM, Yockey L, Lemberg K, Kuehn HS, Rosenzweig SD, Lin X, Chittiboina P, Datta SK, Belhorn TH, Weimer ET, Hernandez ML, Hohl TM, Kuhns DB, Lionakis MS. CARD9-dependent neutrophil recruitment protects against fungal invasion of the central nervous system[J]. PLoS Pathog, 2015, 11(12): e1005293.
[DOI]
|
| [21] |
Alves de Medeiros AK, Lodewick E, Bogaert DJ, Haerynck F, Van Daele S, Lambrecht B, Bosma S, Vanderdonckt L, Lortholary O, Migaud M, Casanova JL, Puel A, Lanternier F, Lambert J, Brochez L, Dullaers M. Chronic and invasive fungal infections in a family with CARD9 deficiency[J]. J Clin Immunol, 2016, 36(3): 204-209.
[DOI]
|
| [22] |
Jachiet M, Lanternier F, Rybojad M, Bagot M, Ibrahim L, Casanova JL, Puel A, Bouaziz JD. Posaconazole treatment of extensive skin and nail dermatophytosis due to autosomal recessive deficiency of CARD9[J]. JAMA Dermatol, 2015, 151(2): 192-194.
[DOI]
|
| [23] |
de Sousa Mda G, Santana GB, Criado PR, Benard G. Chronic widespread dermatophytosis due to Trichophyton rubrum:a syndrome associated with a Trichophyton-specific functional defect of phagocytes[J]. Front Microbiol, 2015, 6: 801.
[DOI]
|
| [24] |
Boudghene Stambouli O, Amrani N, Boudghéne Stambouli K, Bouali F. Dermatophytic disease with deficit in CARD9:A new case with a brain impairment[J]. J Mycol Med, 2017, 27(2): 250-253.
|
| [25] |
Chowdhary A, Perfect J, de Hoog GS. Black molds and melanized yeasts pathogenic to humans[J]. Cold Spring Harb Perspect Med, 2014, 5(8): a019570.
|
| [26] |
Revankar SG. Dematiaceous fungi[J]. Mycoses, 2007, 50(2): 91-101.
[DOI]
|
| [27] |
Revankar SG, Sutton DA. Melanized fungi in human disease[J]. Clin Microbiol Rev, 2010, 23(4): 884-928.
[DOI]
|
| [28] |
张瑞珺, 王晓雯, 万喆, 李若瑜. 播散性暗色丝孢霉病患者CARD9突变及相关免疫学研究[J]. 微生物与感染, 2017, 12(1): 14-23. [URI]
|
| [29] |
Wang X, Zhang R, Wu W, Song Y, Wan Z, Han W, Li R. Impaired specific anti-fungal immunity in CARD9-deficient patients with phaeohyphomycosis[J]. J Invest Dermatol, 2017, 138(3): 607-617.
|
| [30] |
Lanternier F, Barbati E, Meinzer U, Liu L, Pedergnana V, Migaud M, Héritier S, Chomton M, Frémond ML, Gonzales E, Galeotti C, Romana S, Jacquemin E, Angoulvant A, Bidault V, Canioni D, Lachenaud J, Mansouri D, Mahdaviani SA, Adimi P, Mansouri N, Jamshidi M, Bougnoux ME, Abel L, Lortholary O, Blanche S, Casanova JL, Picard C, Puel A. Inherited CARD9 deficiency in 2 unrelated patients with invasive Exophiala infection[J]. J Infect Dis, 2015, 211(8): 1241-1250.
[DOI]
|
| [31] |
梁嫔, 王晓雯, 万喆, 李若瑜. CARD9缺陷的暗色丝孢霉病患者中性粒细胞抗白念珠菌免疫功能的研究[J]. 中国真菌学杂志, 2015, 10(1): 1-5. |
| [32] |
Liang P, Wang X, Wang R, Wan Z, Han W, Li R. CARD9 deficiencies linked to impaired neutrophil functions against Phialophora verrucosa[J]. Mycopathologia, 2015, 179(5-6): 347-357.
[DOI]
|
| [33] |
Wu W, Zhang R, Wang X, Song Y, Liu Z, Han W, Li R. Impairment of immune response against dematiaceous fungi in Card9 knockout mice[J]. Mycopathologia, 2016, 181(9-10): 631-642.
[DOI]
|
| [34] |
Rieber N, Gazendam RP, Freeman AF, Hsu AP, Collar AL, Sugui JA, Drummond RA, Rongkavilit C, Hoffman K, Henderson C, Clark L, Mezger M, Swamydas M, Engeholm M, Schüle R, Neumayer B, Ebel F, Mikelis CM, Pittaluga S, Prasad VK, Singh A, Milner JD, Williams KW, Lim JK, Kwon-Chung KJ, Holland SM, Hartl D, Kuijpers TW, Lionakis MS. Extrapulmonary Aspergillus infection in patients with CARD9 deficiency[J]. JCI Insight, 2016, 1(17): e89890.
|
 2018, Vol. 13
2018, Vol. 13