2. 上海市浦东医院, 复旦大学附属浦东医院检验科, 上海 201399
2. Department of Clinical Laboratory, Shanghai Pudong Hospital, Fudan University, Shanghai 201399, China
乙型肝炎病毒(hepatitis B virus,HBV)是重要的人类病原体,能感染人的肝实质细胞,引起急性和慢性肝脏炎症、肝纤维化、肝硬化和肝癌[1-6]。只有人类和少数灵长类动物的肝细胞对HBV具有易感性[7-8]。人肝细胞对HBV的易感性可归于多种因素,包括肝细胞表面的受体以及肝细胞内的蛋白和其他因子。早期的研究显示,肝细胞内富集的转录因子可调控HBV的基因表达。2012年肝细胞特异的牛磺胆酸钠共转运多肽(sodium taurocholate cotransporting polypeptide,NTCP)被鉴定为HBV的受体,极大地促进了对HBV易感性的研究[9-11]。在此基础上构建的过表达人NTCP的人肝癌细胞系HepG2-NTCP能够被HBV有效感染,为阐明HBV生活史提供了重要研究系统。但是在人肝癌细胞系Huh7细胞和未分化的HepaRG细胞中,过表达人NTCP后虽然可以造成HBV的感染,但是感染效率很低;在小鼠肝癌细胞系和大鼠肝癌细胞系如Hepa1-6、Hep56.1D和TC5123中,即使过表达人NTCP也不能使HBV有效感染[12-13]。并且,HBV感染HepG2-NTCP细胞系不仅要求有较高的感染复数(multiplicity of infection,MOI),还需要聚乙二醇(polyethylene glycol,PEG)和二甲亚砜(dimethyl sulfoxide,DMSO)的辅助[14]。因此,人肝细胞对HBV的易感性还需更深入的研究。
本课题组在前期研究中基于HBV临床突变株6898构建了具有较高复制能力的HBV载体5c3c。5c3c在包膜大蛋白preS1区缺失384bp,用以插入外源的基因片段,插入的外源基因可以利用其上游的Sp1启动子启动表达。此缺失部位包括preS1的C端和preS2的N端,位于不同开放读码框架的Spacer区域(图 1B)[15-16]。此外,还将HBV包膜大蛋白preS1的起始密码子ATG突变为ACG,以避免preS1残留序列对下游插入的外源基因表达产生影响[15, 17]。本课题组前期在5c3c载体中插入了3种基因,分别是干扰素基因、shRNA的表达系统及ds-red基因,这些重组HBV载体不仅转染Huh7细胞后能表达外源基因,且保留有较高的复制能力,在回补HBV包膜蛋白的情况下,能够产生具有感染力的重组HBV(recombinant HBV,rHBV)[15]。

|
| A: The sequences coding the N-signal peptide (Bip or CD59), Flag, and GPI-addition signal peptide (GPI) were inserted respectively into the vectors pCDNA3.1. B: The organization of the 5c3c vector. C: The sequences coding the N-signal peptide (Bip or CD59), Flag, and GPI-addition signal peptide (GPI) were inserted respectively into the vectors 5c3c and 5c3cT. The mutated preS1 start codon (ACG) in 5c3c was reverted to ATG in 5c3cT. 图 1 Flag-GPI表达载体构建示意图 Fig. 1 Schematic presentation of Flag-GPI constructs |
糖基磷脂酰肌醇(glycosylphosphatidylinositol,GPI)是一种蛋白质,通过翻译后修饰而在其C端获得的一个脂质锚,被修饰的蛋白质可以通过GPI锚定在细胞膜上,暴露于细胞表面[18-21]。能够获得GPI修饰的蛋白N端和C端各含有一个信号肽,N端信号肽的作用是将蛋白质带到内质网(endoplasmic reticulum,ER)内腔进行加工;C端信号肽又被称为GPI添加信号肽,其作用是用来替换预先在ER内合成的GPI,使GPI通过特定的化学键连接在蛋白质的C端[22-24]。
基于HBV载体5c3c和GPI的特性,本研究设想在5c3c载体中插入外源基因,该基因编码带有N端分泌信号肽和C端GPI添加信号肽的Flag标签,通过构建表达Flag-GPI的重组HBV,使Flag标签表达在感染细胞的表面, 从而可以利用Flag抗体对感染细胞进行筛选,进而为HBV易感性提供研究工具[25-31]。
在本研究中,设计了两个将Flag序列插入5c3c中的方案。第1个方案中,在5c3c的插入位点依次插入自带起始密码子(ATG)的N端信号肽序列,Flag编序列以及GPI添加信号肽序列;第2个方案中,将5c3c载体中preS1的ACG突变回ATG,称为5c3cT载体,利用preS1的N端充当信号肽,在5c3cT中顺序插入Flag和GPI添加信号肽序列。通过实验验证,最后得到重组HBV载体5c3cT-Flag-GPI和5c3c-CD59-Flag-GPI。它们转染Huh7细胞和HepG2-NTCP细胞后,可以将其表达的Flag锚定在细胞膜上。这两种重组HBV载体都保持一定的病毒复制能力,复制子5c3cT-Flag-GPI在回补HBV包膜蛋白的情况下,可以包装形成完整的重组HBV颗粒。
1 材料与方法 1.1 材料 1.1.1 细胞系293FT细胞系、Huh7细胞系由本实验室保存,HepG2-NTCP细胞系[带有灭瘟素(blasticidin S)抗性基因和人NTCP基因,在含blasticidin S的培养条件下能稳定表达人NTCP的HepG2细胞系]由王勇翔副教授惠赠。
1.1.2 质粒5c3c由本课题组保存,pCDNA3.1质粒由吴可菲硕士惠赠,pRRL-cPPT-PGK-GPI-scFv-AB65-HIS质粒由周保罗课题组惠赠,巨细胞病毒(cytomegalovirus,CMV)-1.1-HBV(由CMV启动子启动的1.1拷贝的HBV基因组)由本课题组保存,p-LMS(可以表达HBV大、中、小3种包膜蛋白的质粒)由崔晓娴博士惠赠。
1.1.3 仪器和试剂主要仪器包括PCR仪(北京东胜创新生物科技有限公司)、pH计(上海天达仪器有限公司)、二氧化碳细胞培养箱(Thermo公司)、EVOS倒置荧光显微镜(北京东胜创新生物科技有限公司)、Leica SP8 X激光共聚焦显微镜系统(德国Leica公司)、LSR Fortessa流式细胞仪(美国BD公司)。主要试剂包括PrimeSTAR Max DNA Polymerase(TaKaRa公司)、Go Taq qPCR Master Mix(Promega公司)、快速质粒小提试剂盒[天根生化科技(北京)有限公司]、普通琼脂糖凝胶DNA回收试剂盒[天根生化科技(北京)有限公司]、转染试剂TurboFect(Thermo Fisher Scientific公司)、PCR DIG Probe Synthesis Kit(Roche公司)、DIG Easy Hyb Granules(Roche公司)、DMEM(Gibco公司)、胎牛血清(Gibco公司)、Trypsin-EDTA(Gibco公司)、流式细胞抗体APC anti-Flag(Biolegend公司)、免疫荧光抗体anti-Flag(Sigma公司)、抗-preS1抗体(Santa Cruz Biotechnology公司)。
1.1.4 引物合成引物由上海桑尼生物科技有限公司合成,引物序列见表 1。
| 引物 | 序列 |
| Bip-N-F | TACTGGCCGTCGTGACTACAAAGACGACGACGACAAAG |
| Bip-N-R | ATATGCATAACTTCATGGTGGCAATTGTGCCTTGTCG |
| Bip-C-F | CCTCTCGCTCGGGGACTACAAAGACGACGACGACAAAG |
| Bip-C-R | CCAACAAAGGCCACGACGGCCAGTAATATGCATAAC |
| CD59-N-F | GTCCTGTTCGGGCTGCTGGACTACAAAGACGACGACGACAAAGGAAGTG |
| CD59-N-R | AGACCCTCCTTGGATTCCCATGGTGGCAATTGTGCCTTGTCGAGGTTTG |
| CD59-C-F | TGCCATTCAGGTCACAGCGACTACAAAGACGACGACGACAAAGGAAGTG |
| CD59-C-R | GAAGACAGCCAGGACGAGCAGCAGCCCGAACAGGACAGACCCTCCTTGG |
| Bip-F | CCGAATTCCCACCATGAAGTTATGCATATTAC |
| Bip-R | CCGGATCCTCAAGTCAGCAAGCCCATGGTTAC |
| CD59-F | CCGAATTCCCACCATGGGAATCCAAGGAG |
| CD59-R | CGGGATCCTCAAGTCAGCAAGCCCATGG |
| 5c3c-core-F | AATGCCCCTATCTTATCAACACT |
| 5c3c-core-R | GAGATTGAGATCTTCTGCGACG |
细胞均在37 ℃ CO2培养箱中用DMEM(含10% FBS,100 U/ml青霉素和100 μg/ml链霉素)培养,HepG2-NTCP细胞的培养需要在培养基中另加blasticidin S(5 μg/ml)。
1.2.2 免疫荧光细胞用4%多聚甲醛室温固定30 min,PBS洗2次,每次5 min。加入含有1% Triton X-100的PBS破膜,室温孵育10 min。用含5% BSA、0.1% Triton X-100的PBS孵育细胞,进行封闭。弃去封闭液,用新配制的合适浓度的一抗孵育液(anti-Flag抗体按照1:500~1 000稀释)室温孵育2 h或4 ℃过夜。弃去一抗,PBS洗5次,每次5 min。配制合适浓度的二抗孵育液(一般按照1:500~1 000稀释),室温孵育1 h。弃去二抗,PBS洗5次,每次5 min。加入DAPI稀释液,室温孵育2 min。弃去DAPI,PBS洗5次,每次5 min。最后封片,置于荧光显微镜下观察。检测细胞膜表面抗原时PBS中不加入Triton X-100,其他步骤相同。
1.2.3 流式细胞术(针对6孔板的贴壁细胞)弃去旧的培养基后用PBS轻轻清洗细胞2遍,加入400 μl胰酶稀释液(100 μl胰蛋白酶和300 μl PBS),37 ℃下消化5~10 min。加入800 μl DMEM(含10% FBS,100 U/ml青霉素和100 μg/ml链霉素)终止消化作用,重悬吹散后350 g离心5 min。用PBS重悬,对细胞进行计数后分装到1.5 ml的EP管中,使每管约含(5~10)×105个细胞。加入5 μl封闭液,室温封闭10 min。加入2 μl 0.2 μg/μl的APC anti-Flag抗体,冰上避光孵育20 min。用PBS洗2次,每次350 g离心5 min,收集细胞。用500 μl PBS重悬后上流式细胞仪分析。
1.2.4 Southern印迹法配制质量体积比为1%的琼脂糖凝胶,上样,70 V电泳约2 h。取出胶,用变性液变性1 h。完成后,用中和液中和1 h。结束后,将凝胶、裁剪好的尼龙膜、滤纸浸泡入20×SSC中。转膜过夜后,将尼龙膜在2×SSC溶液中浸泡5 min,接着紫外交联2 min。将尼龙膜放入圆柱形管中,加入5 ml的预杂交液,42 ℃预杂交30 min。取出探针,100 ℃变性5 min,迅速冰浴3 min。将探针加入新的预杂交液中,配制形成杂交液。倒出预杂交液,换成杂交液,42 ℃杂交6~8 h。高盐溶液洗膜2次,每次5 min。低盐溶液洗膜2次,每次15 min。接下来在杂交炉中的步骤温度都为25~50 ℃。Washing缓冲液润洗1~5 min。Blocking缓冲液封闭30 min。anti-DIG antibody溶液孵育30 min。Washing缓冲液洗2次,每次15 min。Detection缓冲液润洗2~5 min。在尼龙膜上覆盖CSPD工作液,室温避光5 min。发光,30 min以上。
2 结果 2.1 Flag-GPI表达载体的构建通过GPI锚将蛋白锚定在细胞膜上并暴露于细胞膜外侧,需要目的蛋白(多肽)的N端和C端各含有一个信号肽。根据文献,选取了2个N端信号肽序列,分别命名为Bip和CD59。Bip信号肽序列来源于分泌表达载体pSecTag2A-Bip,其上Bip的作用是将所表达的蛋白引导入ER的分泌途径。CD59是补体调节蛋白CD59的N端信号肽,CD59本身通过GPI锚而被锚定在细胞膜表面[32]。C端的GPI添加信号肽的基因序列采用了周保罗课题组惠赠的载体质粒pRRL-cPPT-PGK-GPI-scFv-AB65-HIS上的GPI添加信号肽基因序列。每个N端信号肽都含有起始密码子(ATG),GPI添加信号肽的C端含有终止密码子(TGA)。
在真核表达载体pCDNA3.1中,选择在EcoRⅠ与BamHⅠ之间的酶切位点插入N端信号肽基因序列、Flag编码序列和C端GPI添加信号肽基因序列。为增强插入基因的翻译,在N端信号肽的起始密码子(ATG)前插入了Kozak序列(图 1A)。同时,也构建了不含N端信号肽序列的对照质粒,即在pCDNA3.1载体中仅插入Flag编码序列和C端GPI添加信号肽,在Flag前端带有Kozak序列和起始密码子ATG(图 1A)。以上这些质粒分别被命名为pCDNA3.1-Bip-Flag-GPI,pCDNA3.1-CD59-Flag-GPI和pCDNA3.1-Flag-GPI。
在含有1.1拷贝HBV基因组的5c3c载体质粒上进行了同样的操作,构建了5c3c-Bip-Flag-GPI和5c3c-CD59-Flag-GPI(图 1C)。
5c3c载体上preS1仍保留其在N端的11个氨基酸的编码序列。HBV包膜大蛋白preS1的N端在天然情况下可被豆蔻酰化,因此可能含有将其定向带到ER的N端信号肽。基于该推断,将5c3c载体中preS1的突变起始密码子ACG变回ATG,新的载体命名为5c3cT。随后将Flag编码序列和GPI添加信号肽序列依次插入5c3cT载体中(图 1C)。该载体质粒被命名为5c3cT-Flag-GPI。
2.2 Flag-GPI的细胞表面锚定验证免疫荧光实验结果显示,pCDNA3.1-Bip-Flag-GPI和pCDNA3.1-CD59-Flag-GPI转染Huh7细胞(图 2A)和293FT细胞(图 2B)后,可将Flag标签锚定在细胞表面。阴性对照pCDNA3.1-Flag-GPI在细胞内可表达Flag,但不能将Flag标签锚定在细胞表面(图 2A和2B)。通过流式细胞术进一步证实pCDNA3.1-Bip-Flag-GPI和pCDNA3.1-CD59-Flag-GPI转染Huh7细胞后,细胞表面Flag阳性的细胞数量显著增加(图 2C)。
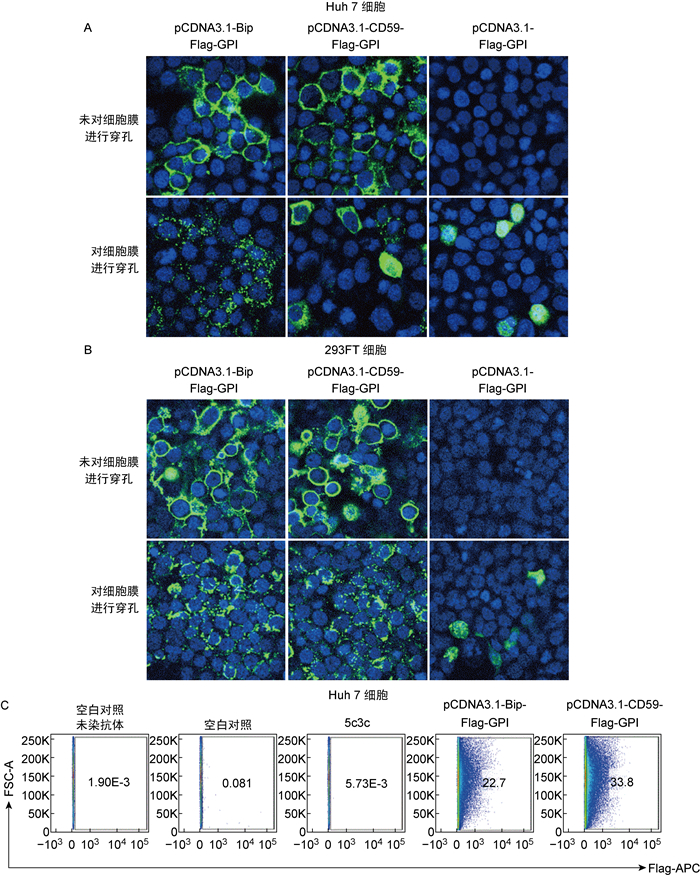
|
| A: Transfections of pCDNA3.1-Bip-Flag-GPI and pCDNA3.1-CD59-Flag-GPI into Huh7 cells. pCDNA3.1-Flag-GPI served as negative control. B: Transfections of pCDNA3.1-Bip-Flag-GPI and pCDNA3.1-CD59-Flag-GPI into 293FT cells. pCDNA3.1-Flag-GPI served as negative control. C: Flow cytometry analysis. Surface-displayed Flag positive cells were detected and selected by anti-Flag antibodies. 图 2 pCDNA3.1-Bip-Flag-GPI和pCDNA3.1-CD59-Flag-GPI转染细胞后可以将Flag标签锚定在细胞表面 Fig. 2 Anchorage of Flag tags on the cell membrane after transfection of pCDNA3.1-Bip-Flag-GPI and pCDNA3.1-CD59-Flag-GPI |
将5c3c-Bip-Flag-GPI、5c3c-CD59-Flag-GPI和5c3cT-Flag-GPI转染Huh7细胞后进行免疫荧光实验,发现5c3c-CD59-Flag-GPI转染的细胞表面可检测到Flag标签(图 3A),而5c3c-Bip-Flag-GPI转染Huh7细胞后不表达Flag(结果未展示),5c3cT-Flag-GPI转染的Huh7细胞表面也呈现Flag阳性(图 3A)。免疫荧光实验结果也证明,转染5c3c-CD59-Flag-GPI和5c3cT-Flag-GPI的HepG2-NTCP细胞表面也能检测到Flag标签(图 3B)。流式细胞检测结果进一步表明,5c3c-CD59-Flag-GPI和5c3cT-Flag-GPI转染的Huh7细胞可以将Flag标签锚定在细胞膜上(图 3C)。
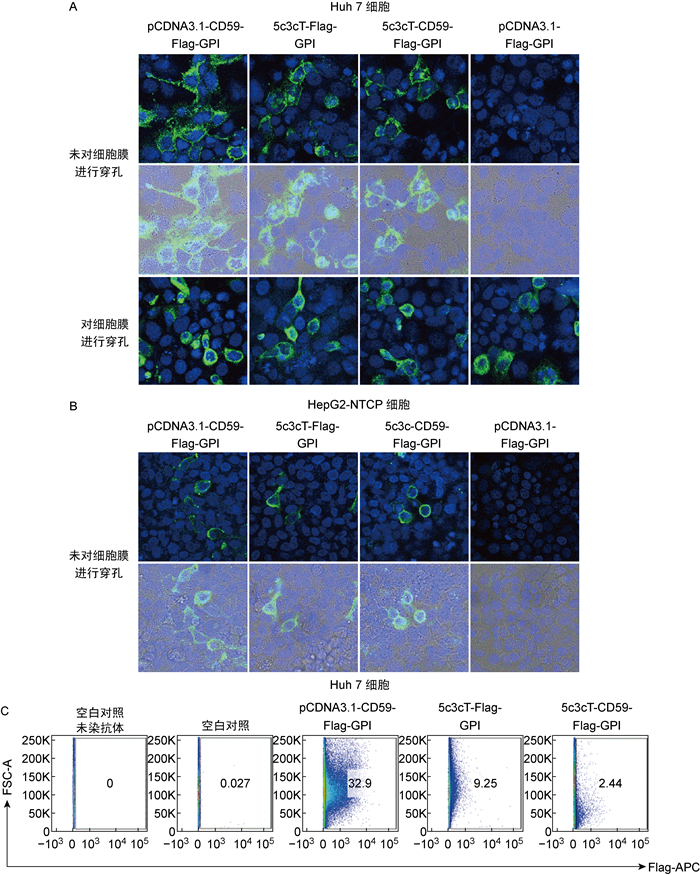
|
| A: Transfections of 5c3cT-Flag-GPI and 5c3c-CD59-Flag-GPI into Huh7 cells. pCDNA3.1-Flag-GPI served as negative control. B: Transfections of 5c3cT-Flag-GPI and 5c3c-CD59-Flag-GPI into HepG2-NTCP cells. pCDNA3.1-Flag-GPI served as negative control. C: Flow cytometry analysis. Surface-displayed Flag positive cells were detected and selected by anti-Flag antibodies. 图 3 5c3cT-Flag-GPI和5c3c-CD59-Flag-GPI转染细胞后可以将Flag标签锚定在细胞表面 Fig. 3 Anchorage of Flag tags on the cell membrane after transfection of 5c3cT-Flag-GPI and 5c3c-CD59-Flag-GPI |
用DNA印迹法(Southern印迹法)验证获得的两个重组HBV复制子转染Huh7细胞后能否有效复制。实验结果表明,5c3c-CD59-Flag-GPI和5c3cT-Flag-GPI均能复制(图 4)。如图 4所示,在复制能力上空载体5c3c的最强,5c3cT-Flag-GPI与CMV-1.1-HBV相当,5c3cT-Flag-GPI比5c3c-CD59-Flag-GPI强。
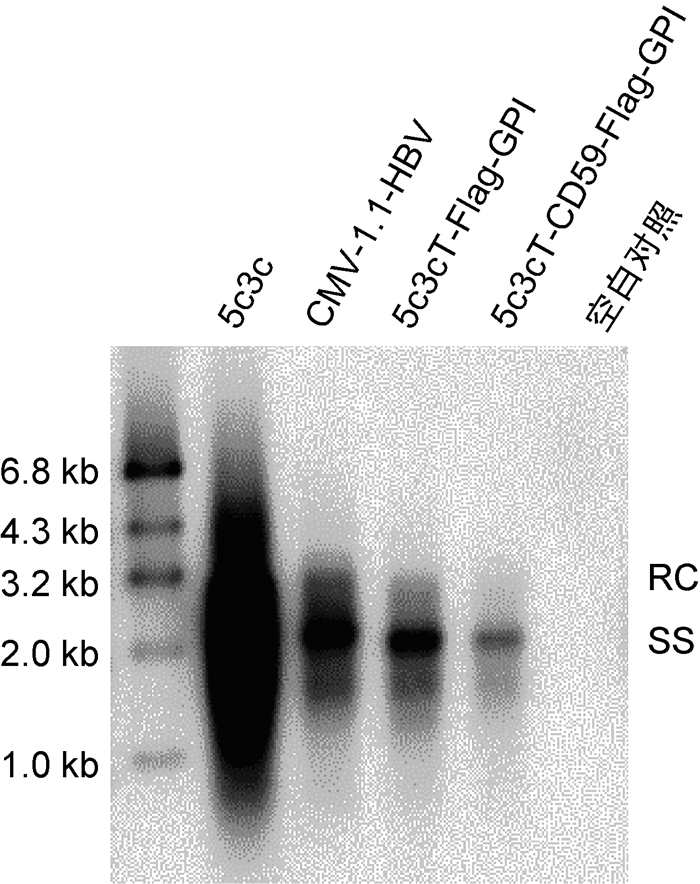
|
| From the left to the right, the samples are 5c3c, CMV-1.1-HBV, 5c3cT-Flag-GPI, 5c3c-CD59-Flag-GPI, and blank control. 5c3c and CMV-1.1-HBV served as positive controls. Blank control served as a negative control. 图 4 Southern印迹法验证5c3cT-Flag-GPI和5c3c-CD59-Flag-GPI的复制能力 Fig. 4 The replication ability of 5c3cT-Flag-GPI and 5c3c-CD59-Flag-GPI verified by Southern blot |
由于5c3cT-Flag-GPI的复制能力比5c3c-CD59-Flag-GPI强,因此采用5c3cT-Flag-GPI进行进一步的实验。在Huh7细胞中共转表达HBV表面蛋白的p-LMS质粒和5c3cT-Flag-GPI质粒,纯化和浓缩细胞培养上清液后,用抗preS1的抗体进行pull-down实验,判断有无完整的重组HBV产生(图 5)。共转p-LMS质粒和5c3c载体作为阳性对照,单转5c3c载体作为阴性对照。实验结果显示,5c3cT-Flag-GPI在回补HBV包膜蛋白后,可产生完整的重组HBV颗粒。

|
| Cotransfection of 5c3c and p-LMS with pull-down assays served as positive control, transfection of 5c3c with pull-down assays served as negative control. 图 5 Pull-down实验验证重组HBV的产生 Fig. 5 Verification of formation of recombinant HBV particles with pull-down assays |
在本研究中,首先在pCDNA3.1载体上获得pCDNA3.1-Bip-Flag-GPI和pCDNA3.1-CD59-Flag-GPI,转染Huh7和293FT细胞后可将Flag标签锚定在细胞表面(图 2)。这两个质粒转染293FT细胞后,进行对细胞膜穿孔和未穿孔的免疫荧光实验。结果显示,被穿孔的293FT细胞,细胞膜上有明显的穿孔痕迹,细胞膜表现为不连续的点状绿色荧光。推测与蛋白质相连的GPI锚(两个疏水的脂肪酸长链)大多插入在细胞膜上的脂质筏区域,该区域的稳定性较高,不溶于Triton X-100。因此在采用Triton X-100对细胞膜进行穿孔时,脂质筏区域不能被Triton X-100“穿透”,所以锚定有Flag而未被Triton X-100消化的脂质筏就呈现为不连续的点状绿色荧光[33-34]。然而对比观察pCDNA3.1-Bip-Flag-GPI和pCDNA3.1-CD59-Flag-GPI转染Huh7细胞后被Triton X-100穿孔后的免疫荧光结果发现,Huh7的细胞膜偶尔会出现不连续的点状绿色荧光,更多的是直接观察到细胞内核周围的绿色荧光,这与293FT细胞上所观察到的结果并不完全一致。原因可能是293FT细胞和Huh7细胞的细胞膜磷脂双分子中脂质筏的比例可能不一样,293FT细胞膜磷脂双分子层中脂质筏的比例可能高于Huh7细胞膜中的,293FT细胞的细胞膜更难被Triton X-100消化,因此穿孔后293FT细胞的细胞膜更多呈现为不连续的点状绿色荧光。
pCDNA3.1-Bip-Flag-GPI和pCDNA3.1-CD59-Flag-GPI转染Huh7和293FT细胞后可以将Flag标签锚定在细胞膜上说明Bip和CD59可以正常发挥信号肽的功能,并且与Flag C端的GPI添加信号肽协同作用,协助将Flag标签锚定在细胞膜上。但是将这两个N端信号肽对应插入在载体5c3c上,就只有5c3c-CD59-Flag-GPI转染Huh7细胞后可以将Flag标签锚定在细胞膜上,而5c3c-Bip-Flag-GPI不能在转染的Huh7细胞中表达Flag标签(结果未展示)。此现象说明即使在pCDNA3.1载体上可以正常发挥作用的N端信号肽在5c3c载体上也不一定具有活性。可能是因为5c3c载体更为复杂,插入的N端信号肽在HBV基因组中发挥功能尚需具备一定的兼容性。本研究的目的之一是使Flag标签在转染细胞内可以通过GPI锚定在细胞膜上,但是否表达Flag标签的细胞都能有效地将Flag进行GPI修饰进而锚定在细胞膜上还需要进一步的研究,后续实验将检测Flag膜锚定细胞数占Flag阳性细胞数的百分比,从而衡量GPI修饰效率和(或)Flag-GPI细胞膜锚定的效率。
载体5c3cT-Flag-GPI转染Huh7细胞后也可以将Flag标签锚定在细胞膜上,证明5c3c中残留的preS1序列确实具有N端信号肽的作用。HBV载体的相关研究也表明,HBV基因组的长度越短,该载体的复制能力则往往越强[16]。复制子5c3cT-Flag-GPI的基因组长度比复制子5c3c-CD59-Flag-GPI的短,但其复制能力比复制子5c3c-CD59-Flag-GPI的强,进一步验证了这一观点。
本研究基于课题组前期工作基础和GPI锚的相关特性,构建了重组HBV载体5c3cT-Flag-GPI和5c3c-CD59-Flag-GPI,转染Huh7细胞后可将Flag标签通过GPI锚定在细胞膜上,并可利用Flag抗体通过流式细胞术对表面含有Flag标签的细胞进行分选。5c3cT-Flag-GPI和5c3c-CD59-Flag-GPI转染Huh7细胞后都能进行复制,证明其都能产生完整的病毒核心颗粒。在反式回补HBV的包膜蛋白之后,5c3cT-Flag-GPI可以产生完整的重组HBV。因为产生的重组HBV滴度较低,所以重组HBV未能有效感染HepG2-NTCP细胞(结果未展示)。由图 5可知在共转5c3cT-Flag-GPI和p-LMS未进行pull-down的情况下,复制子5c3cT-Flag-GPI的复制能力很强,说明此时可以产生大量的HBV核心颗粒;但是在共转5c3cT-Flag-GPI和p-LMS进行pull-down时,形成完整重组HBV颗粒的滴度却很低。该现象提示包装形成的重组HBV滴度不高的原因可能是重组HBV的包装系统不够高效。提示后续实验将改进包膜蛋白的提供方式来对重组HBV的包装体系进行优化,本课题组以往的包装系统采用反式提供HBV的包膜蛋白,但是包装效率不高。考虑到HBV的特性,顺式提供其包膜蛋白将是我们优化包装体系的一个重要研究方向。总的来说,本研究为进一步优化Flag-GPI重组HBV包装体系和感染实验奠定了基础。
| [1] |
Seto WK, Lo YR, Pawlotsky JM, Yuen MF. Chronic hepatitis B virus infection[J]. Lancet, 2018, 392(10161): 2313-2324.
[DOI]
|
| [2] |
Tsai KN, Kuo CF, Ou JJ. Mechanisms of hepatitis B virus persistence[J]. Trends Microbiol, 2018, 26(1): 33-42.
[DOI]
|
| [3] |
Allweiss L, Dandri M. Experimental in vitro and in vivo models for the study of human hepatitis B virus infection[J]. J Hepatol, 2016, 64(1 Suppl): S17-S31.
[DOI]
|
| [4] |
Boonstra A, Woltman AM, Janssen HL. Immunology of hepatitis B and hepatitis C virus infections[J]. Best Pract Res Clin Gastroenterol, 2008, 22(6): 1049-1061.
[DOI]
|
| [5] |
Rehermann B, Nascimbeni M. Immunology of hepatitis B virus and hepatitis C virus infection[J]. Nat Rev Immunol, 2005, 5(3): 215-229.
[DOI]
|
| [6] |
Yang HC, Tsou HH, Pei SN, Chang CS, Chen JH, Yao M, Lin SJ, Lin J, Yuan Q, Xia N, Liu TW, Chen PJ, Cheng AL, Hsu C, Taiwan Cooperative Oncology Group. Quantification of HBV core antibodies may help predict HBV reactivation in patients with lymphoma and resolved HBV infection[J]. J Hepatol, 2018, 69(2): 286-292.
[DOI]
|
| [7] |
Lebossé F, Testoni B, Fresquet J, Facchetti F, Galmozzi E, Fournier M, Hervieu V, Berthillon P, Berby F, Bordes I, Durantel D, Levrero M, Lampertico P, Zoulim F. Intrahepatic innate immune response pathways are downregulated in untreated chronic hepatitis B[J]. J Hepatol, 2017, 66(5): 897-909.
[DOI]
|
| [8] |
Li H, Zhuang Q, Wang Y, Zhang T, Zhao J, Zhang Y, Zhang J, Lin Y, Yuan Q, Xia N, Han J. HBV life cycle is restricted in mouse hepatocytes expressing human NTCP[J]. Cell Mol Immunol, 2014, 11(2): 175-183.
[DOI]
|
| [9] |
Yan H, Zhong G, Xu G, He W, Jing Z, Gao Z, Huang Y, Qi Y, Peng B, Wang H, Fu L, Song M, Chen P, Gao W, Ren B, Sun Y, Cai T, Feng X, Sui J, Li W. Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus[J]. Elife, 2012, 1: e00049.
[DOI]
|
| [10] |
Yan H, Liu Y, Sui J, Li W. NTCP opens the door for hepatitis B virus infection[J]. Antiviral Res, 2015, 121: 24-30.
[DOI]
|
| [11] |
Fu L, Hu H, Liu Y, Jing Z, Li W. Woodchuck sodium taurocholate cotransporting polypeptide supports low-level hepatitis B and D virus entry[J]. Virology, 2017, 505: 1-11.
[DOI]
|
| [12] |
Sun Y, Wang S, Yi Y, Zhang J, Duan Z, Yuan K, Liu W, Li J, Zhu Y. The hepatitis B surface antigen binding protein: an immunoglobulin G constant region-like protein that interacts with HBV envelop proteins and mediates HBV entry[J]. Front Cell Infect Microbiol, 2018, 8: 338.
[DOI]
|
| [13] |
Watashi K, Urban S, Li W, Wakita T. NTCP and beyond: opening the door to unveil hepatitis B virus entry[J]. Int J Mol Sci, 2014, 15(2): 2892-2905.
[DOI]
|
| [14] |
Ortega-Prieto AM, Skelton JK, Wai SN, Large E, Lussignol M, Vizcay-Barrena G, Hughes D, Fleck RA, Thursz M, Catanese MT, Dorner M. 3D microfluidic liver cultures as a physiological preclinical tool for hepatitis B virus infection[J]. Nat Commun, 2018, 9(1): 682.
[DOI]
|
| [15] |
Hong R, Bai W, Zhai J, Liu W, Li X, Zhang J, Cui X, Zhao X, Ye X, Deng Q, Tiollais P, Wen Y, Liu J, Xie Y. Novel recombinant hepatitis B virus vectors efficiently deliver protein and RNA encoding genes into primary hepatocytes[J]. J Virol, 2013, 87(12): 6615-6624.
[DOI]
|
| [16] |
Bai W, Cui X, Xie Y, Liu J. Engineering hepadnaviruses as reporter-expressing vectors: recent progress and future perspectives[J]. Viruses, 2016, 8(5): E125.
[DOI]
|
| [17] |
Bai W, Cui X, Chen R, Tao S, Hong R, Zhang J, Zhang J, Wang Y, Xie Y, Liu J. Re-designed recombinant hepatitis B virus vectors enable efficient delivery of versatile cargo genes to hepatocytes with improved safety[J]. Viruses, 2016, 8(5): E129.
[DOI]
|
| [18] |
Müller GA. The release of glycosylphosphatidylinositol-anchored proteins from the cell surface[J]. Arch Biochem Biophys, 2018, 656: 1-18.
[DOI]
|
| [19] |
Fujihara Y, Ikawa M. GPI-AP release in cellular, developmental, and reproductive biology[J]. J Lipid Res, 2016, 57(4): 538-545.
[DOI]
|
| [20] |
Paulick MG, Bertozzi CR. The glycosylphosphatidylinositol anchor: a complex membrane-anchoring structure for proteins[J]. Biochemistry, 2008, 47(27): 6991-7000.
[DOI]
|
| [21] |
Kinoshita T. Glycosylphosphatidylinositol (GPI) anchors: biochemistry and cell biology: introduction to a thematic review series[J]. J Lipid Res, 2016, 57(1): 4-5.
[DOI]
|
| [22] |
Matabaro E, He Z, Liu YS, Zhang HJ, Gao XD, Fujita M. Molecular switching system using glycosylphosphatidylinositol to select cells highly expressing recombinant proteins[J]. Sci Rep, 2017, 7(1): 4033.
[DOI]
|
| [23] |
Mayor S, Riezman H. Sorting GPI-anchored proteins[J]. Nat Rev Mol Cell Biol, 2004, 5(2): 110-120.
[DOI]
|
| [24] |
Ray A, Jatana N, Thukral L. Lipidated proteins: Spotlight on protein-membrane binding interfaces[J]. Prog Biophys Mol Biol, 2017, 128: 74-84.
[DOI]
|
| [25] |
Kono S, Yoshida K, Tomosugi N, Terada T, Hamaya Y, Kanaoka S, Miyajima H. Biological effects of mutant ceruloplasmin on hepcidin-mediated internalization of ferroportin[J]. Biochim Biophys Acta, 2010, 1802(11): 968-975.
[DOI]
|
| [26] |
Ye C, Wang W, Cheng L, Li G, Wen M, Wang Q, Zhang Q, Li D, Zhou P, Su L. Glycosylphosphatidylinositol-anchored anti-HIV scFv efficiently protects CD4 T cells from HIV-1 infection and deletion in hu-PBL mice[J]. J Virol, 2017, 91(3): e01389-16.
[DOI]
|
| [27] |
Liu L, Wang W, Matz J, Ye C, Bracq L, Delon J, Kimata JT, Chen Z, Benichou S, Zhou P. The glycosylphosphatidylinositol-anchored variable region of llama heavy chain-only antibody JM4 efficiently blocks both cell-free and T cell-T cell transmission of human immunodeficiency virus type 1[J]. J Virol, 2016, 90(23): 10642-10659.
[DOI]
|
| [28] |
Liu L, Wen M, Zhu Q, Kimata JT, Zhou P. Glycosyl phosphatidylinositol-anchored C34 peptide derived from human immunodeficiency virus type 1 Gp41 is a potent entry inhibitor[J]. J Neuroimmune Pharmacol, 2016, 11(3): 601-610.
[DOI]
|
| [29] |
Liu L, Wang W, Yang L, Ren H, Kimata JT, Zhou P. Trimeric glycosylphosphatidylinositol-anchored HCDR3 of broadly neutralizing antibody PG16 is a potent HIV-1 entry inhibitor[J]. J Virol, 2013, 87(3): 1899-1905.
[DOI]
|
| [30] |
Liu L, Wen M, Wang W, Wang S, Yang L, Liu Y, Qian M, Zhang L, Shao Y, Kimata JT, Zhou P. Potent and broad anti-HIV-1 activity exhibited by a glycosyl-phosphatidylinositol-anchored peptide derived from the CDR H3 of broadly neutralizing antibody PG16[J]. J Virol, 2011, 85(17): 8467-8476.
[DOI]
|
| [31] |
Wen M, Arora R, Wang H, Liu L, Kimata JT, Zhou P. GPI-anchored single chain Fv--an effective way to capture transiently-exposed neutralization epitopes on HIV-1 envelope spike[J]. Retrovirology, 2010, 7: 79.
[DOI]
|
| [32] |
Miwa T, Zhou L, Maldonado MA, Madaio MP, Eisenberg RA, Song WC. Absence of CD59 exacerbates systemic autoimmunity in MRL/lpr mice[J]. J Immunol, 2012, 189(11): 5434-5441.
[DOI]
|
| [33] |
Bieberich E. Sphingolipids and lipid rafts: Novel concepts and methods of analysis[J]. Chem Phys Lipids, 2018, 216: 114-131.
[DOI]
|
| [34] |
周一然, 宋建国. 脂质筏——病原微生物出入细胞的一种门户[J]. 生命科学, 2004, 16(3): 144-147. [DOI]
|
 2019, Vol. 14
2019, Vol. 14



