肺炎克雷伯菌(Klebsiella pneumoniae, KP)是一种革兰染色阴性、有荚膜的肠杆菌科细菌, 广泛存在于环境中, 亦寄生于人类的皮肤、鼻咽部、肠道等, 为条件致病菌, 主要感染免疫功能低下者[1]。1986年7例由KP引起的肝脓肿并发眼内炎首次被报道, 并被定义为高毒力肺炎克雷伯菌(hypervirulent Klebsiella pneumoniae, HVKP)[2]。HVKP也可引起健康人群肝脓肿伴远处播散, 如眼内炎、坏死性筋膜炎、中枢神经系统感染等, 称为侵袭综合征[2-3]。此后, HVKP的报道在全球范围逐渐增多, 早诊断、早治疗可改善其感染的预后, 然而目前仍然缺乏确切的分子诊断标准和特异性分子标志物(不同文献之间所述标准不一), 对人类健康造成严重威胁。本研究对分离自本院的25株HVKP与28株普通肺炎克雷伯菌(classic Klebsiella pneumoniae, cKP)血清型和毒力基因分布特点进行比较分析, 探索HVKP的分子标志物, 期望对该病的分子诊断提供数据。
1 研究对象与方法 1.1 对象从复旦大学附属华山医院(2009―2018年)住院患者中, 根据临床病史和病原学检查结果, 筛选出侵袭综合征KP阳性患者(表 1), 从本院保存的菌库中获得相应的非重复KP菌株共25株, 将其视为HVKP组; 从菌库中随机抽取血流感染的KP菌株, 并根据病史剔除有合并其他侵袭性感染的菌株, 最终得到28株, 将其视为cKP组。
| 菌株编号 | 菌株来源 | 侵袭综合征表现 |
| KP1 | 血 | 肝脓肿、化脓性腰椎间盘感染、菌血症 |
| KP2 | 血 | 肝脓肿、眼内炎、肺脓肿、菌血症 |
| KP3 | 血 | 肝脓肿、肺脓肿、泌尿系感染、菌血症 |
| KP4 | 脓液 | 肝脓肿、肺脓肿 |
| KP5 | 血 | 肝脓肿、皮肤软组织感染、肺部感染、菌血症 |
| KP6 | 血 | 肝脓肿、肺脓肿、菌血症 |
| KP7 | 脓液 | 肝脓肿、肺脓肿 |
| KP8 | 脓液 | 肝脓肿、肺脓肿 |
| KP9 | 脓液 | 肝脓肿、脑脓肿、肺部感染 |
| KP10 | 脓液 | 肝脓肿、肛周脓肿 |
| KP11 | 脓液 | 肝脓肿、皮肤软组织感染 |
| KP12 | 血 | 肝脓肿、腰大肌脓肿、菌血症 |
| KP13 | 血 | 肝脓肿、眼内炎、菌血症 |
| KP14 | 血 | 肝脓肿、皮肤软组织感染、菌血症 |
| KP15 | 血 | 肝脓肿、眼内炎、菌血症 |
| KP16 | 血 | 肝脓肿、眼内炎、肺部感染、菌血症 |
| KP17 | 脓液 | 肝脓肿、中枢神经系统感染 |
| KP18 | 血 | 肝脓肿、中枢神经系统感染、菌血症 |
| KP19 | 脓液 | 肝脓肿、脑脓肿 |
| KP20 | 血 | 肝脓肿、眼内炎、肺部感染、菌血症 |
| KP21 | 血 | 肝脓肿、眼内炎、菌血症 |
| KP22 | 血 | 肝脓肿、肺脓肿、菌血症 |
| KP23 | 血 | 肝脓肿、皮肤软组织感染、肺部感染 |
| KP24 | 血 | 颈部蜂窝织炎、化脓性椎间盘感染、菌血症 |
| KP25 | 血 | 皮肤软组织感染、菌血症 |
本研究关于HVKP组和cKP组的划分主要通过临床定义。据文献报道, HVKP引起的侵袭综合征主要表现为肝脓肿合并肝外侵袭性感染, 如眼内炎、坏死性筋膜炎、中枢神经系统感染等[3]。
血清型主要包括K1、K2、K5、K20、K54和K57[4-6]; 毒力基因包括[6-9]:①荚膜多糖合成和合成调控相关基因[10-11] wcaG和rmpA、rmpA2、magA; ②菌毛合成相关基因[12] fimH、mrkD; ③脂多糖相关基因[13] uge、wabG; ④铁摄取系统相关基因[14] aero、iucB、iutA、iroNB、ybtA、kfuBC; ⑤尿素酶相关基因[10] ureA、allS。
1.2 方法菌株进行复苏和培养, 采用Tiangen TIANamp Bacteria DNA Kit提取菌株DNA。血清型和毒力基因的引物序列参照文献(表 2、表 3), 由生工生物工程(上海)股份有限公司合成。PCR体系20 μL: 1 μL DNA模板、0.5 μL引物R、0.5 μL引物F、10 μL Premix Taq (TaKaRa Premix Taq Version 2.0)、8 μL ddH2O。PCR条件:预变性95 ℃ 3 min; 变性95 ℃ 30 s, 退火(温度见表 2、3) 30 s, 延伸72 ℃ 1 min, 30个循环; 72 ℃维持10 min。PCR产物在1%浓度琼脂糖凝胶中电泳(电压120 V, 时间30 min), 经紫外成像仪拍照保存。
| Serotype | Sequence (5′-3′) | bp | Annealing(℃) | |
| K1[10] | K1-F | GGTGCTCTTTACATCATTGC | 1 283 | 58 |
| K1-R | GCAATGGCCATTTGCGTTAG | |||
| K2[10] | K2-F | GACCCGATATTCATACTTGACAGAG | 641 | 58 |
| K2-R | CCTGAAGTAAAATCGTAAATAGATGGC | |||
| K5[10] | K5-F | TGGTAGTGATGCTCGCGA | 280 | 58 |
| K5-R | CCTGAACCCACCCCAATC | |||
| K20[10] | K20-F | CGGTGCTACAGTGCATCATT | 741 | 58 |
| K20-R | GTTATACGATGCTCAGTCGC | |||
| K54[10] | K54-F | CATTAGCTCAGTGGTTGGCT | 881 | 58 |
| K54-R | GCTTGACAAACACCATAGCAG | |||
| K57[10] | K57-F | CCAGTAATCAGTCCAGAAACAACC | 1037 | 58 |
| K57-R | TAGCTTTTTTCATTCTTGTGTTTGTT |
| Virulence genes | Sequence(5′-3′) | bp | Annealing(℃) | |
| rmpA[15] | rmpA-F | ACTGGGCTACCTCTGCTTC | 516 | 58 |
| rmpA-R | CTTGCATGAGCCATCTTTCA | |||
| rmpA2[15] | rmpA2-F | TGTGCAATAAGGATGTTACATTAGT | 535 | 58 |
| rmpA2-R | TTTGATGTGCACCATTTTTCA | |||
| aero[15] | aero-F | GCATAGGCGGATACGAACAT | 556 | 49 |
| aero-R | CACAGGGCAATTGCTTACCT | |||
| wcaG[16] | wcaG-F | GGTTGGKTCAGCAATCGTA | 169 | 49 |
| wcaG-R | ACTATTCCGCCAACTTTTGC | |||
| allS[16] | allS-F | CCGAAACATTACGCACCTTT | 508 | 49 |
| allS-R | ATCACGAAGAGCCAGGTCAC | |||
| fimH[16] | fimH-F | TGCTGCTGGGCTGGTCGATG | 688 | 49 |
| fimH-R | GGGAGGGTGACGGTGACATC | |||
| uge[16] | uge-F | TCTTCACGCCTTCCTTCACT | 543 | 49 |
| uge-R | GATCATCCGGTCTCCCTGTA | |||
| wabG[16] | wabG-F | ACCATCGGCCATTTGATAGA | 683 | 49 |
| wabG-R | CGGACTGGCAGATCCATATC | |||
| ureA[16] | urea-F | GCTGACTTAAGAGAACOTTATG | 337 | 55 |
| urea-R | GATCATGGCGCTACCTCA | |||
| iutA[16] | iutA-F | GGCTGGACATCATGGGAACTGG | 300 | 55 |
| iutA-R | CGTCGGGAACGGGTAGAATCG | |||
| iroNB[16] | iroNB-F | GGCTACTGATACTTGACTATTC | 992 | 50 |
| iroNB-R | CAGGATACAATAGCCCATAG | |||
| ybtA[16] | ybtA-F | ATGACGGAGTCACCGCAAAC | 960 | 55 |
| ybtA-R | TTACATCACGCGTTTAAAGG | |||
| kfuBC[16] | kfuBC-F | GAAGTGACGCTGTTTCTGGC | 797 | 55 |
| kfuBC-R | TTTCGTGTGGCCAGTGACTC | |||
| mrkD[16] | mrkD-F | TTCTGCACAGCGGTCCC | 240 | 49 |
| mrkD-R | GATACCCGGCGTTTTCGTTAC |
应用SPSS 20.0进行统计学分析。分类变量用卡方检验做比较。对2组之间有显著差异的分子标志物分别计算其灵敏度、特异度、准确度和约登指数。应用二元Logistic回归(向后:LR)对分子标志物进行多因素分析, P<0.05为有统计学差异。
2 结果 2.1 HVKP组中最常见的血清型为K1型HVKP组(25株)中最常见的血清型为K1型, 占60% (15/25);另外还检测到K2和K20各2株, 未测到血清型K5、K54和K57。HVKP组与cKP组相比, 血清型K1有统计学差异(χ2=9.983, P<0.05), K2和K20虽然在统计学上无差异, 但这2种血清型只在HVKP组中测到(表 4)。
| Serotype | HVKP (n=25) |
cKP (n=28) |
χ2 | P |
| K1 | 15(60.00%) | 5(17.86%) | 9.983 | 0.002 |
| K2 | 2(8.00%) | 0 | - | 0.218 |
| K5 | 0 | 0 | - | - |
| K20 | 2(8.00%) | 0 | - | 0.218 |
| K54 | 0 | 0 | - | - |
| K57 | 0 | 0 | - | - |
HVKP组中毒力基因阳性率最高的前3种为uge、fimH和wabG, 分别占100%、96%和92%。与cKP组相比, 毒力基因有统计学差异的是rmpA2 (χ2=6.335, P=0.012)、magA (χ2=9.983, P=0.002)、fimH (χ2=9.389, P=0.002)、aero(χ2=6.692, P=0.010)、iutA(χ2=23.645, P=0.000)、kfuBC(χ2=14.018, P=0.000)。其他基因虽然在统计学上无差异, 但在HVKP组中基因的阳性率基本都高于cKP组。如果增大样本量, 可能会得到不同的结果(表 5)。
| Virulence genes | HVKP (n=25) |
cKP (n=28) |
χ2 | P |
| rmpA | 15(60.00%) | 13(46.43%) | 0.976 | 0.323 |
| rmpA2 | 20(80.00%) | 13(46.43%) | 6.335 | 0.012 |
| magA | 15(60.00%) | 5(17.86%) | 9.983 | 0.002 |
| wcaG | 9(36.00%) | 7(25.00%) | 0.758 | 0.384 |
| fimH | 24(96.00%) | 17(60.71%) | 9.389 | 0.002 |
| mrkD | 18(72.00%) | 16(57.14%) | 1.268 | 0.260 |
| uge | 25(100%) | 23(82.14%) | 3.061 | 0.080 |
| wabG | 23(92.00%) | 23(82.14%) | 0.425 | 0.515 |
| aero | 16(64.00%) | 8(28.57%) | 6.691 | 0.010 |
| iutA | 18(72.00%) | 2(7.14%) | 23.645 | 0.000 |
| iroNB | 4(16.00%) | 0 | 2.824 | 0.093 |
| ybtA | 23(92.00%) | 21(75.00%) | 1.636 | 0.201 |
| kfuBC | 20(80.00%) | 8(28.57%) | 14.018 | 0.000 |
| ureA | 22(88.00%) | 26(92.86%) | 0.018 | 0.894 |
| allS | 9(36.00%) | 6(21.43%) | 1.382 | 0.240 |
对HVKP与cKP组之间有显著差异的分子标志物, 分别计算其灵敏度、特异度、准确度和约登指数。根据约登指数将标志物的诊断效能由高到低排列:iutA>kfuBC>magA(K1)>aero>fimH>rmpA2。经多因素Logistic回归分析, 发现iutA在HVKP与cKP组之间有统计学差异(P=0.002), 见表 6、表 7和图 1。
| Molecular markers | Accuracy(%) | Sensitivity(%) | Specificity(%) | Yoden index | OR(95% CI) |
| K1 | 71.7 | 60.0 | 82.1 | 0.421 | 6.900(1.967, 24.209) |
| rmpA2 | 66.0 | 80.0 | 53.6 | 0.336 | 4.615(1.350, 15.784) |
| magA | 71.7 | 60.0 | 82.1 | 0.421 | 6.900(1.967, 24.209) |
| fimH | 66.0 | 96.0 | 39.3 | 0.353 | 15.529(1.828, 131.902) |
| aero | 67.9 | 64.0 | 71.4 | 0.354 | 4.444(1.397, 14.138) |
| iutA | 52.8 | 72.0 | 92.9 | 0.649 | 33.429(6.215, 179.805) |
| kfuBC | 75.5 | 80.0 | 71.4 | 0.514 | 10.000(2.787, 35.885) |
| Molecular markers | B | S.E. | Wals | P | Exp(B) | 95% CI |
| K1 | 1.045 | 1.115 | 0.879 | 0.349 | 2.844 | 0.320, 25.282 |
| rmpA2 | -1.569 | 1.144 | 1.882 | 0.170 | 0.208 | 0.022, 1.960 |
| aero | -1.582 | 1.248 | 1.609 | 0.205 | 0.205 | 0.018, 2.370 |
| fimH | 2.067 | 1.272 | 2.644 | 0.104 | 7.900 | 0.654, 95.439 |
| iutA | 4.377 | 1.432 | 9.340 | 0.002 | 79.623 | 4.807, 1 318.947 |
| kfuBC | 0.473 | 1.075 | 0.194 | 0.660 | 1.605 | 0.195, 13.192 |
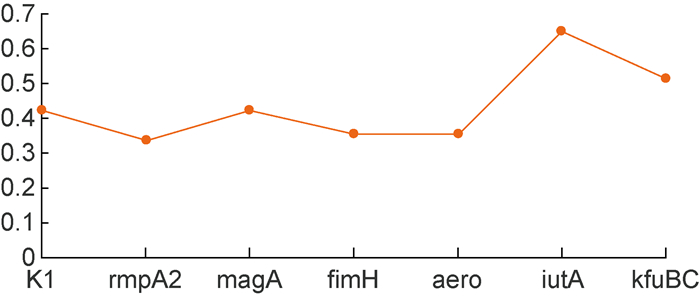
|
| 图 1 HVKP分子标志物约登指数 Fig. 1 Yoden index of molecular markers in HVKP |
目前, 关于HVKP的分子标志物相关报道不多。本研究将侵袭综合征患者中分离的菌株视为HVKP, 单纯血流感染患者中分离的菌株视为cKP, 通过对既往所报道的KP血清型和毒力基因分别在HVKP组和cKP组中进行检测和比较, 筛选HVKP的分子标志物, 并评估其效能。
荚膜多糖是KP重要的毒力因子, 主要通过抗巨噬细胞吞噬作用、抑制早期炎症反应、抵抗抗菌肽和抑制树突细胞成熟帮助细菌免疫逃逸[6]。在目前发现的82种荚膜血清型中HVKP主要为K1、K2、K5、K20、K54和K57型[6-7, 16]。其中K1和K2型在亚洲地区常见[5-6], 血清型K1是亚洲地区最常见的血清型(21.7%), 在北美、欧洲和澳大利亚不常见[16]。研究表明K1型与侵袭综合征密切相关, K2型菌株毒力一般低于K1型。本研究中HVKP组K1型占60.00%, cKP组K1型占17.86%, 两者之间有统计学差异(χ2 =9.983, P=0.002)。除此之外, HVKP组中还检测到K2和K20型各2株, 虽然与cKP组之间无统计学差异, 这可能与样本量较小有关。本研究和既往研究结果较相符, 均表明K1型是HVKP最常见的血清型。
荚膜多糖K1型主要的调控基因是magA[17]。研究发现magA只存在于K1型KP菌株中, 而K1型被认为是HVKP的主要血清型[18]。magA与高黏力表型密切相关, 且该基因阳性的菌株往往在小鼠实验中表现出较高的毒力[19]。rmpA、rmpA2是荚膜多糖合成相关的转录调控因子基因, 可调控多种血清型合成, 形成高黏力表型[6, 20]。一般认为K1、K2型KP菌株高黏力表型多见, 其荚膜多糖合成调控基因rmpA和rmpA2阳性率也往往较高[5]。
本研究中HVKP组magA和rmpA2基因分别占60.00%和80.00%, 与cKP组之间有统计学差异, 可作为HVKP的重要分子标志物, 与其他研究结果一致[5]。然而, rmpA在HVKP组阳性率为60.00%, 在cKP组阳性率为46.43%, 虽然HVKP组阳性率高于cKP组, 但是在统计学上无差异, 与大部分文献报道不符。这可能是因为样本量太小, 若能增大样本量, 其更有说服力。但也有一些研究报道, 部分菌株rmpA、rmpA2均阳性却没有高黏力表现, 而且为低毒力, 可能与基因突变有关。
菌毛有助于细菌定植, 形成生物膜, T1P和T3P是KP的主要菌毛[6]。T1P由FimA和FimH组成, 可介导细菌与宿主细胞上含甘露糖的受体结合, 使细菌定植于泌尿生殖道、呼吸道、肠道等[6, 21]。T3P由MrkA和MrkD组成, 主要黏附于内皮细胞、呼吸道和尿路的上皮细胞[6]。本研究中, fimH在HVKP组中阳性率为96.00%, 在cKP组中阳性率为60.71%, 有统计学差异(χ2=9.389, P=0.002);而mrkD在HVKP组中阳性率为72.00%, 在cKP组中阳性率为57.14%, 无统计学差异(χ2=1.268, P=0.260)。虽然两者在HVKP和cKP组中阳性率均不低, 但是fimH比mrkD的特异性更强, 故fimH提示为HVKP的可能性更大。
铁对于细菌新陈代谢至关重要, 铁摄取系统是细菌重要的毒力分子机制。研究表明kfuBC编码铁摄取系统, 是KP重要的毒力因子[9, 20], 在K1、K2血清型的HVKP中多见[22]。本研究中kfuBC在HVKP组中阳性率为80.00%, 在cKP组中占28.57%, 两者差异较大(χ2=14.018, P=0.000), kfuBC可成为HVKP的分子标志物。
KP有4种铁载体——enterbactin、aerobactin、yersiniabactin和salmochelin, 其中enterbactin和aerobactin最为常见。有研究认为aerobactin是KP重要的毒力因子, 可使毒力增加100倍[6], 是HVKP常见的铁载体。它由aero编码合成, 而iutA则编码aerobactin的转运体, 转运螯合体进入细胞[23-24]。本研究中aero在HVKP组中阳性率为64.00%, 在cKP组中阳性率为28. 57%, 两者之间有统计学差异(χ2=6.691, P=0.010), 提示aero可作为HVKP分子标志物, 与既往文献报道相符。王等研究发现引起肝脓肿的毒力较高的KP菌株中aero阳性率超过90%[1]。小鼠实验发现, 低毒力、铁载体阴性的KP菌株经基因编辑插入aero后毒力明显增强, 而敲除aero的KP突变体毒力和侵袭性明显下降。这些研究都提示aero对KP毒力十分重要, aero阳性可在很大程度上提示高毒力[1, 25]。本研究中iutA基因在HVKP组中占72.00%, 而在cKP组中仅占7.14%, 同样差异明显(χ2=23.645, P=0.000), 说明iutA可作为HVKP的分子标志物。
铁载体中yersiniabactin在HVKP中可高达90%, 其转运体主要由ybtA编码; enterbactin经c-葡萄糖基修饰后成为salmochelin, 而iroNB是它的修饰基因。在本研究中yersiniabactin相关的ybtA基因在HVKP组的阳性率(92.00%)高于在cKP组的阳性率(75.00%), 但无统计学差异; enterbactin相关的iroNB基因在HVKP组的阳性率为16.00%, 而在cKP中未检测到, 可能该毒力基因与HVKP的高毒力有关, 但由于样本量较小, 在统计学上无差异。所以, 本研究中暂认为ybtA和iroNB基因不适合作为HVKP的分子标志物。
毒力基因wcaG与荚膜多糖合成相关, 编码合成细菌荚膜中岩藻糖成分, 有助于逃逸巨噬细胞的吞噬作用[10]。但本研究中wcaG基因在2组的阳性率均不高, 在HVKP组占36.00%, 在cKP组占25.00%, 故认为wcaG可能不适合作为HVKP的分子标志物。
脂多糖由O抗原、核心多糖和脂质组成, 是KP重要的毒力因素[6]。wabG是脂多糖核心多糖的合成酶基因之一, uge是UDP-半乳糖醛酸酯异构酶编码基因, 与脂多糖合成相关。本研究结果显示, wabG在HVKP组中占92.00%, 在cKP组中占82.14%, uge在HVKP组中阳性率为100%, 在cKP组中为82.14%, 两者阳性率均较高, 且无明显差异, 不适合作为HVKP的特异性分子标志物。
尿素酶催化尿素分解为氨和二氧化碳, 为细菌生长提供氮源[6]。基因簇ureABCDEFG编码尿素酶, 其中ureA、ureB和ureC是其主要的结构亚基[26]。allS编码尿囊素调节子激活剂, 同时也与铁载体aerobactin生成相关[10, 26]。本研究中ureA阳性率在HVKP组(88.00%)和cKP组(92.86%)差异不大(χ2=0.018, P=0.894);基因allS的阳性率不高, 在HVKP组(36.00%)中阳性率高于cKP组(21.43%), 但是无统计学差异(χ2=1.382, P=0.240)。ureA和allS基因不适合作为HVKP的分子标志物。
本研究存在的一些不足之处:①样本量较小, 若扩大样本量, 结论可能会发生改变。比如部分试验数据表明一些毒力基因和血清型阳性率在HVKP组中高于cKP组, 但在统计学上无显著差异, 若能增大样本量, 可能会得到不同的结果。②HVKP为临床定义, 即为引起侵袭综合征的KP菌株, 未通过动物实验对其高毒力进行验证, 研究缺乏足够的严谨性。③虽然本文在选择cKP菌株时对临床病例资料进行了筛选, 只选择单纯血流感染的病例, 剔除合并其他部位侵袭性感染的病例, 减少了混入HVKP组的风险, 但并不能完全将其笼统地归为cKP组。
| [1] |
王京.引起肝脓肿的肺炎克雷伯菌毒力基因分析与分子流行特征研究[D].北京: 解放军医学院, 2013. [CNKI]
|
| [2] |
Liu YC, Cheng DL, Lin CL. Klebsiella pneumoniae liver abscess associated with septic endophthalmitis[J]. Arch Intern Med, 1986, 146(10): 1913-1916.
[DOI]
|
| [3] |
Siu LK, Yeh KM, Lin JC, Fung CP, Chang FY. Klebsiella pneumoniae liver abscess: a new invasive syndrome[J]. Lancet Infect Dis, 2012, 12(11): 881-887.
[DOI]
|
| [4] |
Lee A, Mao W, Warren MS, Mistry A, Hoshino K, Okumura R, Ishida H, Lomovskaya O. Interplay between efflux pumps may provide either additive or multiplicative effects on drug resistance[J]. J Bacteriol, 2000, 182(11): 3142-3150.
[DOI]
|
| [5] |
Yu WL, Ko WC, Cheng KC, Lee CC, Lai CC, Chuang YC. Comparison of prevalence of virulence factors for Klebsiella pneumoniae liver abscesses between isolates with capsular K1/K2 and non-K1/K2 serotypes[J]. Diagn Microbiol Infect Dis, 2008, 62(1): 1-6.
[DOI]
|
| [6] |
徐水宝, 金嘉琳. 高毒力肺炎克雷伯菌的分子致病机制[J]. 微生物与感染, 2017, 12(5): 320-326. [DOI]
|
| [7] |
王丽凤, 沈定霞. 高毒力肺炎克雷伯菌的致病机制研究进展[J]. 中华微生物学和免疫学杂志, 2016, 36(6): 468-471. [DOI]
|
| [8] |
Clegg S, Murphy CN. Epidemiology and virulence of Klebsiella pneumoniae[J]. Microbiol Spectr, 2016.
[DOI]
|
| [9] |
Li B, Zhao Y, Liu C, Chen Z, Zhou D. Molecular pathogenesis of Klebsiella pneumoniae[J]. Future Microbiol, 2014, 9(9): 1071-1081.
[DOI]
|
| [10] |
Turton JF, Perry C, Elgohari S, Hampton CV. PCR characterization and typing of Klebsiella pneumoniae using capsular type-specific, variable number tandem repeat and virulence gene targets[J]. J Med Microbiol, 2010, 59(Pt 5): 541-547.
[URI]
|
| [11] |
Brisse S, Fevre C, Passet V, Issenhuth-Jeanjean S, Tournebize R, Diancourt L, Grimont P. Virulent clones of Klebsiella pneumoniae: identification and evolutionary scenario based on genomic and phenotypic characterization[J]. PLoS One, 2009, 4(3): e4982.
[DOI]
|
| [12] |
Gerlach GF, Clegg S, Allen BL. Identification and characterization of the genes encoding the type 3 and type 1 fimbrial adhesins of Klebsiella pneumoniae[J]. J Bacteriol, 1989, 171(3): 1262-1270.
[DOI]
|
| [13] |
Izquierdo L, Coderch N, Piqué N, Bedini E, Corsaro MM, Merino S, Fresno S, Tomás JM, Regué M. The Klebsiella pneumoniae wabG gene: role in biosynthesis of the core lipopolysaccharide and virulence[J]. J Bacteriol, 2003, 185(24): 7213-7221.
[DOI]
|
| [14] |
Hsieh PF, Lin TL, Lee CZ, Tsai SF, Wang JT. Serum-induced iron-acquisition systems and TonB contribute to virulence in Klebsiella pneumoniae causing primary pyogenic liver abscess[J]. J Infect Dis, 2008, 197(12): 1717-1727.
[DOI]
|
| [15] |
Fang CT, Lai SY, Yi WC, Hsueh PR, Liu KL, Chang SC. Klebsiella pneumoniae genotype K1: an emerging pathogen that causes septic ocular or central nervous system complications from pyogenic liver abscess[J]. Clin Infect Dis, 2007, 45(3): 284-293.
[DOI]
|
| [16] |
和晋渝.肺炎克雷伯菌的血清分型及毒力基因分布的研究[D].重庆: 重庆医科大学, 2012. [CNKI]
|
| [17] |
Fang CT, Lai SY, Yi WC, Hsueh PR, Liu KL. The Function of wzy_K1 (magA), the serotype Kl polymerase gene in Klebsiella pneumoniae cps gene cluster[J]. J Infect Dis, 2010, 201(8): 1268-1269.
[DOI]
|
| [18] |
Chuang YP, Fang CT, Lai SY, Chang SC, Wang JT. Genetic determinants of capsular serotype K1 of Klebsiella pneumoniae causing primary pyogenic liver abscess[J]. J Infect Dis, 2006, 193(5): 645-654.
[DOI]
|
| [19] |
Fang CT, Chuang YP, Shun CT, Chang SC, Wang JT. A novel virulence gene in Klebsiella pneumoniae strains causing primary liver abscess and septic metastatic complications[J]. J Exp Med, 2004, 199(5): 697-705.
[DOI]
|
| [20] |
叶李铭, 麦丽婷, 黄静. 高毒力肺炎克雷伯杆菌的临床特征和高毒力机制[J]. 国际呼吸杂志, 2017, 37(3): 221-226. [DOI]
|
| [21] |
Sebghati TA, Korhonen TK, Hornick DB, Clegg S. Characterization of the type 3 fimbrial adhesins of Klebsiella strains[J]. Infect Immun, 1998, 66(6): 2887-2894.
[URI]
|
| [22] |
Chen Z, Liu M, Cui Y, Wang L, Zhang Y, Qiu J, Yang R, Liu C, Zhou D. A novel PCR-based genotyping scheme for clinical Klebsiella pneumoniae[J]. Future Microbiol, 2014, 9(1): 21-32.
[DOI]
|
| [23] |
Guo Y, Wang S, Zhan L, Jin Y, Duan J, Hao Z, Lv J, Qi X, Chen L, Kreiswirth BN, Wang L, Yu F. Microbiological and clinical characteristics of hypermucoviscous Klebsiella pneumoniae isolates associated with invasive infections in China[J]. Front Cell Infect Microbiol, 2017, 7: 24.
[DOI]
|
| [24] |
Russo TA, Olson R, MacDonald U, Beanan J, Davidson BA. Aerobactin, but not yersiniabactin, salmochelin, or enterobactin, enables the growth/survival of hypervirulent (hypermucoviscous) Klebsiella pneumoniae ex vivo and in vivo[J]. Infect Immun, 2015, 83(8): 3325-3333.
[DOI]
|
| [25] |
Rahimian J, Wilson T, Oram V, Holzman RS. Pyogenic liver abscess: recent trends in etiology and mortality[J]. Clin Infect Dis, 2004, 39(11): 1654-1659.
[DOI]
|
| [26] |
Paczosa MK, Mecsas J. Klebsiella pneumoniae: going on the offense with a strong defense[J]. Microbiol Mol Biol Rev, 2016, 80(3): 629-661.
[DOI]
|
 2019, Vol. 14
2019, Vol. 14


