随着我国人口老龄化,带状疱疹发病率越来越高,对于带状疱疹疫苗的需求也越来越迫切。我国多家企业研发的减毒活疫苗已经进入临床研究阶段,但其保护率较为低下,迫切需要新型带状疱疹疫苗的研发。本文就水痘-带状疱疹病毒、带状疱疹的发病机制和疫苗研发情况进行综述。
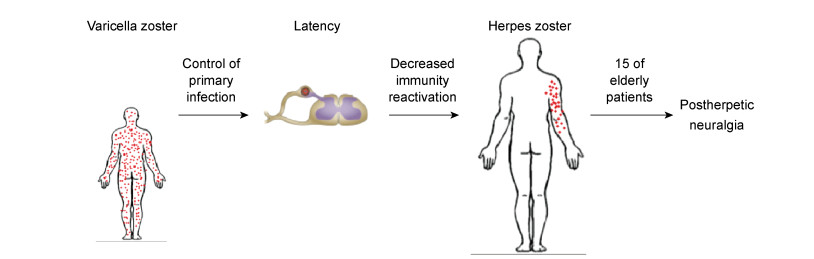
1 概述水痘-带状疱疹病毒(varicella zoster virus,VZV)属疱疹病毒亚科,即人疱疹病毒3型,是双链DNA病毒,病毒颗粒150~200nm,病毒糖蛋白E(gE)是宿主免疫系统识别的最主要糖蛋白[1]。VZV的初次感染一般发生在幼儿期,以水痘为其主要临床表现,见图 1。该病毒有极高的自然感染率,据报道全世界>50岁人群中约99%的血清VZV呈阳性反应[2]。病毒感染人体后潜伏于机体神经节的神经元内,呈隐匿性感染。当机体免疫力下降时,病毒再次活化并大量复制,可在周围感觉神经及该神经所支配的单侧皮节发生免疫反应,引起以红斑、簇集分布的水疱以及神经痛为主要特征的带状疱疹[3-4]。
|
| 图 1 水痘-带状疱疹病毒感染的不同阶段 Fig. 1 Different phases of varicella zoster virus infection |
带状疱疹发病率在世界范围内有逐年升高趋势,在北美,发病率增长了3~5倍[5],全人群发病率达到25%~30%[6];带状疱疹发病率有随个体年龄增加而升高的趋势。有报道显示,在欧洲每1 000人发病率约为2.0~4.6人,年龄<10岁的儿童每1 000人发病率约为1人,年龄≥50岁者发病率每1 000人约为7~8人,年龄≥80岁的老年人发病率每1 000人达到10人[7]。有报道显示中国发病率与欧美国家相似,发病率也随个体年龄增加而升高,年龄≥50岁者发病率约每1 000人为2.66人,年龄≥80岁的老年人发病率达到每1 000人为8.55人[8]。
带状疱疹后遗神经痛(postherpetic neuralgia,PHN)为带状疱疹的临床症状中最复杂且最常见的一种不良并发症,表现为烧灼样疼痛或是电击样痛,部分患者还会出现瘙痒性疼痛,以持续性疼痛、跳痛为主,甚至还伴有痛觉过敏或是异常性疼痛,在身体、心理、功能和社交等方面严重影响患者的生活质量[9]。对PHN目前还没有统一定义,传统的定义为皮疹发作后90 d疼痛仍在持续,现有人认为应为确定皮疹发作后1~6个月不等[10]。由于缺乏共识,PHN的发病率为5%~30%, 但是,当患者年龄>85岁时,发病率可达50%[11-13]。
2 带状疱疹的发病机制当机体免疫力下降,如年龄增大、HIV感染和患有慢性肾病等疾病时,带状疱疹的发病率显著上升。其发病机制目前未完全清楚,但有学者提出,与体内细胞免疫应答的关系十分密切[14]。因为人是VZV的唯一宿主,这给相关机制研究带来很大难度。Haberthur等通过猿猴水痘病毒(simian varicella virus,SVV)感染恒河猴,建立动物模型,以此评价CD4+ T细胞、CD8+ T细胞和B细胞在疾病发生中的功能。结果显示,当去除恒河猴CD8 T细胞时, 病毒载量轻微上升;而当去除恒河猴CD4+ T细胞时, 病毒载量大幅上升,并引起播散性水痘,且CD8+ T细胞反应和抗体水平也有明显下降[15]。提示CD4+ T细胞在控制带状疱疹中起至关重要的作用。
Xing等研究了急性带状疱疹和PHN患者淋巴细胞的功能,这些患者中CD4+ T细胞和CD4+ T/CD8+ T细胞比例相比正常人明显下降,且病情严重者的CD4+ T细胞较中、轻度患者有显著下降;患者的调节性T细胞(regulatory T cells,Treg细胞)或CD4+ CD25+ FoxP3+ T细胞的比例比正常人明显升高,且严重患者升高的比例明显高于中、轻度患者。提示,Treg细胞的上升抑制了病毒特异性CD4+ T细胞发挥的抗病毒功能[16]。
在类风湿性关节炎(rheumatoid arthritis,RA)患者中带状疱疹的发病率明显上升。Krasselt等研究RA患者VZV体液免疫应答,即VZV抗体效价与疾病的关系。结果显示,RA患者中,VZV抗体效价明显低于正常对照者;当患者年龄>60岁时,抗体效价下降幅度更加明显。该研究提示体液免疫可能与疾病的控制有一定的相关性,在疫苗研发中应考虑能否诱导机体的体液免疫应答[17]。
当免疫力下降时,CD4+ T细胞水平降低,隐匿性感染的VZV复发,病毒大量复制,导致患者的皮肤出现皮疹,引发炎症反应;外周神经亦可出现炎症,相对应的感觉神经也出现炎症及出血性坏死现象,严重时还出现神经元的受损或坏死。患者的严重炎症浸润在被治愈过程中出现永久性的病理改变(外周神经重塑性改变),最终出现与损伤前不一样的外周神经功能的非正常愈合,使得PHN疼痛持续存在[17]。
有研究表明,中枢神经的病变也可引起难以根治的PHN,导致病程迁延。Ji等发现脊髓胶质细胞异常激活引发的炎症反应参与了神经病理性疼痛的发生[18]。Zhang等建立了PHN的大鼠模型,感染病毒后脊髓星形胶质细胞明显激活。鞘内注射L-α-氨基己二酸(星形胶质细胞特异抑制剂),可明显减弱机械性异常疼痛,而米诺环素(小胶质细胞特异抑制剂)则无效,表明是脊髓星形胶质细胞而非小胶质细胞对PHN大鼠的慢性疼痛有促进作用[19]。中枢神经的电生理改变也是发生PHN的原因之一,VZV复制导致中枢疼痛传导神经元与粗传入纤维(非感觉伤害)之间形成新突触联系。当机体外周神经遭受损伤时,脊髓、外周神经发生生理、生化改变,包括肽类物质生成、增多等,产生自发性放电,引起疼痛[20-21]。
3 疫苗的研发接种疫苗是控制水痘有效和可靠的预防手段。日本大阪大学Takahashi等在1974年成功研发了水痘减毒Oka株,即为现在国内外上市的疫苗。该水痘疫苗为冻干减毒活疫苗,由生产用毒种接种人二倍体细胞,培养、收获病毒,加入冻干保护剂后而制成。冻干水痘减毒活疫苗标准为每剂病毒量不少于2 000 PFU,能诱导一定的中和抗体。此疫苗具有良好的保护效果,单剂水痘疫苗接种,其水痘预防有效率为80%~85%,重症水痘预防有效率为95%[22-23]。
老年人和免疫缺陷患者预防接种疫苗是防治带状疱疹的主要策略。2006年美国食品药品监督管理局(Food and Drug Administration,FDA)批准上市的第1个带状疱疹疫苗Zostavax,同样为Oka减毒株。工艺同水痘减毒活疫苗类似,其标准为每剂病毒量19 400 PFU,是水痘减毒活疫苗的10倍。高滴度的病毒量能诱导一定程度的病毒特异性T细胞免疫反应。Ⅲ期临床结果显示,该疫苗在>60岁人群中能降低51%的带状疱疹发病率,减少61%的疼痛压力,降低67%的PHN[24]。但是,该疫苗的保护率随年龄增长而显著下降,在60~69岁人群中,抗带状疱疹的整体保护率约为64%,而在>70岁的人群中,保护率下降到38%[25]。
2017年美国FDA批准新上市的带状疱疹疫苗Shingrix,是美国葛兰素史克公司(GSK)研发的新型重组蛋白疫苗,含有中国仓鼠卵巢细胞(Chinese hamster ovary cell,CHO细胞)表达的gE糖蛋白和新型佐剂AS01B。Ⅲ期临床试验结果显示该疫苗的整体有效性为97.2%,在50~59岁人群中保护率为96.6%,对60~69岁的人群保护率为97.4%,而在≥70岁人群中保护率也能达到97.9%,且保护率持续3年而不下降[26-27]。在评价该疫苗的安全性和有效性的Ⅰ/Ⅱ期临床试验中,研究者同时用gE/AS01B和104 PFU的VZV减毒活疫苗(模仿Zostavax)进行接种。结果显示,在体液免疫反应中,相比VZV减毒活疫苗gE/AS01B诱导出更高的抗gE和抗VZV抗体水平;在细胞免疫评价中,胞内因子染色分析2种细胞因子以上的VZV特异性CD4+ T细胞水平,显示gE/AS01B诱导出明显高于VZV减毒活疫苗的VZV特异性CD4+ T细胞水平,但未能诱导出CD8+ T细胞[28]。在另外2篇Ⅱ期临床试验报道中[29-30],>70岁接受gE/AS01B的受试者在第3个月细胞免疫应答水平与其他年龄受试者相似,提示该疫苗在>70岁老年人有很好的效应。随访结果显示,长达6年后,受试者的gE/AS01B特异性CD4+ T细胞水平仍比接种前高3.8倍[31]。
除了上述2个已上市的疫苗外,其他正在研究的疫苗首选是重组蛋白疫苗。Jacquet等用CHO细胞表达的重组嵌合抗原gE-IE63免疫豚鼠,结果显示,能诱导出较强的体液免疫反应,免疫后血清能中和VZV;同时,淋巴细胞增殖实验显示细胞免疫应答也能被诱导[32]。另外,Zhu等以HBcAg作为载体,在其中插入VZV gE蛋白的表位肽(121~135位氨基酸),可自发形成病毒样颗粒。采用该病毒样颗粒免疫小鼠后亦能诱导产生一定效价的gE特异性抗体,且能中和VZV病毒[33]。
有研究者使用DNA疫苗来预防带状疱疹。Bao等将VZV gE蛋白基因插入pcDNA3.1,构建了DNA疫苗。免疫小鼠后能诱导产生抗原特异性的抗体反应,且能诱导细胞免疫反应[34]。Kim等用含有VZV的gE、IE(immediate early)63、IE62蛋白的质粒作为DNA疫苗免疫小鼠,能诱导出一定的VZV特异的细胞和体液免疫。而且该质粒含有IL-7和IL-33基因(作为内源性佐剂),能诱导更强的细胞和体液免疫[35]。
国内带状疱疹疫苗的研发基本集中在减毒活疫苗,上海生物制品研究所有限责任公司、长春祈健生物制品有限公司、长春百克生物科技股份公司、北京万泰生物药业股份有限公司等多家疫苗企业的带状疱疹减毒活疫苗均已进入Ⅰ/Ⅱ期临床试验(http://www.chinadrugtrials.org.cn/eap/main,国家药品监督管理局药物临床试验登记与信息公示平台)。而重组蛋白加佐剂疫苗国内暂无产品进入临床研究,基本都在临床前研究阶段。GSK的重组带状疱疹疫苗Shingrix有效性明显高于带状疱疹减毒活疫苗,且该疫苗已于2019年5月被有条件批准在中国上市,因此未来国内开发策略将会偏向于新型重组蛋白疫苗。
4 疫苗的应用美国默沙东公司带状疱疹减毒活疫苗(Zostavax)已经在欧盟、美国、加拿大和澳大利亚等52个国家得到批准,免疫程序为皮下接种1剂,应用于>50岁人群,该疫苗尚未在我国上市。
带状疱疹疫苗Shingrix已在美国、欧盟和日本等国家批准上市,免疫程序为2剂肌内注射。因该疫苗具有良好的保护效率,美国疾病控制和预防中心(Centers for Disease Control and Prevention,CDC)免疫实践顾问委员会(Advisory Committee on Immunization Practices,ACIP)发表了3条意见:①推荐Shingrix用于≥50岁免疫功能正常的老年人群体,预防带状疱疹及其相关并发症;②推荐Shingrix用于之前已接种美国默沙东公司生产的疫苗Zostavax且免疫功能正常的成人群体,预防带状疱疹及其相关并发症;③ Shingrix在预防带状疱疹及其相关并发症方面,优于Zostavax[36]。
为落实国务院常务会议精神,加快临床急需的境外已上市药品进口我国的注册,美国GSK公司研制的带状疱疹疫苗Shingrix于2018年11月入选首批临床急需境外新药名录。2019年5月22日,国家药品监督管理局有条件批准了重组带状疱疹疫苗的进口注册申请,用于≥50岁成人预防带状疱疹[37]。
关于上述2种上市疫苗的安全性,国内的对带状疱疹减毒活疫苗Zostavax(美国默沙东公司生产)安全性评价结果表明,在中年和老年人群中,安全性均良好,疫苗相关的不良反应及严重不良反应比较差异均无统计学意义[38]。为了监测可能出现的疫苗不良事件,专门成立了名为“反应性”独立监测组,以观察新型重组疫苗Shingrix的安全性。结果显示,所有研究参与者中,疫苗接种后30 d内记录到231例严重不良事件,其中疫苗组103例,安慰剂组128例。对不良事件进行评估,4起事件(疫苗组1起,安慰组3起)被认为与疫苗接种相关——低血压伴晕厥,单神经炎和神经性耳聋,肌肉、骨骼和胸部疼痛。平均随访3.5年,研究者或独立监测者均未发现与疫苗相关的重大安全问题[39]。
5 结语带状疱疹的发病机制尚未完全清楚,但有研究表明细胞免疫(特别是CD4 T细胞)可能是控制带状疱疹发病的关键因素。除了细胞免疫,体液免疫在一定程度上也能影响带状疱疹的发病。在今后疫苗研发中,要同时考虑体液免疫和细胞免疫两方面。美国GSK公司的带状疱疹疫苗Shingrix虽有很好的保护率,但该疫苗配方复杂,佐剂产能有限,从而导致疫苗供应不足,故有必要研发安全、有效,且配制简单的新型带状疱疹疫苗。
| [1] |
Kennedy PG. Varicella-zoster virus latency in human ganglia[J]. Rev Med Virol, 2002, 12(5): 327-334.
[DOI]
|
| [2] |
Kilgore PE, Kruszon-Moran D, Seward JF, Jumaan A, van Loon FP, Forghani B, McQuillan GM, Wharton M, Fehrs LJ, Cossen CK, Hadler SC. Varicella in Americans from NHANES Ⅲ: implications for control through routine immunization[J]. J Med Virol, 2003, 70(Suppl 1): S111-S118.
[URI]
|
| [3] |
Gilden D, Nagel M, Cohrs R, Mahalingam R, Baird N. Varicella zoster virus in the nervous system [J/OL]. F1000Res, 2015. https://f1000research.com/articles/4-1356/v1.
|
| [4] |
Gershon AA, Breuer J, Cohen JI, Cohrs RJ, Gershon MD, Gilden D, Grose C, Hambleton S, Kennedy PG, Oxman MN, Seward JF, Yamanishi K. Varicella zoster virus infection[J]. Nat Rev Dis Primers, 2015, 1: 15016.
[DOI]
|
| [5] |
Kawai K, Yawn BP, Wollan P, Harpaz R. Increasing incidence of herpes zoster over a 60-year period from a population-based study[J]. Clin Infect Dis, 2016, 63(2): 221-226.
[DOI]
|
| [6] |
Johnson RW, Alvarez-Pasquin MJ, Bijl M, Franco E, Gaillat J, Clara JG, Labetoulle M, Michel JP, Naldi L, Sanmarti LS, Weinke T. Herpes zoster epidemiology, management, and disease and economic burden in Europe: a multidisciplinary perspective[J]. Ther Adv Vaccines, 2015, 3(4): 109-120.
[DOI]
|
| [7] |
Pinchinat S, Cebrián-Cuenca AM, Bricout H, Johnson RW. Similar herpes zoster incidence across Europe: results from a systematic literature review[J]. BMC Infect Dis, 2013, 13: 170.
[DOI]
|
| [8] |
Li Y, An Z, Yin D, Liu Y, Huang Z, Xu J, Ma Y, Tu Q, Li Q, Wang H. Disease burden due to herpes zoster among population aged ≥50 years old in China: a community based retrospective survey[J]. PLoS One, 2016, 11(4): e152660.
[DOI]
|
| [9] |
布晓婧, 刘彤云. 带状疱疹后遗神经痛的研究现状[J]. 皮肤病与性病, 2018, 40(2): 189-192. [DOI]
|
| [10] |
Watson P. Postherpetic neuralgia[J]. Am Fam Physician, 2011, 84(6): 690-692.
[URI]
|
| [11] |
Friesen KJ, Chateau D, Falk J, Alessi-Severini S, Bugden S. Cost of shingles: population based burden of disease analysis of herpes zoster and postherpetic neuralgia[J]. BMC Infect Dis, 2017, 17(1): 69.
[DOI]
|
| [12] |
Marra F, Chong M, Najafzadeh M. Increasing incidence associated with herpes zoster infection in British Columbia, Canada[J]. BMC Infect Dis, 2016, 16(1): 589.
[DOI]
|
| [13] |
Rullán M, Bulilete O, Leiva A, Soler A, Roca A, González-Bals MJ, Lorente P, Llobera J; PHN Group. Efficacy of gabapentin for prevention of postherpetic neuralgia: study protocol for a randomized controlled clinical trial[J]. Trials, 2017, 18(1): 24.
[DOI]
|
| [14] |
James SF, Traina-Dorge V, Deharo E, Wellish M, Palmer BE, Gilden D, Mahalingam R. T cells increase before zoster and PD-1 expression increases at the time of zoster in immunosuppressed nonhuman primates latently infected with simian varicella virus[J]. J Neurovirol, 2014, 20(3): 309-313.
[DOI]
|
| [15] |
Haberthur K, Engelmann F, Park B, Barron A, Legasse A, Dewane J, Fischer M, Kerns A, Brown M, Messaoudi I. CD4 T cell immunity is critical for the control of simian varicella virus infection in a nonhuman primate model of VZV infection[J]. PLoS Pathog, 2011, 7(11): e1002367.
[DOI]
|
| [16] |
Xing Q, Hu D, Shi F, Chen F. Role of regulatory T cells in patients with acute herpes zoster and relationship to postherpetic neuralgia[J]. Arch Dermatol Res, 2013, 305(8): 715-722.
[DOI]
|
| [17] |
Hadley GR, Gayle JA, Ripoll J, Jones MR, Argoff CE, Kaye RJ, Kaye AD. Post-herpetic neuralgia: a review[J]. Curr Pain Headache Rep, 2016, 20(3): 17.
[DOI]
|
| [18] |
Ji RR, Xu ZZ, Gao YJ. Emerging targets in neuroinflammation-driven chronic pain[J]. Nat Rev Drug Discov, 2014, 13(7): 533-548.
[DOI]
|
| [19] |
Zhang GH, Lv MM, Wang S, Chen L, Qian NS, Tang Y, Zhang XD, Ren PC, Gao CJ, Sun XD, Xu LX. Spinal astrocytic activation is involved in a virally-induced rat model of neuropathic pain[J]. PLoS One, 2011, 6(9): e23059.
[DOI]
|
| [20] |
Colloca L, Ludman T, Bouhassira D, Baron R, Dickenson AH, Yarnitsky D, Freeman R, Truini A, Attal N, Finnerup NB, Eccleston C, Kalso E, Bennett DL, Dworkin RH, Raja SN. Neuropathic pain[J]. Nat Rev Dis Primers, 2017, 3: 17002.
[DOI]
|
| [21] |
Krasselt M, Baerwald C, Liebert UG, Seifert O. Humoral immunity to varicella zoster virus is altered in patients with rheumatoid arthritis[J]. Clin Rheumatol, 2019, 38(9): 2493-2500.
[DOI]
|
| [22] |
Shaw J, Gershon AA. Varicella virus vaccination in the United States[J]. Viral Immunol, 2018, 31(2): 96-103.
[DOI]
|
| [23] |
Ozaki T, Asano Y. Development of varicella vaccine in Japan and future prospects[J]. Vaccine, 2016, 34(29): 3427-3433.
[DOI]
|
| [24] |
Oxman MN, Levin MJ, Johnson GR, Schmader KE, Straus SE, Gelb LD, Arbeit RD, Simberkoff MS, Gershon AA, Davis LE, Weinberg A, Boardman KD, Williams HM, Zhang JH, Peduzzi PN, Beisel CE, Morrison VA, Guatelli JC, Brooks PA, Kauffman CA, Pachucki CT, Neuzil KM, Betts RF, Wright PF, Griffin MR, Brunell P, Soto NE, Marques AR, Keay SK, Goodman RP, Cotton DJ, Gnann JW Jr, Loutit J, Holodniy M, Keitel WA, Crawford GE, Yeh SS, Lobo Z, Toney JF, Greenberg RN, Keller PM, Harbecke R, Hayward AR, Irwin MR, Kyriakides TC, Chan CY, Chan IS, Wang WW, Annunziato PW, Silber JL; Shingles Prevention Study Group. A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults[J]. N Engl J Med, 2005, 352(22): 2271-2284.
[DOI]
|
| [25] |
de Boer PT, Wilschut JC, Postma MJ. Cost-effectiveness of vaccination against herpes zoster[J]. Hum Vaccin Immunother, 2014, 10(7): 2048-2061.
[DOI]
|
| [26] |
Lal H, Cunningham AL, Godeaux O, Chlibek R, Diez-Domingo J, Hwang SJ, Levin MJ, McElhaney JE, Poder A, Puig-Barberà J, Vesikari T, Watanabe D, Weckx L, Zahaf T, Heineman TC; ZOE-50 Study Group. Efficacy of an adjuvanted herpes zoster subunit vaccine in older adults[J]. N Engl J Med, 2015, 372(22): 2087-2096.
[DOI]
|
| [27] |
Bharucha T, Ming D, Breuer J. A critical appraisal of 'Shingrix', a novel herpes zoster subunit vaccine (HZ/Su or GSK1437173A) for varicella zoster virus[J]. Hum Vaccin Immunother, 2017, 13(8): 1789-1797.
[DOI]
|
| [28] |
Leroux-Roels I, Leroux-Roels G, Clement F, Vandepapelière P, Vassilev V, Ledent E, Heineman TC. A phase 1/2 clinical trial evaluating safety and immunogenicity of a varicella zoster glycoprotein e subunit vaccine candidate in young and older adults[J]. J Infect Dis, 2012, 206(8): 1280-1290.
[DOI]
|
| [29] |
Chlibek R, Smetana J, Pauksens K, Rombo L, van den Hoek JA, Richardus JH, Plassmann G, Schwarz TF, Ledent E, Heineman TC. Safety and immunogenicity of three different formulations of an adjuvanted varicella-zoster virus subunit candidate vaccine in older adults: a phase Ⅱ, randomized, controlled study[J]. Vaccine, 2014, 32(15): 1745-1753.
[DOI]
|
| [30] |
Chlibek R, Bayas JM, Collins H, de la Pinta ML, Ledent E, Mols JF, Heineman TC. Safety and immunogenicity of an AS01-adjuvanted varicella-zoster virus subunit candidate vaccine against herpes zoster in adults ≥50 years of age[J]. J Infect Dis, 2013, 208(12): 1953-1961.
[DOI]
|
| [31] |
Chlibek R, Pauksens K, Rombo L, van Rijckevorsel G, Richardus JH, Plassmann G, Schwarz TF, Catteau G, Lal H, Heineman TC. Long-term immunogenicity and safety of an investigational herpes zoster subunit vaccine in older adults[J]. Vaccine, 2016, 34(6): 863-868.
[DOI]
|
| [32] |
Jacquet A, Haumont M, Massaer M, Garcia L, Mazzu P, Daminet V, Grégoire D, Jacobs P, Bollen A. Immunogenicity of a recombinant varicella-zoster virus gE-IE63 fusion protein, a putative vaccine candidate against primary infection and zoster reactivation[J]. Vaccine, 2002, 20(11-12): 1593-1602.
[DOI]
|
| [33] |
Zhu R, Liu J, Chen C, Ye X, Xu L, Wang W, Zhao Q, Zhu H, Cheng T, Xia N. A highly conserved epitope-vaccine candidate against varicella-zoster virus induces neutralizing antibodies in mice[J]. Vaccine, 2016, 34(13): 1589-1596.
[DOI]
|
| [34] |
Bao L, Wei G, Gan H, Ren X, Ma R, Wang YI, Lv H. Immunogenicity of varicella zoster virus glycoprotein E DNA vaccine[J]. Exp Ther Med, 2016, 11(5): 1788-1794.
[DOI]
|
| [35] |
Kim AR, Park J, Kim JH, Kwak JE, Cho Y, Lee H, Jeong M, Park SH, Shin EC. Herpes zoster DNA vaccines with IL-7 and IL-33 molecular adjuvants elicit protective T cell immunity[J]. Immune Netw, 2018, 18(5): e38.
[DOI]
|
| [36] |
Centers for Disease Control and Prevention. Shingrix recommendations [EB/OL]. [2018-01-25]. https://www.cdc.gov/vaccines/vpd/shingles/hcp/shingrix/recommendations.html.
|
| [37] |
国家药品监督管理局.重组带状疱疹疫苗获批上市[EB/OL]. [2019-05-22]. http://www.nmpa.gov.cn/WS04/CL2094/337895.html.
|
| [38] |
罗冀南. 带状疱疹疫苗Zostavax在中年人群和老年人群中应用的效果及安全性比较[J]. 黑龙江医学, 2016, 40(2): 103-105. [DOI]
|
| [39] |
Shah RA, Limmer AL, Nwannunu CE, Patel RR, Mui UN, Tyring SK. Shingrix for herpes zoster: a review[J]. Skin Therapy Lett, 2019, 24(4): 5-7.
[URI]
|
 2020, Vol. 15
2020, Vol. 15


