2. 广西医科大学第一附属医院, 南宁 530021
2. The First Affiliated Hospital of Guangxi Medical University, Nanning 530021, Guangxi Zhuang Autonomous Region, China
盐单胞菌属于革兰阴性杆菌,有嗜盐特性,目前发现的盐单胞菌有30余种。大多盐单胞菌是从海洋、盐湖等含盐水环境中分离得到[1-7]。20世纪初,国外曾报道过几例盐单胞菌引起人类感染,其感染症状主要为发热、C反应蛋白(C-reactive protein, CRP)升高,可伴有肺部炎症[7-8]。但目前国内尚未见盐单胞菌感染相关报道。本文报道1例婴幼儿血流感染盐单胞菌病例,患儿感染症状典型。来自该患儿的盐单胞菌生长速度慢,常规生化、质谱方法数据库局限而难以鉴定,最终经16S rRNA基因测序,确定为盐单胞菌。临床医师根据该盐单胞菌的药物敏感(药敏)情况给予药物治疗后,患儿病情好转。详情报道如下。
1 临床材料 1.1 病例患儿,男,年龄2个月24天。因发现皮下出血点3 d,就诊于广西壮族自治区妇幼保健院。入院时主要症状及体征:全身出现皮下出血点,以眼睑为著;呼吸急促,有三凹征,双侧呼吸运动对称;双肺呼吸音粗,闻及痰鸣音。
1.1.1 血常规检查门、急诊检查血小板7×109/L↓,入院时白细胞13.0×109/L↑,血小板4×109/L↓。
1.1.2 凝血功能检查纤维蛋白原(fibrinogen, FIB)1.78 g/L↓,凝血酶时间(thrombin time, TT)18.5 s↑,D-二聚体1 056 μg/L↑。入院后,前3 d CRP由0.5 mg/L逐渐升高至12.6 mg/L。
1.1.3 免疫学检验报告显示, 抗双链DNA抗体IgG(定性)阳性。
1.1.4 骨髓穿刺镜检结果显示骨髓增生活跃,粒系增生活跃,红系增生活跃,血小板少见,巨核细胞产血小板功能减低。
1.1.5 肺部CT报告提示支气管肺炎。
1.1.6 细菌学检测抗生素使用前、后分别送检痰培养。结果显示,无致病菌生长。入院输血前及抗生素使用前进行血培养(儿童瓶,单次),0.54 d报告阳性;将血培养阳性液涂片革兰染色,镜检显示为革兰阴性杆菌;继续转种至血平板与巧克力平板,于5% CO2孵箱培养,48 h无细菌生长。其余无特殊异常。
对该病例的诊断:①免疫性血小板减少症;②重症肺炎;③呼吸衰竭;④感染性休克;⑤心力衰竭;⑥重度贫血。临床治疗:辅助通气改善呼吸衰竭;输注同型去白细胞悬浮红细胞改善贫血,输注冷沉淀、新鲜冰冻血浆、单采血小板纠正凝血功能障碍;激素治疗。入院后,前4 d经验性给予美罗培南抗感染,美罗培南治疗期间体温在37.6~38.2 ℃波动,白细胞降至6.2×109/L,之后抗生素改用哌拉西林/他唑巴坦治疗。住院8 d后,体温降至36.8 ℃,感染指标CRP降至0.89 mg/L,血小板升至859×109/L,好转出院。
1.2 仪器和方法 1.2.1 仪器BacT/ALERT3D全自动血培养仪、VITEK 2 Compact全自动微生物鉴定及药敏分析仪和配套革兰阴性(Gram negative, GN)菌鉴定卡、基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)为法国梅里埃生物公司产品,DL-96为珠海迪尔生物工程有限公司产品,营养肉汤、哥伦比亚血平板及巧克力平板购自广州迪景微生物科技有限公司,快速革兰染色液购自成都瑞琦科技实业股份有限公司,S1000TM Thermal Cycler PCR仪为美国Bio-Rad公司产品。
1.2.2 方法采集患儿4 mL静脉血,注入儿童血培养瓶中,置于BacT/ALERT3D全自动血培养仪进行培养,将报告阳性的培养液涂片革兰染色后镜检。并将血培养阳性液转种于哥伦比亚血平板及巧克力平板,置35 ℃、5% CO2中培养;取0.5 mL血培养阳性液加入2 mL无菌肉汤,置35 ℃、5% CO2中孵育,每隔24 h观察1次培养情况。采用VITEK 2 Compact及DL-96全自动微生物鉴定及药敏分析仪对菌株进行鉴定。用加热煮沸法提取细菌DNA,即用无菌接种环挑取2~3个单个菌落,置于1 mL无菌去离子水中,100 ℃加热20 min,12 000 r/min离心5 min,取上清液作为基因扩增模板。16S rRNA基因扩增及测序送北京睿博兴科公司进行。
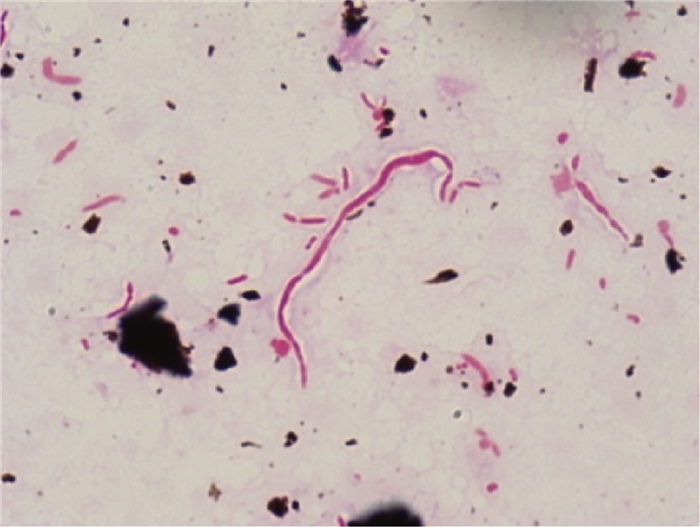
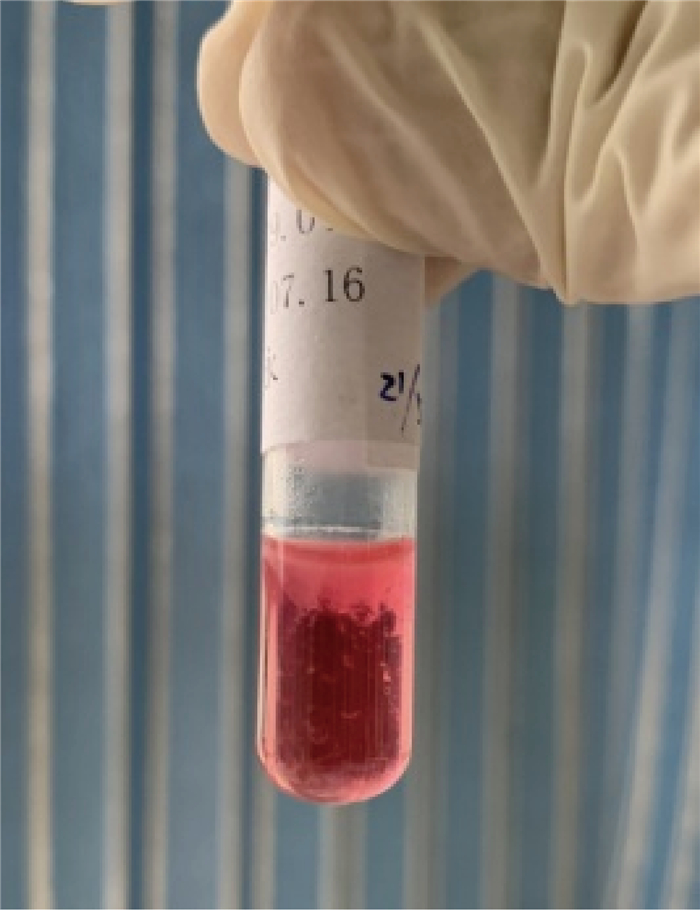
2 结果 2.1 显微镜检查血培养阳性液涂片染色镜检观察到宽大革兰阴性微弯杆菌(图 1)。按常规流程于孵育24 h及48 h后观察血平板及巧克力平板培养情况,均未见菌体生长。采用增加肉汤增菌法实验以传代返祖:取0.5 mL血培养阳性液,加入2 mL无菌肉汤,置35 ℃、5% CO2中孵育。同时延长平板培养时间,每隔24 h观察1次培养情况。巧克力平板孵育至第5天时,观察到一区有湿润、黏液状、凸起、完整、反光、微黄透明菌落生长(图 2);将菌落涂片革兰染色,镜下形态与图 1血培养液涂片镜下形态一致。另外,肉汤孵育24 h后,见红色絮状沉淀(图 3),取肉汤培养液,再转种至血平板及巧克力平板,置35 ℃、5% CO2中孵育24 h后血平板及巧克力平板亦长出菌落,其形态与图 2菌落形态一致;将菌落涂片革兰染色,镜下形态与图 1血培养液涂片镜下形态一致。
|
| 图 1 显微镜下菌体形态为宽大革兰阴性微弯杆菌(1 000×) Fig. 1 Microscopic morphology under Gram staining showed gram-negtive, wide and slightly bent bacillus (1 000×magnification) |

|
| 图 2 巧克力平板孵育5 d菌落形态 Fig. 2 Culture on chocolate agar plate for 5 d |
|
| 图 3 肉汤增菌后见絮状沉淀物 Fig. 3 Flocculent sediment after broth culturing |
该菌氧化酶、触酶阳性,在6.5% NaCl培养基中能生长,生化反应不活跃。VITEK 2 Compact仪鉴定为玫瑰假单胞菌,鉴定率为67.63%;DL-96鉴定为洋葱伯克霍尔德菌,鉴定率为99.15%,2种仪器鉴定结果差别大。VITEK 2 Compact仪鉴定率不高,而该菌的菌落形态与洋葱伯克霍尔德菌的常见菌落形态不同,故对2种仪器鉴定结果持怀疑态度。另外,对菌种进行基质辅助激光解吸电离飞行时间质谱分析,亦未鉴定出。
2.3 药敏试验由于美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)暂无此菌药敏解释标准,因此参照2018年CLSI-100中非肠杆菌科菌药敏折点[9],DL-96 NE药敏板显示阳性孔生长,其对哌拉西林最小抑菌浓度(minimum inhibitory concentration,MIC)>128 μg /mL,判为耐药;对哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、左氧氟沙星、环丙沙星、复方新诺明、氨曲南、庆大霉素、阿米卡星、美洛培南、亚胺培南及米诺环素敏感。VITEK 2 Compact GN13卡药敏结果显示,其对哌拉西林/他唑巴坦、头孢唑林、头孢他啶、头孢曲松、头孢吡肟、亚胺培南、阿米卡星、庆大霉素、妥布霉素、左氧氟沙星、环丙沙星和复方新诺明均敏感。
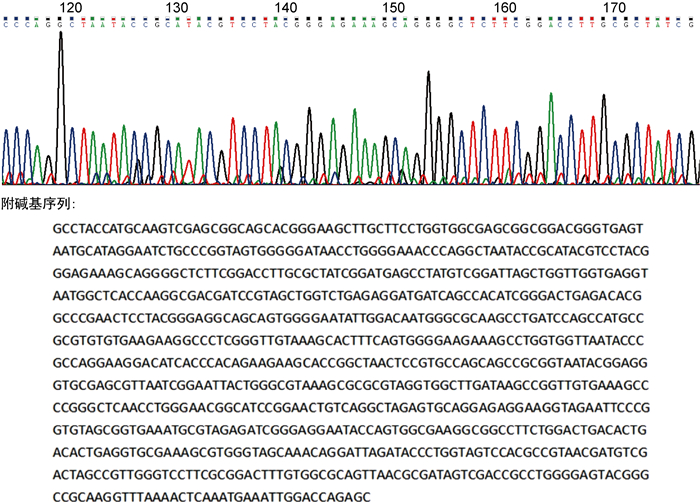
2.4 16S rRNA基因测序鉴定对该菌进行靶向DNA测序,16S rRNA基因扩增采用广谱引物:27f (5′-AGAGTTTGATCCT-GGCTCAG-3′)与1492r(5′-GGTTACCTTGTT-ACGACTT-3′)[10]。结果可见单一、清晰的目的条带,与嗜盐单胞菌属(Halomonas sp.)序列相似度高,为99.04%,与亚硝酸盐单胞菌相似度为98.58%,两者相似度未>0.8%,所以基因测序仅鉴定到嗜盐单胞菌属,部分测序结果见图 4。
|
| 图 4 16S rRNA基因测序结果 Fig. 4 16S rRNA gene sequencing |
瑞士2000年首次报道1例人被鱼咬伤后感染盐单胞菌的病例[7],其感染症状仅为伤口红肿,CRP升高,而体温及血白细胞计数正常。医院内首次暴发盐单胞菌血流感染于1999—2000年,地点为突尼斯军队医院新生儿危重病房[8],文献报道提及的新生儿盐单胞菌血流感染症状为发热、CRP升高,部分伴随肺部感染,临床医师经验性给予美罗培南治疗后好转。本文报道的患儿症状与文献报道的部分相似[8],即发热、CRP升高,伴有肺部炎症。但不同的是,本报告的患儿出现血小板减少症状,经实验室检查怀疑免疫性血小板减少可能性大。根据文献报道[11-14],血流感染可能伴随血小板减低,故该患者并不能排除盐单胞菌血流感染进一步加重血小板减低的可能。也有可能是免疫性血小板减低使患儿免疫力低下,导致感染的可能性增大。本报告检出的盐单胞菌药敏检测结果显示,该菌除对哌拉西林耐药外,对其他β-内酰胺类、喹诺酮类、氨基糖苷类及碳青霉烯类抗生素敏感,与突尼斯相关报道相符[8]。而本病例中临床医师经验性使用美罗培南和哌拉西林/他唑巴坦抗感染治疗有效,且与药敏结果相符,也佐证了这一结果。
本文报道对象为婴儿,入院后3 h送检血培养,经孵育12 h报告阳性,从血培养送检时间推测,由本次入院引起的院内感染可能性小,且血培养曲线陡峭向上,推测血培养瓶中菌量较大。婴幼儿皮脂厚,消毒要求高,其血培养采血时较成人更容易出现皮肤定植菌污染,但盐单胞菌并非皮肤常见定植污染菌,故推测采血造成血培养污染的可能性小。由于患儿未送检第2套血培养,所以对盐单胞菌引起血流感染的初步诊断结果未能进一步验证,建议婴幼儿血培养应严格按照指南要求操作[15-17]。婴幼儿饮食单一,且不能自主大范围活动,感染途经局限。本病例未能进行患儿母亲的血培养检测,患儿或许在其他医疗机构接种疫苗或就医时感染盐单胞菌亦不能排除。
综上所述,本文报道结果提示,盐单胞菌镜下形态为宽大微弯阴性杆菌;其生长缓慢,需延长时间培养;对大多数β-内酰胺类及碳青霉烯类抗生素敏感;需通过分子诊断技术做出鉴定,而应用生化及MALDI-TOF MS方法则不能。本文报道病例对实验室诊断、临床治疗盐单胞菌感染具有一定的指导意义。
| [1] |
Martínez-Cánovas MJ, Quesada E, Llamas I, Béjar V. Halomonas ventosae sp. nov., a moderately halophilic, denitrifying, exopolysaccharide-producing bacterium[J]. Int J Syst Evol Microbiol, 2004, 54(Pt 3): 733-737.
[URI]
|
| [2] |
Quillaguaman J, Hatti-Kaul R, Mattiasson B, Alvarez MT, Delgado O. Halomonas boliviensis sp. nov., an alkalitolerant, moderate halophile isolated from soil around a Bolivian hypersaline lake[J]. Int J Syst Evol Microbiol, 2004, 54(Pt 3): 721-725.
[PubMed]
|
| [3] |
Kaye JZ, Márquez MC, Ventosa A, Baross JA. Halomonas neptunia sp. nov., Halomonas sulfifidaeris sp. nov., Halomonas axialensis sp. nov. and Halomonas hydrothermalis sp. nov.: halophilic bacteria isolated from deep-sea hydrothermal-vent environments[J]. Int J Syst Evol Microbiol, 2004, 54(Pt 2): 499-511.
[URI]
|
| [4] |
Heyrman J, Balcaen A, De Vos P, Swings J. Halomonas muralis sp. nov., isolated from microbial biofilms colonizing the walls and murals of the Saint-Catherine chapel (Castle Herberstein, Austria)[J]. Int J Syst Evol Microbiol, 2002, 52(Pt 6): 2049-2054.
[URI]
|
| [5] |
Arahal DR, Castillo AM, Ludwig W, Schleifer KH, Ventosa A. Proposal of Cobetia marina gen. nov., comb. nov., within the family Halomonadaceae, to include the species Halomonas marina[J]. Syst Appl Microbiol, 2002, 25(2): 207-211.
[DOI]
|
| [6] |
Arahal DR, Ludwig W, Schleifer KH, Ventosa A. Phylogeny of the family Halomonadaceae based on 23S and 16S rDNA sequence analyses[J]. Int J Syst Evol Microbiol, 2002, 52(Pt 1): 241-249.
[URI]
|
| [7] |
von Graevenitz A, Bowman J, Del Notaro C, Ritzler M. Human infection with Halomonas venusta following fish bite[J]. J Clin Microbiol, 2000, 38(8): 3123-3124.
[DOI]
|
| [8] |
Berger P, Barguellil F, Raoult D, Drancourt M. An outbreak of Halomonas phocaeensis sp. nov. bacteraemia in a neonatal intensive care unit[J]. J Hosp Infect, 2007, 67(1): 79-85.
[DOI]
|
| [9] |
Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; 28th informational supplement. CLSI M100-S28 [S/OL]. 28th ed. Wayne, PA: Clinical and Laboratory Standards Institute, 2018. http://iacld.ir/DL/public/CLSI-2018-M100-S28.pdf.
|
| [10] |
Petti CA. Detection and identification of microorganisms by gene amplification and sequencing[J]. Clin Infect Dis, 2007, 44(8): 1108-1114.
[DOI]
|
| [11] |
李霄, 卢文青, 陈丽萍, 晏长红, 王巧芳, 刘红霞. 血小板及其他实验室指标在新生儿败血症早期诊治中的应用研究[J]. 当代医学, 2018, 24(7): 1-5. [DOI]
|
| [12] |
Kerris EWJ, Hoptay C, Calderon T, Freishtat RJ. Platelets and platelet extracellular vesicles in hemostasis and sepsis[J]. J Investig Med, 2020, 68(4): 813-820.
[DOI]
|
| [13] |
Greco E, Lupia E, Bosco O, Vizio B, Montrucchio G. Platelets and multi-organ failure in sepsis[J]. Int J Mol Sci, 2017, 18(10): 2200.
[DOI]
|
| [14] |
何华云, 雷翠蓉, 陈新红, 杨丽莎, 代金丽. 血清炎性因子、血小板相关指标单独及联合检测对新生儿细菌感染性败血症的诊断价值[J]. 山东医药, 2017, 57(2): 53-54, 55. [DOI]
|
| [15] |
中华医学会儿科学分会新生儿学组, 中国医师协会新生儿科医师分会感染专业委员会. 新生儿败血症诊断及治疗专家共识(2019年版)[J]. 中华儿科杂志, 2019, 57(4): 252-257. [DOI]
|
| [16] |
徐秋红, 覃国雷, 潘漩. 临床微生物学血培养操作规范[J]. 心理月刊, 2019, 14(4): 187. [CNKI]
|
| [17] |
中华人民共和国国家卫生和计划生育委员会. 中华人民共和国卫生行业标准(WS/T 503-2017)-临床微生物血培养操作规范[S]. 北京: 中华人民共和国国家卫生和计划生育委员会, 2017.(2017-09-06). http://www.nhc.gov.cn/ewebeditor/uploadfile/2017/10/20171024163700956.pdf.
|
 2020, Vol. 15
2020, Vol. 15


