2. 四川大学华西公共卫生学院/四川大学华西第四医院, 四川 成都 610041
2. West China School of Public Health and West China Fourth Hospital, Sichuan University, Chengdu 610041, Sichuan Province, China
2019年12月,世界范围内发生了不明原因肺炎疫情。2020年1月7日,多方专家评估后证实此次疫情的病原为一种新型冠状病毒[1-3]。2020年2月,国际病毒分类委员会将此种新型冠状病毒命名为severe acute respiratory syndrome coronavirus 2(SARS-CoV-2)[4]; 同时,世界卫生组织(World Health Organization, WHO)将SARS-CoV-2感染引起的肺炎命名为COVID-19。SARS-CoV-2已呈现向全球蔓延的趋势,令中国和全世界都蒙受着巨大的损失并面临极大的公共健康风险。目前尚无预防及治疗的特效药物,防控形势极为严峻。
患者的治愈固然离不开药物对病毒扩增的抑制作用和对人体功能的促进和维持作用,但更多的还是源于人体自身免疫系统对病毒的清除效力。本文简要讲述免疫系统抗击并清除SARS-CoV-2的过程。同时免疫系统并非完美无缺,有时反而会引发负面反应。在不少重症患者的血浆中各类细胞因子的含量急剧飙升,引发“细胞因子风暴”(cytokine storm),进而导致炎症反应过度和失控,并对机体的正常细胞造成伤害。这样的“细胞因子风暴”与感染者的症状严重性密切相关,最终还可能导致患者死亡。另外,利用血浆疗法治疗重症患者、制备疫苗来预防SARS-CoV-2感染等免疫相关的治疗策略正受到广泛期待。众多研究小组都在通过不同的策略研究制备高效、安全的疫苗。然而通过疫苗接种来诱导免疫系统产生保护性中和抗体真的能一帆风顺吗?本文还将进一步从免疫系统的角度讨论疫苗制备过程中可能遇到的困难与挑战。
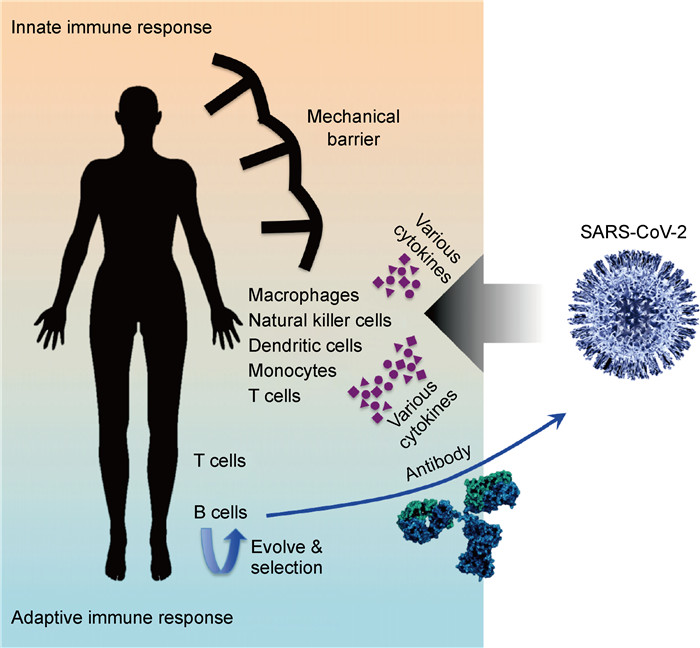
1 免疫系统的正面抗击面对SARS-CoV-2的侵染,人体的免疫系统早已进化出了一整套高效的免疫屏障和应对手段,一方面能被动防止病毒的入侵,另一方面还能主动消灭已经入侵的病毒(图 1)。
|
| 图 1 人体免疫系统对抗SARS-CoV-2感染的简要模式图 Fig. 1 Schematic picture of human immune responses against the SARS-CoV-2 |
黏附在固体表面或空气中飘浮的SARS-CoV-2会试图通过各种渠道进入人体内。人体表面的皮肤能够阻断绝大部分SARS-CoV-2的入侵。这些黏附在皮肤表面的病毒并不能穿透表皮层,用水清洗皮肤(洗手、洗澡)更可以有效地将这些病毒冲走。
SARS-CoV-2最终找到渠道进入呼吸系统,但并非代表一定就会引起感染。人体的鼻腔、咽喉、气管及支气管内都能够分泌大量黏液,这些黏液能够黏附病毒,形成喷嚏或痰液并排出体外,从而抑制病毒感染肺部组织细胞。
少量的病毒可以被物理屏障阻断于人体肺部之外,但当人体受到较多量的病毒感染时,总有一小部分病毒会最终抵达肺部。与SARS-CoV一样,SARS-CoV-2也是通过其表面刺突蛋白(spike protein,S蛋白)与肺部上皮细胞的受体蛋白血管紧张素转换酶2(recombinant angiotensin I converting enzyme 2, ACE-2)相结合而实现侵染[2, 5]。病毒表面S蛋白具有2种结构构象,融合前构象(prefusion)和融合后构象(postfusion)[6]。冠状病毒感染细胞时,通过病毒表面S蛋白与ACE-2受体相结合形成复合物,并通过质膜内陷形成内吞体包裹病毒进入宿主细胞。病毒经内吞作用(endocytosis)转运到溶酶体后,其表面S蛋白会被溶酶体内的蛋白酶切割并诱导构象变化,从融合前构象转变为融合后构象。这些变化促进了病毒颗粒与宿主细胞的膜融合,从而释放病毒基因组至细胞质,最终完成侵染过程。
病毒侵染细胞后,机体的固有免疫(innate immunity)系统会启动各项机制进行对抗。被病毒感染的细胞本身就具有一系列抗病毒机制:其胞内蛋白元件检测到病毒RNA后,各类抗病毒蛋白通过信号通路被激活表达。这些抗病毒蛋白能够对病毒在胞内的复制、合成、装配、分泌等各个步骤起到抑制作用。同时,细胞因子(cytokine),包括各类干扰素(interferon, IFN)、白细胞介素(interleukin, IL)、淋巴因子(lymphokine)等也被激活表达。它们是分子量较小的蛋白质,由细胞合成并分泌到胞外,广泛参与细胞间的信号传递,并将此处发生病毒感染的信息传递出去。各类细胞因子能够招募多种免疫细胞,如巨噬细胞(macrophage)、树突细胞(dendritic cell)、自然杀伤细胞(natural killer cell)等。这些免疫细胞参与了一系列的生理过程,包括对病毒颗粒的吞噬和降解、释放更多的细胞因子以促进炎症反应、清除被病毒感染的细胞等。
与此同时,适应性免疫(adaptive immunity)系统在消灭病毒的过程中起着尤为重要的核心作用(图 1)。当机体被病毒感染后,游离在全身各处的成熟B细胞(naïve B cell)有可能与病毒颗粒相遇。当B细胞中由V、D和J基因片段重排产生的抗体(antibody)天然性地识别病毒颗粒时,B细胞会迅速转变为浆母细胞(plasmablast)并开始大量分泌IgM。这类抗体属于早期产生的抗体,虽然其抗原特异性较低,但在一定程度上也能参与遏制病毒的扩增,为机体产生特异性较强的高效中和抗体赢得时间。除了变为浆母细胞外,一部分能够识别病毒颗粒的B细胞还会进入淋巴小结中,与受到病毒激活的辅助性T细胞形成生发中心(germinal center)。这些B细胞的抗体会在此处进一步突变和筛选,最终进化出特异性识别病毒颗粒的高效中和抗体。突变出高效中和抗体的B细胞会转变为浆细胞(plasma cell),并移至骨髓,分泌大量IgG型抗体。由于经历过多轮筛选和突变,这些新生成的抗体对病毒颗粒有非常高的特异性和中和效力。它们通过体内循环系统到达被感染的部位,不仅能结合病毒以阻止其进一步对细胞的感染,还能进一步促进免疫细胞对病毒的吞噬及通过抗体依赖细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity,ADCC)直接杀伤被病毒感染的靶细胞。
从物理屏障到细胞因子介导的固有免疫,从固有免疫到产生具有记忆性的适应性免疫,人体免疫系统进化出了一系列全方位、高精准的抗病毒机制,保证了人体在对抗SARS-CoV-2的战斗中能大概率取胜。
2 “细胞因子风暴”的负面作用目前,SARS-CoV-2感染致死的患者以老年人居多,究其原因主要还是因为老年人本身的免疫力较差,不足以遏制病毒的扩增。同时,部分老年人还合并一些基础疾病,感染SARS-CoV-2后,身体功能的下降又加重了本身的基础疾病,最终导致器官衰竭。
然而,还有一些年轻的患者被SARS-CoV-2感染后,初期肺炎症状表现较轻,中、后期病情会突然恶化,急转直下。这些患者出现呼吸困难,并发展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[7]。同时,患者还会呈现凝血功能障碍、内脏器官衰竭等一系列极为致命的症状。
这些病情急转直下的患者是因为其体内产生了“细胞因子风暴”,也称“炎症风暴”。上述提到,细胞合成分泌的细胞因子能招募更多的免疫细胞,促进局部的炎症反应,进而抑制病毒的扩增并清除病毒颗粒(图 1)。然而当机体免疫应答激活太久或太强时,有可能促发细胞因子的级联反应,引发过度及失控的炎症反应,这就是“细胞因子风暴”。比如,SARS-CoV感染可诱导产生大量的IFN-γ[8],同时血液中其他的促炎症细胞因子,如IL-1β、IL-6、IL-12、IFN-γ诱导蛋白10(IFN-γ inducible protein-10, IP-10)、单核细胞趋化蛋白1(monocyte chemotactic protein 1, MCP-1)等的水平也会急剧增高,其表达水平与患者肺部损伤的程度密切相关[9]。在中东呼吸综合征(Middle East respiratory syndrome, MERS)冠状病毒感染的患者中,也同样检测到IFN-γ、肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、IL-15、IL-17等细胞因子在血液中的升高[10]。在H7N9流感病毒感染的急性患者血液中,IP-10、IFN-γ诱导单核细胞因子(monokine induced by IFN-γ, MIG)、巨噬细胞炎症蛋白1β(macrophage inflammatory protein 1β, MIP-1β)、MCP-1、IL-6、IL-8、IFN-α等细胞因子升高趋势也非常明显[11]。而在此次SARS-CoV-2感染的患者血液中同样检测到大量的IL-1β、IFN-γ、IP-10、MCP-1等细胞因子[12]。与一般病房中的患者相比,重症监护病房(intensive care unit,ICU)中的患者具有更高浓度的细胞因子水平(G-CSF,IP-10,MCP-1,MIP-1A和TNF-α)[12]。上述数据都进一步表明“细胞因子风暴”对SARS-CoV-2感染患者的病程具有负面作用。
正是因为“细胞因子风暴”可能带来的负面效应,在临床治疗中采取利用细胞因子促进免疫应答的治疗方案时,需特别慎重。比如,IFN在病毒感染的早期可能发挥抗病毒作用,但在感染后期使用,则极有可能对“细胞因子风暴”推波助澜,导致严重的不良反应。
探索降低“细胞因子风暴”负面影响的有效方案已成为临床上研究的热点。这样的策略虽然减缓了机体对病毒的清除,但能极大延长患者的生存时间,为其最终康复取得时机。人们开始尝试利用各类细胞因子的特异性抗体来中和其促炎症作用。虽然应用抗TNF和抗IL-1抗体的随机对照实验并没有降低接受治疗患者的病死率,但抗IL-6抗体则可能减缓“细胞因子风暴”导致的器官衰竭。另外,近年来,不同研究小组和公司也在致力于开发用于降低体内细胞因子水平的新技术、新方法。比如,CytoSorb疗法可利用特殊材料吸收血液中游离的细胞因子,从而降低过量的系统性炎症反应[13, 14]。而间接抑制固有免疫系统中的补体系统(complement system)也有可能被广泛应用于临床,从而下调过度激活的免疫系统[15]。
3 抗体依赖性增强效应可能对免疫治疗造成挑战疫情的恶化促使成千上万的医学科研工作者投入药物治疗和预防的研发中。研发免疫相关的治疗手段无疑是其中的热点之一。现在,有些医院开始尝试使用传统的血浆疗法,鼓励曾经感染但已恢复的患者献出血浆用于治疗重症患者。然而,血浆疗法具有不安全、效果不稳定、成本高、获取量较小等一系列缺点。因此,研发安全、有效的疫苗接种未感染人群,才是长治久安之道。
不论是血浆治疗,还是疫苗防护,这些方法都基于一个假设,即人体能够产生特异性识别病毒颗粒并具有中和效力的抗体。康复者的血浆为什么被认为可以用来治愈重症患者,主要就是因为他们体内曾经感染过病毒,其适应性免疫系统中的B细胞有可能进化筛选出能高效、特异结合病毒颗粒的抗体。而疫苗接种为什么可以保护未感染人群,就是因为人体接种疫苗后,模拟了病毒感染,能诱导机体产生免疫应答,最终生成具有保护力的抗体。
最近的报道显示,急性感染的患者能够产生针对SARS-CoV-2核衣壳蛋白(nucleocapsid protein,N蛋白)的IgM、IgG抗体[16]。而之前关于SARS-CoV感染患者的研究也显示人体能够产生针对N蛋白和S蛋白的抗体[17],且此抗体能持续较长时间[18]。不同科研小组也筛选到针对SARS-CoV表面S蛋白的抗体S230、80R、m396以及F26G19,抗体CR3022[19]最近还被证实能与SARS-CoV-2表面蛋白的受体结合区域(receptor-binding domain)发生交叉反应[20]。这些结果都表明人体能产生针对SARS-CoV-2的抗体。
人体感染冠状病毒后,免疫系统能够产生各种各样针对病毒颗粒及其组分的特异性抗体。在这些抗体中,只有针对病毒表面S蛋白的抗体能够结合病毒颗粒; 而那些针对病毒其他元件和组分的抗体并不能与病毒颗粒发生结合,这是因为这些组分被包裹在病毒内部,抗体无法与其接触。这些结合病毒表面S蛋白的抗体各式各样,它们在S蛋白上分别具有不同的结合位点。可以想象的是,其中有一部分抗体,其结合位点恰恰与病毒表面S蛋白上细胞受体的结合部位重合。这类抗体不仅能结合病毒颗粒,还能够与细胞表面受体竞争性地结合病毒颗粒。若抗体的结合力够强,这类抗体就能阻止病毒表面蛋白与细胞受体的结合,从而抑制病毒感染,我们称这类抗体为中和抗体(neutralizing antibody)。而另外大部分能结合病毒颗粒,却不具备体外中和效力的抗体,在人体内也能通过其恒定区的Fc区域起到非常重要的作用。抗体的Fc区域可以通过结合效应细胞上的Fc受体,招募各类效应细胞:招募自然杀伤细胞,引发ADCC; 招募结合血清中的补体分子,诱导补体依赖的细胞毒性作用(complement dependent cytotoxicity, CDC); 招募巨噬细胞,引发抗体依赖细胞介导的吞噬作用(antibody-dependent cellular phagocytosis,ADCP)。综上所述,这些依赖或不依赖Fc区域的功能,都使抗体在病毒清除过程中起着举足轻重的作用,也使人们憧憬着安全、高效的疫苗可以诱导出广谱、高效的中和抗体。
然而,开发疫苗并非如此简单。以登革病毒(Dengue virus)为例。登革病毒有4类血清型,而人体在感染某个血清型的登革病毒后,机体能产生针对该血清型的具有终身保护效力的抗体[21]。但是有趣的是,登革病毒导致威胁生命的登革出血热症状并非发生在第1次感染[22],而往往发生在第2次感染不同血清类型病毒之后(氨基酸序列差异为30%~35%)。究其原因,是因为第1次感染后诱导产生针对某一血清型登革病毒的抗体,其浓度或亲和力不足以中和第2次感染中另一血清型的病毒,反而促进病毒感染增强。这种现象被称为抗体依赖的增强效应(antibody-dependent enhancement effect,ADE效应)。ADE效应在登革病毒、黄热病毒、寨卡病毒、埃博拉病毒、人类免疫缺陷病毒等感染中都广泛存在[23, 24]。
在ADE效应发生时,结合病毒颗粒的抗体,通过其Fc区域使病毒颗粒被拥有Fc受体或补体受体的细胞吞噬,反而促进其对这类细胞的侵染。正如前文所述,某些种类的病毒感染细胞时,病毒颗粒通过内吞作用进入宿主细胞体内,在溶酶体中完成病毒膜与宿主膜的融合过程。而依赖于抗体的内吞作用反而促进了病毒颗粒被宿主细胞所吞噬,加重病毒感染。因此,抗体是否抑制或促进病毒感染,是其中和效力与ADE效应共同平衡的结果; 而血清对病毒的影响则是其中所包含的所有抗体分子(中和效力与ADE效应)的综合表现。
正是因为ADE效应的存在,针对登革病毒(1960年发现)的疫苗一直没有研发成功。直到2019年首个登革热疫苗才被批准上市。即使有了疫苗,这款疫苗也只可用于那些曾经感染过登革病毒的人,且接种前必须接受一系列检查和测试,否则接种该疫苗反而有可能加重未来感染登革病毒后的症状。这些限制也都是由于担心感染不同血清型的登革病毒可能发生ADE效应而设置的。
现在,尚没有数据显示针对SARS-CoV-2的抗体也具有ADE效应。但近年来一些关于SARS-CoV抗体的研究支持这一可能性。有研究表明,曾经感染过SARS-CoV的康复者血清被稀释后具有一定的促进病毒感染增强的作用[25]。这些增强作用被证实是来源于针对S蛋白的抗体,而非N蛋白的抗体[25, 26]。进一步的研究证实,针对SARS-CoV表面S蛋白的单克隆抗体具有ADE效应[25]。
当前,全球范围内尚没有针对SARS(2003年发现)或MERS-CoV(2012年发现)的疫苗获准接种人群。科学家们为此展开了众多临床前动物实验。虽然在猴子中的SARS疫苗[27, 28]和MERS疫苗[29, 30]免疫方案较为成功地起到了保护作用,但是在雪貂中的疫苗实验结果则表明,SARS疫苗并没有预防SARS-CoV感染,反而在肝组织造成严重的炎症反应和局部坏死[31, 32]。而在仓鼠和小鼠中的疫苗实验也显示免疫后血清呈现ADE效应[26, 33]。
更进一步分析,即使疫苗能够起到对该种病毒的防护作用,但在受到不同亚型病毒或相似的冠状病毒感染时,是否也能起到保护作用而不会发生ADE效应呢?这就类似于感染了某一血清型的登革病毒的人群,当再次感染其他血清型登革病毒时,其症状会更为严重。这也类似于接种了登革热疫苗的人群,当其感染寨卡病毒时反而可能出现更为剧烈的病毒复制和感染症状[34]。
显而易见,为回答“SARS-CoV-2疫苗是否有可能导致不同突变型或其他冠状病毒的感染加重”这个问题,科学家们还需要充分考虑到抗体的ADE效应以及病毒的变异等诸多问题,在细胞水平和动物模型中完成更广泛、更深入的实验,寻找选择更为合理、安全的蛋白抗原,设置更为有效的疫苗接种策略。
4 结语在抗疫工作中,人类面对的客观世界是无限的,而人类对自然界的探索和认知也必然是无止境的。在这场抗击疫情的斗争中,科研工作者们必须充分认识到机体免疫系统与SARS-CoV-2的密切关系,深入了解免疫系统在感染过程中的利与弊,积极借鉴其他病毒的防治策略。只有这样,人们才能未雨绸缪,采取更安全的应对措施,运筹帷幄,制定出更有效的预防和治疗策略。
| [1] |
Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, Zhao X, Huang B, Shi W, Lu R, Niu P, Zhan F, Ma X, Wang D, Xu W, Wu G, Gao GF, Tan W; China Novel Coronavirus Investigating and Research Team. A novel coronavirus from patients with pneumonia in China, 2019[J]. N Engl J Med, 2020, 382(8): 727-733.
[DOI]
|
| [2] |
Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, Si HR, Zhu Y, Li B, Huang CL, Chen HD, Chen J, Luo Y, Guo H, Jiang RD, Liu MQ, Chen Y, Shen XR, Wang X, Zheng XS, Zhao K, Chen QJ, Deng F, Liu LL, Yan B, Zhan FX, Wang YY, Xiao GF, Shi ZL. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature, 2020, 579(7798): 270-273.
[DOI]
|
| [3] |
Wu F, Zhao S, Yu B, Chen YM, Wang W, Song ZG, Hu Y, Tao ZW, Tian JH, Pei YY, Yuan ML, Zhang YL, Dai FH, Liu Y, Wang QM, Zheng JJ, Xu L, Holmes EC, Zhang YZ. A new coronavirus associated with human respiratory disease in China[J]. Nature, 2020, 579(7798): 265-269.
[DOI]
|
| [4] |
Coronaviridae Study Group of the International Committee on Taxonomy of Viruses. The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2[J]. Nat Microbiol, 2020, 5(4): 536-544.
[DOI]
|
| [5] |
Wrapp D, Wang N, Corbett KS, Goldsmith JA, Hsieh CL, Abiona O, Graham BS, McLellan JS. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation[J]. Science, 2020, 367(6483): 1260-1263.
[DOI]
|
| [6] |
Li F. Structure, function, and evolution of coronavirus spike proteins[J]. Annu Rev Virol, 2016, 3(1): 237-261.
[DOI]
|
| [7] |
Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, Qiu Y, Wang J, Liu Y, Wei Y, Xia J, Yu T, Zhang X, Zhang L. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study[J]. Lancet, 2020, 395(10223): 507-513.
[DOI]
|
| [8] |
Huang KJ, Su IJ, Theron M, Wu YC, Lai SK, Liu CC, Lei HY. An interferon-gamma-related cytokine storm in SARS patients[J]. J Med Virol, 2005, 75(2): 185-194.
[DOI]
|
| [9] |
Wong CK, Lam CW, Wu AK, Ip WK, Lee NL, Chan IH, Lit LC, Hui DS, Chan MH, Chung SS, Sung JJ. Plasma inflammatory cytokines and chemokines in severe acute respiratory syndrome[J]. Clin Exp Immunol, 2004, 136(1): 95-103.
[DOI]
|
| [10] |
Mahallawi WH, Khabour OF, Zhang Q, Makhdoum HM, Suliman BA. MERS-CoV infection in humans is associated with a pro-inflammatory Th1 and Th17 cytokine profile[J]. Cytokine, 2018, 104: 8-13.
[DOI]
|
| [11] |
Zhou J, Wang D, Gao R, Zhao B, Song J, Qi X, Zhang Y, Shi Y, Yang L, Zhu W, Bai T, Qin K, Lan Y, Zou S, Guo J, Dong J, Dong L, Zhang Y, Wei H, Li X, Lu J, Liu L, Zhao X, Li X, Huang W, Wen L, Bo H, Xin L, Chen Y, Xu C, Pei Y, Yang Y, Zhang X, Wang S, Feng Z, Han J, Yang W, Gao GF, Wu G, Li D, Wang Y, Shu Y. Biological features of novel avian influenza A (H7N9) virus[J]. Nature, 2013, 499(7459): 500-503.
[DOI]
|
| [12] |
Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, Zhang L, Fan G, Xu J, Gu X, Cheng Z, Yu T, Xia J, Wei Y, Wu W, Xie X, Yin W, Li H, Liu M, Xiao Y, Gao H, Guo L, Xie J, Wang G, Jiang R, Gao Z, Jin Q, Wang J, Cao B. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395(10223): 497-506.
[DOI]
|
| [13] |
Hinz B, Jauch O, Noky T, Friesecke S, Abel P, Kaiser R. CytoSorb, a novel therapeutic approach for patients with septic shock: a case report[J]. Int J Artif Organs, 2015, 38(8): 461-464.
[DOI]
|
| [14] |
Bruenger F, Kizner L, Weile J, Morshuis M, Gummert JF. First successful combination of ECMO with cytokine removal therapy in cardiogenic septic shock: a case report[J]. Int J Artif Organs, 2015, 38(2): 113-116.
[DOI]
|
| [15] |
Skjeflo EW, Christiansen D, Espevik T, Nielsen EW, Mollnes TE. Combined inhibition of complement and CD14 efficiently attenuated the inflammatory response induced by Staphylococcus aureus in a human whole blood model[J]. J Immunol, 2014, 192(6): 2857-2864.
[DOI]
|
| [16] |
Hsueh PR, Huang LM, Chen PJ, Kao CL, Yang PC. Chronological evolution of IgM, IgA, IgG and neutralisation antibodies after infection with SARS-associated coronavirus[J]. Clin Microbiol Infect, 2004, 10(12): 1062-1066.
[DOI]
|
| [17] |
Woo PC, Lau SK, Wong BH, Chan KH, Chu CM, Tsoi HW, Huang Y, Peiris JS, Yuen KY. Longitudinal profile of immunoglobulin G (IgG), IgM, and IgA antibodies against the severe acute respiratory syndrome (SARS) coronavirus nucleocapsid protein in patients with pneumonia due to the SARS coronavirus[J]. Clin Diagn Lab Immunol, 2004, 11(4): 665-668.
[DOI]
|
| [18] |
Li T, Xie J, He Y, Fan H, Baril L, Qiu Z, Han Y, Xu W, Zhang W, You H, Zuo Y, Fang Q, Yu J, Chen Z, Zhang L. Long-term persistence of robust antibody and cytotoxic T cell responses in recovered patients infected with SARS coronavirus[J]. PLoS One, 2006, 1: e24.
[DOI]
|
| [19] |
ter Meulen J, van den Brink EN, Poon LL, Marissen WE, Leung CS, Cox F, Cheung CY, Bakker AQ, Bogaards JA, van Deventer E, Preiser W, Doerr HW, Chow VT, de Kruif J, Peiris JS, Goudsmit J. Human monoclonal antibody combination against SARS coronavirus: synergy and coverage of escape mutants[J]. PLoS Med, 2006, 3(7): e237.
[DOI]
|
| [20] |
Tian X, Li C, Huang A, Xia S, Lu S, Shi Z, Lu L, Jiang S, Yang Z, Wu Y, Ying T. Potent binding of 2019 novel coronavirus spike protein by a SARS coronavirus-specific human monoclonal antibody[J]. Emerg Microbes Infect, 2020, 9(1): 382-385.
[DOI]
|
| [21] |
Guzman MG, Alvarez M, Rodriguez-Roche R, Bernardo L, Montes T, Vazquez S, Morier L, Alvarez A, Gould EA, Kouri G, Halstead SB. Neutralizing antibodies after infection with dengue 1 virus[J]. Emerg Infect Dis, 2007, 13(2): 282-286.
[DOI]
|
| [22] |
Screaton G, Mongkolsapaya J, Yacoub S, Roberts C. New insights into the immunopathology and control of dengue virus infection[J]. Nat Rev Immunol, 2015, 15(12): 745-759.
[DOI]
|
| [23] |
Ngono AE, Shresta S. Immune response to dengue and Zika[J]. Annu Rev Immunol, 2018, 36: 279-308.
[DOI]
|
| [24] |
Taylor A, Foo SS, Bruzzone R, Dinh LV, King NJ, Mahalingam S. Fc receptors in antibody-dependent enhancement of viral infections[J]. Immunol Rev, 2015, 268(1): 340-364.
[DOI]
|
| [25] |
Wang SF, Tseng SP, Yen CH, Yang JY, Tsao CH, Shen CW, Chen KH, Liu FT, Liu WT, Chen YM, Huang JC. Antibody-dependent SARS coronavirus infection is mediated by antibodies against spike proteins[J]. Biochem Biophys Res Commun, 2014, 451(2): 208-214.
[URI]
|
| [26] |
Kam YW, Kien F, Roberts A, Cheung YC, Lamirande EW, Vogel L, Chu SL, Tse J, Guarner J, Zaki SR, Subbarao K, Peiris M, Nal B, Altmeyer R. Antibodies against trimeric S glycoprotein protect hamsters against SARS-CoV challenge despite their capacity to mediate FcgammaRⅡ-dependent entry into B cells in vitro[J]. Vaccine, 2007, 25(4): 729-740.
[DOI]
|
| [27] |
Qin E, Shi H, Tang L, Wang C, Chang G, Ding Z, Zhao K, Wang J, Chen Z, Yu M, Si B, Liu J, Wu D, Cheng X, Yang B, Peng W, Meng Q, Liu B, Han W, Yin X, Duan H, Zhan D, Tian L, Li S, Wu J, Tan G, Li Y, Li Y, Liu Y, Liu H, Lv F, Zhang Y, Kong X, Fan B, Jiang T, Xu S, Wang X, Li C, Wu X, Deng Y, Zhao M, Zhu Q. Immunogenicity and protective efficacy in monkeys of purified inactivated Vero-cell SARS vaccine[J]. Vaccine, 2006, 24(7): 1028-1034.
[DOI]
|
| [28] |
Luo F, Liao FL, Wang H, Tang HB, Yang ZQ, Hou W. Evaluation of antibody-dependent enhancement of SARS-CoV infection in rhesus macaques immunized with an inactivated SARS-CoV vaccine[J]. Virol Sin, 2018, 33(2): 201-204.
[URI]
|
| [29] |
de Wit E, van Doremalen N, Falzarano D, Munster VJ. SARS and MERS: recent insights into emerging coronaviruses[J]. Nat Rev Microbiol, 2016, 14(8): 523-534.
[DOI]
|
| [30] |
Zhou Y, Jiang S, Du L. Prospects for a MERS-CoV spike vaccine[J]. Expert Rev Vaccines, 2018, 17(8): 677-686.
[DOI]
|
| [31] |
Weingartl H, Czub M, Czub S, Neufeld J, Marszal P, Gren J, Smith G, Jones S, Proulx R, Deschambault Y, Grudeski E, Andonov A, He R, Li Y, Copps J, Grolla A, Dick D, Berry J, Ganske S, Manning L, Cao J. Immunization with modified vaccinia virus Ankara-based recombinant vaccine against severe acute respiratory syndrome is associated with enhanced hepatitis in ferrets[J]. J Virol, 2004, 78(22): 12672-12676.
[DOI]
|
| [32] |
Czub M, Weingartl H, Czub S, He R, Cao J. Evaluation of modified vaccinia virus Ankara based recombinant SARS vaccine in ferrets[J]. Vaccine, 2005, 23(17-18): 2273-2279.
[DOI]
|
| [33] |
Jaume M, Yip MS, Kam YW, Cheung CY, Kien F, Roberts A, Li PH, Dutry I, Escriou N, Daeron M, Bruzzone R, Subbarao K, Peiris JS, Nal B, Altmeyer R. SARS CoV subunit vaccine: antibody-mediated neutralisation and enhancement[J]. Hong Kong Med J, 2012, 18(Suppl 2): 31-36.
[URI]
|
| [34] |
Dejnirattisai W, Supasa P, Wongwiwat W, Rouvinski A, Barba-Spaeth G, Duangchinda T, Sakuntabhai A, Cao-Lormeau VM, Malasit P, Rey FA, Mongkolsapaya J, Screaton GR. Dengue virus sero-cross-reactivity drives antibody-dependent enhancement of infection with zika virus[J]. Nat Immunol, 2016, 17(9): 1102-1108.
[DOI]
|
 2020, Vol. 15
2020, Vol. 15


