2. 上海动物保健有限公司,上海 201103
2. Shanghai animal health co., LTD, Shanghai 201103, China
猫冠状病毒(feline coronavirus, FCoV)属于套式病毒目冠状病毒科正冠状病毒亚科甲型冠状病毒属甲型冠状病毒1型[1],其基因组由1条长约29 000个核苷酸(nucleotide, nt)的单股正链RNA组成。基因组编码11个开放阅读框(open reading frames, ORFs),包括2个复制酶蛋白(pp1a和pp1ab)、4个结构蛋白[刺突蛋白(spike protein, S蛋白)、核衣壳蛋白(nucleocapsid, N蛋白)、膜蛋白(membrane protein, M蛋白)和包膜蛋白(envelope protein, E蛋白)]和5个附属蛋白(ORF3a-c和ORF7a, b)[2]。
按照病毒抗原性差异,FCoV可分为Ⅰ型和Ⅱ型两种血清型;根据病毒的致病性,FCoV可分为猫肠道冠状病毒(feline enteric coronavirus, FECV)和猫传染性腹膜炎病毒(feline infectious peritonitis virus, FIPV)两种生物型,两种血清型病毒在两种生物型病毒中普遍存在[3]。FECV致病性低,可引起轻度肠炎或无明显感染;FIPV毒力强,致死性强。FIPV被认为是FECV的突变体[4]。
目前,负责FCoV生物型转换的分子机制尚未完全研究清楚,主要集中在对ORF3c、ORF7b和S基因的研究。ORF3c和ORF7b基因突变被认为在致病性FIPV生物型的发生中起作用[5]。ORF3c和S基因突变与猫传染性腹膜炎(feline infectious peritonitis, FIP)的发生有关[6, 7]。本研究收集了3只经临床初步诊断患FIP的猫腹水样品进行FIPV ORF3、ORF7和S基因检测及遗传进化性分析,旨在从分子水平寻找其致病的关键靶点,并为FIPV的分子流行病学调查提供基础信息。
1 材料与方法 1.1 样品腹水样品取自上海市某宠物医院于2018年7月~2018年9月接诊的有腹水症状的猫,且患猫经血常规、血液生化、X线检查初步诊断为FIP,所有腹水样品均经宠物主同意后采集并进行编号。经本实验室建立的实时荧光反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)方法检测,编号为SH1802、SH1807和SH1809的3例样品均为FIPV阳性。将样品置于-80 ℃冰箱中保存备用。
1.2 主要试剂病毒RNA提取试剂盒购自上海美吉生物医药科技有限公司;PrimeScriptTM One Step RT-PCR Kit Ver.2 (Dye Plus)、DNA纯化回收试剂盒、pMDTM 19-T Vector Cloning Kit、DL-2 000 Marker和E.coli DH5α Competent Cells均购自宝日医生物技术(北京)有限公司。
1.3 3株FIPV的RNA提取参照病毒RNA提取试剂盒说明书,从猫腹水样品中提取病毒RNA。
1.4 3株FIPV的非结构蛋白基因ORF3、ORF7和S2序列的扩增参照文献合成FIPV非结构蛋白基因ORF3、ORF7和S2的PCR引物[7],以3例猫腹水样品中获得的病毒RNA为模板,分别利用一步法试剂PrimeScriptTM One Step RT-PCR Kit Ver.2 (Dye Plus)进行RT-PCR扩增。PCR产物经1.5 %琼脂糖凝胶电泳检测,阳性扩增产物电泳后,按照DNA纯化回收试剂盒说明书对目的条带进行胶回收纯化,将回收纯化产物与pGM-T载体连接,阳性质粒送上海桑尼生物科技有限公司测序。
1.5 3株FIPV的非结构蛋白基因ORF3、ORF7和S2基因序列分析及进化树构建应用DNAStar 7.0软件的MegAlign程序对测序获得的序列进行同源性比对。从NCBI GenBank(https://www.ncbi.nlm.nih.gov/genbank/)中下载FCoV参考毒株(表 1)的基因序列,使用MEGA 5.05软件中邻接法(neighbor-joining)构建遗传进化树,并用Bootstrap方法重复1 000次进行检验,其他参数使用默认值。
| Accession No. | Strain designation | Strain origin | Year | Host | Serotype |
| EU186072 | Black | USA | 1 980 | Cat | Ⅰ |
| FJ938051 | RM | USA | 2 002 | Cat | Ⅰ |
| KX722529 | UG-FH8 | Belgium | 2 015 | Cat | Ⅰ |
| DQ848678 | FCoV C1Je | UK | 2 007 | Cat | Ⅰ |
| KY292377 | HLJ/DQ/2016/01 | Heilongjiang, China | 2 016 | Cat | Ⅰ |
| KY566209 | HLJ/HRB/2016/10 | Heilongjiang, China | 2 016 | Cat | Ⅰ |
| KY566210 | HLJ/HRB/2016/11 | Heilongjiang, China | 2 016 | Cat | Ⅰ |
| KY566211 | HLJ/HRB/2016/13 | Heilongjiang, China | 2 016 | Cat | Ⅰ |
| DQ160294 | FCoV/NTU2/R/2003 | Taiwan, China | 2 016 | Cat | Ⅰ |
| AB535528 | C3663 | Japan | 1 994 | Cat | Ⅰ |
| FJ938059 | UU10 | Netherlands | 2 007 | Cat | Ⅰ |
| HQ392472 | UU30 | Netherlands | 2 008 | Cat | Ⅰ |
| JN183883 | UU54 | Netherlands | 2 010 | Cat | Ⅰ |
| AB695067 | Yayoi | Japan | 1 981 | Cat | Ⅰ |
| DQ010921 | FIPV 79-1146 | USA | 1 979 | Cat | Ⅱ |
| JQ408981 | DF-2 | USA | 1 981 | Cat | Ⅱ |
| JQ408980 | DF-2 R3i | USA | 1 981 | Cat | Ⅱ |
利用PCR对编号为SH1802、SH1807和SH1809的3个阳性样品的FIPV非结构蛋白基因ORF3、ORF7和S2进行扩增,将所扩增出的特异性目的片段进行了克隆和测序,将所测序列提交至GenBank,获得的序列登录号为MT112929~MT112937。
2.2 3株FIPV的ORF3基因序列分析从SH1802、SH1807和SH1809 3个样品中扩增得到FIPV的ORF3a基因总长度为213个核苷酸,均编码70个氨基酸(amino acid, aa),与血清Ⅰ型毒株编码的氨基酸长度一致。它们之间的核苷酸同源性为92.5%~96.2%,氨基酸同源性为91.5%~95.8%。SH1802、SH1807和SH1809与Ⅰ型毒株UG-FH8的核苷酸同源性分别为94.8%、93.9%和93.0%,与Ⅱ型毒株FIPV 79-1146的核苷酸同源性分别为71.4%、70.4%和71.4%。
从SH1802、SH1807和SH1809 3个样品中测得的病毒ORF3b基因的核苷酸存在突变,但不引起编码氨基酸数量(73个氨基酸)的改变,均与血清Ⅰ型毒株(除Black和FCoV C1Je外)编码的氨基酸长度一致。两者之间核苷酸同源性为90.1%~93.7%,氨基酸同源性为89.0%~91.8%。SH1802、SH1807和SH1809与Ⅰ型毒株UG-FH8的核苷酸同源性分别为91.9%、91.0%和88.3%,与Ⅱ型毒株FIPV 79-1146的核苷酸同源性分别为69.0%、67.6%和67.1%。SH1802、SH1807和SH1809与Black和FCoV C1Je之间核苷酸同源性为82.0%~92.5%,氨基酸同源性为77.0%~88.7%。
从SH1802、SH1807和SH1809 3个样品中测得的病毒ORF3c基因与大多数血清Ⅰ型非截短ORF3c基因一样,由714个核苷酸组成,编码237个氨基酸。它们之间核苷酸同源性为95.0%~96.1%,氨基酸同源性为92.4%~95.0%。SH1802、SH1807和SH1809与Ⅰ型毒株UG-FH8的核苷酸同源性分别为95.9%、94.8%和95.5%,与Ⅱ型毒株FIPV 79-1 146的核苷酸同源性分别为87.8%、86.9%和87.2%。
根据获得的ORF3c基因序列和GenBank中FIPV ORF3c基因的参考序列构建系统发育树(图 1),其中SH1802、SH1807和SH1809处于同一遗传进化分支,并与血清Ⅰ型国内外毒株均处于同一大的遗传进化分支;与血清Ⅱ型FIPV 79-1146、DF-2和DF-2 R3i处于不同分支,亲缘关系较远。

|
| 图 1 基于FIPV ORF3c基因序列的遗传进化树 Fig. 1 Phylogenetic tree based on ORF3c gene of FIPV |
从SH1802、SH1807和SH1809 3个样品中扩增得到的FIPV的ORF7a基因总长度为306个核苷酸,均编码101个氨基酸,与血清Ⅰ型和Ⅱ型毒株编码的氨基酸长度一致。它们之间核苷酸同源性为93.1%~95.4%,氨基酸同源性为94.1%~97.1%。SH1802、SH1807和SH1809与Ⅰ型毒株UG-FH8的核苷酸同源性分别为93.1%、94.4%和94.1%,与Ⅱ型毒株FIPV 79-1146的核苷酸同源性分别为93.8%、95.1%和93.1%。分析3株FIPV的附属蛋白ORF7a的氨基酸序列发现,第9位均为亮氨酸(Leu, L),第12位均为缬氨酸(Val, V),第47位则分别为异亮氨酸(Ile, I)、丝氨酸(Ser, S)和天冬酰胺(Asn, N),见图 2。

|
| Notes: Amino acids at positions 9, 12 and 47 of ORF7a are highlighted by black boxes. 图 2 FIPV非结构蛋白ORF7a氨基酸序列比对(注:方框标记的分别是第9、12和47位氨基酸) Fig. 2 Amino acids sequences alignments of ORF7 |
从SH1807和SH1809 2个样品中扩增得到的FIPV的ORF7b基因编码1个由206个氨基酸组成的蛋白质ORF7b,与血清Ⅰ型(Black除外)和Ⅱ型毒株编码的氨基酸长度一致。而样品SH1802和参考毒株FCoV/NTU2/R/2003均在ORF7b基因的第26~28位有3个连续核苷酸缺失,导致缺少1个氨基酸。与参考序列相比,它们有多个位点发生氨基酸的变化,但在第170位的氨基酸均为H。它们之间核苷酸同源性为91.1%~93.2%,氨基酸同源性为90.8%~92.2%。样品SH1802、SH1807和SH1809与Ⅰ型毒株UG-FH8的核苷酸同源性分别为90.9%、91.8%和92.9%,与Ⅱ型毒株FIPV 79-1146的核苷酸同源性分别为89.5%、91.3%和91.0%。
根据获得的FIPV ORF7b基因序列和GenBank中FIPV ORF7b基因的参考序列构建系统发育树(图 3),其中SH1802、SH1807和SH1809处于同一遗传进化分支,并与UU30、UU54和C3663亲缘关系最近,与其他血清Ⅰ型毒株(RM除外)均处于同一大的遗传进化分支;与血清Ⅰ型RM、血清Ⅱ型FIPV 79-1146、DF-2和DF-2 R3i处于不同分支,亲缘关系较远。

|
| 图 3 基于FIPV ORF7b基因序列的遗传进化树 Fig. 3 Phylogenetic tree based on ORF7b gene of FIPV |
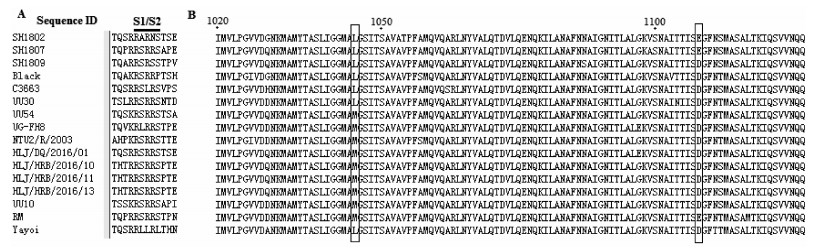
从SH1802、SH1807和SH1809 3个样品中扩增得到的S2基因序列之间核苷酸同源性为88.9%~90.1%,氨基酸同源性为92.4%~94.4%。它们与参考株S2基因序列的核苷酸相似性为64.6%~89.51%,氨基酸相似性为61.3%~95.6%。SH1802、SH1807和SH1809的S1/S2裂解位点处有连续的R-R-S/A-R-R-S序列模体(图 4A),符合FIPV裂解位点的氨基酸序列特征[8]。3个样品的S2蛋白在第1 045位存在甲硫氨酸(Met, M)被亮氨酸完全替换,即M1045L,第1 047位则没有发生变化,均为S;而SH1802、SH1807在1 108位也存在天冬氨酸(Asp, D)被谷氨酸(Glu, E)完全替换,即D1108E,而SH1809在该位置未发生替换(图 4B)。
|
|
A: Amino acids sequences analysis of spike S1/S2 site. B: Amino acids sequences alignments of the spike protein 2. Notes: Amino acids at positions 1 045 and 1 108 of S2 are highlighted by black boxes. 图 4 FIPV S蛋白氨基酸序列分析 Fig. 4 Amino acids sequences analysis of spike protein |
根据获得的S2基因序列和GenBank中FIPV S基因的参考序列构建系统发育树(图 5),其中SH1802、SH1807和SH1809处于同一遗传进化分支,并与HLJ/DQ/2016/01和UG-FH8亲缘关系最近,与其他血清Ⅰ型毒株均处于同一大的遗传进化分支;与血清Ⅱ型FIPV 79-1146、DF-2和DF-2 R3i处于不同分支,亲缘关系较远。

|
| 图 5 基于FIPV S2基因序列的遗传进化树 Fig. 5 Phylogenetic tree based on S2 gene of FIPV |
以往研究表明,所有FECV中的ORF3c基因均是完整的,完整的ORF3c基因被认为是FECV在肠道中有效复制所必需的,但对FIPV的复制则是非必需的[9]。在FIPV中,只有71.4%的ORF3c基因发生了突变,意味着ORF3c基因的突变并不是导致FIP的唯一原因[10]。本研究中的SH1802、SH1807和SH1809 3个样品均为患FIP猫的腹水样品,且病毒的ORF3c基因均为完整的3c基因,与以往研究结果一致。
ORF7b基因的缺失不仅存在于FECV中,而且也存在于FIPV中。然而,在大多数野毒株中没有发现ORF7b基因的缺失,意味着该基因的缺失与致病性无关[11]。本研究中3例患FIP猫的腹水样品里,有2例检测到具有完整的FIPV ORF7b基因,而1例存在3个核苷酸的缺失,这表明ORF7b基因的缺失与致病性无关。2例样品可以同时检测到具有完整ORF3c基因和完整ORF7b基因,而另1例检测到完整ORF3c基因和缺失3个核苷酸的ORF7b基因,推测ORF3c和ORF7b基因不是决定FCoV毒力的唯一因素,与之前报道的一致[5]。
据报道,在118个Ⅰ型FIPV中,95.8%的FIPV显示S基因中有M1058L或S1060A[以C1Je (DQ848678)为参考毒株],即M1045L或S1047A[以Black (EU186072)为参考毒株]的突变,而183个FECV样品中没有发生突变。这两个氨基酸位点的差异,可用于鉴别诊断FIPV和FECV两个生物型[12]。本研究中3株病毒的S蛋白第1 045位存在氨基酸的完全替换,即M1045L,第1 047位则没有发生变化,均为S。有研究认为,ORF3c和S基因的突变与FIP的发生有关[6, 7]。腹水标本中80%的FCoVs在S和3c基因中均有突变,余下的20%在S或3c基因中有突变,研究显示这两个基因中的一个或两个突变可能参与了FCoV组织嗜性的改变[6]。另有研究报道[13, 14],S蛋白的突变与FIP的发生机制有关。本研究中3株病毒的3c基因均是完整的,而S基因均在1 045位发生Met被Leu替换,因此推测S基因的突变可能参与了FCoV组织嗜性的改变。
本研究中的3株病毒在ORF7b基因的第170位氨基酸均为组氨酸(His, H),这与大部分FIPV在第170位氨基酸为H,而FECV在此位置为酪氨酸(Tyr, Y)的报道相一致[7]。有研究证明,与FECV的S1/S2位点模体序列R-R-S/A-R-R-S相比,FIPV在该区域表现出高度的变异性[8]。本研究的3株病毒的S1/S2裂解位点符合FIPV裂解位点的氨基酸序列特征。S1/S2位点的突变与病毒致病特性的改变有关,是FIP发生的关键因素[8]。
遗传进化分析结果表明,基于ORF3c、ORF7b和S2基因的进化树可以分成两个主要分支,即以Black为代表的血清型Ⅰ型毒株进化分支和以FIPV 79-1146为代表的血清型Ⅱ型毒株进化分支。目前,世界上主要流行的FIPV主要属于血清型Ⅰ型毒株[15]。值得注意的是,本研究中的3株病毒与血清型Ⅰ型毒株的亲缘关系最近,进一步证明这3株病毒属于血清型Ⅰ型毒株。目前国内对FIPV的分子流行病学研究较少,本研究结果提示,需要加强监测FIPV分子变异动态,加强对FIPV的风险评估,这将对FIP的预防和控制具有重要意义。
| [1] |
International Committee on Taxonomy of Viruses. ICTV Taxonomy History: Cornidovirineae[R/OL]. (2019-10-18). https://talk.ictvonline.org/taxonomy/p/taxonomy-history?taxnode_id=20186105.
|
| [2] |
Myrrha LW, Silva FM, Peternelli EF, Junior AS, Resende M, de Almeida MR. The paradox of feline coronavirus pathogenesis: a review[J]. Adv Virol, 2011, 2011: 109849.
[DOI]
|
| [3] |
Pedersen NC. A review of feline infectious peritonitis virus infection: 1963-2008[J]. J Feline Med Surg, 2009, 11(4): 225-258.
[DOI]
|
| [4] |
Vennema H, Poland A, Foley J, Pedersen NC. Feline infectious peritonitis viruses arise by mutation from endemic feline enteric coronaviruses[J]. Virology, 1998, 243(1): 150-157.
[DOI]
|
| [5] |
Borschensky CM, Reinacher M. Mutations in the 3c and 7b genes of feline coronavirus in spontaneously affected FIP cats[J]. Res Vet Sci, 2014, 97(2): 333-340.
[DOI]
|
| [6] |
Oguma K, Ohno M, Yoshida M, Sentsui, H. Mutation of the S and 3c genes in genomes of feline coronaviruses[J]. J Vet Med Sci, 2018, 80(7): 1094-1100.
[DOI]
|
| [7] |
Bank-wolf BR, Stallkamp I, Wiese S, Moritz A, Tekes G, Thiel HJ. Mutations of 3c and spike protein genes correlate with the occurrence of feline infectious peritonitis[J]. Vet Microbiol, 2014, 173(3-4): 177-188.
[DOI]
|
| [8] |
Licitra BN, Millet JK, Regan AD, Hamilton BS, Rinaldi VD, Duhamel GE, Whittaker GR. Mutation in spike protein cleavage site and pathogenesis of feline coronavirus[J]. Emerg Infect Dis, 2013, 19(7): 1066-1073.
[DOI]
|
| [9] |
Kipar A, Meli ML. Feline infectious peritonitis: still an enigma[J]. Vet Pathol, 2014, 51(2): 505-526.
[DOI]
|
| [10] |
Chang HW, de Groot RJ, Egberink HF, Rottier PJ. Feline infectious peritonitis: Insights into feline coronavirus pathobiogenesis and epidemiology based on genetic analysis of the viral 3c gene[J]. J Gen Virol, 2010, 91(Pt 2): 415-420.
[URI]
|
| [11] |
Lin CN, Su BL, Huang HP, Lee JJ, Hsieh MW, Chueh LL. Field strain feline coronaviruses with small deletions in ORF7b associated with both enteric infection and feline infectious peritonitis[J]. J Feline Med Surg, 2009, 11(6): 413-419.
[DOI]
|
| [12] |
Chang HW, Egberink HF, Halpin R, Spiro DJ, Rottier PJ. Spike protein fusion peptide and feline coronavirus virulence[J]. Emerg Infect Dis, 2012, 18(7): 1089-1095.
[DOI]
|
| [13] |
Lewis CS, Porter E, Matthews D, Kipar A, Tasker S, Helps CR, Siddell SG. Genotyping coronaviruses associated with feline infectious peritonitis[J]. J Gen Virol, 2015, 96(Pt 6): 1358-1368.
|
| [14] |
Porter E, Tasker S, Day MJ, Harley R, Kipar A, Siddell SG, Helps CR. Amino acid changes in the spike protein of feline coronavirus correlate with systemic spread of virus from the intestine and not with feline infectious peritonitis[J]. Vet Res, 2014, 45(1): 49.
[DOI]
|
| [15] |
Pedersen NC. An update on feline infectious peritonitis: virology and immunopathogenesis[J]. Vet J, 2014, 201(2): 123-32.
[DOI]
|
 2020, Vol. 15
2020, Vol. 15


