2. 云南省寄生虫病防治所, 云南 昆明 665000
2. Yunnan Institute of Parasitic Diseases, Kunming 665000, Yunnan Province, China
基孔肯亚病毒(chikungunya virus,CHIKV)是一种由埃及伊蚊和白纹伊蚊传播的蚊媒病毒,属于披膜病毒科甲病毒属,是具有包膜的单股正链RNA病毒。其潜伏期为2 d~6 d,感染后可引起基孔肯亚出血热。基孔肯亚出血热(Chikungunya hemorrhagic fever, CHICK)是一种伴有皮疹的发热性疾病,常伴随严重的可持续数月至数年的关节疼痛,因其高发病率和高传染性而引人注目。2005年在印度洋西部留尼汪岛流行期间,岛内三分之一人口被该病毒感染[1];2014年在加勒比海南部库拉索岛流行期间,岛内33%~50%的居民也被该病毒感染[2]。
CHIKV最初分离于1952—1953年间,发现地为非洲坦桑尼亚的马孔达部落,病名来自该部落的方言,意为患有严重关节疼痛的患者所采取的弯曲姿势[3]。随着后来更多毒株被陆续发现,根据E1包膜糖蛋白序列差异CHIKV被分为东非/中非/南非群、西非群和亚洲群等谱系[4]。
CHIK最初只在非洲流行,埃及伊蚊是病毒传播的主要媒介。从2004年起,CHIK开始向东非、印度洋岛屿[5]、南亚[6]、东南亚以及太平洋岛屿蔓延[7]。CHIK在非洲肯尼亚暴发期间,病毒E1糖蛋白发生A226V突变,导致之前只由埃及伊蚊传播的病毒获得了适应并通过白纹伊蚊有效传播的能力[8],由此CHIKV逐渐传播到了欧洲、中美洲、南美洲和美国[7]。目前,CHIK疫情已经在全世界94个国家有过报道[9]。
我国的CHIK病例主要以输入性病例为主,云南、广东、浙江、河南都曾报道过CHIK输入性病例。2010年9月,广东东莞、阳江两地出现国内首次CHIK流行,疫情持续了40 d,共造成253人感染[10]。在沉寂了多年后的2019年9月,云南瑞丽再次暴发了CHIK疫情,并在国内首次出现CHIKV的垂直传播,使我国对CHIK的防控形势更加严峻。CHIKV垂直传播发生的条件和机制是什么?危险因素有哪些?如何有效预防CHIKV的垂直传播?这一系列问题亟待解决。
本文总结了近年来CHIKV垂直传播的案例,对新生儿感染CHIKV的临床表现进行了归纳,对CHIKV垂直传播的可能方式和机制进行了探讨,并对目前用于CHIKV垂直传播的动物模型进行了回顾和展望。在此基础上,对CHIKV垂直传播的诊断、治疗和预防提出了一些自己的看法,以期为CHIKV及其垂直传播的深入研究提供帮助。
1 CHIKV垂直传播案例CHIKV垂直传播最早出现于2005年留尼汪岛疫情期间。Lenglet等[5]对2005年6月1日至2006年2月28日留尼汪岛南部感染CHIKV的160名孕妇进行了观察,结果发现,在9例妊娠早期感染CHIKV后流产的孕妇中,3例出现了胎儿子宫内死亡。9名孕妇均通过抗CHIKV IgM检测确诊,而反转录聚合酶链反应(reverse transcription polymerase chain reaction, RT-PCR)检测显示母亲血清中病毒RNA阴性,但羊水、胎盘以及胎儿大脑中病毒RNA均呈阳性。而在151名妊娠晚期感染CHIKV的女性中,只有2例发生了胎儿子宫内死亡。在这151名妊娠晚期感染的孕妇中,有118人在分娩时病毒血症为阴性,其新生儿均未见异常;有33人在分娩时病毒血症仍为阳性且伴有发热等症状,其所产新生儿中,有16例(48.5%)出现新生儿CHIK,有发热、皮疹等临床表现,且胎盘病毒检测为阳性。值得注意的是,在这33例孕妇中,因胎儿窘迫、胎儿心率异常、粪便吸入等原因,43.7%的孕妇以剖宫产手术的方式分娩,而在剖宫产手术时胎儿也可能因接触含病毒的血液而感染[5]。
2007年CHIK在斯里兰卡流行期间也出现了母婴垂直传播。在当年的4月1日至10月31日,该国的50名CHIKV感染孕妇中,有2例发生流产,1例发生胎儿子宫内死亡,均为孕早期感染。在41例由这些孕妇所生且有病例资料的新生儿中,10例有异常表现,其中7例抗CHIKV IgM抗体阳性。这10例孕妇的感染时间既有妊娠早期也有妊娠晚期,其新生儿临床表现差异也较大:从轻症的发热、嗜睡、皮疹到较为严重的心力衰竭、呼吸窘迫、癫痫、脑膜脑炎等。此外,CHIKV检测阴性的新生儿中也有5例出现房室隔缺损、动脉导管未闭、3岁后卵圆孔未闭等先天性疾病,还有11例出现皮肤色素沉着等症状[11]。
2014年到2015年,CHIK在美洲暴发期间,库拉索岛、哥伦比亚、巴西的萨尔瓦多等多地先后出现散发的CHIKV垂直传播病例。在库拉索岛,61名CHIKV感染孕妇所产的新生儿中,有3名被确诊感染,其中1名产妇在分娩前7周感染,新生儿出生1天后死亡;另2名产妇在分娩时均处于感染急性期,新生儿出生后出现发热、皮疹、抽搐等症状,经2~3周治疗后均已出院。此外,还有11例孕妇在产前1周内发生感染,其中2例新生儿出现感染症状并死亡,但CHIKV血清学检测阴性[2]。在哥伦比亚,8名感染CHIKV孕妇所产的新生儿在出生后出现严重的临床症状,其中3例死亡[12]。在巴西的萨尔瓦多,3名感染CHIKV孕妇所产的新生儿出现皮疹、发热和血液动力学障碍,其中1名伴有脑出血,病原学检测证实新生儿及产妇的血清和尿液CHIKV均为阳性[13-14]。2016年,Torres等[15]对2014~2015年中美洲和南美洲的169名有CHIK症状的新生儿进行了总结,指出CHIKV的垂直传播率为27.7%~48.29%,其发生率与剖宫产或自然分娩无关,新生儿病死率为5.3%。
2016年印度也出现了CHIKV的母婴垂直传播。在印度北部的新生儿三级护理中心,有16名新生儿被确诊为CHIKV感染,其中1名死于多器官衰竭和儿茶酚胺难治性低血压;其他新生儿则表现为发热、嗜睡、癫痫、皮疹等症状,但均无关节炎[6]。
2019年10月在云南瑞丽暴发的我国第2起CHIK疫情中,我们观察到2例CHIKV的垂直传播病例。2名分娩时伴有CHIKV感染的孕妇经剖宫产诞下3名新生儿,经PCR诊断均为CHIKV阳性,其中2名新生儿出现中度窒息、皮肤红疹、发热、皮肤黄染症状,但均无神经系统症状。这是我国首次出现的CHIKV垂直传播案例,提示我国不仅要重视CHIK的常规防控,也要重视CHIK流行时的母婴健康。
CHIKV垂直传播案例分布见图 1。
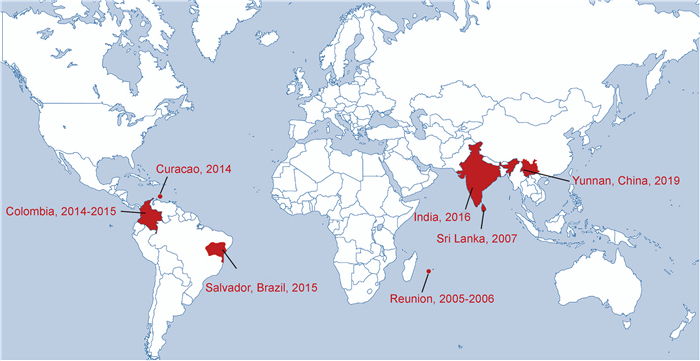
|
| 图 1 基孔肯亚病毒垂直传播案例分布图 Fig. 1 The distribution of Chikungunya virus vertical transmission cases |
通过分析归纳上述案例,尤其是信息相对完整的案例,不难发现CHIKV垂直传播所引起的胎儿/新生儿表现大致可分为两类(见表 1),一类是畸胎、死胎或流产,共8例,其中6例来自孕早期感染孕妇,2例来自孕晚期感染孕妇;另一类是新生儿CHIK或其它异常,共29例,其中21例来自分娩时正处于CHIKV感染急性期的产妇。
| Location and year | Teratology, fetaldeath or abortion Number of cases (time of infection) | Chikungunya fever or other abnormalities in newborn Number of cases (time of infection) |
| Reunion,2005[5] | 3(The first trimester),2(The third trimester) | 16(Delivery in acute infection) |
| Sri Lanka,2007[11] | 3(The first trimester) | 7(The first trimester or the third trimester) |
| Curacao,2014[2] | 1(The third trimester),2(Delivery in acute infection) | |
| Yunnan,China,2019 | 3(Delivery in acute infection) |
按照上述案例描述,新生儿CHIK多发生于分娩时仍有病毒血症的产妇所产的新生儿,其临床表现既具有成人CHIK的一些共性,也具有新生儿自身的一些特性。成人感染CHIKV后潜伏期约2 d~6 d,然后出现发热、皮疹和关节痛。CHIK为自愈性疾病,病程通常为1周。但关节症状通常在几天之内进行性加重,在感染恢复后仍可持续长达数月甚至数年,是该病最显著的特征。该病发热多为高热,对退烧药反应差[4]。皮疹多为面部和躯干部位短暂出现的斑丘疹,有时伴水肿或瘙痒[16]。多数患者会出现关节炎症状,表现为急性对称性双侧关节痛及关节肿胀,好发于指间关节、手腕和脚踝,近端关节也会因膝关节和肘关节的大面积积液而发炎[4]。在疾病急性期,口腔炎、口腔溃疡、剥脱性皮炎、囊泡、大疱和紫癜等皮疹也有报道,胃肠道症状也较常见[17]。少数患者会出现严重并发症,包括抽搐、脑膜脑炎以及吉兰巴雷综合征等中枢神经系统症状[18],以及心肌炎[19]、胰腺炎、内分泌失调、肾功能衰竭、呼吸衰竭、心血管疾病[4]等其他系统并发症。在实验室检查方面,CHIK患者主要表现为短暂的白细胞减少和淋巴细胞减少、轻度的血小板减少、C反应蛋白低水平升高和肝细胞溶解等[16-17]。
新生儿CHIK的临床表现和成人有许多相似之处。患儿CHIK通常在出生第1周内出现症状,潜伏期3 d~7 d,平均4 d[13]。新生儿症状均出现于出生后数天,而非出生当时,且潜伏期与成人相同,提示感染很可能发生在分娩期间,而不是分娩之前。患儿最常见症状包括发热和皮疹,其中皮疹可以为黄斑皮疹、红斑皮疹[14]、大疱性皮损,以及腋窝、口周和生殖器的色素沉着等多种表现。与成人相比,新生儿CHIK的一个显著特点是关节炎很少见[6]。除了发热和皮疹外,患儿还可出现嗜睡[6]、水肿[13]、呼吸窘迫[12]、心肌炎[12]、败血症[2, 12]、脑炎[2, 12, 14]、癫痫[2, 6, 13-14]等严重并发症,甚至死亡[2, 6, 12]。血小板减少症、淋巴细胞减少症和低凝血酶原症也有报道[13]。在这些并发症中,神经系统感染及其所引起的神经认知功能障碍[12]等慢性后遗症在新生儿中表现较为突出,这可能与新生儿血脑屏障及脑组织发育不完善有关。有调查表明50%的CHIK患儿会出现长期神经发育迟缓[20],包括协调能力和语言能力(57%)、社交能力(36%)、运动/姿势(27%)等特定神经认知发育迟缓。核磁共振扫描显示,患儿脑白质区域,主要是额叶区域[21],受到严重损害,这可能是患儿发生神经认知功能障碍等慢性后遗症的病理基础。
3 CHIKV垂直传播的可能方式及机制病原体的母婴垂直传播方式通常包括子宫内(经胎盘)传播、分娩时传播和产后传播。子宫内传播是指妊娠期间胎儿在子宫内发生感染,最常见的途径是病原体通过胎盘屏障由孕妇传给胎儿。经胎盘传播如果发生在孕早期,由于此时正是胎儿发育过程中器官形成的重要阶段,因此容易引起胎儿畸形、死胎及流产等后果。可以发生子宫内传播的典型病原体包括能够引起先天性风疹综合征的风疹病毒和引起新生儿小头畸形的寨卡病毒等[22]。目前缺乏有效的治疗措施对发生子宫内传播的胎儿进行干预,故需要尽量减少孕妇感染的风险。分娩时传播是指新生儿在分娩过程中发生感染,常见于新生儿通过产道时,皮肤、黏膜接触病原体而发生感染,典型的病原体包括能够引起新生儿淋菌性结膜炎的淋病奈瑟菌[23]以及引起肝炎的乙型肝炎(以下简称“乙肝”)病毒[24]。由于分娩时传播距新生儿出生时间很近,所以有机会通过主动免疫、被动免疫或者使用抗生素的方式进行治疗或预防。产后传播主要是指新生儿出生以后发生的感染,比如通过哺乳等途径。由于此时新生儿和产妇已是独立的个体,因此可以通过多种措施预防和治疗垂直传播的发生。需要说明的是,病原体通过母婴传播的途径可能不止一条,而是多种途径的组合,上述例子中的病原体也有可能通过其它方式发生母婴垂直传播。
国内外已有的CHIKV垂直传播的文章大多为病例报道,以及对新生儿感染症状和后遗症的研究,鲜有对CHIKV垂直传播方式及机制的研究,仅有的1篇针对机制的研究也只是利用恒河猴进行的动物实验。因此,CHIKV垂直传播的方式目前还不明确,其是否能够通过胎盘也存在争议。
不过,由于不同的垂直传播方式具有各自鲜明的特点,因此我们可以根据目前已有的临床观察进行初步推测。如前文所言,根据目前已经报道的病例,CHIKV垂直传播所引起的胎儿/新生儿表现可以分为两类,一类是畸胎、死胎或者流产,主要发生在孕早期感染CHIKV的孕妇。另一类是新生儿CHIK,多发生孕后期感染的孕妇,且分娩时仍有病毒血症。
对于第1类病例,从畸胎、流产以及孕早期感染等特点分析,其感染方式很可能是孕妇通过胎盘传播给胎儿。因为孕早期是胎儿主要器官形成的关键时期,胎儿在此时感染CHIKV会造成不可逆的后果,表现则以先天性畸胎、死胎和流产为主。对于第2类病例,从孕晚期和分娩时仍有病毒血症等特点分析,其感染方式很可能是通过产道(或剖宫产)由产妇传给新生儿。支持产道(或剖宫产)传播的其它证据还包括新生儿的临床表现,第2类病例的临床症状均出现在分娩后第1周内,潜伏期3 d~7 d,平均4 d,没有在出生后立刻表现出临床症状者,我们在瑞丽观察的3例新生儿垂直传播病例均符合以上特点,说明新生儿接触病毒的时间为分娩时,此后还需要经过数天的潜伏期才会发病。不过上述分析皆属推测,详细的机制还有待进一步实验证实。
4 CHIKV垂直传播动物模型的研究现状及展望如上文所言,目前针对CHIKV垂直传播的动物模型研究只有一篇报道,所使用的动物模型为恒河猴。在该研究中,Chen等[25]使用妊娠后期恒河猴经右臂皮下注射途径感染CHIKV,以模拟人的垂直传播,在感染21 d后,将母猴与胎猴处死,收集母猴和胎猴的血液、关节、心、脑、肾、脾、肝、淋巴、脊髓等组织以及母猴的乳腺、胎盘、羊水等组织,利用实时荧光定量PCR技术检测病毒RNA,并使用HE染色观察组织病理变化。结果发现,虽然此时母猴的病毒血症已消失,但在母猴的脾、淋巴组织、关节及关节周围组织和脊髓组织中均能检测到病毒RNA,而胎猴和胎盘中并未检测到病毒RNA,也未出现畸胎、死胎。这些结果提示,在恒河猴孕晚期感染CHIKV,病毒可能不通过胎盘感染胎猴,因此排除了孕晚期病毒经胎盘传播的可能性。需要指出的是,该研究的结论与留尼汪岛的临床观察存在一些差异。根据留尼汪岛的病例报道,CHIKV可以跨胎盘垂直传播,但是在恒河猴实验中,CHIKV却不能通过胎盘。临床观察和动物实验的差异该如何解释,目前还缺乏令人信服的说法。
该研究设计上的不完善或许是一种可能的原因。如上文分析,CHIKV垂直传播最可能的方式有两种,一种是孕早期经胎盘传播,引起胎儿畸形或流产;另一种是在分娩时经产道传播,引起新生儿CHIK。如果想验证第1种可能性,应该在恒河猴孕早期进行感染,之后取出母猴、胎猴及胎盘组织,对病毒RNA和病理改变进行分析。反之,如果想验证第2种可能性,则应在恒河猴分娩前1周内接种CHIKV,以保证母猴分娩时存在病毒血症,然后让其自然分娩,再对新生猴进行各项检查。如研究剖宫产的影响,还需经剖宫产取出胎猴。Chen等[25]的研究中,实验动物在孕晚期感染病毒,但并未让孕猴分娩,而是直接从宫内取出胎猴进行病毒检测。这样的研究策略虽然可以提供有力的证据,排除孕晚期CHIKV通过胎盘传播的可能性,但是却难以提供判断孕早期胎盘传播可能性以及分娩时经产道传播可能性的相应证据。在今后的灵长类动物实验中,上述两种垂直传播方式的可能性应该值得重点关注。
除了用灵长类动物研究垂直传播,用小鼠建立CHIKV垂直传播模型也值得考虑。因为小鼠具有价格低、生存力强、繁殖快等优点,故常用于各种疾病的动物模型。小鼠感染CHIKV的研究已有多篇报道。根据已有结果,野生型成年小鼠对CHIKV感染有抵抗力,只有干扰素受体部分或完全敲除的成年小鼠才会发生轻度或严重感染,不过野生型新生小鼠对CHIKV却比较易感[26]。小鼠经皮下接种CHIKV后,病毒可以在肌肉、关节甚至中枢神经系统中增殖,6 d~7 d时出现病毒血症,7 d~10 d内出现嗜睡、行走困难、后肢拖拉、体重增加减少等症状[27],在临床表现上与人类具有较高的相似性。虽然CHIKV垂直传播的小鼠模型尚未见诸报道,不过利用小鼠研究寨卡病毒垂直传播的模型已被广泛使用,或许借鉴寨卡病毒的技术能有助于未来建立CHIKV垂直传播小鼠模型。
5 CHIKV垂直传播的诊断、预防和治疗CHIKV垂直传播的诊断,尤其是发生在分娩时垂直传播的诊断,主要依靠临床表现和实验室诊断。CHIKV的实验室诊断主要依赖于血液样本中病毒RNA检测或CHIKV特异性IgM和IgG抗体检测。病毒RNA的检测主要通过定量RT-PCR(quantitative RT-PCR, qRT-PCR)。在症状发作后的第一周内,血浆样品中可检测到病毒RNA,此时病毒血症水平很高[28]。除血液外,其他多种体液和组织中也可检测到病毒RNA。在免疫学指标方面,患者在症状出现后5 d可以检测到CHIKV特异性IgM抗体,可持续数月。IgG比IgM晚1 d~2 d出现[29]。血清学结果必须排除其他虫媒病毒的干扰,因为他们之间可能存在交叉免疫反应。
母婴垂直传播的诊断不同于普通成人感染的诊断。在分娩后,需要对产妇和新生儿同时进行实验室检测,而在分娩前,则是对孕妇进行实验室检测。实验室检测阳性的孕妇对在其临近分娩时需要高度注意,如有可能,可以考虑推迟分娩时间。Escobar等[30]在研究中发现,经RT-PCR诊断感染CHIKV的60名孕妇中,15名孕妇在急性感染期间分娩,但有些人通过服用抗宫缩药延迟分娩直到发热发作之后,将其中12名新生儿进行CHIKV检测,未见新生儿病毒感染发生。孕妇在感染急性期过后分娩的新生儿没有CHIKV感染症状,这些结果提示CHIKV的垂直传播可以通过延迟分娩来预防。
针对CHIKV的疫苗和抗病毒药物的开发尚在进行,目前还没有疫苗或特异性的治疗方法获得批准。消灭蚊虫、切断传播途径等方式仍然是预防CHIKV感染的主要措施。目前在研究的CHIKV疫苗包括灭活疫苗、减毒活疫苗、亚单位疫苗、DNA疫苗和重组载体疫苗等多种形式。Tretyakova等[31]所采用的结合了DNA疫苗和减毒活疫苗优点的新型免疫DNA (iDNA)感染性克隆技术,可以在体外和体内从质粒中启动活疫苗病毒的复制,似乎是针对CHIKV和其他甲病毒的一种有前途的疫苗接种策略。针对CHIKV感染的治疗研究也尚处于实验室阶段,目前临床上仍以对症治疗为主。干扰素(interferon, IFN)虽然常用于抗病毒治疗,但Gardner等[32]认为IFN-α对于CHIK的治疗价值有限,不过可作为一种预防手段。具有中和活性的特异性单抗是目前抗病毒药物开发的一个重要方向,Pal和Dowd等[33]筛选出4个单克隆抗体(CHK-102、CHK-152、CHK-166和CHK-263),并证明它们对缺乏IFN受体的小鼠具有保护作用。其中保护效果最好的CHK-152已被人源化。如果可以证明CHIKV垂直传播的主要方式是分娩时经产道传播,那么预防新生儿感染CHIKV或许可以借鉴预防新生儿感染乙肝的策略,即出生后立即给新生儿接种乙肝疫苗,同时注射具有中和活性的乙肝免疫球蛋白,以达到阻断垂直传播的目的。不过,这些均有待CHIKV垂直传播方式被完全阐明。
6 结论随着CHIK流行范围的扩大,CHIKV所引起的母婴垂直传播成为一个必须重视的问题。新生儿感染后可能出现发育迟缓等严重后遗症,目前这方面的研究都相对较少。CHIKV垂直传播的机制目前也尚不清楚,根据临床表现分析,孕早期的跨胎盘传播和分娩时经产道(或剖宫产)传播是CHIKV最有可能的两种垂直传播方式。动物模型的缺乏使得完全阐明CHIKV垂直传播方式和机制还需要一段时间,改进已有的灵长类动物模型,开发小鼠动物模型应该是未来研究的主要方向。虽然目前针对CHIK还缺乏特异性预防和治疗手段,不过,对于临近分娩时有病毒血症的孕妇来说,推迟分娩或许有助于降低CHIKV垂直传播的风险。总之,对于CHIK可能流行的国家,临床医生应该熟悉CHIKV垂直传播的可能性及其后果,了解CHIKV垂直传播的预防手段,此类知识将有助于改善CHIKV的垂直传播。
| [1] |
Josseran L, Paquet C, Zehgnoun A, Caillere N, Le Tertre A, Solet JL, Ledrans M. Chikungunya disease outbreak, Reunion Island[J]. Emerg Infect Dis, 2006, 12(12): 1994-1995.
[DOI]
|
| [2] |
van Enter BJD, Huibers MHW, van Rooij L, Steingrover R, van Hensbroek MB, Voigt RR, Hol J. Perinatal outcomes in vertically infected neonates during a chikungunya outbreak on the island of Curacao[J]. Am J Trop Med Hyg, 2018, 99(6): 1415-1418.
[DOI]
|
| [3] |
Robinson MC. An epidemic of virus disease in Southern Province, Tanganyika Territory, in 1952-53. I. Clinical features[J]. Trans R Soc Trop Med Hyg, 1955, 49(1): 28-32.
[DOI]
|
| [4] |
Simon F, Javelle E, Oliver M, Leparc-Goffart I, Marimoutou C. Chikungunya virus infection[J]. Curr Infect Dis Rep, 2011, 13(3): 218-228.
[DOI]
|
| [5] |
Lenglet Y, Barau G, Robillard P Y, Randrianaivo H, Michault A, Bouveret A, Gérardin P, Boumahni B, Touret Y, Kauffmann E, Schuffenecker I, Gabriele M, Fourmaintraux A. Infection à Chikungunya chez la femme enceinte et risque de transmission materno-fœtale[J]. J Gynecol Obstet Biol Reprod, 2006, 35(6): 578-583.
[DOI]
|
| [6] |
Kumar S, Agrawal G, Wazir S, Kumar A, Dubey S, Balde M, Yadav BS. Experience of perinatal and neonatal chikungunya virus (CHIKV) infection in a tertiary care neonatal centre during outbreak in North India in 2016: a case series[J]. J Trop Pediatr, 2019, 65(2): 169-75.
[DOI]
|
| [7] |
Hamer DH, Chen LH. Chikungunya: establishing a new home in the Western hemisphere[J]. Ann Intern Med, 2014, 161(11): 827-828.
[DOI]
|
| [8] |
Schuffenecker I, Iteman I, Michault A, Murri S, Frangeul L, Vaney MC, Lavenir R, Pardigon N, Reynes JM, Pettinelli F, Biscornet L, Diancourt L, Michel S, Duquerroy S, Guigon G, Frenkiel MP, Brehin AC, Cubito N, Desprès P, Kunst F, Rey FA, Zeller H, Brisse S. Genome microevolution of chikungunya viruses causing the Indian Ocean outbreak[J]. PLoS Med, 2006, 3(7): e263.
[DOI]
|
| [9] |
Nsoesie EO, Kraemer MU, Golding N, Pigott DM, Brady OJ, Moyes CL, Johansson MA, Gething PW, Velayudhan R, Khan K, Hay SI, Brownstein JS. Global distribution and environmental suitability for chikungunya virus, 1952 to 2015[J]. Euro Surveill, 2016, 21(20).
[DOI]
|
| [10] |
Wu D, Wu J, Zhang Q, Zhong H, Ke C, Deng X, Guan D, Li H, Zhang Y, Zhou H, He J, Li L, Yang X. Chikungunya outbreak in Guangdong Province, China, 2010[J]. Emerg Infect Dis, 2012, 18(3): 493-495.
[DOI]
|
| [11] |
Senanayake MP, Senanayake SM, Vidanage KK, Gunasena S, Lamabadusuriya SP. Vertical transmission in chikungunya infection[J]. Ceylon Med J, 2009, 54(2): 47-50.
[DOI]
|
| [12] |
Villamil-Gómez W, Alba-Silvera L, Menco-Ramos A, Gonzalez-Vergara A, Molinares-Palacios T, Barrios-Corrales M, Rodríguez-Morales AJ. Congenital chikungunya virus infection in Sincelejo, Colombia: a case series[J]. J Trop Pediatr, 2015, 61(5): 386-392.
[DOI]
|
| [13] |
Lyra PP, Campos GS, Bandeira ID, Sardi SI, Costa LF, Santos FR, Ribeiro CA, Jardim AM, Santiago AC, de Oliveira PM, Moreira LM. Congenital chikungunya virus infection after an outbreak in Salvador, Bahia, Brazil[J]. AJP Rep, 2016, 6(3): e299-e300.
[DOI]
|
| [14] |
Bandeira AC, Campos GS, Sardi SI, Rocha VF, Rocha GC. Neonatal encephalitis due to Chikungunya vertical transmission: First report in Brazil[J]. IDCases, 2016, 5: 57-59.
[DOI]
|
| [15] |
Torres JR, Falleiros-Arlant LH, Dueñas L, Pleitez-Navarrete J, Salgado DM, Castillo JB. Congenital and perinatal complications of chikungunya fever: a Latin American experience[J]. Int J Infect Dis, 2016, 51: 85-88.
[DOI]
|
| [16] |
Simon F, Parola P, Grandadam M, Fourcade S, Oliver M, Brouqui P, Hance P, Kraemer P, Mohamed A A, de Lamballerie X, Charrel R, Tolou H. Chikungunya infection: an emerging rheumatism among travelers returned from Indian Ocean islands. Report of 47 cases[J]. Medicine (Baltimore), 2007, 86(3): 123-137.
[DOI]
|
| [17] |
Borgherini G, Poubeau P, Staikowsky F, Lory M, Le Moullec N, Becquart JP, Wengling C, Michault A, Paganin F. Outbreak of chikungunya on Reunion Island: early clinical and laboratory features in 157 adult patients[J]. Clin Infect Dis, 2007, 44(11): 1401-1407.
[DOI]
|
| [18] |
Tournebize P, Charlin C, Lagrange M. [Neurological manifestations in Chikungunya: about 23 cases collected in Reunion Island][J]. Rev Neurol (Paris), 2009, 165(1): 48-51.
[DOI]
|
| [19] |
Simon F, Paule P, Oliver M. Chikungunya virus-induced myopericarditis: toward an increase of dilated cardiomyopathy in countries with epidemics?[J]. Am J Trop Med Hyg, 2008, 78(2): 212-213.
[DOI]
|
| [20] |
Contopoulos-Ioannidis D, Newman-Lindsay S, Chow C, LaBeaud AD. Mother-to-child transmission of Chikungunya virus: a systematic review and meta-analysis[J]. PLoS Negl Trop Dis, 2018, 12(6): e0006510.
[DOI]
|
| [21] |
Gérardin P, Sampériz S, Ramful D, Boumahni B, Bintner M, Alessandri JL, Carbonnier M, Tiran-Rajaoefera I, Beullier G, Boya I, Noormahomed T, Okoï J, Rollot O, Cotte L, Jaffar-Bandjee MC, Michault A, Favier F, Kaminski M, Fourmaintraux A, Fritel X. Neurocognitive outcome of children exposed to perinatal mother-to-child Chikungunya virus infection: the CHIMERE cohort study on Reunion Island[J]. PLoS Negl Trop Dis, 2014, 8(7): e2996.
[DOI]
|
| [22] |
Arora N, Sadovsky Y, Dermody TS, Coyne CB. Microbial vertical transmission during human pregnancy[J]. Cell Host Microbe, 2017, 21(5): 561-567.
[DOI]
|
| [23] |
Chang JH, Huang YL, Chen CC, Li SY. Vertical transmission of Neisseria gonorrhoeae to a female premature neonate with congenital pneumonia[J]. J Formos Med Assoc, 2013, 112(10): 648-649.
[DOI]
|
| [24] |
Mavilia MG, Wu GY. Mechanisms and prevention of vertical transmission in chronic viral hepatitis[J]. J Clin Transl Hepatol, 2017, 5(2): 119-129.
[DOI]
|
| [25] |
Chen CI, Clark DC, Pesavento P, Lerche NW, Luciw PA, Reisen WK, Brault AC. Comparative pathogenesis of epidemic and enzootic Chikungunya viruses in a pregnant Rhesus macaque model[J]. Am J Trop Med Hyg, 2010, 83(6): 1249-1258.
[DOI]
|
| [26] |
Couderc T, Chrétien F, Schilte C, Disson O, Brigitte M, Guivel-Benhassine F, Touret Y, Barau G, Cayet N, Schuffenecker I, Desprès P, Arenzana-Seisdedos F, Michault A, Albert ML, Lecuit M. A mouse model for Chikungunya: young age and inefficient type-I interferon signaling are risk factors for severe disease[J]. PLoS Pathog, 2008, 4(2): e29..
[DOI]
|
| [27] |
Ziegler SA, Lu L, da Rosa AP, Xiao SY, Tesh RB. An animal model for studying the pathogenesis of chikungunya virus infection[J]. Am J Trop Med Hyg, 2008, 79(1): 133-139.
[DOI]
|
| [28] |
Jaffar-Bandjee MC, Das T, Hoarau JJ, Krejbich Trotot P, Denizot M, Ribera A, Roques P, Gasque P. Chikungunya virus takes centre stage in virally induced arthritis: possible cellular and molecular mechanisms to pathogenesis[J]. Microbes Infect, 2009, 11(14-15): 1206-1218.
[DOI]
|
| [29] |
Niedrig M, Zeller H, Schuffenecker I, Drosten C, Emmerich P, Rumer L, Donoso-Mantke O. International diagnostic accuracy study for the serological detection of chikungunya virus infection[J]. Clin Microbiol Infect, 2009, 15(9): 880-884.
[DOI]
|
| [30] |
Escobar M, Nieto AJ, Loaiza-Osorio S, Barona JS, Rosso F. Pregnant women hospitalized with chikungunya virus infection, Colombia, 2015[J]. Emerg Infect Dis, 2017, 23(11): 1777-1783.
[DOI]
|
| [31] |
Tretyakova I, Hearn J, Wang E, Weaver S, Pushko P. DNA vaccine initiates replication of live attenuated chikungunya virus in vitro and elicits protective immune response in mice[J]. J Infect Dis, 2014, 209(12): 1882-1890.
[DOI]
|
| [32] |
Gardner J, Anraku I, Le TT, Larcher T, Major L, Roques P, Schroder WA, Higgs S, Suhrbier A. Chikungunya virus arthritis in adult wild-type mice[J]. J Virol, 2010, 84(16): 8021-8032.
[DOI]
|
| [33] |
Pal P, Dowd KA, Brien JD, Edeling MA, Gorlatov S, Johnson S, Lee I, Akahata W, Nabel GJ, Richter MK, Smit JM, Fremont DH, Pierson TC, Heise MT, Diamond MS. Development of a highly protective combination monoclonal antibody therapy against Chikungunya virus[J]. PLoS Pathog, 2013, 9(4): e1003312.
[DOI]
|
 2021, Vol. 16
2021, Vol. 16


