2. 山东第一医科大学第一附属医院(山东省千佛山医院)检验医学科,山东省医药卫生临床检验诊断学重点实验室,山东 济南 250000;
3. 中国疾病预防控制中心传染病预防控制所,传染病预防控制国家重点实验室,北京 102206;
4. 海南省三亚市人民医院检验科,中心实验室,海南 三亚 572000
2. Department of Clinical Laboratory Medicine, The First Affiliated Hospital of Shandong First Medical University & Shandong Provincial Qianfoshan Hospital, Shandong Medicine and Health Key Laboratory of Laboratory Medicine, Jinan 250000, Shandong Province, China;
3. National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
4. Central and Clinical Laboratory of Sanya People's Hospital, Sanya 572000, Hainan Province, China
棒状杆菌属(Corynebacterium)是一类无芽孢,大多数菌株为无动力的革兰染色阳性杆菌,主要寄生在人的鼻腔、咽喉、眼结膜、外阴、皮肤等部位。一般无致病性,通常被认为是皮肤和黏膜的正常菌群[1-2]。然而,近年来已有大量研究表明棒状杆菌存在潜在致病力,特别是纹带棒状杆菌(Corynebacterium striatum, Cs),为多种院内感染的病原体,如败血症[1]、呼吸道感染[2-3]等。纹带棒状杆菌作为条件致病菌,它的多重耐药性特征使其成为一种院内感染病原体,且在免疫力低下人群中的感染率日趋增高[2-6]。为了解我国纹带棒状杆菌的药物敏感性特征,本研究对2017年3月—2020年6月山东省某三甲医院临床分离的83株纹带棒状杆菌进行抗菌药物敏感性检测,并探讨其耐药机制,期望为该菌的防治提供参考。
1 材料与方法 1.1 材料 1.1.1 主要仪器与试剂主要仪器:生化培养箱(山东博科生物产业有限公司)、B2生物安全柜(北京东联公司)、恒温金属浴(北京大龙兴创实验仪器股份有限公司)、基因扩增热循环仪(西安天隆科技有限公司)、电泳仪(美国伯乐公司),超微量分光光度计(德国Lmplen公司),实时荧光定量PCR仪(西安天隆科技有限公司)。主要试剂:哥伦比亚血平板(英国OXOID公司),核酸染料Gold View(北京索莱宝科技有限公司),细菌基因组DNA、RNA提取试剂盒[天根生化科技(北京)有限公司],TB Green® Premix Ex TaqTM Ⅱ (日本TAKARA公司),四环素盐酸盐、红霉素盐酸盐(上海YEASEN公司),所有试剂均按说明书指定条件保藏并在有效期内使用。药敏板购自上海星佰生物技术有限公司,均在有效期内使用并按产品说明书保存。耐药基因检测引物设计如表 1所示,由北京天一辉远生物技术有限公司合成。
| Name | Sequence(5’→3’) | Tm (℃) | Size (bp) | Reference |
| gyrA | F:GCGGCTACGTAAAGTCC | 55 | 400 | [7] |
| R:CCGCCGGAGCCGTTCAT | ||||
| ermX | F:AACCATGATTGTGTTTCTGAACG | 52 | 566 | [7] |
| R:ACCAGGAAGCGGTGCCCT | ||||
| tetW | F:GAGAACCAATCAGCCGGGAA | 54 | 450 | [8] |
| R:GGTCCTCACGCCACCTTTTA | ||||
| aph(3”)-Ⅰb | F:CTTGGTGATAACGGCAATTC | 50 | 548 | [9] |
| R:CCAATCGCAGATAGAAGGC | ||||
| aph(6)-Ⅰd | F:ATCGTCAAGGGATTGAAACC | 52 | 509 | [9] |
| R:GGATCGTAGAACATATTGGC | ||||
| aac(6’)-Ⅰb | F:TTGCGATGCTCTATGAGTGGCTA | 58 | 482 | [9] |
| R:CTCGAATGCCTGGCGTGTTT | ||||
| secA | F:TCCAGTCCTCGACATAGC | 54 | 146 | this study |
| R:CAATGAGCAGCGCAAGG | ||||
| ermX(qPCR) | F:ACCTCACCACTGCCATTC | 54 | 132 | this study |
| R:ACCACTGAGCCGTCATC | ||||
| tetW(qPCR) | F:GCCACACCATCCATATCG | 54 | 91 | this study |
| R:TGTACACCGGAGCCAAG |
本研究收集的83株实验菌株来源于山东某三甲医院2017年3月—2020年6月分离的纹带棒状杆菌(已剔除重复菌株)。在哥伦比亚血琼脂平板上35 ℃过夜培养,并用16SrDNA进行扩增,扩增产物送北京睿博兴科生物技术有限公司进行测序,用blast进行序列比对。细菌基因组DNA提取严格按照TIANGEN生物公司试剂盒说明的方法进行,并采用紫外分光光度计进行检测,制备好的DNA于-20 ℃保存备用。
1.2 方法 1.2.1 药物敏感性检测根据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)推荐的抗菌药物敏感性实验执行标准[10],采用微量肉汤稀释法检测83株纹带棒状杆菌对12种常用药物的敏感性,按照CLSI的标准,判定菌株对每种药物的最低抑菌浓度(minimal inhibitory concentration, MIC)范围,确定MIC50、MIC90值。肺炎链球菌ATCC49619和大肠埃希菌ATCC25922作为质控菌株,标准菌株由中国疾病预防控制中心提供。以2016年M45-ED3(CLSI)文件[10]作为折点判断标准,确定12种抗生素的MIC值。所有实验操作均在P2级生物安全实验室完成。
1.2.2 耐药基因检测采用PCR对四环素抗性核糖体保护蛋白基因(tetW)、核糖体甲基化酶基因(ermX)、喹诺酮类药物耐药基因(gyrA)、3种氨基糖苷类修饰酶基因[aph(3”)-Ⅰb、aph(6)-Ⅰd、aac(6’)-Ⅰb]进行检测。PCR总反应体系25 μL:2 Χ PCR Master 12.5 μL,上、下游引物各1 μL,ddH2O 9.5 μL,DNA模板1 μL。PCR反应中使用到的引物信息如表 1所示。5 μL PCR产物经1.5%琼脂糖凝胶电泳后,在紫外灯下观察结果。阳性产物送北京睿博兴科生物技术有限公司测序,测序结果用blast进行比对分析。
1.2.3 基因表达差异分析检测采用微量肉汤稀释法检测3株纹带棒状杆菌的最低抑菌浓度(见表 6),在不同浓度的红霉素、环丙沙星作用下,对ermX和tetW基因的表达进行干预。在哥伦比亚血平板上接种纹带棒状杆菌,35 ℃过夜培养后取单菌落置于液体脑心浸液肉汤BHI培养基,37 ℃,180 r/min过夜培养。将菌液以1∶100转接于20 mL液体BHI,每种药物接种3管,其中1管不加药物作为对照,其余2管分别加入该菌株的50% MIC、25%MIC浓度的该药物,37 ℃,180 r/min过夜培养。5000 r/min离心10 min,弃上清,之后用去离子水洗3次。按照细菌总RNA提取试剂盒说明方法提取细菌的总RNA,按照逆转录试剂盒说明方法将RNA逆转录为cDNA,随后按照荧光定量试剂盒说明推荐方法进行PCR扩增。PCR反应体系:2 Χ SYBR Green 10 μL; 上、下游引物各0.4 μL; Rox Reference Dye II 0.4 μL; 灭菌蒸馏水6.8 μL; 模板2 μL。扩增条件具体如下。扩增曲线:95 ℃预变性20 s,95 ℃变性10 s,54 ℃退火34 s。溶解曲线:95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,60 ℃ 15 s。采用公式2-ΔΔCt计算基因相对表达量差异倍数。
2 结果 2.1 菌株基本情况经16S rDNA扩增及序列分析显示,实验菌株均为纹带棒状杆菌。83株纹带棒状杆菌样本来源及分布病区如表 2、表 3所示。
| Sample Type | Number (% total cultures) |
| Sputum | 44(53.0) |
| Blood | 17(20.5) |
| Swab | 5(6.0) |
| Urine | 4(4.8) |
| Catheter | 4(4.8) |
| Cerebrospinal fluid | 3(3.6) |
| Drainage fluid | 2(2.4) |
| Pleuroperitonealfluid | 2(2.4) |
| Secretion | 1(1.2) |
| Isolation Units | Number | Isolation Units | Number | |
| ICU | 40 | PRG | 1 | |
| Neurosurgery Department | 11 | Vasculocardiology Department | 1 | |
| Nephrology | 7 | Bone Trauma Surgery | 1 | |
| HCND | 3 | Rehabilitation Medicine Department | 1 | |
| HCRM | 3 | Cerebrovascular Neurosurgery | 1 | |
| Hepatological Surgery | 3 | Gastroenterology Department | 1 | |
| HCCD | 2 | Cardiac Surgery | 1 | |
| Critical Care Neurosurgery | 2 | Extracardiac Care unit | 1 | |
| Neurology Department | 2 | Oncology Department | 1 | |
| Pneumology Department | 1 | |||
| ICU:Intensive Care Unit. HCND: Health Care Neurology Department. HCRM: Health Care Respiratory Medicine. HCCD: Health Care Cardiology Department. PRG: Pediatric Respiratory Gastroenterology. | ||||
83株纹带棒状杆菌对12种抗生素的敏感性结果如表 4所示。纹带棒状杆菌对万古霉素、利奈唑胺100%敏感,对红霉素(MIC50>16 μg/mL、MIC90>16 μg/mL)、环丙沙星(MIC50>32 μg/mL、MIC90>32 μg/mL)、克林霉素(MIC50>16 μg/mL、MIC90>16 μg/mL)均表现出完全耐药,对青霉素、头孢噻肟、美罗培南的耐药率分别为97.6%、95.2%、92.8%,对四环素的耐药率为86.7%,对庆大霉素的耐药率为38.6%,对多西环素和利福平的耐药率最低,分别为13.3%和6.0%。
| Antibiotic | Number of resistant (% total cultures) | MIC50(μg/mL) | MIC90(μg/mL) | Breakpoints[10] | ||
| S | I | R | ||||
| Penicillin | 81(97.6) | >16 | >16 | ≤0.12 | 0.25~2 | ≥4 |
| Cefotaxime | 79(95.2) | >32 | >32 | ≤1 | 2 | ≥4 |
| Meropenem | 77(92.8) | >32 | >32 | ≤0.25 | 0.5 | ≥1 |
| Gentamycin | 32(38.6) | 4 | >64 | ≤4 | 8 | ≥16 |
| Erythromycin | 83(100) | >16 | >16 | ≤0.5 | 1 | ≥2 |
| Ciprofloxacin | 83(100) | 32 | >32 | ≤1 | 2 | ≥4 |
| Doxycycline | 11(13.3) | 8 | 16 | ≤4 | 8 | ≥16 |
| Tetracycline | 72(86.7) | 32 | 64 | ≤4 | 8 | ≥16 |
| Clindamycin | 83(100) | >32 | >32 | ≤0.5 | 1~2 | ≥4 |
| Rifampicin | 5(6.0) | <0.25 | <0.25 | ≤1 | 2 | ≥4 |
| Vancomycin | 0(0) | 0.5 | 0.5 | ≤2 | - | - |
| Linezolid | 0(0) | <0.25 | <0.25 | ≤2 | - | - |
| S: susceptible. I: intermediate. R: resistant. “-”: no basis for judgment. | ||||||
83株菌均检测到喹诺酮类药物耐药基因(gyrA); ermX基因的检出率为100%;在四环素耐药菌株中,tetW基因的检出率为88%;在庆大霉素耐药的菌株中,aph(3”)-Ⅰb基因的检出率为36.1%、aph(6)-Ⅰd基因的检出率为37.3%、aac(6’)-Ⅰb基因的检出率为15.7%。具体结果如表 5所示。
| Antibiotic | Gene | Rate of drug resistance (%) | Rate of drug resistance gene (%) |
| Erythromycin | ermX | 100 | 100 |
| Clindamycin | ermX | 100 | 100 |
| Tetracycline | tetW | 86.7 | 88.0 |
| Ciprofloxacin | gyrA | 100 | 100 |
| Gentamycin | aph(3”)-Ⅰb | 38.6 | 36.1 |
| aph(6)-Ⅰd | 38.6 | 37.3 | |
| aac(6’)-Ⅰb | 38.6 | 15.7 |
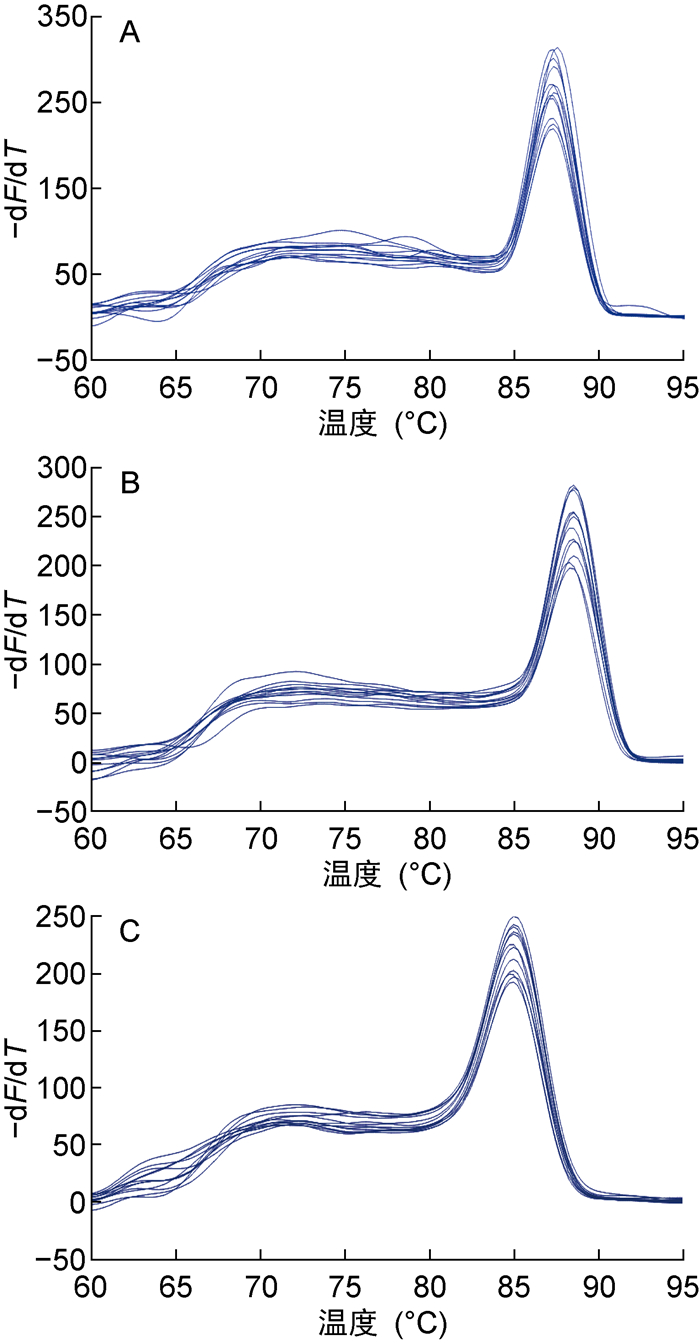
荧光定量PCR结果表明,在不同浓度的红霉素、四环素的作用下,ermX和tetW基因的相对表达量差异倍数结果如表 6所示。ermX和tetW基因的相对表达量均有所变化,但变化不明显。部分扩增产物溶解曲线如图 1所示,候选基因的溶解曲线均为单峰,说明所设计的引物特异性良好。
| Strain | MIC(ERY)(μg/mL) | MIC(TET)(μg/mL) | ermX | tetW | |||
| 50%MIC | 25%MIC | 50%MIC | 25%MIC | ||||
| Cs763 | 2 560 | 32 | 0.76 | 1.66 | 0.66 | 0.38 | |
| Cs766 | 2 560 | 32 | 0.48 | 0.71 | 1.27 | 0.60 | |
| Cs776 | 16 | 32 | 1.89 | 1.66 | 3.25 | 1.75 | |
| Cs:Corynebacterium striatum. ERY: Erythromycin. TET: Tetracycline. | |||||||
|
| A: secA; B: ermX; C: tetW. 图 1 耐药基因的溶解曲线 Fig. 1 Dissolution curve of drug resistance gene |
本研究从医院临床标本中获得了83株纹带棒状杆菌(Cs),其中ICU病区的最多,占比48%(40株); 从痰液标本中获得了44株(53%)。Verroken等[3]在进行流行病学分析时发现,当在医院发现1株新的纹带棒状杆菌时,至少会有1名患者被收入ICU病区或是呼吸道感染科室,而本研究中ICU病区有27例的临床诊断是呼吸道感染,结果与文献报道类似。本研究的菌株是否来自同一克隆群,进一步的分子流行病学分析将提供重要的线索。
药物敏感性分析表明,83株纹带棒状杆菌均为多重耐药菌株,而来自北京、广东、河北唐山地区医院的分离菌株的多重耐药率分别为88.8%、100%、97.3%[8]。此外,重庆地区医院分离菌株同样表现出100%多重耐药率[11]。本研究中的菌株对红霉素、环丙沙星、克林霉素表现出完全耐药,对万古霉素、利奈唑胺表现出完全敏感,这与在河南地区某医院分离的纹带棒状杆菌有相似的耐药谱[12],同样的情况也出现在内蒙古地区[13]。这和国外的情况亦类似[1, 3, 14-17],例如:2010—2014年从日本医院分离的24株纹带棒状杆菌对万古霉素(MIC50为0.5 μg/mL、MIC90为0.5 μg/mL)完全敏感,对喹诺酮类药物(MIC50>16 μg/mL、MIC90>16 μg/mL)完全耐药,对克林霉素(MIC50>8 μg/mL、MIC90>8 μg/mL)也表现出完全耐药[1]; 2011年1月—8月在美国伦敦医院分离的24株纹带棒状杆菌也表现出了相似的耐药谱,对红霉素、克林霉素耐药,对万古霉素敏感[3]。
通常,双歧杆菌和棒状杆菌对红霉素类耐药是由菌株的染色体携带ermX基因所致[18]。本研究中对红霉素和克林霉素耐药的菌株均检测到ermX基因,提示纹带棒状杆菌携带的核糖体甲基化酶基因使红霉素作用靶点的核糖体蛋白甲基化,从而降低药物作用,这是纹带棒状杆菌对红霉素耐药的潜在机制。50%MIC、25%MIC红霉素作用浓度对ermX基因的表达无显著影响,提示耐药菌株对红霉素的耐药方式属于内在型耐药[19-20],无论诱导剂存在与否,核糖体甲基化酶基因(ermX)都可持续而稳定的表达。
杨雪静等[18]的研究发现,纹带棒状杆菌对四环素的耐药性主要与tet基因簇有关。本研究中除1株对四环素耐药的菌株未检测到tetW基因,其余耐药菌株均扩增到了tetW基因。测序结果与耐药质粒Pja144188的tetW基因相似度为99%。研究发现,在50%MIC、25%MIC四环素浓度作用下,tetW基因的表达无显著变化,推测tetW基因编码核糖体保护蛋白继而对四环素等产生耐药性是一个稳定表达的过程,并不会因为药物是否存在而改变其表达。
本研究对山东地区分离的83株纹带棒状杆菌进行了药物敏感性、耐药机制检测。结果显示,该地区的纹带棒状杆菌有较广的耐药谱和耐药基因携带率。这将为后续的纹带棒状杆菌耐药流行病学研究及院内感染防控提供参考,而对于纹带棒状杆菌的耐药机制还须进一步研究。
| [1] |
Ishiwada N, Watanabe M, Murata S, Takeuchi N, Taniguchi T, Igari H. Clinical and bacteriological analyses of bacteremia due to Corynebacterium striatum[J]. J Infect Chemother, 2016, 22(12): 790-793.
[PubMed]
|
| [2] |
Gomila M, Renom F, Gallegos Mdel C, Garau M, Guerrero D, Soriano JB, Lalucat J. Identification and diversity of multiresistant Corynebacterium striatum clinical isolates by MALDI-TOF mass spectrometry and by a multigene sequencing approach[J]. BMC Microbiol, 2012, 12(1): 52.
[DOI]
|
| [3] |
Verroken A, Bauraing C, Deplano A, Bogaerts P, Huang D, Wauters G, Glupczynski Y. Epidemiological investigation of a nosocomial outbreak of multidrug-resistant Corynebacterium striatum at one Belgian university hospital[J]. Clin Microbiol Infect, 2014, 20(1): 44-50.
[PubMed]
|
| [4] |
Renom F, Gomila M, Garau M, Gallegos MD, Guerrero D, Lalucat J, Soriano JB. Respiratory infection by Corynebacterium striatum: epidemiological and clinical determinants[J]. New Microbes New Infect, 2014, 2(4): 106-114.
[DOI]
|
| [5] |
McMullen AR, Anderson N, Wallace MA, Shupe A, Burnham CA. When good bugs go bad: epidemiology and antimicrobial resistance profiles of Corynebacterium striatum, an emerging multidrug-resistant, opportunistic pathogen[J]. Antimicrob Agents Chemother, 2017, 61(11): 1111-1117.
|
| [6] |
Nudel K, Zhao X, Basu S, Dong X, Hoffmann M, Feldgarden M, Allard M, Klompas M, Bry L. Genomics of Corynebacterium striatum, an emerging multidrug-resistant pathogen of immunocompromised patients[J]. Clin Microbiol Infect, 2018, 24(9): 1016.e7-1016.e13.
[DOI]
|
| [7] |
李科, 张德纯, 张名均, 杨金梅, 杨晓容, 刘胜男. 多重耐药纹带棒状杆菌的耐药机制研究[J]. 中国抗生素杂志, 2014, 39(5): 361-364. [DOI]
|
| [8] |
王雪冰, 陈东科, 董爱英, 林晓晖, 邱小彤, 周海健, 李振军. 纹带棒状杆菌临床分离株分子分型和耐药性分析[J]. 中国抗生素杂志, 2019, 44(4): 471-477. [DOI]
|
| [9] |
Navas J, Fernández-Martínez M, Salas C, Cano ME, Martínez-Martínez L. Susceptibility to aminoglycosides and distribution of aph and aac(3)-XI genes among corynebacterium striatum clinical isolates[J]. PLoS One, 2016, 11(12): e0167856.
[DOI]
|
| [10] |
Clinical and Laboratory Standards Institute. Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria[S]. Wayne, PA: Clinical and Laboratory Standards Institute, 2016.
|
| [11] |
邓洪均. 住院患者分离的纹带棒状杆菌耐药性及同源性研究[J]. 检验医学与临床, 2015, 12(18): 2741-2742. [DOI]
|
| [12] |
陈万贞, 李格非, 姚宗会, 马冰, 许俊红, 马琼, 闫文娟, 袁有华, 张江峰, 王山梅, 李轶. 河南地区纹带棒状杆菌感染的临床特点及耐药性分析[J]. 检验医学, 2019, 34(11): 984-986. [DOI]
|
| [13] |
王俊瑞, 杜小莉, 崔晶花, 郭素芳, 福泉, 王艳艳, 范文兵, 韩艳秋. 住院患者分离纹带棒状杆菌耐药性及同源性分析[J]. 中华医学杂志, 2014, 94(32): 2501-2505. [DOI]
|
| [14] |
Galimand M, Fishovitz J, Lambert T, Barbe V, Zajicek J, Mobashery S, Courvalin P. AAC(3)-XI, a new aminoglycoside 3-N-acetyltransferase from Corynebacterium striatum[J]. Antimicrob Agents Chemother, 2015, 59(9): 5647-5653.
[DOI]
|
| [15] |
Campanile F, Carretto E, Barbarini D, Grigis A, Falcone M, Goglio A, Venditti M, Stefani S. Clonal multidrug-resistant Corynebacterium striatum strains, Italy[J]. Emerg Infect Dis, 2009, 15(1): 75-78.
[PubMed]
|
| [16] |
Scholle D. A spontaneous joint infection with Corynebacterium striatum[J]. J Clin Microbiol, 2007, 45(2): 656-658.
[PubMed]
|
| [17] |
Yang HS, Kim YJ, Cho SY, Shin E, Lee HJ. Central venous catheter-related bloodstream infection by Corynebacterium striatum identified by 16S rRNA and rpoB gene sequencing[J]. Ann Lab Med, 2015, 35(5): 548-550.
[PubMed]
|
| [18] |
杨雪静, 侯佳惠, 曹俊敏, 王原. 纹带棒状杆菌四环素、大环内酯类抗生素相关耐药基因的研究[J]. 中国卫生检验杂志, 2014, 24(6): 899-902. [CNKI]
|
| [19] |
王明贵, 朱德妹, 吴卫红, 张婴元, 汪复. 肺炎链球菌对红霉素的耐药性及耐药表型[J]. 中华传染病杂志, 2002(2): 6-8. [CNKI]
|
| [20] |
Glanzer S, Pulido SA, Tutz S, Wagner GE, Kriechbaum M, Gubensäk N, Trifunovic J, Dorn M, Fabian WM, Novak P, Reidl J, Zangger K. Structural and functional implications of the interaction between macrolide antibiotics and bile acids[J]. Chemistry, 2015, 21(11): 4350-4358.
[PubMed]
|
 2021, Vol. 16
2021, Vol. 16


