乳杆菌属(Lactobacillus)为革兰氏阳性无芽胞杆菌,一般呈链杆状或球杆状,因能发酵糖类产生大量乳酸而得名。乳杆菌属细菌在自然界中分布广泛,有些是人和动物口腔、肠道及阴道的正常菌群[1-2]。此属细菌中大多数是益生菌,极少数可引起急性胆囊炎、心内膜炎和菌血症等,尤其是对于免疫功能低下的人群[3-5]。其中鼠李糖乳杆菌(Lactobacillus rhamnosus)是最常见的致病菌,而唾液乳杆菌(Lactobacillus salivarius)引起的感染很少见,尤其是血流感染[3-4]。2018年11月,本研究团队从上海市东方医院南院胃肠外科收治的1例胃恶性肿瘤肝转移患者的血液样本中分离出1株唾液乳杆菌,现报道如下。
1 材料和方法 1.1 病例资料患者,男,34岁,因发现胃溃疡4年、症状加重1个月,于2018年8月24日入院。入院后完善相关检查,诊断胃恶性肿瘤,病理报告提示部分印戒细胞癌,上腹计算机断层扫描(computed tomography,CT)提示肝转移。患者发病以来胃纳可,睡眠可,两便正常,体重无明显减轻。肾结石病史4年,未行治疗,否认糖尿病、高血压、冠心病病史,否认结核病、乙型肝炎等传染疾病史。否认输血史,否认其他药物、食物过敏史。辅助检查结果提示,无化疗绝对禁忌证。与患者家属充分沟通后,先行化疗。具体化疗方案为FLOT方案:奥沙利铂150 mg静脉滴注d1+亚叶酸钙0.4 g静脉滴注d1+多西他赛80 mg静脉滴注d1+氟尿嘧啶4.4 g静脉滴注d1。化疗前予地塞米松抗过敏,托烷司琼止吐,同时辅以护胃、保肝及支持治疗;化疗过程中无毒副反应。
2018年11月5日,患者在全身麻醉下行根治性远端胃大部切除术(毕Ⅰ式吻合)+肝左外叶切除术+肠粘连松解术。术中置腹腔引流管1根,无感染相关症状及体征。患者于11月17日突发畏寒、寒战,查体温39.0 ℃,白细胞(white blood cell,WBC)11.83×109/L,中性粒细胞(neutrophil,N)84.5%,C反应蛋白(C-reactive protein,CRP)71.1 mg/L,降钙素原(procalcitonin,PCT) 0.79 ng/mL,白细胞介素6(interleukin 6,IL-6)222.6 pg/mL。予以拔除经外周插管的中心静脉导管(peripherally inserted central catheter,PICC),送双侧双瓶血培养。临床予以异丙嗪镇静,地塞米松退热,头孢哌酮舒巴坦抗感染治疗。
血培养双侧需氧瓶及右侧厌氧瓶均于培养2~3 d内检出唾液乳杆菌,结合相关检查,诊断为术后血流感染。药敏试验提示对青霉素、美洛培南、氨苄西林等敏感,调整用药后使用美洛培南进行抗感染治疗。治疗后复查血培养结果均为阴性。11月27日血常规结果提示:WBC为6.64×109/L,N为54%,CRP为18.05 mg/L,PCT为0.107 ng/mL,感染得到有效控制。
1.2 血培养与细菌鉴定11月17日,于患者左右两侧肘正中静脉无菌采集静脉血,分别将8~10 mL静脉血注入需氧血培养瓶和厌氧血培养瓶(美国赛默飞世尔科技公司),使用VersaTREK全自动微生物培养检测系统(美国赛默飞世尔科技公司)培养。培养48~72 h后,VersaTREK全自动微生物培养检测系统报双侧需氧瓶和右侧厌氧瓶阳性。在生物安全柜内,用无菌注射器穿刺取需氧瓶血培养液,分别转种于血平板、巧克力平板和麦康凯平板,置于35 ℃、体积分数5%的CO2环境中培养。厌氧瓶血培养液转种后置于厌氧袋内,于35 ℃厌氧环境中培养,并于35 ℃需氧环境中做耐氧试验。抽取血培养瓶内培养液直接涂片进行革兰氏染色镜检。
将转种的平板分别置于体积分数5% CO2环境和厌氧环境进行培养,24~48 h后观察菌落形态;并涂片染色镜检。
1.2.1 VITEK 2 Compact全自动细菌分析仪将纯培养菌落用0.45% NaCl溶液配制菌悬液,调整菌悬液浓度至2.7~3.3麦氏单位,使用法国生物梅里埃公司VITEK 2 Compact全自动细菌分析仪及其配套的厌氧菌及棒状杆菌鉴定卡(anaerobic and corynebacteria identification card,ANC)进行细菌鉴定。
1.2.2 安图生物Autof ms 1000全自动微生物质谱仪采用直接涂抹法和标准处理法,于安图生物Autof ms 1000全自动微生物质谱检测系统中进行细菌鉴定。直接涂抹法为取少量纯培养菌落直接涂抹于96孔金属靶板,并滴加1 μL 70%甲酸待干,再滴加1 μL基质液,干燥后上机采集图谱进行鉴定分析。标准处理法为取少量纯培养菌落置于1.5 ml离心管中,加入700 μL乙醇溶液,漩涡振荡形成悬浮液,13 000 r/min离心5 min后弃上清液,将离心管在室温下干燥,再加入30 μL 70%甲酸和30 μL乙腈溶液并混匀,13 000 r/min离心5 min后,取1 μL上清液滴加在96孔金属靶板上,待干,再滴加1 μL基质液,干燥后上机采集图谱进行鉴定分析。
1.2.3 16S rRNA测序取生长良好的纯菌落,按基因组提取试剂盒操作步骤提取基因组。聚合酶链反应(polymerase chain reaction,PCR)扩增16S rRNA的反应体系为:脱氧核苷酸5 μL,引物Primer F 1 μL,引物Primer R 1 μL,DNA模板提取液5 μL,2×PCR MIX 25 μL。16S rRNA-F:AGAGTTTGATCCTGGCTCAG;16S rRNA-R:GGTTACCTTGTTACGACTT,扩增片段1 500 bp。凝胶电泳结果提示,1 500 bp处出现条带,将扩增产物送上海赛音生物技术有限公司进行测序,测序结果上传至美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)GenBank数据库进行BLAST比对。
1.3 药敏试验从平板挑取纯菌落制备成0.5麦氏浊度标准的菌悬液,按湖南长沙天地人生物科技有限公司的厌氧菌药敏试验卡(TDR ANA-AST)说明书进行药敏试验,参考美国临床和实验室标准协会的CLSI M45-A3药敏标准中乳杆菌属药敏试验规定,将药敏板置于35 ℃、体积分数5% CO2环境中培养24~48 h,分别判读结果。
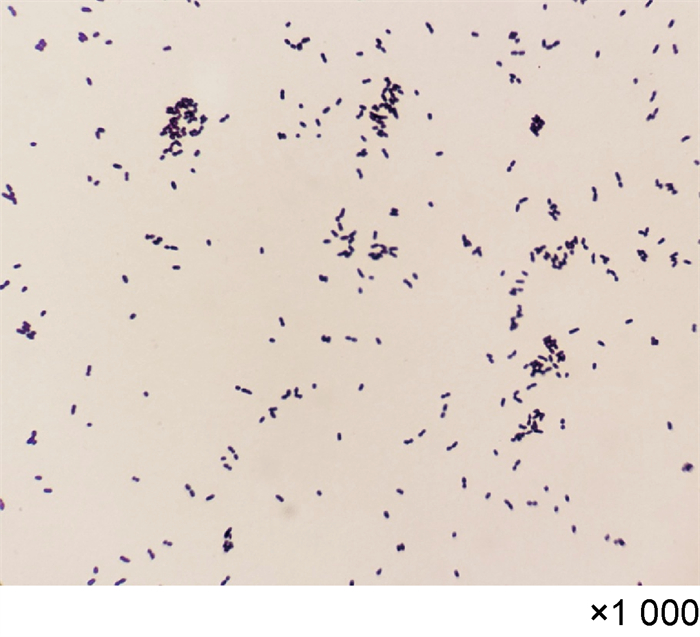
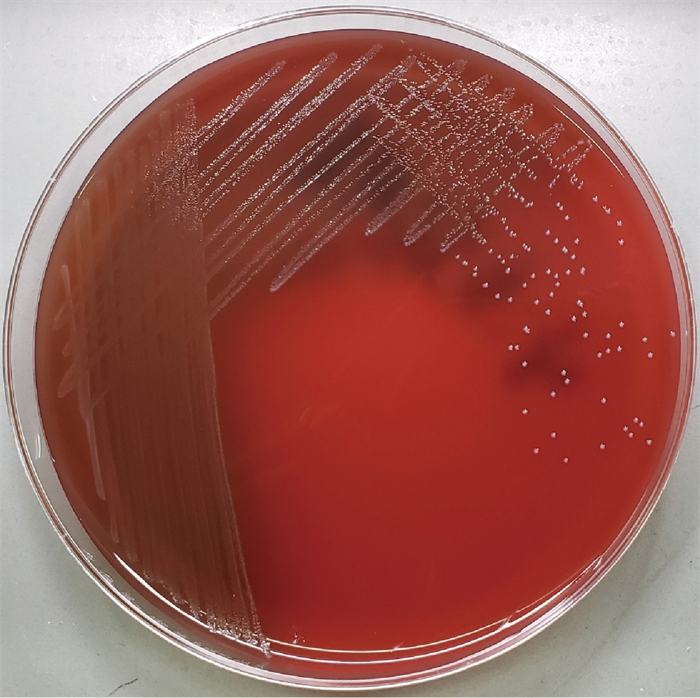
2 结果 2.1 血培养与细菌鉴定将报阳性结果的血培养液用无菌注射器穿刺抽取,直接涂片进行革兰氏染色,显微镜下查见革兰氏阳性杆菌,呈棒状球杆菌,具有圆形顶端,可形成链状(见图 1)。将血培养液分别转种于血平板、麦康凯平板及巧克力平板,置于35 ℃、体积分数5%CO2环境和厌氧环境培养24~48 h,形成直径约为0.5 mm的小菌落,菌落呈圆形、不透明,表面凸起、粗糙(见图 2)。经涂片革兰氏染色鉴定为革兰氏阳性杆菌,与血培养液直接涂片染色镜检结果一致。触酶试验结果为阴性。
|
| 图 1 唾液乳杆菌革兰氏染色镜下结果 Fig. 1 Gram staining of Lactobacillus salivarius |
|
| 图 2 唾液乳杆菌于血平板培养48 h后的菌落形态 Fig. 2 Colonial morphology of Lactobacillus salivarius on blood plate after incubation for 48 h |
VITEK 2 Compact鉴定结果为嗜酸乳杆菌(Lactobacillus acidophilus),一致性为99%。Autof ms 1000质谱仪直接涂抹法和标准处理法的鉴定结果均为唾液乳杆菌,分值分别为9.506和9.68。将16S rRNA测序结果在GenBank数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行BLAST比对分析,鉴定结果为唾液乳杆菌,一致性为99%,与质谱鉴定结果一致。
2.2 药敏试验使用TDR ANA-AST药敏试验卡进行药敏试验,置于35 ℃、CO2体积分数5%的环境中,培养24~48 h后判读结果。药敏结果为:青霉素最低抑菌浓度(minimum inhibitory concentration,MIC)为0.25 μg/mL,美洛培南为0.25 μg/mL,氨苄西林为0.25 μg/mL,克林霉素为0.25 μg/mL,利奈唑胺为1 μg/mL,头孢曲松为1 μg/mL,头孢哌酮为1 μg/mL,红霉素为0.25 μg/mL,左旋氧氟沙星为2 μg/mL,达托霉素为0.5 μg/mL。参考CLSI M45中乳杆菌属药敏试验结果进行判读:唾液乳杆菌对青霉素、美洛培南、氨苄西林、克林霉素、利奈唑胺、红霉素和达托霉素敏感,而头孢曲松、头孢哌酮、左氧氟沙星则无判读标准(见表 1)。
| 抗菌药物 | MIC (μg/mL) | 判读结果 | 药敏试验解释标准(μg/mL) |
| 青霉素 | 0.25 | 敏感 | ≤8,- |
| 氨苄西林 | 0.25 | 敏感 | ≤8,- |
| 达托霉素 | 0.50 | 敏感 | ≤4,- |
| 红霉素 | 0.25 | 敏感 | ≤0.5,≥8 |
| 克林霉素 | 0.25 | 敏感 | ≤0.5,≥2 |
| 利奈唑胺 | 1.00 | 敏感 | ≤4,- |
| 美洛培南 | 0.25 | 敏感 | ≤1,≥4 |
| 亚胺培南 | / | / | ≤0.5,≥2 |
| 万古霉素 | / | / | ≤2,≥16 |
| 头孢曲松 | 1.00 | / | / |
| 头孢哌酮 | 1.00 | / | / |
| 左氧氟沙星 | 2.00 | / | / |
| 注:“/”为未检测和无判读结果或标准。 | |||

|
| 图 3 唾液乳杆菌16S rRNA测序比对结果 Fig. 3 16S rRNA sequencing of Lactobacillus salivarius |
乳杆菌属细菌通常定植于上口腔、呼吸道、肠道和阴道,是人体内主要正常菌群。通常被认为是非致病性的,并且无毒,但偶有报道可引起严重感染,包括心内膜炎、肺部感染、腹腔内脓肿、脑膜炎、结膜炎、龋齿和子宫内膜炎[4]。唾液乳杆菌是一种兼性厌氧菌,有时在微需氧条件下也可生长。恶性肿瘤、白血病、糖尿病、长期使用免疫抑制剂、手术创伤、组织破坏均易诱发厌氧菌感染。厌氧菌感染所导致的血流感染占比高达10%~15%,新生儿中厌氧菌血流感染较为常见[6]。在外科手术患者中,术后厌氧菌引发的感染是导致患者术后死亡的重要原因。
查阅国内外文献,发现仅有2例报道在血培养标本中分离出唾液乳杆菌[3-4]。唾液乳杆菌作为定植于人体的正常菌群,通过血流播散引起感染较为少见。本例唾液乳杆菌引起的血流感染可能与患者恶性肿瘤化疗后免疫力低下且又经历外科手术有关,往往是内源性感染。
乳杆菌属的生长培养特性使其在生长不充分或生化反应较弱甚至不反应时,传统的细菌生化鉴定结果很难被判读,导致难以得到准确的鉴定结果,这为临床精准治疗带来了很多阻碍。基质辅助激光解吸/电离飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF MS)是一种新型微生物快速鉴定方法,可依据特征性蛋白图谱对标本进行分类和鉴定,在微生物领域得到了广泛应用[7-9]。由于质谱鉴定的是细菌表面蛋白,而蛋白主要取决于细菌自身遗传因素,受培养基、培养时间及培养条件等外部因素的影响较小,因而质谱鉴定具有较好的稳定性和可重复性。16S rRNA测序鉴定细菌虽然可得到准确结果,但实验过程较为繁琐,且耗时较长。相比之下,MALDI-TOF MS在快速鉴定方面更有优势。但对于临床较为少见的致病菌,在使用质谱进行快速鉴定后,应再使用16S rRNA测序进行确认,以弥补质谱菌株库不足导致的鉴定误差。
对于从血培养标本和其他无菌部位标本分离得到的致病菌,临床实验室应常规开展药敏试验,根据细菌培养鉴定结果以及规范的药敏试验结果选择抗菌药物进行治疗。但厌氧菌的培养和药敏试验需要特定的条件和时间,在不能及时获得药敏结果的情况下,临床医师可进行经验性用药,待药敏试验结果发布后再根据需要对治疗方案进行调整。按照规范进行微生物标本送检是快速分离致病菌的前提,准确快速地进行菌种鉴定是经验用药的基础[10]。规范的药敏试验对于感染的治疗非常重要,如仅依靠经验用药,可能会导致治疗效果不佳或治疗失败。
因此,实验室应在加强临床沟通的同时对现有菌株鉴定方法进行性能评价,使用不同的鉴定系统快速准确地进行菌种鉴定,积极开展规范的细菌、真菌药敏试验,从而为临床合理用药提供依据。
| [1] |
Jussiaux F, Miot-Sertier C, Nguyen-Lopez D, Badet C, Samot J. Reliability of MALDI-TOF mass spectrometry to identify oral isolates of Streptococcus salivarius and Lactobacillus spp[J]. Arch Oral Biol, 2021, 121: 104983.
[DOI]
|
| [2] |
Azad A, Modaresi F, Zahed M, Zarei M, Ranjbaran A, Jahrom ZK. Multiplex polymerase chain reaction for detection of bacteremia during dental extraction[J]. J Investig Clin Dent, 2019, 10(4): e12425.
[DOI]
|
| [3] |
Wang HK, Teng LJ, Chen YC, Du SH, Hsueh PR. Lactobacillus salivarius empyema with respiratory failure[J]. J Microbiol Immunol Infect, 2017, 50(6): 923-925.
[DOI]
|
| [4] |
Woo PC, Fung AM, Lau SK, Yuen KY. Identification by 16S rRNA gene sequencing of Lactobacillus salivarius bacteremic cholecystitis[J]. J Clin Microbiol, 2002, 40(1): 265-267.
[DOI]
|
| [5] |
Berger U, Lutz P, Sievers C, Trefz FK. Endocarditis lenta caused by Lactobacillus salivarius subsp. Salicinicus[J]. Dtsch Med Wochenschr, 1976, 101(37): 1349-1350.
[DOI]
|
| [6] |
郭建, 支云清, 何丽华, 吕莉, 强素凤, 吴文娟. 口普雷沃菌引起的术后血流感染一例报道[J]. 检验医学, 2015, 30(9): 958-961. [DOI]
|
| [7] |
Li Y, Shan M, Zhu Z, Mao X, Yan M, Chen Y, Zhu Q, Li H, Gu B. Application of MALDI-TOF MS to rapid identification of anaerobic bacteria[J]. BMC Infect Dis, 2019, 19(1): 941.
[DOI]
|
| [8] |
Sornsenee P, Singkhamanan K, Sangkhathat S, Saengsuwan P, Romyasamit C. Probiotic properties of Lactobacillus species isolated from fermented palm sap in Thailand[J]. Probiotics Antimicrob Proteins, 2021, 13(4): 957-969.
[DOI]
|
| [9] |
Kim E, Cho EJ, Yang SM, Kim MJ, Kim HY. Novel approaches for the identification of microbial communities in kimchi: MALDI-TOF MS analysis and high-throughput sequencing[J]. Food Microbiol, 2021, 94: 103641.
[DOI]
|
| [10] |
Turhan O, Ozhak-Baysan B, Zaragoza O, Er H, Sarıtas ZE, Ongut G, Ogunc D, Colak D, Cuenca-Estrella M. Evaluation of MALDI-TOF-MS for the identification of yeast isolates causing bloodstream infection[J]. Clin Lab, 2017, 63(4): 699-703.
[PubMed]
|
 2022, Vol. 17
2022, Vol. 17


