近年来,不动杆菌感染问题日益突出,该菌已成为院内感染的常见致病菌之一,随着发病率的升高其耐药率亦呈上升趋势[1]。约翰逊不动杆菌(Acinetobocter johnsoni)属于不动杆菌属,广泛存在于水体和土壤中,易在潮湿的环境中生存,对污水和污物处理中的磷化合物具有降解作用[2-3]。约翰逊不动杆菌作为条件致病菌可引起人类感染,但此前国内外均未见新生儿感染的报道。本文拟对苏州市立医院确诊的2例约翰逊不动杆菌所致新生儿迟发型败血症进行总结,为其临床防治提供一定的参考。
1 病例资料 1.1 病例1患儿系G3P2,女,胎龄26+5周,出生体重1 050 g,平产分娩,Apgar评分8—8分。其母胎膜早破4 d,产前血常规白细胞(white blood cell,WBC)17.4×109/L,中性粒细胞(neutrophil,N)87.1%,C反应蛋白(C-reactive protein,CRP)15.46 mg/L,产前已予抗感染和地塞米松促胎肺成熟。患儿入院后因“呼吸窘迫综合征”予补充肺表面活性物质,无创呼吸机辅助呼吸2周后改温湿化高流量鼻导管吸氧。入院38 h鼻饲开奶,喂养耐受,青霉素联合头孢哌酮舒巴坦(商品名:舒普深)抗感染7 d后停药。患儿出生后第21天(距停用抗生素14 d)出现精神软,反应差。查体可见:皮肤苍黄,有散在花纹,呼吸浅促,心率180~200次/min;腹膨,肠鸣音弱;四肢肌张力低,血氧饱和度不稳定,毛细血管再充盈时间为2~3 s。血气分析提示代谢性酸中毒,血糖增高。血常规结果显示WBC 3.26×109/L,血小板(platelet,PLT)95×109/L,CRP 27.19 mg/L,降钙素原(procalcitonin,PCT)0.6 ng/mL,同时送检血培养(双份)。胸、腹平片可见肺部片絮状阴影,腹部肠腔积气扩张,予以美洛培南抗感染、纠正酸中毒、禁食、胃肠减压、多巴胺联合多巴酚丁胺改善循环等处理。病程中行腰椎穿刺排除化脓性脑膜炎。复查血常规、CRP、PCT恢复正常,随访2次血培养(每次均双份)阴性,美洛培南抗感染14 d后停药。
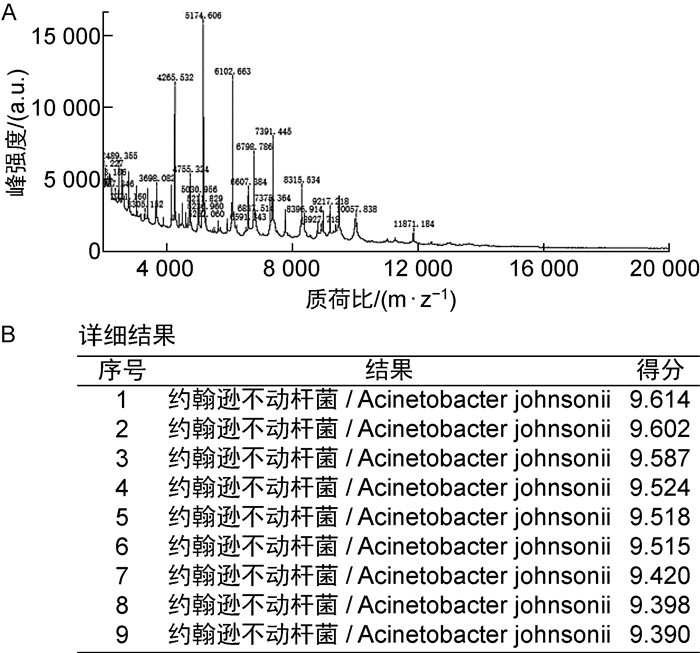
患儿血培养初步报告(培养13 h报阳):革兰阴性杆菌生长,经基质辅助激光解吸/电离飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF MS)(安图生物,型号:Autof ms1000)鉴定为约翰逊不动杆菌(见图 1)。药敏试验:对美洛培南[最低抑菌浓度(minimum inhibitory concentration,MIC)≤1 μ g/mL]、亚胺培南(MIC=2 μ g/mL)、哌拉西林/他唑巴坦(MIC≤4/4 μ g/mL)、头孢哌酮舒巴坦、庆大霉素(MIC≤2 μ g/mL)、阿米卡星(MIC≤8 μ g/mL)敏感,对阿莫西林和头孢菌素类耐药,对环丙沙星中介。
|
| 注:峰强度的质谱信号包括分子离子峰、亚稳离子峰、碎片离子峰、重排离子峰等,微生物全细胞蛋白按照质荷比分离排列,形成特征性质谱峰和质量指纹图谱。鉴定结果:约翰逊不动杆菌,得分9.614。 图 1 MALDI-TOF MS鉴定约翰逊不动杆菌的质谱图及鉴定结果 Fig. 1 Identification of Acinetobocter johnsonii by MALDI-TOF MS |
患儿G1P1,男,胎龄34周,出生体重为1 800 g,因母“重症肝内胆汁淤积”剖宫产分娩,Apgar评分10—10分。母孕期无异常。出生后无创呼吸机辅助呼吸,胸片提示肺炎改变。因患儿出生后腹胀予留置胃管、开塞露通便等处理,腹胀缓解,1周开奶喂养,基本耐受,哌拉西林抗感染治疗7 d。出生后第23天(距停用抗生素16 d)未吸氧的情况下出现反复发绀,精神、反应欠佳,呼吸促,心率波动于200~220次/min,血氧饱和度不稳定。查体可见:皮肤欠红润,有散在花纹,心肺无异常;腹膨,肠鸣音弱;四肢肌张力低,毛细血管再充盈时间3 s。床边血气分析提示代谢性酸中毒合并呼吸性酸中毒,血糖增高。血常规结果显示WBC 4.89×109/L,PLT 91×109/L,CRP 21.3 mg/L,PCT 23 ng/mL,同时送检双份血培养。胸部X线检查显示两肺弥漫分布密度较淡的斑片影。予以无创辅助通气,病情无明显改善,改气管插管、机械通气,美洛培南联合利奈唑胺抗感染,同时给予扩充血容量、纠正酸中毒、禁食、人免疫球蛋白支持、血浆支持、多巴胺联合多巴酚丁胺改善循环等。血培养15 h提示革兰阴性杆菌感染,经MALDI-TOF MS鉴定为约翰逊不动杆菌。药敏试验结果提示:细菌对哌拉西林/他唑巴坦(MIC≤4/4 μ g/mL)、头孢哌酮舒巴坦、阿米卡星(MIC≤2 μ g/mL)、左氧氟沙星(MIC≤1 μ g/mL)敏感,对美洛培南、亚胺培南、头孢吡肟、环丙沙星中介,对头孢他啶耐药。予停用美洛培南、利奈唑胺,改用哌拉西林/他唑巴坦继续抗感染。完善腰椎穿刺检查,其结果不支持化脓性脑膜炎诊断。治疗期间复查患儿的血常规、CRP及PCT,结果无异常,连续监测2次血培养阴性,病情好转,抗感染共14 d后停药予以出院。
2 讨论Bouvet和Grimont[4-5]利用DNA杂交技术对不动杆菌属进行分型,其中与临床感染密切相关的菌型包括鲍曼不动杆菌(基因型2)、醋酸钙不动杆菌(基因型1)、溶血性不动杆菌(基因型4)、约翰逊不动杆菌(基因型7)、鲁氏不动杆菌(基因型4)、琼氏不动杆菌(基因型5)、耐放射性不动杆菌(基因型12)。约翰逊不动杆菌为短杆状革兰阴性球杆菌,单个排列,无鞭毛,无芽孢,在有氧环境中生长良好,生存能力强,在高磷或高盐环境中也可存活[2, 4]。其广泛分布于自然界,主要通过土壤、水体、医院器具、城市污水、物体表面等接触传播,也可通过侵袭性操作如静脉输液、经外周插管的中心静脉导管(peripherally inserted central catheter,PICC)置管、气管插管等引起院内感染暴发与流行[6]。
约翰逊不动杆菌可导致严重感染。Cleland等[7]认为,其是慢性鼻窦炎的相关病原体。Turton等[8]报道了690例不动杆菌菌血症,其中鲍曼不动杆菌感染占78%,约翰逊不动杆菌感染占1.7%。Seifert等[9]在160例不动杆菌败血症中发现13例为约翰逊不动杆菌感染,血培养阳性报告时间平均为2.1 d。本文报道了2例约翰逊不动杆菌致新生儿败血症,血培养报告阳性时间(均 < 24 h)明显早于前述报道,这可能与早产儿免疫系统发育尚不成熟,抵御病原微生物的能力低下有关。因此,约翰逊不动杆菌被认为是一种条件致病菌。
目前,约翰逊不动杆菌感染的治疗尚无指南。既往研究发现,不动杆菌属对亚胺培南和头孢哌酮舒巴坦的敏感率最高(分别达95%和69%),而对哌拉西林的敏感率为44.4%,对哌拉西林/他唑巴坦的耐药率低于41.9%[2, 10]。本文报道的2例患儿约翰逊不动杆菌耐药谱相似,对头孢菌素类均耐药,对头孢哌酮舒巴坦、哌拉西林/他唑巴坦、氨基糖苷类敏感。病例1对美洛培南敏感,对病例2中介。考虑到苏州市立医院存在过度经验性选用头孢哌酮舒巴坦抗感染,科室残存药物浓度高,导致药敏试验结果虽显示敏感,但部分患儿临床抗感染效果欠佳的可能,且约翰逊不动杆菌在本科室第1次出现,结合药敏试验哌拉西林/他唑巴坦MIC<4/4 μ g/mL以及氨基糖苷类抗生素对新生儿肾毒性、耳毒性大,因此病例2采用哌拉西林/他唑巴坦抗感染,获得治愈。
约翰不动杆菌的耐药机制复杂,涉及多种机制,如质粒或染色体介导产生β -内酰胺酶、金属β -内酰胺酶及氨基糖苷类修饰酶[1-2, 11],细菌外排泵过度表达使药物流出增加引起菌体内抗菌药物减少等[12]。有研究认为,约翰逊不动杆菌分离株带有抗生素抗性基因(antibiotic resistance gene,ARG)[13-14],如碳青霉烯酶基因blaNDM-1和blaOXA-5。本文中病例2对美洛培南、亚胺培南等碳青霉烯类药物中介,可能就是因为约翰逊不动杆菌携带了碳青霉烯酶基因。此外,同一菌株可携带不同的抗药基因,同时对多种抗生素产生耐药性,而耐药基因又可通过质粒等形式在种间进行传播,从而导致医院内致病菌感染的暴发和流行。
MALDI-TOF MS是一种新型软电离有机质谱技术,是鉴定多肽、蛋白质的强有力工具。其原理是基于微生物核糖体蛋白和外周蛋白的保守性(主要受遗传因素控制),借助基质辅助电离测得蛋白质和多肽的相对分子质量,形成独特的蛋白质指纹图谱,通过特征性模式峰积累计算而实现对微生物的鉴定。此项技术方便、快速、准确,尤其是对罕见病原菌的鉴定具有快、准、全的优势,已成为医院微生物检测实验室的常用仪器[15]。因约翰逊不动杆菌在临床少见,采用传统方法鉴定有一定困难,且常规培养鉴定周期长、易受污染,临床对病原菌快速鉴定及精准用药的需求日益迫切。本文报道的2例患儿均是采用常规血培养获得约翰逊不动杆菌菌落后,通过MALDI-TOF MS鉴定并最终明确诊断。血培养阳性后直接进行MALDI-TOF MS鉴定可使阳性标本的鉴定时间由24~48 h缩短为几十分钟,为临床用药提供更及时的指导。随着技术的不断发展,MALDI-TOF MS不仅可对阳性血培养瓶中的菌落进行检测,亦可对未经培养的临床标本进行直接检测,从而更加有效地缩短检测时间[15-16]。
3 结语约翰逊不动杆菌是一种少见病原体,早产儿为其感染的高危人群,可导致新生儿迟发型败血症。MALDI-TOF MS有助于快速精准地明确约翰逊不动杆菌感染的诊断,指导合理使用抗生素,从而有助于减少约翰逊不动杆菌耐药菌株的产生。约翰逊不动杆菌的感染途径、耐药机制,尚须进一步深入研究。
| [1] |
Nguyen M, Joshi SG. Carbapenem resistance in Acinetobacter baumannii, and their importance in hospital-acquired infections: a scientific review[J]. J Appl Microbiol, 2021, 131(6): 2715-2738.
[DOI]
|
| [2] |
田国忠, 崔步云. 约翰逊不动杆菌研究进展[J]. 中华流行病学杂志, 2011, 32(3): 316-319. [DOI]
|
| [3] |
Castillo-Ramírez S, Mateo-Estrada V, Gonzalez-Rocha G, Opazo-Capurro A. Phylogeographical analyses and antibiotic resistance genes of Acinetobacter johnsonii highlight its clinical relevance[J]. mSphere, 2020, 5(4): e00581-20.
[DOI]
|
| [4] |
Bouvet PJ, Grimont PA. Taxonomy of the genus Acinetobacter with the recognition of Acinetobacter baumannii sp. nov., Acinetobacter haemolyticus sp. nov., Acinetobacter johnsonii sp. nov., and Acinetobacter junii sp. nov. and emended descriptions of Acinetobacter calcoaceticus and Acinetobacter lwoffii[J]. Int J Syst Bacteriol, 1986, 36(2): 228-240.
[DOI]
|
| [5] |
Bouvet PJ, Grimont PA. Identification and biotyping of clinical isolates of Acinetobacter[J]. Ann Inst Pasteur Microbiol, 1987, 138(5): 569-578.
[DOI]
|
| [6] |
翟盼盼, 吴宇骞, 陆坚. 不动杆菌属分类的研究进展[J]. 新发传染病电子杂志, 2020, 5(1): 51-55. [DOI]
|
| [7] |
Cleland EJ, Bassiouni A, Vreugde S, Wormald PJ. The bacterial microbiome in chronic rhinosinusitis: richness, diversity, postoperative changes, and patient outcomes[J]. Am J Rhinol Allergy, 2016, 30(1): 37-43.
[DOI]
|
| [8] |
Turton JF, Shah J, Ozongwu C, Pike R. Incidence of Acinetobacter species other than A. baumannii among clinical isolates of Acinetobacter: evidence for emerging species[J]. J Clin Microbiol, 2010, 48(4): 1445-1449.
[DOI]
|
| [9] |
Seifert H, Strate A, Schulze A, Pulverer G. Vascular catheter-related bloodstream infection due to Acinetobacter johnsonii (formerly Acinetobacter calcoaceticus var. lwoffii): report of 13 cases[J]. Clin Infect Dis, 1993, 17(4): 632-636.
[DOI]
|
| [10] |
Zong G, Zhong C, Fu J, Zhang Y, Zhang P, Zhang W, Xu Y, Cao G, Zhang R. The carbapenem resistance gene blaOXA-23is disseminated by a conjugative plasmid containing the novel transposon Tn6681 in Acinetobacter johnsonii M19[J]. Antimicrob Resist Infect Control, 2020, 9(1): 182.
[DOI]
|
| [11] |
陈亮, 李真. 不动杆菌属对碳青霉烯类抗菌药物的耐药机制与治疗[J]. 中华医院感染学杂志, 2013, 23(12): 3035-3037. [CNKI]
|
| [12] |
Montaña S, Schramm ST, Traglia GM, Chiem K, Parmeciano Di Noto G, Almuzara M, Barberis C, Vay C, Quiroga C, Tolmasky ME, Iriarte A, Ramírez MS. The genetic analysis of an Acinetobacter johnsonii clinical strain evidenced the presence of horizontal genetic transfer[J]. PLoS One, 2016, 11(8): e0161528.
[DOI]
|
| [13] |
Feng Y, Yang P, Wang X, Zong Z. Characterization of Acinetobacter johnsonii isolate XBB1 carrying nine plasmids and encoding NDM-1, OXA-58 and PER-1 by genome sequencing[J]. J Antimicrob Chemother, 2016, 71(1): 71-75.
[DOI]
|
| [14] |
Rodríguez CH, Nastro M, Dabos L, Barberis C, Vay C, Famiglietti A. First isolation of Acinetobacter johnsonii co-producing PER-2 and OXA-58 β -lactamases[J]. Diagn Microbiol Infect Dis, 2014, 80(4): 341-342.
[DOI]
|
| [15] |
Tsuchida S, Umemura H, Nakayama T. Current status of matrix-assisted laser desorption/ionization-time-of-flight mass spectrometry (MALDI-TOF MS) in clinical diagnostic microbiology[J]. Molecules, 2020, 25(20): 4775.
[DOI]
|
| [16] |
Bar-Meir M, Berliner E, Kashat L, Zeevi DA, Assous MV. The utility of MALDI-TOF MS for outbreak investigation in the neonatal intensive care unit[J]. Eur J Pediatr, 2020, 179(12): 1843-1849.
[DOI]
|
 2022, Vol. 17
2022, Vol. 17



