2. 山东大学第二附属医院检验医学中心, 山东 济南 250033
2. Department of Clinical Laboratory, the Second Hospital of Shandong University, Jinan 250033, Shandong Province, China
肢体凯斯特菌为革兰氏阴性非发酵菌,膜状生长。2003年,Coenye等[1]首次报道了肢体凯斯特菌感染病例。通过文献检索,本文发现截至目前国外文献对该菌的报道仅有18例,国内文献尚未见报道。本实验室从气管切开患者的痰培养中分离到这种膜状生长的非发酵菌,并使用基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry, MALDI-TOF-MS)和16S核糖体RNA(16S ribosomal RNA,16S rRNA)测序2种方法对其进行鉴定,同时汇总以往文献中的主要病例,以加强临床微生物检验人员对该菌的认识和重视。现将病例报道如下。
1 临床资料 1.1 病例患者,男,50岁,重度颅脑手术术后10年。咳嗽、咳痰伴间断发热2天。现病史:患者于2天前无明显诱因出现咳嗽、咳痰较前加重,伴发热,最高体温可达39.5 ℃,遂来我院急诊科就诊。胸部计算机断层扫描(computed tomography,CT)结果提示:①双肺炎症,右肺部分不张,右侧胸膜腔液性密度;②双肺局限性慢性炎症及纤维灶。血常规:白细胞计数为7.14×109/L,中性粒细胞百分比为77.3%。感染炎症指标4项:C-反应蛋白为11.8 mg/L,血清淀粉样蛋白A为114.6 mg/L,降钙素原为0.06 ng/mL,白介素-6为2.26 pg/mL。急诊遂以“肺部感染”收入我院住院治疗。患者自发病以来神志模糊、精神差、睡眠差、饮食尚可,大小便如常。体温36.6 ℃,脉搏92次/分,呼吸20次/分,血压136/85 mmHg。双肺叩诊呈清音,双肺呼吸音粗,可闻及明显的痰鸣音,未闻及干啰音及胸膜摩擦音。
入院诊断:肺部炎症;重型颅脑术后。入院后给予美洛培南抗感染、乙酰半胱氨酸溶液雾化吸入排痰治疗,复查血感染指标降至正常。由于患者反复出现发热,入院后根据痰培养结果先后5次调整抗生素。①入院初期,患者痰培养结果提示铜绿假单胞菌及嗜麦芽窄食单胞菌感染,药敏试验结果提示:铜绿假单胞菌对阿米卡星、哌拉西林他唑巴坦敏感;嗜麦芽窄食单胞菌对米诺环素、复方新诺明敏感。调整抗生素为米诺环素、哌拉西林他唑巴坦继续抗感染治疗后,患者体温明显下降。②患者后续依然反复发热。因吸痰困难,给予支气管镜下吸痰。痰培养结果显示,木糖氧化无色杆菌、嗜麦芽窄食单胞菌感染。药敏试验结果提示:木糖无色杆菌对哌拉西林他唑巴坦敏感;嗜麦芽窄食单胞菌对米诺环素敏感。此次分离到的病原菌对所使用的抗生素敏感,继续目前的抗感染治疗方案,患者体温下降。③考虑患者还是存在反复发热的情况,且一直吸痰困难,于2021年3月23日行气管切开术,术后管路通畅,切口愈合良好。气管切开后,痰培养结果显示铜绿假单胞菌、嗜麦芽窄食单胞菌、肢体凯斯特菌感染。药敏试验结果提示:铜绿假单胞菌对哌拉西林他唑巴坦、舒普申、阿米卡星敏感;嗜麦芽窄食单胞菌对米诺环素敏感;肢体凯斯特菌对亚胺培南敏感。考虑亚胺培南可引发癫痫,调整抗生素为普舒深、美洛培南,患者发热得到控制。④2021年4月16日进一步调整抗生素为哌拉西林他唑巴坦与复方新诺明,感染指标与体温都降至正常范围。⑤继续调整治疗药物为哌拉西林他唑巴坦与安宫牛黄丸。患者体温恢复正常、病情稳定,随后出院。
1.2 材料和方法 1.2.1 主要试剂哥伦比亚血平板、万古霉素巧克力平板、麦康凯平板、革兰氏染色试剂均购自济南百博生物技术股份有限公司。氧化酶试剂及氧化发酵培养基购自杭州滨和微生物试剂有限公司。触酶试剂购自深圳康泰生物。
1.2.2 显微镜镜检痰涂片将痰液直接涂片,自然干燥后用革兰氏染色液进行染色,染色液干燥后在光学显微镜下观察白细胞与鳞状上皮细胞的比例,以确定痰标本的质量。
1.2.3 痰标本培养将痰标本分别接种于哥伦比亚血平板、万古霉素巧克力平板及麦康凯平板,将平板置于35 ℃、CO2体积分数为5%的培养箱中进行培养。
1.2.4 细菌的分离纯化挑取痰标本培养获得的可疑病原菌菌落,使用分区划线法接种至血平板。24 h后,分离得到单个菌落,使细菌得到分离纯化。
1.2.5 细菌生化实验按试剂说明书将膜状生长细菌进行氧化酶试验、触酶试验以及发酵葡萄糖试验。
1.2.6 MALDI-TOF-MS检测将膜状生长的细菌菌落用牙签涂抹到质谱靶板上。用1 μL HCCA基质溶液覆盖上述样品点。使用FlexControl3.4软件采集图谱,使用BioTyper3.1软件分析图谱。
1.2.7 16S核糖体RNA测序将膜状生长细菌的分纯平板送至华大基因进行16S核糖体RNA(16S ribosomal RNA,16S rRNA)测序,然后使用美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中的基本局部比对搜索工具(basic local alignment search tool,BLAST)对测序结果进行比对。
1.2.8 药物敏感试验以2021年美国临床和实验室标准协会(The Clinical & Laboratory Standards Institute, CLSI) 非肠杆菌科药敏组合折点为标准,使用VITEK2 Compact全自动微生物细菌鉴定仪(法国梅里埃公司)及配套AST-GNB药敏卡,严格按照仪器操作规程对膜状生长的细菌进行药物敏感试验。
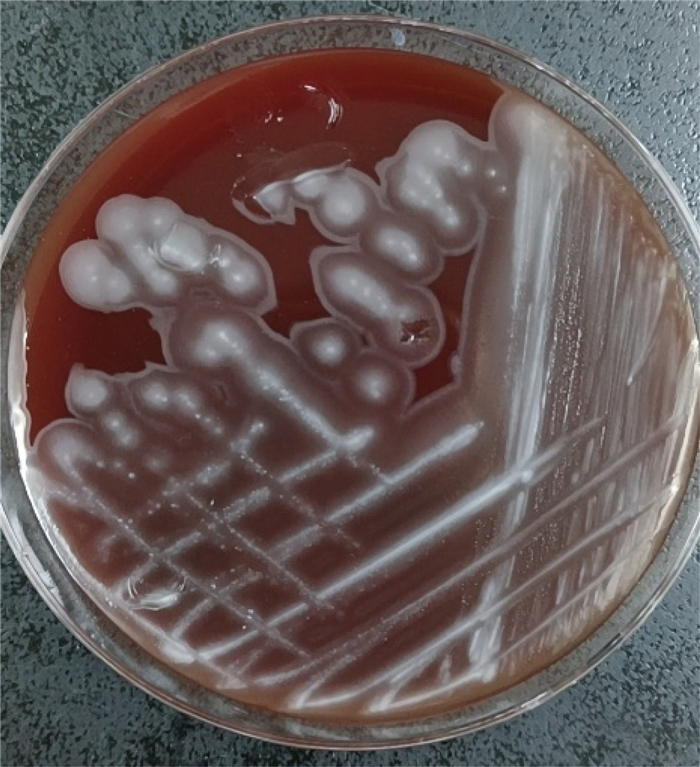
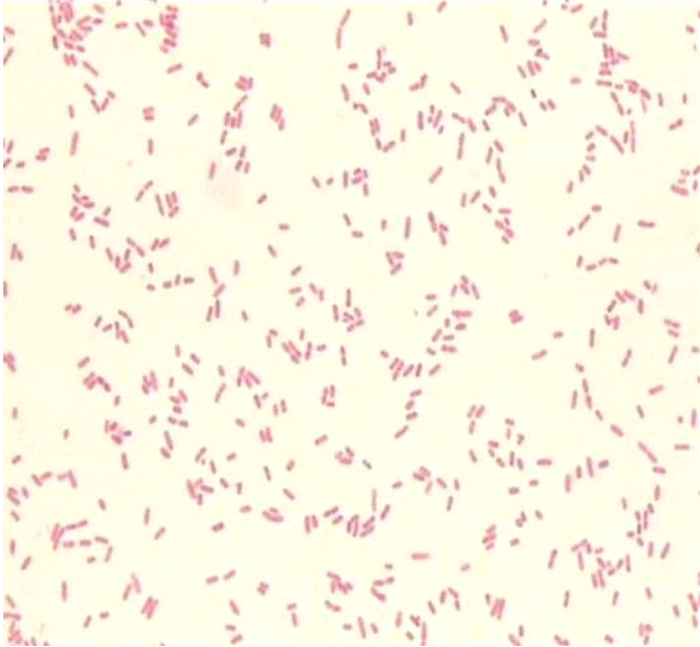
2 结果 2.1 痰涂片镜检、细菌培养及生化试验结果痰涂片经革兰氏染色后,直接低倍镜检可见白细胞>25个/LP,鳞状上皮细胞>25个/LP,标本质量差。痰标本分别接种于血平板、麦康凯平板及万古巧克力平板,培养24 h后,可见血平板上有铜绿假单胞菌、嗜麦芽窄食单胞菌及1种白色膜状细菌生长。用分区划线法将3种可疑病原菌分别接种于血平板,进行分离纯化培养。分离纯化培养24 h后,膜状生长细菌菌落形态如图 1所示,可见其菌落干燥,呈白色、膜状平铺生长。油镜下可观察到,分离纯化后的膜状生长细菌为革兰氏阴性短杆菌(见图 2)。呈膜状生长的细菌的氧化酶试验结果为阴性,触酶试验结果为阳性,葡萄糖发酵试验结果为阴性。
|
| 图 1 痰标本分离纯化培养后呈膜状生长的细菌菌落 Fig. 1 Bacterial colonies growing in film form isolated and purified from the sputum samples |
|
| 图 2 膜状生长细菌的镜下形态 Fig. 2 Morphology of the membrane-growing bacteria under microscope |
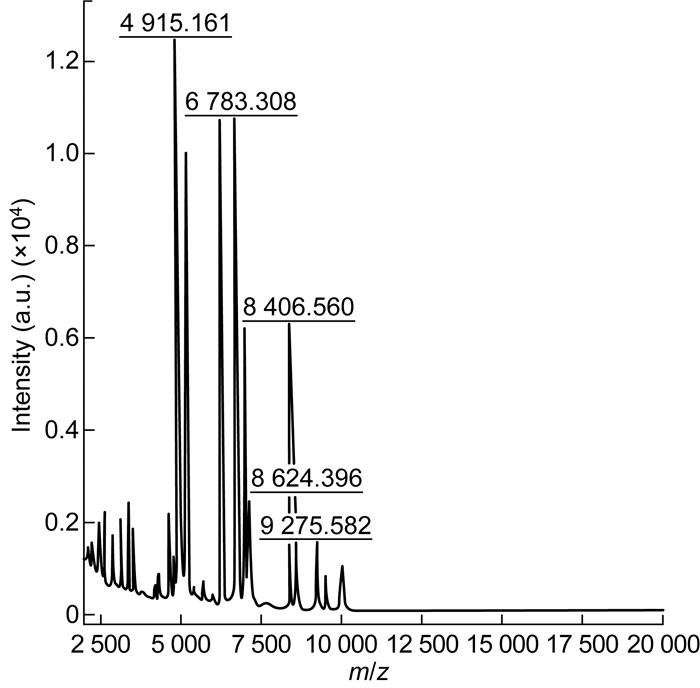
使用MALDI-TOF-MS对分纯得到的膜状生长细菌进行检测,该菌落峰图如图 3所示。使用BioTyper3.1软件将所得图谱与仪器数据库内的信息进行比对,结果显示为肢体凯斯特菌,分值为2.01。
|
| 图 3 MALDI-TOF-MS检测细菌分离株(肢体凯斯特菌) Fig. 3 Detection of the isolated strain(Kerstersia gyiorum)by MALDI-TOF-MS |
将膜状生长细菌的16 sRNA测序结果与NCBI数据库中的信息进行比对,得分最高、可能性最大的分别是博代氏杆菌属和肢体凯斯特菌属,具体如表 1所示。
| Description | Max score | Total score | Query cover | E value | Per. Ident | Accession |
| Bordetella sp. J329 chromo some, complete genome | 2 627 | 7 864 | 100% | 0 | 100.00% | CP021250.1 |
| Kerstersia gyiorum strain HF2 16S ribosomal RNA gene, partial sequence | 2 627 | 2 627 | 100% | 0 | 100.00% | HM117848.1 |
肢体凯斯特菌对CLSI推荐的大多数抗生素敏感,仅对氨曲南及左氧氟沙星中介,其MIC分别为16 μg/mL和4 μg/mL;该菌对环丙沙星耐药,MIC≥4 μg/mL。具体数据如表 2所示。
| 抗菌药物 | 敏感度 | MIC(μg/mL) | 折点 | ||
| S | I | R | |||
| 头孢吡肟 | S | 8 | 8 | 16 | 32 |
| 哌拉西林他唑巴坦 | S | ≤4 | 4 | 8~16 | 32 |
| 氨曲南 | I | 16 | 8 | 16 | 32 |
| 头孢唑琳 | S | 8 | 8 | 16~32 | 64 |
| 头孢曲松 | S | ≤1 | 8 | 16~32 | 64 |
| 头孢他啶 | S | 4 | 8 | 16 | 32 |
| 亚胺培南 | S | ≤1 | 4 | 8 | 16 |
| 环丙沙星 | R | ≥4 | 1 | 2 | 4 |
| 左氧氟沙星 | I | 4 | 2 | 4 | 8 |
| 庆大霉素 | S | ≤1 | 4 | 8 | 16 |
| 阿米卡星 | S | ≤2 | 16 | 32 | 64 |
| 妥布霉素 | S | ≤1 | 4 | 8 | 16 |
| 复方新诺明 | S | ≤20 | 19 | 9 | 19 |
| S: Susceptible,敏感;I: Intermediate,中介; R: Resistant, 耐药。 | |||||
表 3汇总了国外文献报道的7例肢体凯斯特菌感染代表性病例。该表中的肢体凯斯特菌主要分离自50~70岁中老年人,仅有1例分离于16岁男性。该菌可从耳道分泌物、血液、肢体破溃伤口分泌物、穿刺液、痰、肺泡灌洗液等标本中分离。肢体凯斯特菌感染常伴随其他细菌的混合感染。该菌可通过MALDI-TOF-MS及16S rRNA测序方法鉴定。也有研究人员运用高通量测序对该菌进行测序,结合生物信息学分析,对其DNA序列的生物学功能进行标注。
| 患者性别(年龄,报告时间) | 临床诊断 | 标本来源 | 是否混合感染 | 确诊方法 |
| F (69, 2015) [8] | 手足远端溃疡 | 血液 | 否 | MALDI-TOF 16 sRNA |
| F (70, 2019) [7] | 气管造口 | 痰 | 是 | MALDI-TOF 16 sRNA高通量测序 |
| M (16, 2012) [9] | 化脓性中耳炎 | 穿刺液 | 否 | 16 sRNA |
| F (63, 2014) [17] | 呼衰、肾衰 | 肺泡灌洗液 | 是 | MALDI-TOF 16 sRNA |
| F (51, 2018) [10] | 慢性耳炎 | 引流液 | 否 | MALDI-TOF 16 sRNA |
| M (55, 2013) [2] | 慢性耳病 | 分泌物 | 是 | MALDI-TOF 16 sRNA |
| F (54, 2013) [2] | 肢体伤口 | 分泌物 | 是 | MALDI-TOF 16 sRNA |
| M: male;F:female. | ||||
肢体凯斯特菌感染相关的国内病例报告非常罕见,相关的国外文献数量也很有限。肢体凯斯特菌属于产碱杆菌科,该菌生化反应类似于粪产碱杆菌属,即氧化酶和乙酰胺阴性,触酶阳性,发酵葡萄糖阴性,但是粪产碱杆菌有水果气味[2]。全自动微生物鉴定仪Vitek2 Compact数据库中缺乏肢体凯斯特菌的信息,故此方法对该菌的分析不准确。这也可能是肢体凯斯特菌的相关报道较少和容易被忽视的原因之一。
每种微生物都由其自身独特的肽/蛋白质组成。通过MALDI-TOF MS检测微生物的肽/蛋白质指纹图谱,再经软件处理后与微生物数据库中已有的信息进行比对分析,便可于几分钟内在种、属水平完成对该微生物的鉴定[3]。细菌的rRNA包括5S rRNA、16S rRNA和23S rRNA,其中16S rRNA具有含量多、分子量适中、高度保守等特点。因此,16S rRNA基因测序常被用于细菌鉴定,目前已成为确认细菌种属的有效方法[4-5]。本研究采用MALDI-TOF-MS对未知细菌进行鉴定,结果提示为肢体凯斯特菌。同时,委托华大基因使用16S rRNA测序对该菌株进行检测,并将测序结果在NCBI网站上进行比对。结果显示,送检菌株与博代氏杆菌属及肢体凯斯特菌属亲源性最高。结合MALDI-TOF-MS结果,推测待检菌株为肢体凯斯特菌。
Coenye等[1]首次报道了肢体凯斯特菌可从粪便、肢体伤口分泌物以及痰中分离。由于Coenye最初从肢体末端的皮损中分离出该菌,故用希腊文“Kerstersia gyiorum”对其命名,含“肢体”之意。Greninger等[6]从糖尿病患者腿部溃疡处分离得到肢体凯斯特菌,测序获得全长3.94 Mb的基因组,共包含3 428个可翻译序列。Li等[7]从气管造口病人的支气管肺泡灌洗液中分离出肢体凯斯特菌,并对其进行高通量测序。肢体凯斯特菌的多数基因与细菌基本的细胞功能有关,如代谢、转录和翻译,但其中34.4%的基因功能未知。将高通量测序结果在毒力因子数据库(virulence factor data base, VFDB)中进行比对分析发现,肢体凯斯特菌的基因中包含鞭毛、菌毛、铁获得系统、外排泵、内毒素等功能基因。因此有必要使用基因敲除小鼠等动物开展试验,以阐明这些毒力因子在肢体凯斯特菌的致病性中发挥的作用。
在国外报道的病例中,肢体凯斯特菌可从肢体末端皮损入血从而引起菌血症,长期的伤口感染很可能是血流感染的原发灶[8]。肢体凯斯特菌常与其他细菌一起被分离出来,成为混合感染的致病菌。有5篇文献报道从慢性感染性耳炎患者的耳道分泌物中分离得到肢体凯斯特菌[9-13],而该疾病患者的标本中最常分离到的是铜绿假单胞菌。Kitagawa等[14]从患者肢体末端伤口的分泌物中分离出肢体凯斯特菌和创口鲍特菌,提示为混合感染。从免疫缺陷患者的混合感染标本中,可以分离到与肢体凯斯特菌类似的无色杆菌以及产碱杆菌[15]。根据这些病例可以推测,肢体凯斯特菌可能是机体正常菌群中的1种条件致病菌,常伴随其他细菌形成混合感染。
Ogawa等[16]从经皮造瘘口患者的尿液中分离出肢体凯斯特菌。Deutscher等[17]从长期气管切开患者的支气管肺泡灌洗液中分离出嗜麦芽窄食单胞菌、铜绿假单胞菌以及肢体凯斯特菌。本文病例从气管切开患者的痰标本中分离出肢体凯斯特菌。这说明肢体凯斯特菌可从接受气管切开或者经皮造瘘口患者的相关标本中被分离出来。但是肢体凯斯特菌可能只是定植菌,目前并不清楚其对患者病情发展的影响。在本病例中,患者长期卧床、免疫力低下,这株肢体凯斯特菌是否会由定植菌转为造成宿主感染的病原体?另外,肺部感染常见致病菌有肠杆菌科细菌、非发酵菌中的铜绿假单胞菌、不动杆菌以及嗜麦芽窄食单胞菌等。从该患者质量较好的痰液标本中分离到铜绿假单胞菌和嗜麦芽窄食单胞菌。这2种细菌与肢体凯斯特菌会不会产生协同作用?这些问题都值得进一步思考和探索。
肢体凯斯特菌对多种抗生素较为敏感。根据2021年CLSI推荐的非肠杆菌科抗生素的折点判断,本病例分离到的肢体凯斯特菌对氨曲南和左氧氟沙星中介,对环丙沙星耐药,对其余抗生素均敏感。Coenye等[1]与Almuzara等[9]对分离的肢体凯斯特菌进行药敏试验分析,提示该菌的临床菌株对各种抗生素均敏感。但是在巴西首例肢体凯斯特菌感染的病例报道中,该菌对环丙沙星耐药,这与本文的结果具有一致性[18]。从不同地区和身体部位分离的肢体凯斯特菌的耐药性有差异,可能和该菌宿主的既往用药情况有关。本研究分离的肢体凯斯特菌和铜绿假单胞菌对哌拉西林他唑巴坦敏感,患者使用该药后,其反复发热得到控制,提示哌拉西林他唑巴坦在抵抗细菌感染的过程中,可能对铜绿假单胞菌及肢体凯斯特菌都起到作用,从而使该患者的病情逐步好转。
本文首次在国内报道了一株常被临床忽略的非发酵菌:肢体凯斯特菌。文献回顾提示,该菌可导致菌血症、尿路感染、肺部感染、耳部感染等。肢体凯斯特菌常伴随其他细菌形成混合感染,因此须结合临床来明确前者是否为致病菌。在感染机体的过程中,肢体凯斯特菌和其他细菌是否发挥协同作用,也须进一步实验验证。肢体凯斯特菌经常出现在肢体伤口的混合感染中,故在战争创伤引起感染时必然会经常出现。对肢体凯斯特菌的分离、鉴定和研究对于未来战争创伤的防治也具有重要意义。
| [1] |
Coenye T, Vancanneyt M, Cnockaert MC, Falsen E, Swings J, Vandamme P. Kerstersia gyiorum gen. nov., sp. nov., a novel Alcaligenes faecalis-like organism isolated from human clinical samples, and reclassification of Alcaligenes denitrificans Rüger and Tan 1983 as Achromobacter denitrificans comb. nov[J]. Int J Syst Evol Microbiol, 2003, 53(Pt 6): 1825-1831.
[DOI]
|
| [2] |
Pence MA, Sharon J, McElvania Tekippe E, Pakalniskis BL, Ford BA, Burnham CA. Two cases of Kerstersia gyiorum isolated from sites of chronic infection[J]. J Clin Microbiol, 2013, 51(6): 2001-2004.
[DOI]
|
| [3] |
胡继红, 马筱玲, 王辉, 张建中, 罗燕萍, 鲁辛辛, 苏建荣, 张嵘, 赵虎, 余方友, 孙自镛, 顾兵, 刘小平, 赵建宏, 胡云建, 胡志东, 吕火烊, 周铁丽, 金大智, 刘文恩, 喻华, 徐修礼, 杨青. MALDI-TOF MS在临床微生物鉴定中的标准化操作专家共识[J]. 中华检验医学杂志, 2019, 42(4): 241-249. [DOI]
|
| [4] |
周晓君, 轩断断, 张冠男, 王旭明, 苏屿, 邓垂文, 凌海青, 牛莉娜. 1株从败血症患者血液分离的念珠状链杆菌的生物学特征[J]. 中华医院感染学杂志, 2021, 31(8): 1200-1204. [DOI]
|
| [5] |
孙铭艳, 吴倩倩, 王业鑫, 王楠, 刘言霞, 陶元勇. 脓肿分枝杆菌16S rRNA检测及生物学特性研究[J]. 中华皮肤科杂志, 2018, 51(12): 901-904. [DOI]
|
| [6] |
Greninger AL, Kozyreva V, Truong CL, Longoria R, Chaturvedi V. Draft genome sequence of Kerstersia gyiorum CG1, isolated from a leg ulcer[J]. Genome Announc, 2015, 3(5): e01036--15.
[DOI]
|
| [7] |
Li Y, Tang M, Wang G, Li C, Chen W, Luo Y, Zeng J, Hu X, Zhou Y, Gao Y, Zhang L. Genomic characterization of Kerstersia gyiorum SWMUKG01, an isolate from a patient with respiratory infection in China[J]. PLoS One, 2019, 14(4): e0214686.
[DOI]
|
| [8] |
Bostwick AD, Zhang C, Manninen K, Touchberry J, Greene SR, Holland TL. Bacteremia caused by Kerstersia gyiorum[J]. J Clin Microbiol, 2015, 53(6): 1965-1967.
[DOI]
|
| [9] |
Almuzara MN, Barberis CM, Traglia GM, Ordoñez AM, Famiglietti AMR, Ramirez MS, Vay CA. Isolation of Kerstersia gyiorum from a patient with cholesteatomatous chronic otitis media[J]. J Clin Microbiol, 2012, 50(11): 3809-3811.
[DOI]
|
| [10] |
Kim JH, Lee E, Lee Y. The first case of chronic otitis media due to Kerstersia gyiorum in Korea[J]. Ann Lab Med, 2018, 38(6): 607-609.
[DOI]
|
| [11] |
Mwalutende A, Mshana SE, Mirambo MM, Mushi MF, Chalya PL, Giliyoma JM, Schneiderhan W, Zimmermann O, Groß U. Two cases of chronic suppurative otitis media caused by Kerstersia gyiorum in Tanzania: is it an underappreciated pathogen in chronic otitis media?[J]. Int J Infect Dis, 2014, 29: 251-253.
[DOI]
|
| [12] |
Özcan N, Saat N, Yildirim Baylan M, Akpolat N, Atmaca S, Gül K. Three cases of chronic suppurative otitis media (CSOM) caused by Kerstersia gyiorum and a review of the literature[J]. Infez Med, 2018, 26(4): 364-368.
[PubMed]
|
| [13] |
Uysal EB, Çelik C, Tuzcu N, Can F, Doǧan M, Ertürk R, Bakici MZ. A case of chronic suppurative otitis media caused by Kerstersia gyiorum[J]. APMIS, 2015, 123(11): 986-989.
[DOI]
|
| [14] |
Kitagawa D, Kurimoto T, Oyama S, Suzuki S, Masuo K, Suzuki Y, Nakano R, Sato M, Yano H, Maeda K, Nomi K, Nakamura F. A case of Bordetella trematum and Kerstersia gyiorum infections in a patient with congestive dermatitis[J]. J Infect Chemother, 2021, 27(5): 740-746.
[DOI]
|
| [15] |
Aisenberg G, Rolston KV, Safdar A. Bacteremia caused by Achromobacter and Alcaligenes species in 46 patients with cancer (1989-2003)[J]. Cancer, 2004, 101(9): 2134-2140.
[DOI]
|
| [16] |
Ogawa Y, Lee ST, Kasahara K, Koizumi A, Chihara Y, Nakano R, Yano H, Mikasa K. A first case of isolation of Kerstersia gyiorum from urinary tract[J]. J Infect Chemother, 2016, 22(4): 265-267.
[DOI]
|
| [17] |
Deutscher M, Severing J, Balada-Llasat JM. Kerstersia gyiorum isolated from a bronchoalveolar lavage in a patient with a chronic tracheostomy[J]. Case Rep Infect Dis, 2014, 2014: 479581.
[DOI]
|
| [18] |
Pires BMFB, de Oliveira BGRB, de Oliveira FP, de Almeida Silva KCF, Del Peloso PF, Ferreira-Carvalho BT, de Paula GR, Teixeira LA. Ciprofloxacin-resistant Kerstersia gyiorum isolated from a chronic wound in Brazil: a case report[J]. Wound Manag Prev, 2020, 66(10): 42-45.
[DOI]
|
 2022, Vol. 17
2022, Vol. 17


